水稻半矮秆突变体内生真菌分离鉴定及其对植株抗倒伏性的影响
2024-04-08魏吉平李成霞牟佳美柯善文
魏吉平 李成霞 牟佳美 柯善文

摘要:为了探究水稻半矮秆突变体中内生真菌种类与分布及内生真菌对水稻植株抗倒伏性的影响,以水稻中花11及其矮化突变体pex1为研究对象,对植株根、茎、叶等组织植物内生真菌进行分离,运用形态学观察和rDNA-ITS区序列分析法,对内生真菌进行鉴定与分类;在此基础上,采用内生真菌侵染接种的方法,使内生真菌定殖于中花11植株体内,并对植株茎秆特性与强度、株高及抗倒伏指数等指标进行分析。结果表明,共鉴定出15种内生真菌,隶属5纲、6目、8科、8属。从突变体pex1植株的根、茎、叶中都可以分离得到疣孢青霉(Penicillium verruculosum),但在中花11各组织器官中并未分离得到;用疣孢青霉对中花11进行侵染处理后发现,处理组水稻植株茎秆抗折力明显增强,株高降低,茎秆节间壁厚增加,茎秆木质素含量及合成相关基因的表达水平明显上升,倒伏指数下降,说明疣孢青霉可提高水稻植株抗倒伏性,但其具体作用机理尚不清楚。本研究初步探索了内生真菌影响水稻抗倒伏性的生理机制,并为水稻及其他作物的高产优质栽培与育种提供重要的理论基础与微生物资源。
关键词:水稻;内生真菌;疣孢青霉;倒伏;木质素
中图分类号:S511.01;S182 文献标志码:A
文章编号:1002-1302(2024)03-0090-07
水稻(Oryza sativa L.)是我国乃至全世界重要的粮食作物,水稻的安全生产直接影响着粮食安全[1]。我国水稻种植源远流长,在农业生产中占有重要的地位,增加水稻单产成为提高粮食总产量的有效措施,但不断追求水稻高产带来了一定的弊端,其中一个就是倒伏[2-3]。在水稻大田栽培过程中,倒伏是制约水稻生产的重要因素之一,直接影响产量与品质,并增加收获成本,因此,提高水稻抗倒伏能力非常迫切[4]。在水稻育种中,由于水稻矮秆基因与半矮秆基因的导入,使得多数水稻品种株高发生了大幅度的降低,从而提高了水稻抗倒伏性,但也限制了产量的提升[5]。
植物内生真菌是指生活史的部分阶段或全部阶段在植物组织器官内,对宿主植物不会造成明显病害症状的一类真菌,在长期的协同进化过程中,它们与宿主植物形成一种互惠共生的关系,其生长活动能够显著影响宿主植物的生长发育和系统进化[6-7]。植物内生真菌在宿主植物体中发挥多种生物学作用,影响各器官组织的生长发育,在农业领域有很大发展潜力[8]。内生真菌可通过影响宿主植物细胞相关基因的表达水平来改变一些生理酶活性,调控宿主体的生理代谢或信号传导途径,提高宿主体激素、维生素与氨基酸等的含量,促进宿主植物的生长发育,主要表现在以下2个方面:(1)能够产生水解酶、还原酶、激酶及其他代谢物,提高植物体对N、P、K、Na、Mg 等营养元素的吸收、同化和运输能力,促进光合作用、呼吸作用、蛋白质合成、糖代谢等生理活动;(2)合成或促进植物体合成多种生理活性物质,如赤霉素、细胞分裂素、生长素与脱落酸等植物生长激素,调节激素信号,促进宿主植物种子萌发、幼苗生长和生物量积累[9-10]。植物内生真菌是一类新型的微生物资源,具有多种生物学功能,在农业生产应用中具有很大的潜在应用价值[11]。从抗倒伏能力强的水稻中分离筛选有益内生真菌,并研究內生真菌调控水稻抗倒伏能力的作用机制,进一步丰富水稻抗倒伏调控方式的探索,可为选育抗倒伏新品种提供理论依据,并有望应用于水稻及其他作物抗倒伏栽培与品种选育。
目前在农业上多使用农药、化肥及转基因等手段来提高农作物产量,但随之也带来了严重的环境安全、食品安全与社会安全等一系列问题。相比化学防治、农药防治与转基因等生物技术,发展植物内生真菌用于优质高产作物的生产有着无可替代的优点:无污染、不会产生抗药性、有利于人畜安全及环境保护、兼防兼治等,符合发展有机农业的要求。因此,发掘利用水稻内生真菌资源,揭示植物内生真菌的生物学功能作用机制,对水稻高产优质生产有非常重要的意义。笔者所在项目组从粳稻中花11的后代中筛选得到1个抗倒伏能力强的突变体pex1,相对于中花11,该突变体由于OsPEX1基因突变导致植株矮化、茎秆木质素含量高等,从而表现出较强的抗倒伏能力[12]。对其进一步研究发现,pex1突变体有较为丰富的内生真菌,对pex1突变体内生真菌进行分离与筛选,初步探索内生真菌对植株抗倒伏性的影响机制,将有助于进一步理解水稻抗倒伏性的调控机制,并为水稻及其他作物的高产优质栽培与育种提供重要的理论基础与生物资源。
1 材料与方法
1.1 试验材料
1.1.1 水稻种子与内生真菌
水稻品种中花11及其突变体pex1,由华南农业大学植物分子育种重点实验室提供,分离的内生真菌菌株保存于河西学院甘肃省应用真菌工程实验室。
1.1.2 培养基及试剂
内生真菌生长培养基为马铃薯葡萄糖琼脂(PDA)培养基,水稻幼苗生长培养基为1/2MS培养基,配制的培养基经121 ℃灭菌 30 min,冷却至 55~60 ℃后,加入120 μg/mL链霉素与150 μg/mL青霉素抑制细菌生长,充分混匀后倒入平板或培养瓶。试验所用试剂购自生工生物工程(上海)股份有限公司。
1.1.3 再定殖水稻幼苗准备
挑选无霉变、成熟健康种子,经75%乙醇溶液处理5 min后,用无菌水冲洗干净,再用1%次氯酸钠溶液处理10 min,经无菌水冲洗干净后,30 ℃黑暗条件下浸于无菌水中催芽2 d,挑选露白的种子于1/2MS培养基中培养。
1.2 试验方法
1.2.1 内生真菌的分离纯化
在无菌环境下,分别对中花11及其突变体pex1植株根、茎、叶片等部位进行取样,剪成约1 cm长小段,分别用75%乙醇和1%次氯酸钠进行表面消毒,经无菌水冲洗干净后接种于含青霉素和链霉素的培养基上,26 ℃条件下培养7 d。根据菌丝形态、颜色及生长速度等差异,挑取切口处新长出的菌丝进行培养,观察菌落形态是否单一,再次进行纯化培养,直至每个培养基上菌丝体能够单独形成菌落。
1.2.2 内生真菌的鉴定
菌落形态学鉴定:挑取纯化后无污染的单菌落接种至PDA平板培养基中央部位,25 ℃条件下培养10 d,待形成单菌落后,观察菌落形态与颜色,通过显微镜观察孢子及菌丝结构。
分子生物学鉴定:收集分离得到的内生真菌纯菌株菌丝体,采用改良的十六烷基三甲基溴化铵(CTAB)法提取内生真菌基因组DNA[13]。利用rDNA-ITS 序列测序分析对真菌进行分子鉴定,PCR扩增引物为通用引物ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[14]。PCR扩增反应体系为20 μL,含有2 μL DNA模板、10 μL 2×PCR Master、ITS1和ITS4引物各1 μL、6 μL ddH2O;PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。PCR产物经纯化回收后送至生工生物工程(上海)股份有限公司进行测序,将测序结果提交至NCBI(National Center for Biotechnology Information)的GenBank数据库进行BLAST比对分析。
1.2.3 内生真菌接种与定殖检测
将消毒后的中花11种子接种于装有1/2MS培养基的培养瓶中,待种子生根发芽后,将幼苗移至装有Hoagland营养液的塑料桶中,加入50 mL培养好的内生真菌菌液,再放进人工气候培养箱培养3~5 d,重复3次,以不含真菌的PDA液体培养基处理为对照。将用真菌侵染20 d的水稻植株根部用自来水冲洗干净,用“1.2.1”“1.2.2”节中的方法检测内生真菌定殖情况。
1.2.4 茎秆特性和强度测定
在水稻灌浆第20天,随机选取10株主茎茎秆,对其基部第3、4节间进行徒手切片,计算大维管束数量,并用ImageJ图像处理软件测量机械组织厚度与大维管束面积。茎秆抗折力、木质素染色与含量测定、基因表达分析等参照Ke等的方法[12]。
1.2.5 倒伏指数计算
倒伏指数(lodging index,LI)=SL×FW/M。式中:SL为基部节间折断部位至穗顶的距离,cm;FW为基部节间折断部位至穗顶的鲜质量,g;M为基部节间折断时的弯矩,g·cm,M=F×L/4,其中F为使基部茎秆折断时所施加的力,g;L为2个支点间的距离,cm[15]。
1.3 数据分析
采用Microsoft Office Excel对数据进行整理、分析与作图,利用SPSS 20.0软件进行数据统计和方差分析。
2 结果与分析
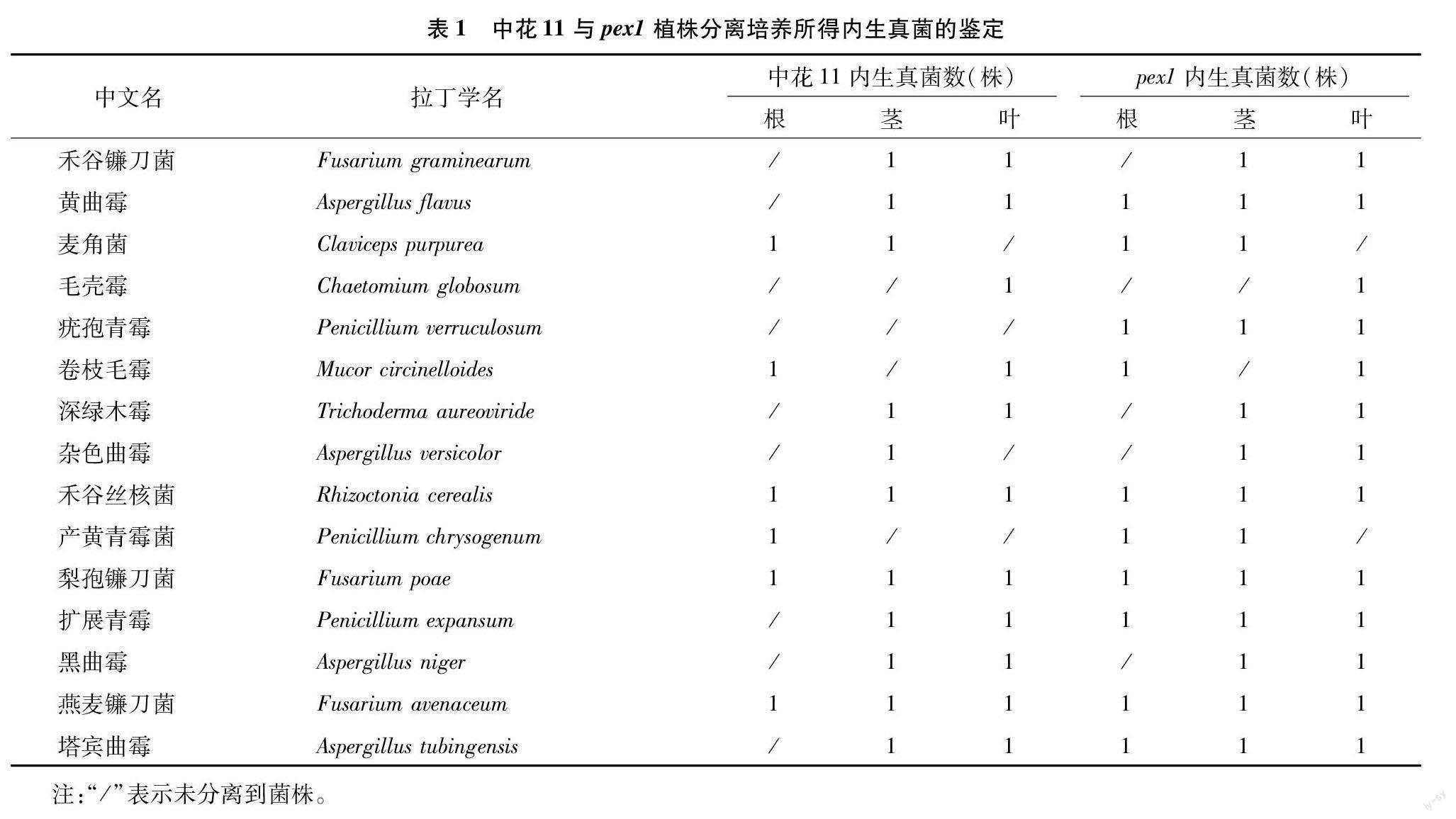
2.1 内生真菌的分离与鉴定
在水稻抽穗后20 d,分别以中花11及其突变体pex1为材料,对植株根、茎、叶组织内生真菌进行分离与纯化,共获得64株纯化菌株,其中28株分离自中花11,36株分离自pex1。对获得的内生真菌进行形态学和分子生物学鉴定,结果表明,所有分离出的内生真菌共有15种,隶属于5纲、6目、8科、8属(表1)。分析结果表明,疣孢青霉(Penicillium verruculosum)僅存在于pex1植株的根、茎、叶中,未能在中花11中分离得到,而其他内生真菌在中花11和pex1中都有分布,疣孢青霉是在中花11和pex1之间唯一存在种类差异的内生真菌。由内生真菌分离与鉴定结果推断,pex1与中花11的表型差异可能不仅与OsPEX1基因突变有关,还可能与其所含内生真菌种类与数量的不同有关。
2.2 内生真菌对水稻抗倒伏性的影响
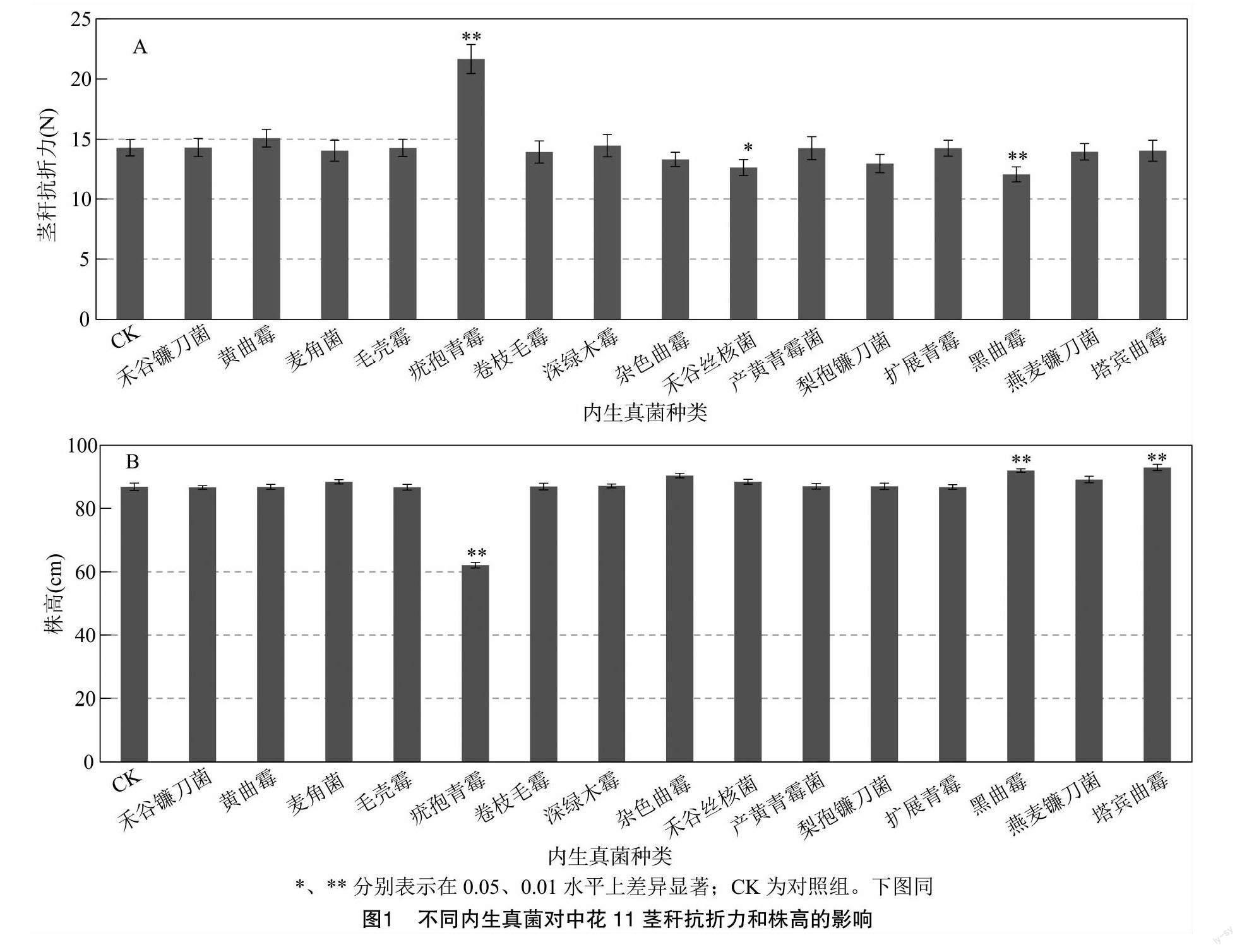
由于水稻植株抗倒伏能力与茎秆抗折力及株高等因素有关[16]。为了验证分离鉴定出的内生真菌是否能够提高水稻植株抗倒伏能力,分别用得到的15种内生真菌菌液处理中花11,挑选内生真菌与中花11稳定共生的植株,在抽穗后20 d测定茎秆抗折力及植株株高。结果表明,相对于对照组(CK),疣孢青霉侵染处理过的水稻植株茎秆抗折力极显著提高,而其他内生真菌处理组水稻茎秆抗折力则无显著变化或显著、极显著降低(图1-A)。此外,由图1-B可知,用不同内生真菌侵染中花11后,疣孢青霉侵染处理的株高极显著低于对照组,而其他内生真菌侵染处理后的株高则无显著变化或极显著增加。以上结果表明,疣孢青霉可通过增加茎秆抗折力及降低株高而影响植株抗倒伏能力。
2.3 疣孢青霉影响水稻抗倒伏性
2.3.1 疣孢青霉增加茎秆基部节间壁厚
为了进一步探究与验证疣孢青霉对水稻植株抗倒伏性的影响,笔者在不同的年份,对比分析了疣孢青霉处理组(Pv+)与对照组(CK)茎秆基部节间壁厚的差异。由表2可见,经疣孢青霉处理后,中花11茎秆基部节间壁厚都极显著大于对照组,总体来说,第1节间壁厚、第2节间壁厚及基部5 cm处壁厚在3年间的均值分别增加了18.88%、22.40%和14.36%。可见,疣孢青霉可通过增加水稻茎秆节间壁厚来提升其抗倒伏性。
2.3.2 疣孢青霉影响植株株高
通过株型观察与分析发现,疣孢青霉处理中花11可降低幼苗及成熟植株株高,相对于对照组,水培10 d幼苗植株株高降低了13.89%(图2-A),成熟植株株高则降低了28.42%(图1-B、图2-B)。
2.3.3 疣孢青霉影响茎秆木质素合成
为了进一步探索疣孢青霉影响水稻抗倒伏性的作用机制,笔者通过木质素染色和含量测定的方法分析了疣孢青霉侵染处理后中花11植株茎秆木质素含量的变化。由图3可知,相对于对照组,疣孢青霉菌处理组茎秆木质素含量增加了70.39%。在灌浆期前10 d分别对处理组和对照组茎秆第2节间进行取样,分析木质素合成相关基因的相对表达水平,结果显示,疣孢青霉处理组茎秆木质素合成相关基因的相对表达水平极显著上升(图3-C)。可见,疣孢青霉菌可通过影响茎秆木质素代谢途径来影响茎秆木质素含量,从而改变茎秆物质结构组成,进而影响水稻植株的抗倒伏性。
2.3.4 疣孢青霉降低植株倒伏指数
倒伏指数是衡量水稻抗倒伏性的直接指标[17]。为了综合评估疣孢青霉对水稻植株倒伏指数的影响,以中花11为试验材料,在不同年份测定疣孢青霉菌处理组与对照组植株的倒伏指数。试验结果表明,与对照组相比,疣孢青霉处理组植株的倒伏指数在2020—2022年里分别降低了40.43%、35.71%、43.18%(图4),进一步说明疣孢青霉可在一定程度上提高水稻抗倒伏性。
3 讨论与结论
内生真菌普遍存在于植物体内,特别是在禾本科植物中最为常见,这些内生真菌的部分成员能够促进宿主植物生长,对宿主的各项生长指标都有着积极的影响[18-19]。镰刀菌(Fusarium culmorum)定殖于沿海沙丘草(Leymus mollis)体内并与之形成共生关系后,能够提高宿主植物对高盐胁迫的忍耐性[20]。马敏芝等对黑麦草内生真菌的研究表明,内生真菌处理可增加叶片相对含水量、叶绿素含量及可溶性糖含量,促进光合作用与蒸腾速率[21]。将白僵菌定殖于玉米植株中,可明显促进玉米生长发育,增加株高与根长,促进植株生长速率的提高,增加生物量的积累[22]。此外,还有研究表明,内生真菌对水稻的生长发育也有着明显的促进作用。史央等用从大戟科植物中筛选出的内生真菌B3菌株处理水稻后发现,B3菌株不仅可明显提高水稻植株分蘖能力,还可增加叶片叶绿素含量[23]。从盐生碱蓬(Suaeda glauca)中分离出的围小丛壳菌(Glomerella cingulata)处理水稻幼苗后,可明显促进其生长,增加水稻幼苗干质量与株高,同时提高植株的总叶绿素含量[24]。从化感水稻中分离出的塔宾曲霉(Aspergillus tubingensis)和黏红酵母菌(Rhodotorula glutinis)发酵液对水稻幼苗生长有明显的促生作用,可显著提高水稻幼苗的株高、根长及POD、PAL活性[14]。本研究对水稻中花11及其矮化突变体pex1植株根、茎、叶的内生真菌进行分离、纯化与鉴定后发现,从突变体pex1植株根、茎、叶中都可以分离得到疣孢青霉菌,而在中花11各器官组织中并未分离得到。有研究表明,疣孢青霉可影响宿主生理代谢活动,牛莉娜等发现从红树林土壤中分离出的疣孢青霉菌株WC1024有較强的免疫增强效果[25]。贺兆伟等利用从烟叶中分离得到的产果胶酶疣孢青霉菌株TS63-9发酵产生的酶液处理烟叶,可改善烟丝感官质量[26]。从瑞香狼毒中分离得到的疣孢青霉菌YL-52发酵液粗提物具有抑菌广谱性,可抑制多种细菌与植物病原真菌[27]。在本研究中,用疣孢青霉侵染处理中花11后发现,疣孢青霉可极显著增强中花11茎秆抗折力,降低植株株高,增加茎秆节间壁厚,并增加茎秆木质素含量,提升茎秆中木质素合成相关基因的表达,说明疣孢青霉可影响水稻植株生长与发育。
水稻发生倒伏主要是由于植株下部的茎秆不足以承受植株上部的质量,主要和株型性状、栽培管理措施、茎秆物理特性、茎秆化学成分及气候条件等因素有关[28-30]。其中,影响水稻植株倒伏的主要性状之一就是株高,植株高度与水稻抗倒伏性呈显著负相关关系,因此,可通过降低株高的途径来有效提升水稻的抗倒伏能力[31]。此外,水稻茎秆形态也是决定植株抗倒伏性的关键因素,其茎基厚度与茎秆强度呈正相关关系,基部节间厚壁组织越发达、壁厚越大的植株,茎秆抗折力也越大,植株抗倒伏能力也越强[32-33]。水稻茎秆主要由木质素、纤维素、半纤维素及其他糖类等物质成分构成,其中,木质素是次生细胞壁的重要组成成分,可影响植株的机械强度,基部茎秆节间木质素含量与植株抗倒伏性呈正相关关系[34]。倒伏指数由株高、茎秆抗折力、鲜质量等指标进行计算,可综合评价水稻茎秆的抗倒伏能力,广泛应用于作物抗倒伏研究中,倒伏指数越低,植株抗倒伏能力越强[16]。在本研究中,水稻中花11 经疣孢青霉菌侵染处理后,植株茎秆抗折力、株高、基部节间壁厚、木质素含量等都发生了极显著变化,使得其倒伏指数极显著降低;本研究还发现,影响水稻木质素合成的OsCAD2、OsCAD7、OsSWN7等重要相关基因[35-36],在疣孢青霉处理组中的表达水平都表现为极显著上调,说明疣孢青霉可通过调控基因表达而影响相关农艺性状,增强水稻植株的抗倒伏能力,但其具体调控机理与分子机制还不清楚,有待进一步研究。
本研究对水稻中花11及其矮化突变体pex1根、茎、叶内生真菌进行了分离,利用菌落形态学鉴定和分子生物学鉴定的方法共鉴定出15种内生真菌,这些真菌隶属于5纲、6目、8科、8属。所分离的内生真菌在中花11和pex1之间存在种类差异性,其中,疣孢青霉只在pex1各组织中分离得到。对从pex1中分离的疣孢青霉进行了初步功能研究,发现其不仅能够有效降低水稻植株株高,还可影响茎秆性状及基因表达,从而提升植株抗倒伏能力,表明疣孢青霉具有作为新型植物益生菌新资源的开发潜力,并对水稻的高产优质生产具有重要的意义。
参考文献:
[1]朱瑞君. 广东省农科院水稻育种与推广研究[D]. 广州:华南农业大学,2020:14-18.
[2]陈书强,赵海新,杨丽敏,等. 寒地水稻高产抗倒伏调控技术的初步研究[J]. 华北农学报,2013,28(6):159-165.
[3]苌兴超,黄永兰,唐秀英,等. Gn1a基因靶向敲除对粳稻产量构成因素的影响[J]. 江西农业大学学报,2023,45(1):10-16.
[4]刘立军,王康君,葛立立,等. 旱种水稻基部节间性状与倒伏的关系及其生理机制[J]. 作物学报,2012,38(5):848-856.
[5]杨德卫,曾美娟,卢礼斌,等. 一个水稻矮秆突变体的遗传分析及基因定位[J]. 植物学报,201 6(6):617-624.
[6]Zhu J T,Wang Z M,Song L X,et al. Anti-alzheimers natural products derived from plant endophytic fungi[J]. Molecules,2023,28(5):2259.
[7]Cao J,Liu B Y,Xu X N,et al. Plant endophytic fungus extract ZNC improved potato immunity,yield,and quality[J]. Frontiers in Plant Science,2021,12:707256.
[8]王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义[J]. 微生物学通报,2015,42(2):349-363.
[9]Gimenez C,Cabrera R,Reina M,et al. Fungal endophytes and their role in plant protection[J]. Current Organic Chemistry,2007,11(8):707-720.
[10]Khan A L,Hussain J,Al-Harrasi A,et al. Endophytic fungi:resource for gibberellins and crop abiotic stress resistance[J]. Critical Reviews in Biotechnology,2015,35(1):62-74.
[11]杨春平,陈华保,吴文君,等. 植物内生真菌次生代谢产物的多样性及潜在应用价值[J]. 西北农业学报,2005,14(2):126-132.
[12]Ke S W,Luan X,Liang J Y,et al. Rice OsPEX1,an extensin-like protein,affects lignin biosynthesis and plant growth[J]. Plant Molecular Biology,2019,100(1):151-161.
[13]吴发红,黄东益,黄小龙,等. 几种真菌DNA提取方法的比较[J]. 中国农学通报,2009,25(8):62-64.
[14]陈颐辉,张宽朝,滕 斌,等. 化感水稻内生真菌的分离鉴定及其发酵产物的生物学效应研究[J]. 热带作物学报,202 2(12):3598-3604.
[15]程慧煌,易振波,曾勇军,等. 超级杂交稻抗倒伏能力及其对施肥量的响应[J]. 核农学报,2018,32(8):1603-1610.
[16]韩雷锋,周 燃,周 涛,等. 水稻抗倒伏和产量性状的相关性分析及QTLs定位[J]. 生物学杂志,2023,40(2):65-70.
[17]李 杰,张洪程,龚金龙,等. 不同种植方式对超级稻植株抗倒伏能力的影响[J]. 中国农业科学,201 4(11):2234-2243.
[18]隋 丽,万婷玉,路 杨,等. 内生真菌对植物促生、抗逆作用研究进展[J]. 中国生物防治学报,2021,37(6):1325-1331.
[19]袁志林,戴传超,史 央,等. 内生真菌B3促进水稻生长的机理研究[J]. 江苏农业科学,2004,32(2):10-13.
[20]Rodriguez R J,Henson J,van Volkenburgh E,et al. Stress tolerance in plants via habitat-adapted symbiosis[J]. The ISME Journal,2008,2(4):404-416.
[21]马敏芝,南志标.内生真菌对感染锈病黑麦草生长和生理的影响[J]. 草业学报,2011,20(6):150-156.
[22]Sui L,Zhu H,Xu W J,et al. Elevated air temperature shifts the interactions between plants and endophytic fungal entomopathogens in an agroecosystem[J]. Fungal Ecology,2020,47:100940.
[23]史 央,戴传超,吴耀春,等. 植物内生真菌强化还田秸杆降解的研究[J]. 环境科学学报,2004,24(1):144-149.
[24]赵 颖,于 飞,郭明敏,等. 碱蓬内生真菌JP3的分离、鉴定及促生作用研究[J]. 沈阳师范大学学报(自然科学版),2015,33(1):116-120.
[25]牛莉娜,林英姿,裴 华,等. 具有免疫增强活性红树林真菌的分离及菌株WC1024的鉴定[J]. 现代预防医学,2012,39(16):4217-4220.
[26]贺兆伟,奚家勤,李玉娥,等. 产果胶酶疣孢青霉菌株TS63-9发酵条件优化及其在烟草中的应用[J]. 湖北农业科学,2017,56(4):686-690,696.
[27]杨利珍,周 乐,徐 虹,等. 一株青霉菌的分离鉴定及抑菌活性成分研究[J]. 西北农业学报,2009,18(4):98-102.
[28]张笑寒. CRISPR/Cas9定点编辑OsGA20ox2基因降低水稻株高研究[D]. 贵阳:贵州大学,2016:5-9.
[29]欧阳慧,杨贤莉,王立志,等. 水稻抗倒伏性评价方法及机理的研究现状与展望[J]. 中国稻米,2023,29(2):12-17.
[30]張家智,王启增,王文玉,等. 不同耕作模式下穴苗数对水稻抗倒伏能力的影响[J]. 江苏农业科学,2022,50(24):79-85.
[31]肖应辉,罗丽华,闫晓燕,等. 水稻品种倒伏指数QTL分析[J]. 作物学报,2005,31(3):348-354.
[32]Zhang B C,Zhou Y H.Rice brittleness mutants:a way to open the ‘black box of monocot cell wall biosynthesis[J]. Journal of Integrative Plant Biology,2011,53(2):136-142.
[33]袁新捷,刘 潇,陈国兴. 水稻核心种质资源茎秆抗倒伏性研究[J]. 华中农业大学学报,202 0(1):147-153.
[34]赵小红,白羿雄,姚有华,等. 禾谷类作物茎秆特性与茎倒伏关系的研究[J]. 植物生理学报,2021,57(2):257-264.
[35]Huang P,Yoshida H,Yano K,et al. OsIDD2,a zinc finger and INDETERMINATE DOMAIN protein,regulates secondary cell wall formation[J]. Journal of Integrative Plant Biology,2018,60(2):130-143.
[36]Zhong R Q,Lee C H,McCarthy R L,et al. Transcriptional activation of secondary wall biosynthesis by rice and maize NAC and MYB transcription factors[J]. Plant and Cell Physiology,2011,52(10):1856-1871.
