依托考昔片自研制剂处方优选及体外溶出度评价
2024-03-28尹朋朋刘茜英许俊博
尹朋朋,刘茜英,肖 慧,许俊博
(华润双鹤药业股份有限公司,北京 100102)
依托考昔为高选择性环氧合酶-2 抑制剂,广泛用于治疗骨关节炎、类风湿关节炎、强直性脊柱炎、慢性下腰背疼痛、急性痛风性关节炎、原发性痛经、术后疼痛等。依托考昔为难溶性化合物,其体内吸收受原料药粒径和辅料用量的影响较大。国家药品监督管理局《仿制药参比制剂目录(第二十二批)》中推荐依托考昔片参比制剂(商品名Arcoxia)有3种规格(30,60,120 mg),参考原国家食品药品监督管理总局《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》等要求,多采用申报的最高规格进行生物等效性研究。故本研究中以120 mg 参比制剂为开发目标,以自研制剂与参比制剂在不同介质中溶出曲线的相似因子(f2)值为评价标准,参考2020 年版《中国药典(四部)》[1]132-133及文献[2-6]优选自研制剂的处方,并评价体外溶出度,为保障自研制剂与参比制剂的体内生物等效性研究提供参考。现报道如下。
1 仪器与试药
1.1 仪器
GL - 25B 型干法制粒机(张家港市开创机械制造有限公司);HLS - 30 型料斗混合器(浙江小伦制药机械有限公司);ZPS8 型旋转式压片机(上海天祥健台制药机械有限公司);BGB - 5F 型高效包衣机(北京航空工艺研究所);Entris Ⅱ型电子天平(德国Sartorius公司,精度为0.01 mg);Agilent 1260型高效液相色谱仪(美国Agilent Technologies 公司);Vision G2 Elite 8 型溶出仪(美国Hansen 公司);KQ - 250DE 型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
依托考昔原料药(广州安信医药有限公司,批号为F4016170303,含量99.50%);N- 氧化物对照品(中国食品药品检定研究院,批号为190435 - 202013,含量99.90%);无水磷酸氢钙(江苏德邦多菱健康科技有限公司,批号为20190610);微晶纤维素SH-101(安徽山河药用辅料股份有限公司,批号为20180301);交联羧甲基纤维素钠SD - 711(美国DuPont 公司,批号为552112301);硬脂酸镁(山东聊城阿华制药股份有限公司,批号为191001);胃溶型薄膜包衣预混剂(上海卡乐康包衣技术有限公司,批号为7HL53251);依托考昔片参比制剂(Arcoxia,西班牙Frosst Iberica SA 公司,批号为S040362,规格为每片120 mg)。
2 方法与结果
2.1 含量测定方法建立
色谱条件:色谱柱为Waters Xterra MS C18柱(50 mm ×4.6 mm,3.5 μm);流动相为0.02 moL/L磷酸二氢钠溶液(以2%磷酸水溶液或氢氧化钠溶液调pH 为2.95 ±0.05)- 乙腈(73∶27,V/V);流速为1.0 mL/min;检测波长为235 nm;柱温为40 ℃;进样量为10 μL。
溶液制备:取依托考昔原料药约33 mg,精密称定,置50 mL 容量瓶中,加乙腈超声(功率250 W,频率30 kHz)溶解,定容,摇匀,即得对照品贮备液;量取2 mL,置10 mL 容量瓶中,加溶出介质,定容,摇匀,即得对照品溶液。取含药溶液12 mL,经0.45 μm 微孔滤膜滤过,取续滤液;量取2 mL,置10 mL 容量瓶中,加溶出介质,定容,摇匀,即得供试品溶液。
方法学考察:取依托考昔原料药和N-氧化物对照品各适量,精密称定,用乙腈-水(1∶1,V/V)溶解,加流动相制成每1 mL约含依托考昔0.1 mg、N-氧化物0.1 μg的系统适用性溶液。按拟订色谱条件进样测定,记录色谱图。结果N- 氧化物峰的相对保留时间约为0.75(0.63~0.79);理论板数按依托考昔峰计不低于2 000,依托考昔峰与N-氧化物峰之间的分离度不小于2.0。按精密度、稳定性、重复性试验相关要求进行考察,结果的RSD均小于2.0%,表明仪器精密度良好,供试品溶液在室温下放置12 h内基本稳定,方法重复性良好。
2.2 溶出曲线考察
溶出条件:采用桨法[1]132-136测定,溶出条件[7-11]见表1。

表1 4种溶出介质下溶出条件Tab.1 Dissolution conditions in four dissolution media
公式:溶出度(%)=(对照品称样量×对照品含量×供试品稀释倍数×供试品溶液峰面积)/(对照品溶液稀释倍数× 规格× 对照品溶液峰面积)× 100%。累积溶出度(%)=An+(An-1+…+A2+A1)×V1/V2,其中,An为各时间点的溶出度,V1为各时间点的固定补液体积,V2为溶出介质的体积。
溶出度测定:精密量取对照品溶液与供试品溶液各适量,按拟订色谱条件进样测定,记录峰面积,以外标法测定参比制剂在4种介质中的溶出度,并绘制溶出曲线,结果见图1。可见,参比制剂在pH 1.0 盐酸溶液中15 min后累积溶出度达100.2%,释放速率过快;在pH 6.8磷酸盐溶液1 h 及水中45 min 后,累积溶出度仅超过80%,3 h 后均未达100%释放,释放速率过慢。故采用pH 4.5 醋酸盐溶液(释放速率适中)为溶出介质进行处方开发。根据《普通口服固体制剂溶出曲线测定与比较指导原则》[2](以下简称《指导原则》),结合本产品在4种介质中的溶出曲线达到平台期的时间,确定pH 1.0 盐酸溶液和pH 4.5 醋酸盐溶液选择60 min,pH 6.8 磷酸盐溶液和水选择90 min为累积溶出度考察终点。
2.3 自研制剂处方开发
原料药粒径:依托考昔原料药为生物药剂学分类系统Ⅱ类(低溶解- 高渗透)化合物,制剂溶出主要受原料药粒径影响[12-13]。根据美国食品和药物管理局对难溶性化合物粒径考察的要求制订原料药粒径考察范围,采用干法制粒工艺制备3批样品(记为自研制剂Ⅰ,Ⅱ,Ⅲ),考察不同原料药粒径对累积溶出度的影响(见表2 和图2)。结果显示,自研制剂Ⅰ,Ⅱ,Ⅲ的f2值分别为48,67,57。原料药粒径d90≤9.87 μm 时,溶出略快于参比制剂,相似度较差(f2<50);d90≤31.5 μm 和≤59.6 μm时,自研制剂与参比制剂溶出曲线相似度较好(f2>50)。故拟订原料药粒径为>10~<50 μm。
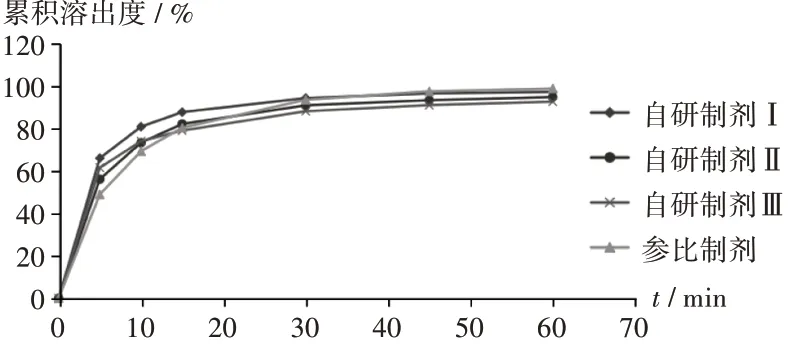
图2 不同原料药粒径下的制剂溶出曲线Fig.2 Dissolution profiles of preparations with different particle sizes of APIs
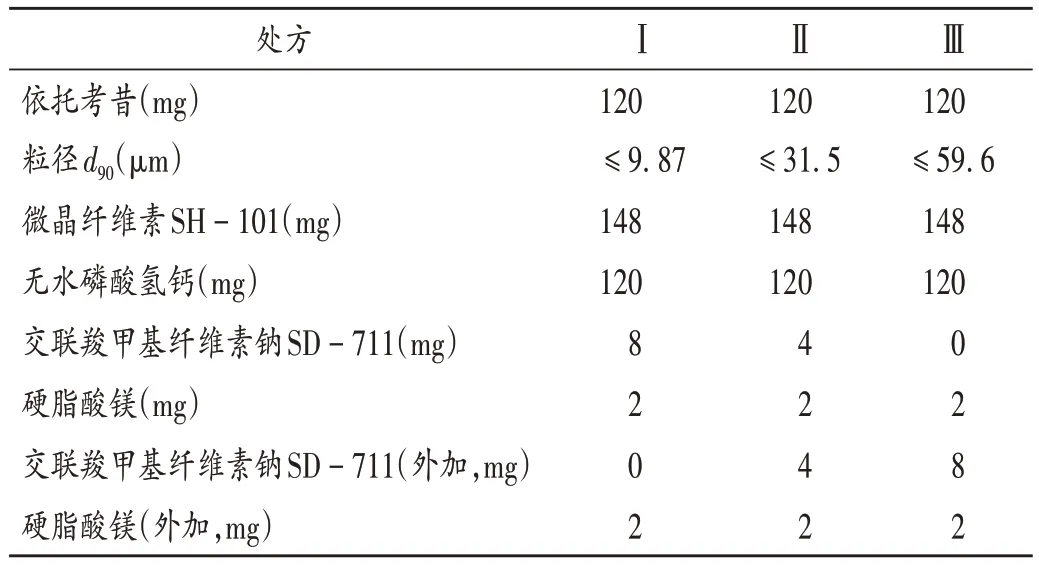
表2 自研制剂处方原料药粒径考察Tab.2 Investigation of particle sizes of APIs in self - made preparations
微晶纤维素SH - 101 与无水磷酸氢钙用量:调整处方中微晶纤维素SH - 101 和无水磷酸氢钙的用量,按干法制粒工艺制备4 批样品(记为自研制剂Ⅰ',Ⅱ',Ⅲ',Ⅳ'),比较自研制剂与参比制剂的溶出曲线(见表3和图3)。结果显示,自研制剂Ⅰ,Ⅱ,Ⅲ,Ⅳ的f2值分别为53,67,50,61。故初步确定处方中微晶纤维素SH -101 的用量为每片128 mg,无水磷酸氢钙的用量为每片140 mg。

图3 不同微晶纤维素SH-101与无水磷酸氢钙用量下的制剂溶出曲线Fig.3 Dissolution profiles of preparations with different dosages of microcrystalline cellulose SH - 101 and anhydrous calcium hydrogen phosphate

表3 处方微晶纤维素SH-101与无水磷酸氢钙用量考察(mg)Tab.3 Investigation of dosages of microcrystalline cellulose SH -101 and anhydrous calcium hydrogen phosphate in self - made preparations(mg)
硬脂酸镁(外加)用量:硬脂酸镁为疏水性辅料,用量过大会对物料润滑过度,引起溶出延缓。内加硬脂酸镁制粒和压片过程中,疏水薄膜难以成形,故仅需保证干法制粒过程中不发生黏辊轴即可,用量对制剂溶出影响较小;外加硬脂酸镁在混合过程中可能形成疏水薄膜包裹颗粒,从而影响制剂溶出。按干法制粒工艺制备了3批样品(记为自研制剂Ⅰ″,Ⅱ″,Ⅲ″),对外加硬脂酸镁的用量进行考察(见表4 和图4)。为保证不同处方制备的样品质量一致,对微晶纤维素SH - 101 的用量进行了微调。结果显示,自研制剂Ⅰ″,Ⅱ″,Ⅲ″的f2值分别为63,67,68。故确定处方中硬脂酸镁(外加)的用量为每片3 mg。

表4 自研制剂处方硬脂酸镁(外加)用量考察(mg)Tab.4 Investigation of dosages of magnesium stearate added in self - made preparations(mg)
最终处方确认:最终拟订处方见表5。根据《指导原则》,应对比自研制剂与参比制剂在4 种溶出介质的溶出曲线。根据f2值对比选点原则[2],pH 1.0 盐酸溶液为快速溶出,不进行f2值对比;pH 4.5 醋酸盐溶液选择5,10,15,30 min的溶出度进行f2值对比;pH 6.8磷酸盐溶液选择5,10,15,30,45,60,90 min;水选择5,10,15,30,45,60 min(见图5)。结果显示,最终拟订处方自研制剂与参比制剂以pH 4.5 醋酸盐溶液、pH 6.8 磷酸盐溶液和水为溶出介质,f2值分别为79,68,78,均高于60,相似性良好;且以pH 1.0 盐酸溶液为溶出介质,参比制剂和自研制剂在15 min 内的溶出度均≥85%,故二者溶出曲线相似[2]。
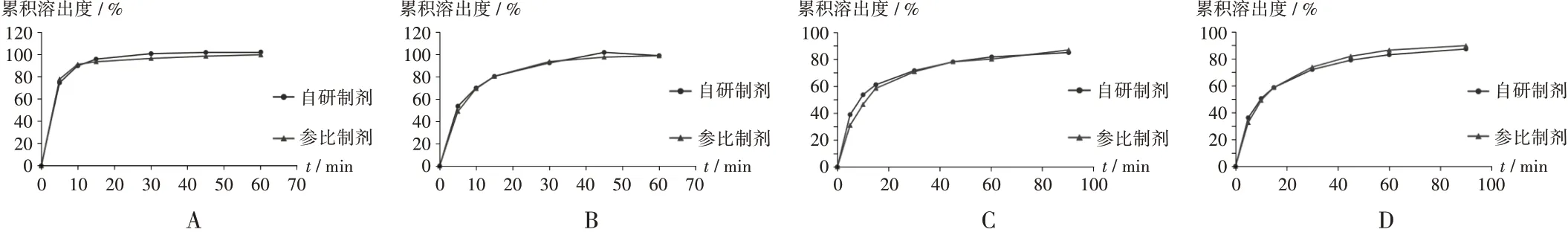
A. pH 1.0盐酸溶液 B. pH 4.5醋酸盐溶液 C.pH 6.8磷酸盐溶液 D. 水图5 4种溶出介质下的自研制剂与参比制剂溶出曲线A.pH 1.0 hydrochloric acid solution B.pH 4.5 acetate solution C.pH 6.8 phosphate solution D.WaterFig.5 Dissolution profiles of self - made and reference preparations in four dissolution media

表5 最终拟订处方(mg)Tab.5 Final prescriptions(mg)
3 讨论
3.1 原料药粒径对制剂溶出度的影响
依托考昔制剂的体外溶出和体内吸收主要受原料药粒径的影响[12-13]。原料药粒径减小,体外溶出提高,体内吸收增加。这主要是由于化合物的溶解速率受与水接触面积的影响,即比表面积越大,溶解速率越快(其中,比表面积为表面积与体积的比值,随着颗粒尺寸的减小而显著增加[14-15])。故将本品制剂中原料药的粒径控制在>10~<50 μm。
3.2 辅料对制剂溶出度的影响
依托考昔片制备为干法制粒工艺,需2次添加硬脂酸镁。疏水性的硬脂酸镁用量会影响原料在水中的溶解度,进而影响制剂的体外溶出和体内吸收[16-18]。内加硬脂酸镁用量对制剂溶出的影响较小,故重点考察外加用量。最终确定本品中硬脂酸镁的外加用量为每片3 mg。难溶性化合物在处方开发中应重点关注硬脂酸镁的用量。
3.3 体内外相关性建立
依托考昔具有高渗透性,故溶解度为该药物吸收的限制因素。普通口服制剂的体外溶出曲线和体内吸收易建立良好的体内外相关性[19-21]。自研制剂与参比制剂的体外溶出曲线对比结果显示,4 条溶出介质下的溶出曲线均有较好的相似度。基于溶出曲线对比,筛选并确定处方,可显著提高生物等效性试验的成功率。
3.4 小结
本研究中以pH 4.5醋酸盐溶液为有区分力的溶出介质,以原料药粒径和辅料用量为主要筛选目标,成功筛选出了与参比制剂溶出性质基本一致的自研制剂处方。为保证自研制剂与参比制剂的生物等效性,后续需更深入地研究。
