铝电解惰性阳极在熔融电解质中腐蚀过程的研究进展
2024-03-18修梦刘建华
修梦 ,刘建华,2
(1.昆明理工大学 冶金与能源工程学院,云南 昆明 650093;2.昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
2022 年中国原铝(电解铝)产量为4 021.4 万t,同比2021 年增长了4.4%[1]。铝电解工业作为能源型产业,电解过程中造成大量碳排放[2-5]。惰性阳极在铝电解的生产过程中产生氧气,减少了CO2的排放量[6-7]。因此,研究惰性阳极对减少铝电解碳排放量至关重要。
为了取代碳素阳极,惰性阳极材料需满足以下几点要求[7-11]:①耐腐蚀能力强,在冰晶石-氧化铝熔盐中腐蚀速率低,溶解度小;②能够阻碍新生成的氧原子向阳极内部渗透;③具有良好的导电性;④机械强度高,抗热震性强,不易脆裂;⑤容易加工成型,易于与金属导体连接;⑥原料易于得到,且价格比较低廉。而在近些年的研究中,惰性阳极的耐腐蚀性一直是关注的重点。根据组成的材料不同,惰性阳极分为合金阳极、氧化物陶瓷阳极和金属陶瓷阳极3 种类型。不同种类惰性阳极在电解质中存在着不同的腐蚀效果,为更清晰了解惰性阳极在电解质中的腐蚀机理,本文对不同种类的惰性阳极在冰晶石-氧化铝熔盐中发生的腐蚀反应进行综述,按照反应原理的不同进行总结和分类,并对相应的抑制腐蚀方法进行描述,以期为未来惰性阳极的发展提供积极影响。
1 惰性阳极铝电解工业化应用国内外研究现状
近些年,随着全球降碳减排需求的不断提升,被称为“无碳铝电解技术”的惰性阳极得到广泛关注[12]。瑞典Moltech 公司2005 年将Ni-Fe 合金阳极进行了4 kA 和25 kA 的铝电解试验;Moltech公司分解后,部分研究人员进入俄铝公司,随后俄铝公司在2015 年进行了100 kA 的惰性阳极铝电解槽工业试验,试验中采用与Moltech 公司相似的合金阳极,但试验结果不理想,也一直未有正式的公开试验数据[13]。2021 年,俄铝惰性阳极电解槽取得重大技术突破,在Krasnoyarsk 铝冶炼厂生产出了世界上含碳量最低的铝,与全行业的平均量相比较,可以减少约85%的碳排放量;每生产1 t铝,排放的二氧化碳量小于0.01 t,每日约产1 t铝[14]。从2009 年开始,Alcoa 公司利用惰性阳极(未揭露成分)新技术生产了700 t 阳极铝。2018 年Alcoa、力拓联合苹果公司、魁北克省和加拿大政府联合注资1.45 亿美元成立Elysis,研究惰性阳极的新技术,在不产生二氧化碳和减少全氟碳生成的情况下,将氧化铝还原成铝,并且Elysis 有望在2024年投入商业使用[15]。
美国ELTECH 公司在1992 年对NiFe2O4-M(M为Cu,Ni,Fe)惰性阳极进行铝电解中试,把6 件重17 kg 的阳极放入电解槽电解640 h。中试后发现所有惰性阳极发生径向开裂,并且中试后得到的原铝含有杂质[16]。中南大学在2013 年对NiFe2O4-M进行铝电解中试,中试的样品尺寸较小(Φ12 ×16 cm,9 kg),电解28 d 后发现生产的原铝中的Fe、Si 含量超过国家标准,并且难于制出工业级大体积、大质量的惰性阳极[17]。2013—2014 年昆明理工大学和尔兹环保材料公司对NiFe2O4-M 阳极进行铝电解中试,此次中试解决了制作大尺寸阳极和径向开裂的问题,但生产出的铝杂质超标这个问题还未解决。
2 反应原理
2.1 碳素阳极
我国铝电解依然使用冰晶石-氧化铝熔盐电解法,利用碳素阳极在高温熔盐中,将氧化铝还原成原铝,反应式见式(1),反应原理图见图1(a)[18]。

图1 不同阳极在铝电解槽中反应原理[18]Fig.1 Reaction principle of different inert anodes in aluminum electrolytic cell[18]
Al2O3(s) +1.5C(s)→2Al(l) +1.5CO2(g) (1)
2.2 惰性阳极
惰性阳极是指在通用冰晶石-氧化铝熔盐电解中,不消耗或者微量消耗的阳极,发生的化学反应见式(2)。相较于碳素阳极,惰性阳极在生产原铝的过程中产生O2,不产生CO2,减小了环保压力,反应原理如图1(b)[18]所示。
3 合金阳极
合金阳极因具有优良的导电性、机械强度高、易加工以及易与导杆连接等优势,被作为铝电解的惰性阳极材料进行研究。通过研究发现合金阳极在熔盐电解质中发生的主要反应是氧化反应、氟化反应和氧化膜的置换和分解反应。
3.1 氧化反应
合金阳极中主要含有4 种金属元素:Al、Cu、Fe和Ni,其氧化反应的标准吉布斯自由能见表1[19]。从表中可知,Al 的标准吉布斯自由能最小,而Ni 和Cu 的标准吉布斯自由能较大,且均为负。因此,Al、Ni、Cu 和Fe 可以被用作合金阳极的材料。

表1 Al、Cu、Fe 和Ni 氧化反应的吉布斯自由能Table 1 Gibbs free energy formula of oxidation reaction of Al,Cu,Fe and Ni
为研究合金在熔盐电解质的氧化反应与腐蚀抑制关系,将合金分为四大类型(图2)分别进行讨论。

图2 合金阳极主要类型Fig.2 Main types of alloy anodes
3.1.1 Cu-Al 合金阳极
对在熔盐电解质中腐蚀的Cu-Al 合金阳极表面进行分析,如图3(a)所示。通过在真空和高温氧气环境的对比,发现在真空中,Cu-Al 合金表面为纯铝;将阳极高温暴露在氧气后,表面会形成一层Al2O3薄膜,阻止阳极进一步氧化[20]。在电解过程中,含铝的合金阳极表面发生氧化反应生成的Al2O3薄膜,能够缓解电解质对基体的腐蚀。S.Krishna等[21-22]将90Cu-10Al 阳极放入KF-AlF3-Al2O3电解质中电解18 h,对腐蚀表面进行表征,见图3(b),结果表明阳极表面形成氧化层,但形状几乎没有发生变化。从图3(b)的①和②区域可知,最外层是被电解质包围的CuO 层,内层由CuO、Cu2O 和CuAlO2组成,这是由于O2-从内向外扩散导致的,并且在氧化层和合金之间形成类似的金属氟化物。同时为了提高阳极耐腐蚀性能,可以将合金阳极放入悬浮液中进行极化或者进行预氧化处理,通过快速形成稳定的氧化层(主要由Cu2O 和CuAlO2组成)来降低腐蚀速率,提高耐腐蚀性[23-24]。

图3 Cu-Al 合金氧化过程Fig.3 Oxidation process of Cu-Al alloy
3.1.2 Cu-Ni-Fe 合金阳极
E.Gavrilovaa等[25-26]研究Cu-Ni-Fe 合金在电解质中的腐蚀,发现Cu 具有较高的迁移率,会先移动到阳极的外表面与氧气反应,生成氧化层,阻碍氧气与大块合金接触。同时,缺少铜的区域能够促进NiFe2O4的生成,进一步阻碍Cu 向外扩散和氧气的侵入,因此Cu 的含量保持在适当的范围,在阳极中有着至关重要的作用。不同含量Cu 阳极电解20 h 后的EDX 图如图4 所示,能够看出随着铜含量逐渐减少,腐蚀层的厚度也在逐渐减小。S.Helle等[27]对富含Cu 的Cu65Ni20Fe15阳极的电解过程进行探究,认为电解氧化过程中主要形成2 个区域:Cu2O 的外层;分散在Cu2O 内侧的NiFe2O4内层,该区域的形成使得氧化层-合金界面没有电解质渗透和剥落,并且氧化层与合金基体之间黏结性能良好。Cu14Ni71Fe15、Cu52Ni33Fe15和Cu65Ni20Fe15阳极电解20 h 后表面氧化层组成如图5 所示,能够清晰看出随着Cu 含量的变化,氧化层的厚度逐渐增加,氧化层构成也不相同。G.Goupil等[28]对(Cu65Ni20Fe15)98.6O1.4阳极和Cu65Ni20Fe15阳极进行电解试验,发现Cu 的含量不同生成NiFe2O4氧化层厚度不同,但氧化层并没有完全阻碍Cu 向外扩散形成CuOx,造成氧化物-合金界面形成了多孔的Cu破损区。如图6 所示,能够清晰看出Cu65Ni20Fe15和(Cu65Ni20Fe15)98.6O1.4在电解后形成氧化层的构成。Liu等[29-30]研究发现Cu-Ni-Fe 合金的氧化过程为2 个相反的过程:①阳极的内部金属Cu 向外扩散形成CuO,溶解到熔体中,导致阳极破损;②熔体中的氧原子同时向阳极表面扩散,与Fe、Ni 发生反应,逐渐生成NiFe2O4。并且发现对阳极进行均质化处理,能够抑制Cu 向外扩散,从而促进NiFe2O4的形成,提高耐腐蚀性能,均匀化处理截面如图7 所示。同时还可以通过添加(Co,Ni)O 涂层,有效阻碍Cu和Fe 在氧化过程中从基体扩散到(Co,Ni)O 涂层外,来提高阳极的耐腐蚀性能[31]。A.P.Khramov等[32]通过添加Al 金属,发现虽然无法避免合金氧化,但腐蚀后尺寸较为稳定,适合应用于长期大型机械强度高的试验。

图4 不同含量Cu 阳极电解20 h 后的EDX图[26]Fig.4 EDX diagram of different content of Cu anode after electrolysis for 20 h[26]

图5 电解20 h 后的Cu14Ni71Fe15、Cu52Ni33Fe15和Cu65Ni20Fe15电极表面形成的氧化层组成示意图[27]Fig.5 Oxide layer composition diagram of Cu14Ni71Fe15,Cu52Ni33Fe15 and Cu65Ni20Fe15 electrode surface after electrolysis for 20h [27]

图6 Cu65Ni20Fe15和(Cu65Ni20Fe15)98.6O1.4在相同环境下电解的后形成刻度示意图[28]Fig.6 Scale diagram of Cu65Ni20Fe15 and (Cu65Ni20Fe15)98.6O1.4 formed after electrolysis in the same environment [28]

图7 未处理(上)和均匀化处理(下)52Cu-30Ni-18Fe 电解24 h 后的截面[30]Fig.7 Cross section of untreated (upper) and homogenized (lower) 52Cu-30Ni-18Fe after electrolysis for 24 h[30]
3.1.3 Fe-Ni 合金阳极
Cao等[33]研究了57Fe -43Ni、50Fe -50Ni 和43Fe-57Ni 3 种合金阳极在2 种不同熔盐中的腐蚀行为。在45KF-50AlF3-5Al2O3熔盐中,3 种合金阳极经析氧反应后形成由Fe2O3、Fe3O4和FeO 组成的钝化膜。在43Fe-57Ni 合金中由于Ni 向外扩散,形成了NiO 层,与Fe2O3发生固相反应形成NiFe2O4,增加阳极的耐腐蚀性能。3 种Fe-Ni 合金阳极腐蚀后的SEM 图如图8 所示,可以清晰看出钝化后产生的金属氧化层能够阻碍电解质腐蚀,钝化原理如图9 所示。Fe-Ni 合金在48.2NaF-43.8AlF3-8.0Al2O3熔盐电解,初始钝化后形成FeO,通过氧化反应生成Fe2O3薄膜附着在FeO 上,由于化学溶解使得合金表面不断形成氧化物来抵抗溶解,从而起到保护合金基体的作用。合金阳极57Fe-43Ni 和43Fe-57Ni在熔盐电解质腐蚀后的SEM 图和形成氧化膜的机理示意如图10 和图11 所示[34]。Cao等[35]还发现通过对Fe-Ni 合金预氧化处理或者添加一定量的金属元素,可以通过生成氧化层来提高阳极在电解质中耐腐蚀性。如图12 所示,不同含量Fe-Ni 合金阳极经过预氧化处理后,在SEM 图中可以清晰看出氧化层将电解质和基体分隔开。同时,Guan等[36]利用真空熔炼法向Fe-Ni 合金中添加不同含量的Al,生成致密氧化物来抵抗电解质的腐蚀,添加不同含量Al 的合金阳极腐蚀5 h 后的SEM 图如图13(a)所示,添加不同含量Al 使基体的抗腐蚀能力有所不同。添加一定量的Cr 合金也可以促进Cr2O3氧化层生长,提高Fe -Ni 合金的抗氧化性。如图13(b)和图13(c)所示,添加Cr 的合金阳极在800 ℃和900 ℃电解质腐蚀后,生成的氧化物层能够减缓电解质对基体的腐蚀[37]。

图8 Fe-Ni 合金在5KF-50AlF3-5Al2O3(wt.%)腐蚀后的SEM图Fig.8 SEM image of Fe-Ni alloy after corrosion in 5KF-50AlF3-5Al2O3(wt.%)
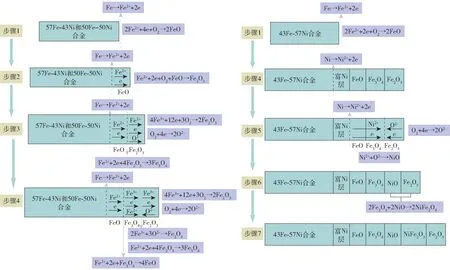
图9 钝化原理图[33]Fig.9 Passivation mechanism diagram [33]

图10 在48.2NaF-43.8AlF3-8.0Al2O3电解质腐蚀后的SEM图Fig.10 SEM image of Fe-Ni alloy after corrosion in 48.2NaF-43.8AlF3-8.0Al2O3 electrolyte

图11 形成氧化膜的机理示意图[34]Fig.11 Mechanism diagram of oxide film formation [34]

图12 预氧化处理的Fe-Ni 合金的SEM图[35]Fig.12 SEM image of pre-oxidized Fe-Ni alloy [35]

图13 添加不同金属对Fe-Ni 合金阳极抗腐蚀性的影响Fig.13 Effects of adding different metals on corrosion resistance of Fe-Ni alloy anode
3.1.4 Cu-Ni 合金阳极
研究(Cu3.25Ni)100-xFex合金的氧化过程,发现首先Cu 向阳极表面扩散,形成外部CuOx氧化层,随后Fe 和Ni 发生内部的氧化,形成NiO +FeOx内部氧化层,共同反应形成NiFe2O4。此外,研究发现Fe的存在能够有效限制Ni 的氟化反应,提高阳极的耐腐蚀性能[38]。Cu-Ni 合金阳极中添加不同含量Fe,在电解质电解20 h 后的表面层组成示意如图14所示,从示意图中可以看出随着Fe 含量的增加,氧化层结构存在差异,相同时间下,添加Fe 能够减缓电解质对阳极的腐蚀。
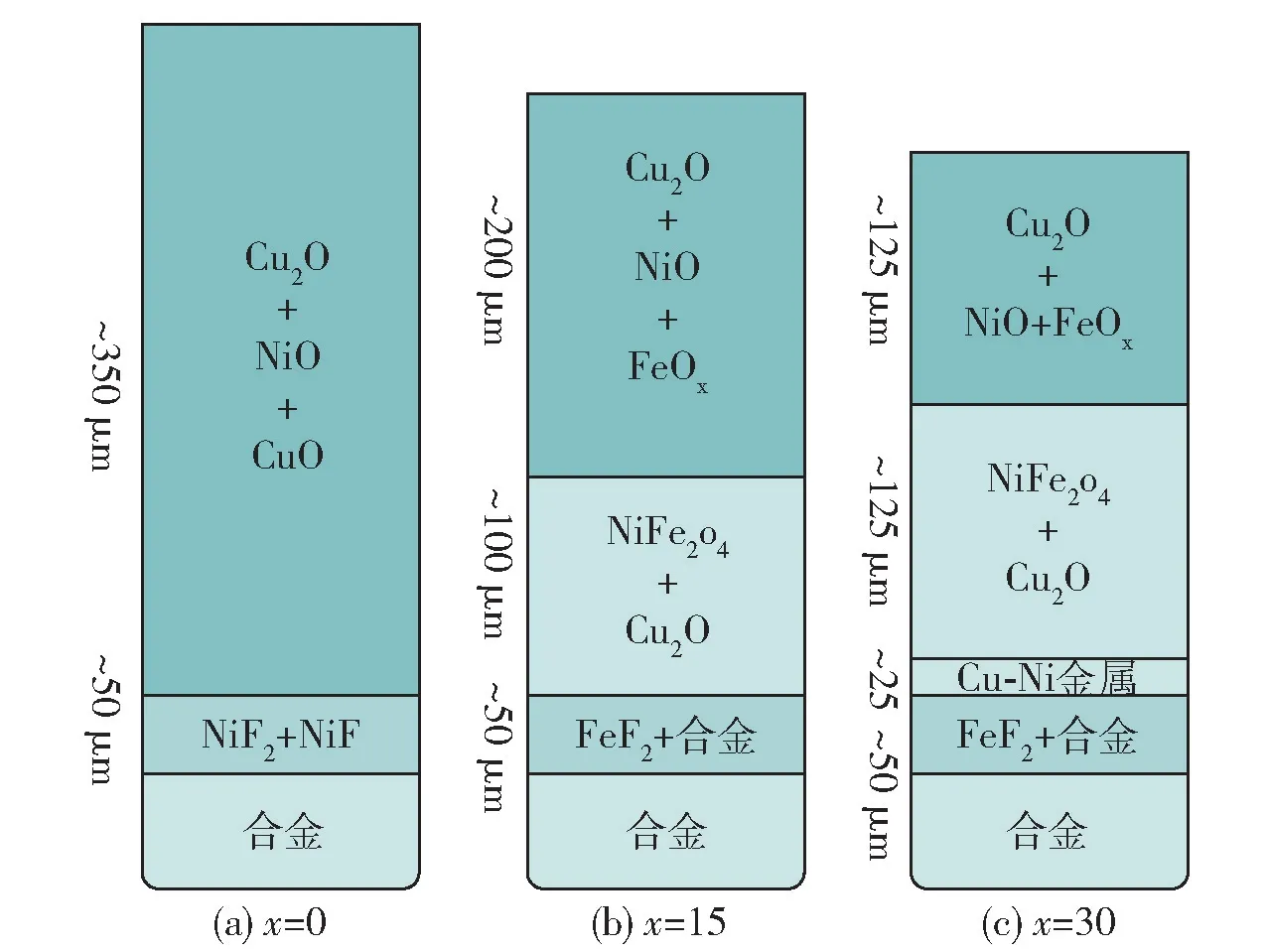
图14 (Cu3.25Ni)100-xFex电解20 h 后表面层组成Fig.14 (Cu3.25Ni)100-xFex surface layer composition after 20 h electrolysis
3.2 氟化反应
刘丹等[39]研究发现Cu-Fe -Ni -Al 阳极在8NaF-KF-AlF3-7A12O3电解质电解后,电解质中的氟元素在电解过程中发生氟化反应渗透到阳极氧化膜的最里层,形成金属氟化物,不利于电解的进行。虽然Cu-Ni-Fe 合金阳极能够在电解过程中生成NiFe2O4保护层,但同时可能发生氟化反应,破坏阳极的耐腐蚀性能,从而导致阳极过早降解。为防止氟化反应,可通过在阳极表面施加难以渗透的涂层来保护合金阳极,以提高耐腐蚀性能。如(Co,Ni)O涂层可以作为保护层来减缓电解质的渗透,提高Cu-Ni-Fe 合金阳极的耐腐蚀性[40]。合金阳极表面氧化反应后生成的氧化层能够减缓氟化物对基体的侵蚀,但氟化物的腐蚀性较强,长时间腐蚀对基体的影响也不可忽视。
3.3 氧化膜的置换反应和氧化膜的分解
合金阳极表面虽然有能够保护阳极内部的致密氧化膜,由于氧化膜与溶解铝的置换反应(式(3))和氧化膜的分解反应(或析出放电)(式(4))的存在,导致氧化膜对阳极内部保护能力减弱,并且2 种反应中产生的金属Me 会沉积到阴极铝液中,从而影响铝电解产品质量下降[19]。
因此,在选择合金阳极材料时,需要选择在高温冰晶石熔盐中溶解度低且生成氧化膜溶解度小的材料。虽然可以添加合金元素来提高阳极耐腐蚀性能,但不同金属对氧化膜致密化影响不同[19]。同时还需对氧化膜是否多孔进行判断,通过计算氧化膜的体积与被氧化的金属体积之比(PB),当PB 值在1.2~2.2 之间的金属氧化膜较好。
4 氧化物陶瓷阳极
氧化物陶瓷阳极因具有良好的抗氧化、抗腐蚀性能被作为惰性阳极的材料。研究发现发生该阳极发生的主要腐蚀反应是化学溶解、铝热反应和陶瓷相的溶解。氧化物陶瓷阳极分类如图15 所示。
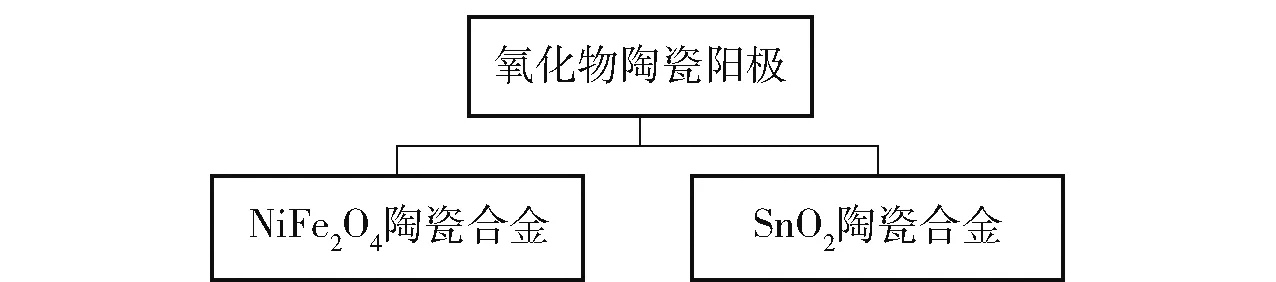
图15 氧化物陶瓷阳极分类Fig.15 Classification of oxide ceramic anodes
4.1 化学溶解
NiFe2O4陶瓷在电解过程中存在着一定程度的微弱电解,见式(5)。
随着电解产生的NiO 和Fe2O3与熔体中的AlF3可能发生化学反应,生成相应的氟化物[41],反应见式(6)~(7)。
而上述生成的NiF2和FeF3可能会与熔体中溶解的Al 反应,反应见式(8)~(9)。
若式(6)和式(7)所维持的平衡遭到破坏,会加快NiFe2O4陶瓷的化学溶解过程,导致式(8)和式(9)反应生成的AlF3沉积在阳极空隙中,减小阳极的抗腐蚀能力,加快阳极腐蚀的速率。王兆文等[42]研究发现电解质对氧化物陶瓷阳极的腐蚀主要有2 个过程:①离子在阳极放电,生成的氧和阳极中的金属发生氧化反应,产生的金属氧化物溶解在电解质熔盐中;②阳极反应生成的AlF3沉积在空隙中,减少阳极耐腐蚀性能。为了提高阳极的抗腐蚀性能,Xi等[43]发现可以添加烧结助剂来提高NiFe2O4陶瓷的抗腐蚀性。例如,添加V2O5可以促进晶粒的发育,稳定陶瓷内部结构,减少化学溶解,从而提高NiFe2O4陶瓷的抗腐蚀性能[44]。SnO2在1 000 ℃的冰晶石-氧化铝熔液中的溶解度仅为0.01%,在此不作分析[45]。
4.2 铝热还原
在铝电解过程中,阳极通常与阴极保持一定的距离,因此阳极并不会直接与铝液接触,然而阳极氧化物仍然会被溶解在电解质中的铝还原,反应通式见式(10)。
蔡棋夙等[46]研究SnO2阳极在Na3AlF6-Al2O3熔体中腐蚀行为,发现在不通电的情况下,槽底有铝时的腐蚀速率比无铝时约高10 倍。由热力学式(11)和式(12)的标准吉布斯自由能大于0 可知,氟化物熔体的侵蚀作用不大,而式(13)的标准吉布斯自由能小于0,表明阳极受到强烈腐蚀。由此表明铝热还原对SnO2基电极的腐蚀行为起着主要作用。
还可以在电解质中通入一定大小的电流,使电解质中产生氧气,从而把阳极周围的铝氧化,减少铝热反应的进行。
4.3 陶瓷相阳极溶解
Xiao等[47-48]研究发现SnO2在NaF-AlF3-Al2O3熔体中具有一定的溶解度,溶解度与Al2O3浓度、NaF/AlF3比例、还原气氛的组成和电解温度相关。为分析SnO2阳极的腐蚀因素,王化章[49]将SnO2阳极放入Na3AlF6-Al2O3熔体中,通过改变NaF 和AlF3的含量来探究NaF 和AlF3对SnO2阳极的腐蚀影响,发现过量的NaF 和AlF3对阳极的腐蚀都有不利的影响,NaF 的影响更为严重;该研究还证实熔体中Al2O3的浓度对SnO2阳极的腐蚀速率有显著的影响,当Al2O3浓度接近饱和时,腐蚀速率较低。为了提高SnO2阳极的致密度和抗腐蚀性能,张晓顺等[50]进行了在SnO2阳极中增加Cu、ZnO 和Fe2O3添加剂的试验,发现Fe2O3能够促进SnO2阳极的烧结,提高阳极的致密性,增加阳极的抗腐蚀能力。SnO2基阳极有可能发生电化学溶解腐蚀,反应见式(14)。
5 金属陶瓷阳极
金属陶瓷阳极是一种由合金和氧化物陶瓷构成的复合材料,同时具有金属的导电性和陶瓷在冰晶石熔体中的稳定性,以镍铁尖晶石为陶瓷相的复合材料是目前最具潜力的惰性阳极材料[51]。研究发现腐蚀反应主要是金属相的溶解、陶瓷相的溶解、晶界腐蚀和电解液浸渗。金属陶瓷阳极主要类型如图16 所示。

图16 金属陶瓷阳极主要分类Fig.16 Main classification of cermet anodes
5.1 金属相的溶解和陶瓷相的溶解
金属陶瓷阳极的金属相是为改善基体的电导率而加入的,但金属离子具有相对较强的电化学活性,在阳极极化条件下,可能会把熔体中含氧配合离子聚集在阳极上,通过放电释放出氧气;也有可能将含有金属相的阳极氧化,与熔体离子作用形成相应的配合离子进入熔体,从而引起阳极的消耗[52]。陶瓷相的溶解在氧化物陶瓷中进行了描述,再此不作赘述。以Ni 为例,发生电化学溶解时,电解反应见式(15)。
NiFe2O4-10NiO 阳极放入冰晶石-氧化铝电解液中进行腐蚀,通过测试发现阳极的金属优先被腐蚀,给阳极表面造成大量空洞。NiFe2O4相中的Fe优先溶解导致NiFe2O4晶粒的不均匀腐蚀,溶解在电解液中的Al2O3与阳极中的NiO 或FeO 发生反应,在阳极表面生成较厚的NiFe2O4-NiAl2O4-FeAl2O4保护层,该层阻碍了阳极表面金属相的溶解和陶瓷相溶解[53]。
Cu2O/Cu 陶瓷在Na3AlF6-CaF2-Al2O3电解液中的腐蚀可以用2 种机制来描述:陶瓷的溶解形成CuAlO2钝化层和Cu 相在电解液中物理迁移。Feng等[54-55]研究发现Cu2O/Cu 金属陶瓷中腐蚀速率随着Cu 含量的增加而增加,证实Cu 的含量对阳极抗腐蚀性能有影响。
对添加不同含量金属的NiFe2O4-10NiO 阳极进行分析,发现17(Cu-10Ni)/(NiFe2O4-10NiO)阳极表面形成致密的NiFe2O4层,且随着电解时间的延长,NiFe2O4层逐渐变厚。在新形成的致密陶瓷层中,NiO 相被NiFe2O4相吞噬而消失,金属相在电解过程中被氧化,其中Cu 元素的溶解速度高于Fe 和Ni 元素[56]。在17Ni/(NiFe2O4-10NiO)阳极表面存在大量孔洞或气孔的过渡层,但由于铝酸盐的某些反应,阳极表面会形成致密层。在不同浓度氧含量的烧结气氛中,NiFe2O4-y-z中NiO 和Fe 含量随氧含量的降低而增加,降低了材料的抗腐蚀性[57]。在xCu/(10NiO-NiFe2O4)阳极电解的过程中,金属Cu会发生大量腐蚀,阳极表面出现大量气孔,电解液渗入到阳极内部。黄有国等[58]发现5Cu/(NiFe2O4-10NiO)阳极表面虽然比较完好,但阳极内部金属相优先腐蚀,添加烧结助剂可以提高阳极的抗腐蚀性,He Hanbing等[59]研究发现在10Cu/(10NiO-NiFe2O4)陶瓷和17Cu/(10NiO-NiFe2O4)陶瓷中添加BaO 有利于增加阳极表面的致密化,从而提高阳极的耐腐蚀性。
5.2 晶界腐蚀和电解质浸渗
晶界腐蚀是指材料在具有腐蚀性介质中沿着晶界发生的一种局部腐蚀。王化章[49]发现,当惰性阳极材料的致密度较低的时候,具有腐蚀性的电解质会进入阳极的内部孔隙中,甚至会到微观晶粒的间隙中,形成晶界腐蚀,导致电极的肿胀、脱落,到最后的瓦解。随着电解的进行,阳极表层金属相优先腐蚀后,陶瓷的颗粒逐渐被电解质分解,进入电解质中,从而导致阳极腐蚀的加速。
6 总结
本文综述了近些年惰性阳极在电解过程中可能会发生的各类反应。根据材料不同对惰性阳极进行分类,分别讨论合金阳极、氧化物陶瓷阳极和金属陶瓷阳极在电解质中发生的反应,分析腐蚀的原因,总结减缓阳极腐蚀的方法。
1)合金阳极在电解质中腐蚀发生的主要反应是氧化反应、氟化反应、氧化膜的置换反应和氧化膜的分解反应。合金阳极主要由Al、Cu、Fe 和Ni 这4种元素组成,通过计算标准吉布斯自由能,发现这些元素会发生氧化反应,在合金阳极表面生成氧化物薄膜,减缓阳极的损耗。但合金阳极与电解质直接接触,氟化物的腐蚀性较强,会损坏阳极基体和表面氧化膜。研究人员为了提高合金阳极的使用寿命,通过向阳极中添加其他金属来提高氧化膜的致密化,通过喷涂难以溶解的涂层来保护基体,也可以通过对基体均匀化处理来提高阳极的耐腐蚀性。合金阳极的导电性能良好,但是耐腐蚀性能与氧化物陶瓷和金属陶瓷相差较远,要发展合金阳极,可以从提高合金的耐腐蚀性和降低腐蚀电解质的温度等方面展开研究。
2)氧化物陶瓷阳极在电解质中腐蚀发生的主要反应是化学溶解、铝热反应和陶瓷相的溶解。对近些年氧化物陶瓷阳极的研究进行总结,发现研究主要集中在NiFe2O4和SnO2陶瓷。NiFe2O4会在电解过程中发生微量的化学溶解,但主要的问题是陶瓷相在电解质中的溶解。SnO2主要是与生成的铝液发生铝热反应,在电解过程中通入电流,阳极产生氧气,将阳极周围的铝氧化,可以减少铝热反应。对氧化物陶瓷阳极,也可通过添加烧结助剂,控制熔盐中Al2O3、NaF 和AlF3的比例来减少化学溶解和陶瓷相的溶解。氧化物陶瓷自身耐腐蚀性能良好,但是导电率较低,如何增加氧化物陶瓷的导电率是研究的关键。
3)金属陶瓷阳极在电解质中腐蚀发生的主要反应是金属相的溶解、陶瓷相的溶解、晶界腐蚀和电解质浸渗。金属陶瓷与氧化物陶瓷相比,导电率有所增加,但由于添加的金属在熔盐电解质中容易被腐蚀,对金属陶瓷的耐腐蚀性能产生影响。金属陶瓷阳极可以通过改变金属相的含量、添加烧结助剂等方式来降低金属相和陶瓷相的溶解、晶界腐蚀和电解质渗透。因此,如何在增加金属陶瓷阳极的电导率的同时,保护金属不被腐蚀是金属阳极的研究重点。
中国作为全球最大铝的消费市场和工业应用市场,加快推进惰性阳极在铝电解中的应用对国内的能源利用、环境保护和打破国外的技术封锁至关重要。在现有的惰性阳极中,金属陶瓷阳极有望实现工业化应用,目前,金属陶瓷阳极的发展关键在于金属陶瓷材料的结构优化,提高材料自身的性能。同时,通过加大惰性阳极电解规模、研究电解质与阳极界面的交互作用机制、降低惰性阳极腐蚀速率等方法,能够加快铝电解惰性阳极的推广进程,为早日实现工业化应用提供可能。
