复方南星止痛凝胶的制备及评价*
2023-12-28宋学忠曾丽婧章晨峰王团结王振中
宋学忠,曾丽婧,闫 明,季 园,章晨峰,张 欣,王团结,肖 伟,王振中**
(1. 南京中医药大学药学院 南京 210023;2. 江苏康缘药业股份有限公司 连云港 222001;3. 中药制药过程控制与智能制造技术全国重点实验室 连云港 222001;4. 中国药科大学中药学院 南京 210023)
复方南星止痛膏是江苏康缘阳光药业有限公司生产的中药橡胶膏,方中含有生天南星、生川乌、丁香、肉桂、白芷、细辛、川芎、徐长卿、乳香(制)、没药(制)、樟脑、冰片等药物,其功能主治为:散寒除湿,活血止痛。由于复方南星止痛膏在临床上存在过敏现象[1-2],如个别患者在贴药处局部出现皮肤发红发痒、起小水泡,成为制约其临床应用的关键因素,且郑智音等[3]、刘齐等[4]对橡胶膏进行研究分析,认为致敏因素多源于基质,并提出可采用新剂型对策以缓解过敏现象,而中药凝胶剂作为近年发展起来的中药新剂型,具有质地均匀细腻、释药速度快且对人体皮肤无致敏性[5],可以在很大程度上减轻原膏的过敏反应,因此针对复方南星止痛膏的皮肤过敏性现象,课题组以复方南星止痛膏作为研究对象,选择凝胶剂进行剂型改良,并对制剂处方进行筛选和优化,对制剂的质量进行评价,如:外观、挥发性成分鉴别、pH 值、黏度、凝胶稳定性、丁香酚含量、次乌头碱含量等;并经过与原膏过敏性对比研究,形成工艺稳定,质量可控,降低过敏性的凝胶,为复方南星止痛膏新剂型开发提供科学选择。
1 仪器与材料
1.1 仪器
S210-pH 计,梅特勒-托利多(上海)仪器有限公司;MYPII-2磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;ME104E 电子天平,梅特勒-托利多仪器有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;NDJ-5S黏度计,上海平轩科学仪器有限公司;TDL-5-A 低速大容量离心机,上海安亭科学仪器厂;TC-16MW 台式高速离心机,湖南赫西仪器装备有限公司;Agilent 7980A 气相色谱仪,Agilent Technologies, Inc.;Waters Alliance e2695 高效液相色谱仪,Waters Corporation。
1.2 药品与试剂
卡波姆系列Carbopol 980NF,批号012491998,北京凤礼精求医药有限公司;甘油(丙三醇),批号2019022501,丰益油脂科技有限公司;三乙醇胺,批号F20070225;1-氯-2,4-二硝基苯,批号102295220,Merck KGaA, Darmstadt, Germany;甲醇,色谱纯,批号:021830,MREDA;樟脑,批号H2018001;冰片,批号YP2108099,均购于江苏康缘阳光药业有限公司;复方南星止痛膏药粉,批号2201943,江苏康缘药业股份有限公司;复方南星止痛凝胶,自制。复方南星止痛膏,批号211041,由江苏康缘药业股份有限公司提供。丁香酚对照品,批号110725-201615,纯度99.3%;丹皮酚对照品,批号110708-201908,纯度99.8%;桂皮醛对照品,批号110710-202022,纯度99.5%;樟脑对照品,批号110747-202011,纯度98.8%;冰片对照品,批号110743-201706,纯度97.6%;次乌头碱对照品,批号110798-201609,纯度99.2%,以上对照品均购于中国食品药品检定研究院。
1.3 动物
普通级豚鼠,雌雄各半,体质量300-350 g;购自南京市浦口区莱芙养殖场,许可证号SCXK(苏)2019-0005;于江苏康缘药业股份有限公司药理中心开展试验,许可证号SYXK(苏)2018-0025;动物实验遵循江苏康缘药业股份有限公司有关实验动物管理和使用规定。
2 方法与结果
2.1 CNPRG制备
初定处方量为卡波姆0.5 g,甘油5.0 g,药粉量1.0 g,pH=7.0。称取南星膏药味中除樟脑、冰片外,取生天南星等十味,粉碎成细粉,过筛,混合均匀,备用。称取处方量的卡波姆,加入适量水过夜充分溶胀。将精密称取的药粉(处方量的复方南星止痛膏药粉、冰片、樟脑混合而成)加入处方量的甘油搅拌均匀后再加入已过夜溶胀好的卡波姆充分搅拌均匀,补足水至50 g,加入三乙醇胺调节pH。
2.2 CNPRG评价方法建立
查阅文献评价方法[6-9],并经预实验考察,将单因素试验评价指标确定为外观性状、黏度、涂展性;Box-Behnken 试验评价指标:外观性状、黏度、涂展性、稳定性,并在其评价指标基础给出Box-Behnken 试验综合评分公式;综合评分=25%×(外观性状+黏度+涂展性+稳定性)。
2.2.1 CNPRG评价指标测定方法
①外观性状:凝胶剂应均匀、细腻,在常温下时保持胶状,不干涸,不液化。②黏度:取3批凝胶剂适量,采用NDJ-5S 黏度计(4 号转子,6 r·min-1)测定凝胶剂黏度3 次,取平均值。③涂展性:取3 批凝胶剂适量,涂抹于手上,以其涂抹难易程度进行评分。④离心稳定性:取3 批凝胶剂适量,分别置于3 支离心管中,在3000 r·min-1的条件下离心30 min,观察凝胶的外观性状,凝胶剂不应分层或有药液析出。⑤低温稳定性:取3 批凝胶剂适量,于-20℃左右冰箱中放置48 h,取出后恢复至室温,观察凝胶的外观性状,凝胶剂不应分层或有药液析出。⑥高温稳定性:取3 批凝胶剂适量,于55℃条件下恒温加热12 h,取出后恢复至室温,观察凝胶的外观性状,凝胶剂不应分层或有药液析出。
2.2.2 CNPRG评价综合评分细则
CNPRG评价综合具体评分细则见表1。

表1 复方南星止痛凝胶评分细则
2.3 CNPRG单因素考察
2.3.1 Carbopol 980NF用量考察
固定载药量1.0 g,甘油用量5.0 g,调节pH=7.0,设计Carbopol 980NF 用量为0.2 g、0.3 g、0.4 g、0.5 g、0.6 g,考察Carbopol 980NF 用量对凝胶的外观性状、黏度、涂展性的影响。从表2 中可知随着卡波姆用量越大,凝胶越粘稠。当卡波姆用量为0.2 g时,外观性状、黏度和涂展性均较差,因此卡波姆用量不宜低于0.2 g。当卡波姆用量为0.3-0.6 g 时,差异体现在黏度上,卡波姆用量为0.6 g 时,质地较稠。因此卡波姆用量宜在0.3-0.5 g之间。

表2 卡波姆用量考察结果
2.3.2 pH值考察
固定Carbopol 980NF 用量0.5 g,甘油5.0 g,载药量1.0 g,将pH 值调至5.0、6.0、7.0、8.0。考察pH 值对凝胶的影响。从表3 中可知,pH 值主要影响凝胶的黏度与涂展性,pH值越大,凝胶越粘稠,越不易涂展。当pH=5.0-6.0 时,黏度与涂展性能良好。当pH=7.0 时,虽黏度与涂展性能略有下降,但并不影响使用。当pH=8.0 时,凝胶过于黏稠,不易涂展,因此pH 的选择宜在5.0-7.0之间。
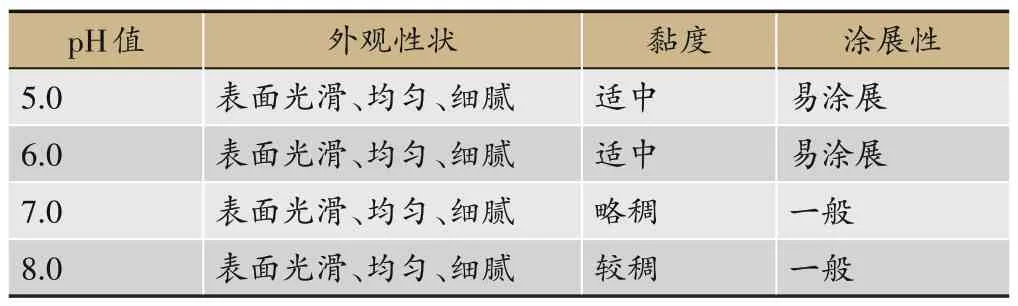
表3 pH值考察结果
2.3.3 甘油用量考察
固定Carbopol 980NF 用量0.5 g,载药量1.0 g,调节pH=7.0,设计甘油用量为2.50 g、3.75 g、5.00 g、6.25 g、7.50 g,考察甘油用量对凝胶的影响。由表4 可知,甘油用量对凝胶的影响较小,而中药凝胶剂甘油用量一般为5%-15%[5],因此可以根据实际情况在5%-15%之间选择合适的用量。本实验出于经济且使其充分发挥保湿、溶解药物的作用,在后续的Box-Behnken 实验将固定的甘油的用量为5.00 g(即10%)。
2.3.4 载药量考察
固定Carbopol 980NF 用量0.5 g,甘油5.0 g,调节pH=7.0,设计载药量1.0 g、2.0 g、3.0 g、4.0 g,5.0 g,考察载药量对凝胶的影响。从表5 中可知,当载药量高于4.0 g 时,凝胶表面粗糙,细腻度差,质地较粘稠、涂展性一般,因此载药量不宜高于4.0 g。当载药量为1.0-2.0 g时,各项评价指标评价均较好。当载药量为3.0 g时,外观性状、黏度虽略差,但涂展性能良好,不影响使用。因此载药量宜为1.0-3.0 g。
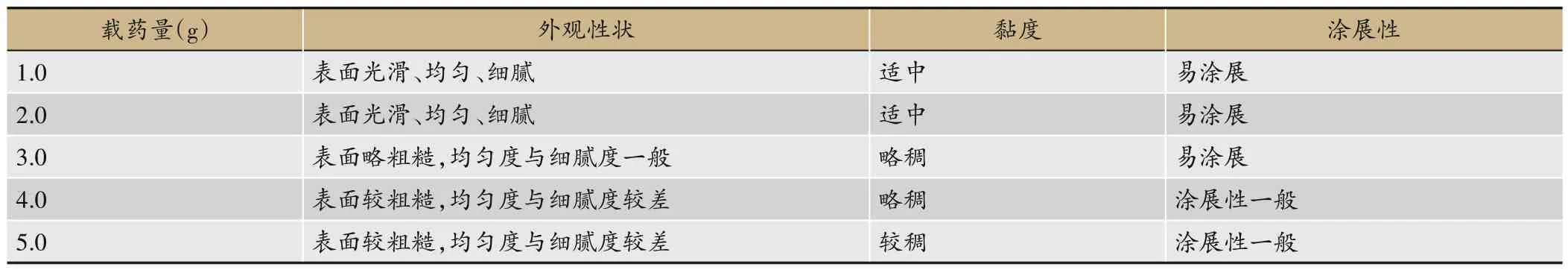
表5 载药量对凝胶的影响
2.4 Box-Behnken结合响应面试验优化CNPRG处方
2.4.1 Box-Behnken结合响应面试验设计
根据上述单因素的试验结果,以Carbopol 980NF用量(A)、载药量(B)及pH值(C)设置三因素三水平进行Box-Behnken 试验结合响应面面法优化凝胶处方配比,以综合评分为评价指标。综合评分公式见2.2 项下;综合评分细则见表1;因素水平表见表6;响应面试验设计与结果见表7。
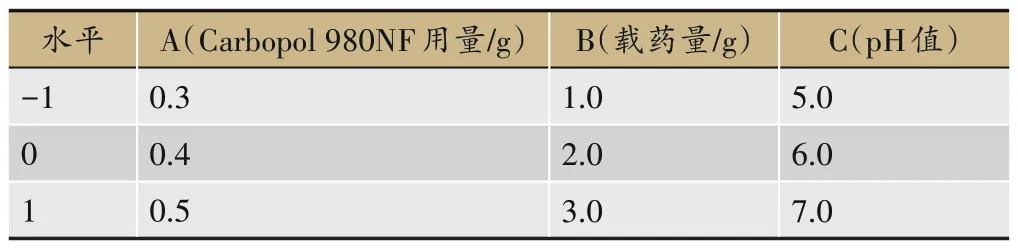
表6 响应面试验因素与水平表
2.4.2 模型拟合结果
用Design-Expert V11.0 软件对响应值综合得分与各因素进行回归拟合,结果见回归方程方差分析表8,并得综合评分(Y)对3 个因素的二次多项回归模型方程:Y=-94.75+137.45×A+0.01×B+24.72×C+7.25×AB-11.10×AC-0.63×BC-104.13×A2-0.06×B2-1.52×C2;P<0.01,说明模型达到极显著水平,表明处方优化试验设计合理可靠,模型相关系数R2=0.9425,进一步说明模型可信度较高;且模型失拟项不显著,表明拟合程度良好,试验点均能用模型描述,由上述可得:可用此模型来预测和分析CNPRG 的处方配比。根据P值来看,各因素中B、C、AB、AC、A2、C2对响应值综合评分显著,可见单因素影响的显著性排序为:载药量>pH值>Carbopol 980NF用量。
2.4.3 验证试验
采用Numerical优化函数得出的CNPRG 的最优配比,Numerical优化最佳值为卡波姆用量0.35 g,载药量1.02 g,pH=6.18,预测综合评分为9.990,愿望函数值1.000,说明预测值具有较好的可靠性。进行百倍放大验证试验:卡波姆用量35 g,载药量102 g,根据实际情况优化pH=6.20,制作3 份CNPRG 平行样进行验证。结果由表9 看出,3 份平行样的综合评分平均值为9.92,与Box-Behnken 试验给出的预测综合得分9.99,偏差0.07%,说明试验结果可靠。
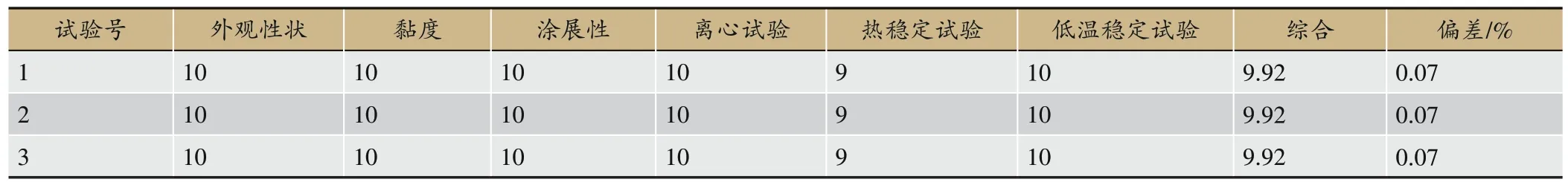
表9 验证实验结果
2.5 次乌头碱含量测定方法的建立
2.5.1 色谱条件
色谱条件参照原膏方法[10]:色谱柱 Luna 5u C18(2)100 A(250 mm×4.6,5.0 μm);流动相为水-甲醇-三氯甲烷-二乙胺(30∶80∶2∶0.1);流速1 mL·min-1;进样量10 μL;柱温25℃;检测波长232 nm。
2.5.2 对照品溶液的制备
取次乌头碱10 mg置于10 mL容量瓶中,加入二氯甲烷溶液至刻度,制得1 mg·mL-1的标准品母液。再精密吸取母液适量,用二氯甲烷溶液稀释成10 μg·mL-1的对照品溶液,备用。
2.5.3 供试品溶液的制备
精密称定复方南星止痛凝胶100 g,置于500 mL容量瓶中,加入甲醇适量,超声1 h,超声结束后加甲醇定容。滤过,取续滤液250 mL,减压回收。残渣加入2%盐酸100 mL加热溶解(70℃,此操作重复3次)。放冷,冷藏1 h,滤过,取续滤液50 mL 至分液漏斗,用三氯甲烷萃取(40 mL,40 mL,40 mL,30 mL),合并三氯甲烷层,用无水碳酸钠脱水,减压回收至干,残渣用二氯甲烷溶解,定容至1 mL,即得。
2.5.4 阴性样品溶液的制备
精密称取不含乌头的CNPRG100 g,自“2.5.3”项相同方法制备。
2.5.5 专属性考察
将对照品溶液、供试品溶液和阴性样品溶液按“2.5.1”项下色谱条件分别进样分析,次乌头碱与其他组分色谱峰达到基线分离,阴性样品溶液无干扰(图1)。
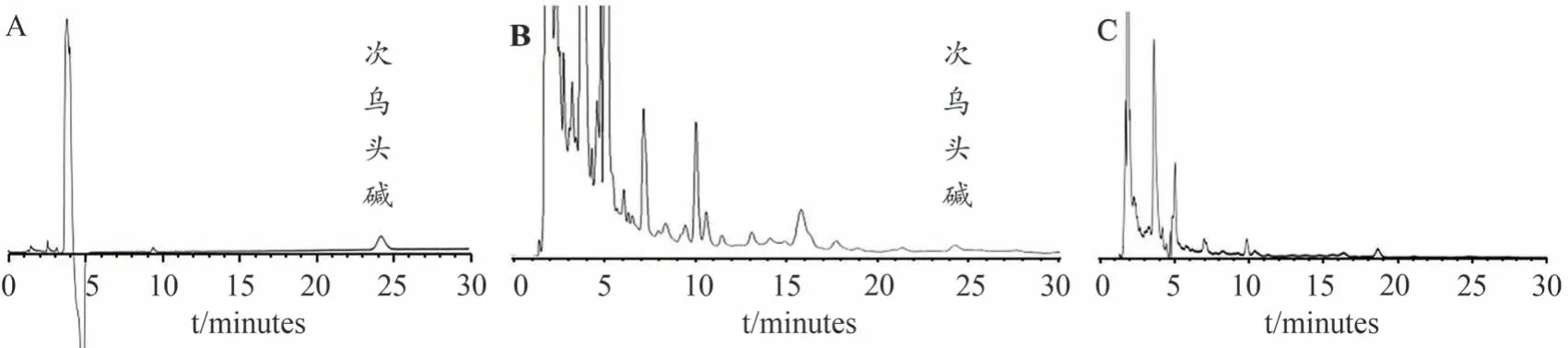
图1 对照品溶液(A)、供试品溶液(B)和阴性样品溶液(C)的高效液相色谱图
2.5.6 线性关系考察
精密称取次乌头碱对照品依次配制成100.00、50.00、25.00、12.50、6.25 μg·mL-1系列对照品溶液,分别按“2.5.1”项下色谱条件进样分析。以峰面积为纵坐标(Y),质量浓度为横坐标(X),进行线性回归分析,并绘制标准曲线,得方程:Y=1296 6X+2851 8,R2=0.999 6,表明次乌头碱在6.09-973.95 μg·mL-1范围内浓度与峰面积线性关系良好。
2.5.7 精密度考察
按“2.5.1”项下色谱条件,精密吸取对照品溶液10 μL,连续进样6 次,测得次乌头碱精密度RSD 为2.1%,表明仪器精密度良好。
2.5.8 稳定性考察
按“2.5.1”项下色谱条件分别在0、2、4、6、8、12 h时,精密吸取“2.5.3”项下供试品溶液10 μL,进样分析,测得次乌头碱稳定性RSD 为1.8%,表明供试品溶液在12 h内稳定性良好。
2.5.9 重复性考察
按“2.5.1”项下色谱条件,制备“2.5.3”项下供试品溶液平行6份,精密吸取10 μL,进样,测得次乌头碱重复性RSD为2.4%,表明供试品溶液重复性良好。
2.5.10 加样回收率考察
精密量取9 份已知浓度供试品溶液,分别加入样品含量80%、100%、120%的对照品溶液各3 份,按“2.5.1”项下色谱条件进样分析,测得次乌头碱80%、100%、120% 的平均加样回收率分别为108.54%、106.47%、103.24%,RSD 分别为1.72%、1.62%,1.91%,回收率符合要求。
2.6 丁香酚含量测定方法的建立
2.6.1 色谱条件
色谱条件参照原膏方法[10]:采用DB-WAX 色谱柱(30 m×0.25 mm,0.25 μm);程序升温,起始温度115℃保持1 min,以每分钟15℃升温至190℃,保持4 min,再以每分钟20℃升温至210℃,保持15 min,测定;进样口温度220℃;检测器温度250℃;流速1.0 mL·min-1;载气为氮气;分流比20∶1;进样量1 μL。
2.6.2 对照品溶液的制备
精密称取丁香酚对照品适量,加醋酸乙酯溶解成浓度为1 mg·mL-1的对照品母液。精密吸取对照品母液,加乙酸乙酯稀释成浓度为62.50 μg·mL-1的对照品溶液,备用。
2.6.3 供试品溶液的制备
精密称定CNPRG100 g,置1000 mL 烧瓶中,加水约250 mL,连接挥发油测定器,自测定器上端加水充满刻度部分,并溢入烧瓶为止,再加醋酸乙酯3 mL,连接回流冷凝管,缓缓加热至沸,并保持微沸4 h,将挥发油测定器中的溶液移至分液漏斗中,分取醋酸乙酯层,水层用醋酸乙酯提取1次,再用醋酸乙酯多次洗涤挥发油测定器和分液漏斗,合并上述醋酸乙酯液,转移至25 mL量瓶中,加醋酸乙酯至刻度,摇匀,即得。
2.6.4 阴性样品溶液的制备
①不含丁香样品溶液的制备:精密称取不含丁香的CNPRG100 g,与“2.6.3”项相同方法制备。②不含处方药物样品溶液的制备:精密称取不含处方药物的CNPRG100 g,与“2.6.3”项相同方法制备。
2.6.5 专属性考察
分别将对照品溶液、供试品溶液、不含丁香样品溶液和不含处方药物样品溶液,按“2.6.1”项下色谱条件进样分析,丁香酚与其他组分色谱峰均达到基线分离,在丁香酚出峰的地方,不含丁香样品溶液有出峰,但面积较小,而不含处方药物样品溶液无干扰,推测是处方中其他药物含有丁香酚导致出峰,经文献调研得出肉桂[11]、白芷[12]、徐长卿[13]中含有丁香酚,而细辛[14]、川芎[15]含有甲基丁香酚因而有峰出现。因而不影响丁香酚含量测定(图2)。
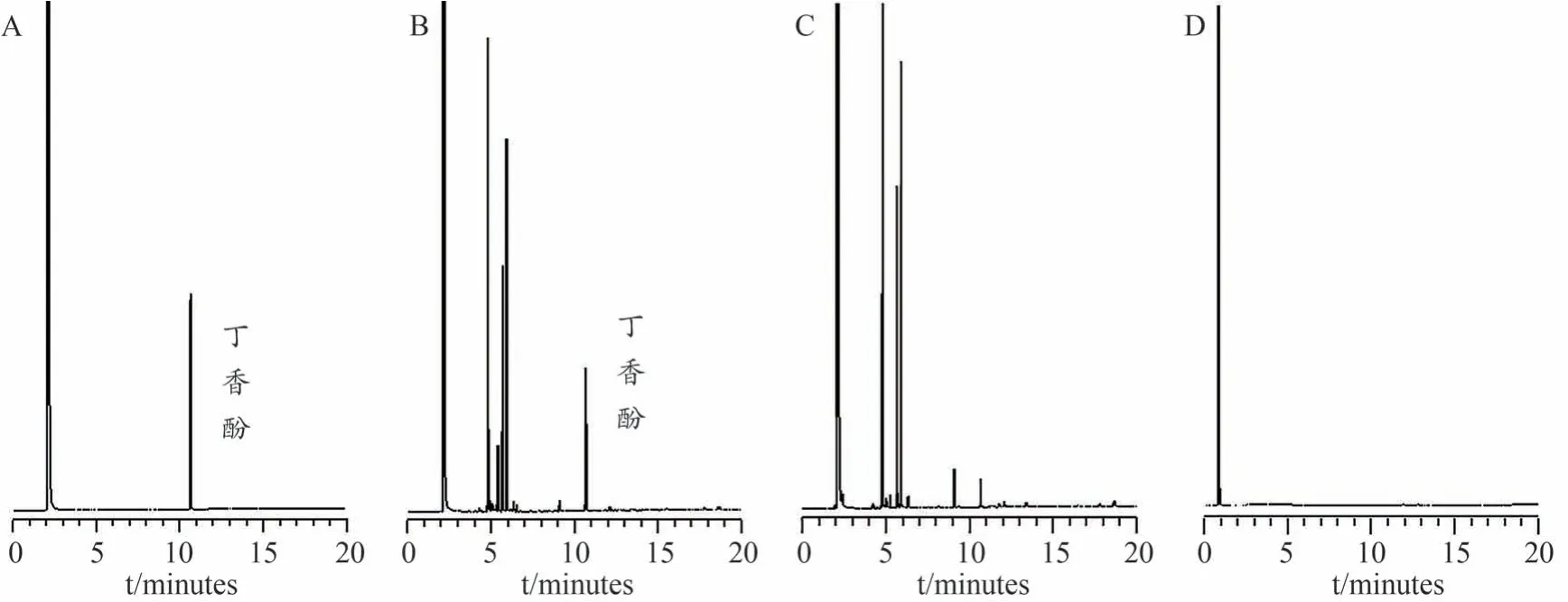
图2 对照品溶液(A)、供试品溶液(B)、不含丁香样品溶液(C)、不含药物样品溶液(D)的GC图
2.6.6 线性关系考察
吸取丁香酚对照品储备液适量,分别制备含丁香酚浓度为1000.00、500.00、100.00、50.00、25.00、12.50、6.25 和3.13 μg·mL-1的溶液,按“2.6.1”项下色谱条件进样分析。以峰面积为纵坐标(Y),质量浓度为横坐标(X),进行线性回归分析,并绘制标准曲线,得方程:Y=0.562 9X+2.530 4,R2=0.999 3,说明丁香酚在3.14-100 5.91 μg·mL-1范围内浓度与峰面积线性关系良好。
2.6.7 精密度考察
按“2.6.1”项下色谱条件,精密吸取对照品溶液1 μL,连续进样6 次,测得丁香酚RSD 为1.30%,表明仪器精密度良好。
2.6.8 稳定性考察
按“2.6.1”项下色谱条件分别在0、2、4、6、8、12 h时,精密吸取“2.6.3”项下供试品溶液1 μL,进样分析,测得丁香酚RSD 为0.73%,表明供试品溶液在12 h 内稳定性良好。
2.6.9 重复性考察
按“2.6.1”项下色谱条件,制备“2.6.3”项下供试品溶液平行6 份,精密吸取1 μL,测得丁香酚RSD 为0.6%,表明供试品溶液重复性良好。
2.6.10 加样回收率考察
精密量取9 份已知浓度供试品溶液,分别加入样品含量80%、100%、120% 对照品溶液各3 份,按“2.5.1”项下色谱条件进样分析,测得丁香酚的平均加样回收率分别为95.27%、98.64%、105.57%,RSD 分别为0.70%、0.87%、0.54%,符合要求。
2.7 CNPRG质量评价
2.7.1 外观、pH值、黏度、稳定性、次乌头碱含量、丁香酚含量
质量评价结果见表10,各项检测结果均合格,表明CNRPG制备方法合理、质量稳定、评价方法科学。

表10 质量评价表
2.7.2 挥发性成分鉴别
鉴别参考原膏方法[10],取丁香酚、桂皮醛对照品,加乙酸乙酯制成每1 mL分别含16 μL与2 μL的溶液;另取樟脑、冰片及丹皮酚对照品加乙酸乙酯制成每1 mL各含5 mg的溶液,以上混合作为对照品溶液。采用DB-WAX 色谱柱(30 m×0.25 mm,0.25 μm);程序升温,起始温度90℃保持1 min,以每分钟3℃升温至190℃,保持1 min,再以每分钟20℃升温至210℃,保持10 min,测定;进样口温度220℃;检测器温度250℃;流速1.0 mL·min-1,分流比20:1,载气为氮气。分别取“2.6.3”项下的供试品溶液与上述对照品溶液适量,注入气相色谱仪。在供试品色谱图中呈现与混合对照品色谱图中各对照品保留时间相同的色谱峰(见图3)。
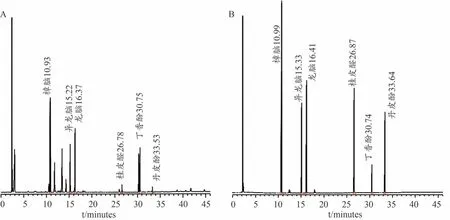
图3 供试品溶液(A)、混合对照品溶液(B)的GC图
2.8 CNPRG皮肤致敏性评价
2.8.1 分组与给药
根据《中药、天然药物免疫毒性(过敏性、光变态反应)研究的技术指导原则》[16],选取健康豚鼠46 只,雌雄各半,共有46 只豚鼠,原膏组16 只,其余每组10 只。分为4 组:阴性对照组,涂抹生理盐水每只0.4 mL;阳性对照组,1-氯-2,4-二硝基氯代苯每只0.4 mL;原膏组,复方南星止痛膏给药每只3 cm×3 cm;凝胶组,CNPRG给药每只3 cm×3 cm。
2.8.2 对照品配制
①阴性对照品:自配氯化钠注射液。②阳性对照品:给药当天称取适量1-氯-2,4-二硝基苯,加适量的95%乙醇溶解,借助加热(45°C)处理至完全溶解,使其浓度为10 mg·mL-1,用于致敏给药。给药当天称取适量1-氯-2,4-二硝基苯,加适量的丙酮溶解,借助加热(45°C)至完全溶解,使其浓度为1 mg·mL-1,用于激发给药。
2.8.3 致敏、激发及结果
第0 天、第7 天和第14 天进行致敏,末次致敏14天后进行激发。
给药6 h 后观察72 h 内皮肤过敏反应情况,并按照指导原则中皮肤过敏反应程度的评分准则表评分,按指导原则中皮肤致敏性评价标准表计算发生率。
结果见表11,阴性对照组和凝胶组动物给药局部皮肤均未见红斑和水肿,致敏率均为0%,无致敏性;原膏组动物激发后,5/10 动物给药局部可见轻度至中度红斑和/或轻度水肿,致敏率为25%,具有轻度致敏性;阳性对照组动物激发后,7/10 动物给药局部可见轻度至中度红斑和/或轻度至中度水肿,致敏率为70 %,具有高度致敏性。结果表明CNPRG 缓解缓解了原膏的致敏性。
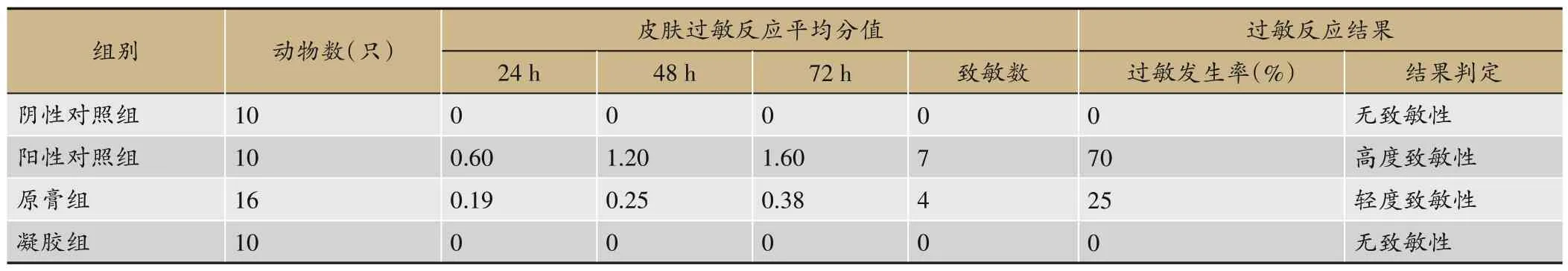
表11 皮肤过敏反应结果总结表
3 讨论
3.1 处方评价及优化
凝胶剂具有辅料种类少、皮肤相容性好、不易致敏等优势,制备工艺简单通过查阅文献[7-9],从多种制备辅料中优选出最常用基质如保湿剂:甘油、pH 调节剂:三乙醇胺,在选择常用凝胶骨架材料时,比较了Carbopol 940 和Carbopol 980NF,最终选择含苯量更少的Carbopol 980NF,然后通过单因素考察确定以上用量范围,有望为复方南星止痛膏新剂型开发提供方向。
凝胶剂处方近年常用优化方法包括响应面法[17-21]、正交设计[22]、均匀设计法等。正交设计采用直观分析法(方差分析)分析试验数据,即分析各水平的极差,极差最大者为最优,因此只能确定主要因素,而无法确定其对指标的具体影响程度;而均匀设计法因实验次数太少,难以保证准确性和预测性;本实验选择采用较为常见的box-bohenken 结合响应面法,与中心组合设计结合响应面法相比,存在实验数更少的优势,其采用多种模型方程回归来拟合因素与响应值之间的函数关系,从而建立合适模型,再通过模型拟合函数来寻找最优处方;最终本实验成功优化出最佳处方:卡波姆用量0.35 g,载药量1.02 g,pH 值6.20,甘油用量5.00 g。
3.2 质量评价
凝胶质量评价参考文献[21]及2020 版《中国药典》凝胶剂制剂检查[23]和复方南星止痛膏原标准[10],选择处方中挥发性成分丁香酚、毒性成分次乌头碱作为质控成分,初步建立了外观、pH、黏度、离心稳定性、热稳定性、低温稳定性、气相成分鉴别、次乌头碱及丁香酚含量测定等质量指标评价方法。复方南星止痛凝胶通过以上质量指标评价,证明其制备方法合理、成品质量稳定,可作为复方南星止痛膏新剂型开发的选择方向。
复方南星止痛膏原工艺将处方中各味药均以细粉形式直接制成橡胶膏剂,本次制备新型制剂凝胶并未改变前处理及制备工艺,而且凝胶剂自身亦存在载药量较少的局限,导致复方南星止痛凝胶载药量较少,对其开展体外透皮研究和药效研究时凝胶用量较大,因此后期研究将着重于探索并建立复方南星止痛凝胶科学、合理、稳定的体外透皮研究和药效研究。
3.3 致敏性评价
CNPRG 致敏性评价参考《中药、天然药物免疫毒性(过敏性、光变态反应)研究的技术指导原则》[11],设置原膏组与凝胶组进行比较试验,结果表明凝胶剂确能缓解原膏的致敏反应。在不改变制备工艺的基础上,凝胶剂通过改良基质,将潜在致敏辅料[3]更换为皮肤相容性好、无毒、无刺激的卡波姆、甘油、水,从而缓解原膏的致敏性[5],因此可为复方南星止痛膏的剂型改良提供参考,也为存在过敏现象的中药贴膏剂型改良提供借鉴意义。
