哈茨木霉WF2 菌株鉴定及对烟草黑胫病的防效
2023-12-20黎妍妍姚经武曹春霞黄大野
危 潇,黎妍妍,姚经武,曹春霞,黄大野
(1.湖北省生物农药工程研究中心/国家生物农药工程技术研究中心/农业农村部微生物农药创制重点实验室,武汉 430064;2.湖北工业大学,武汉 430068;3.湖北省烟草科学研究院,武汉 430030)
木霉菌(Trichodermasp.)作为一类重要的生防真菌,广泛存在于自然界中,通常定居在腐烂的木材和其他形式的有机基质中,具有分布广、适应性强、繁殖快等特点[1,2]。木霉属包括多个菌种,有超过400 多个种类[3]。在农业防治上,常用的有绿木霉(T.virens)、长枝木霉(T.longibrachiatum)、绿色木霉(T.viride)、康宁木霉(T.koningii)、哈茨木霉(T.harzianum)、棘孢木霉(T.asperellum)、深绿木霉(T.atroviride)、盖姆斯木霉(T.gamsii)等[3]。它既可以作为生物防治剂,也可以作为生物促进剂。木霉可以使用多种复杂的直接和间接生物防治机制[4]来防治多种植物病害,既可以对抗生物胁迫如广谱病原微生物(真菌、细菌、昆虫和线虫)等,也可以对抗非生物胁迫如恶劣的环境条件等。对病原体的直接影响包括细胞壁降解酶(CWDEs)的产生、抗生素的合成、对空间和营养物质(主要是碳、氮和铁)的竞争以及与真菌病原体建立直接的寄生关系[4]。
烟草是中国重要的经济作物,但烟叶生产主要依赖化学农药防治土传病害,长期使用化学农药易导致病原菌抗药性增强,同时还会造成环境污染[5]。因此,需探索出绿色、有效的烟草土传病害防治方法。与化学农药相比,生物农药具有高效、选择性强、低残留、不易产生抗药性等优点。在环境保护、绿色发展等理念的支持下,生物农药已成为生物防治领域的研究热点[5]。
本研究从湖北省五峰县烟田土壤中分离获得1株木霉,通过生物学特征分析和分子生物学手段鉴定其种类,并采用对峙试验和活体盆栽试验测定其对烟草黑胫病菌和烟草根腐病菌,即烟草疫霉(Phytophthora nicotianae)和尖孢镰刀菌(Fusarium oxysporum)的生防效果,为利用绿色环保的生物农药防治烟草病害提供应用基础。
1 材料与方法
1.1 供试材料及培养基
供试木霉菌株WF2 分离自湖北省五峰县烟田土壤样品。供试病原真菌烟草疫霉和尖孢镰刀菌由湖北省生物农药工程研究中心提供。供试烟草为云烟87。培养基为马铃薯琼脂葡萄糖(PDA)培养基:去皮马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 L、pH 自然;马铃薯琼脂葡萄糖(PDB)培养基:去皮马铃薯200 g、葡萄糖20 g、蒸馏水1 L、pH 自然;V8培养基:V8 汁220 mL、碳酸钙2 g、琼脂18 g、蒸馏水1 L,pH 自然;发酵培养基:麸皮50 g、蒸馏水50 g、pH 自然。
1.2 哈茨木霉的分离纯化培养
称取10 g 土壤样品,加入90 mL 无菌水,室温下150 r/min 振荡培养30 min。吸取上清液,采用10 倍梯度稀释法分离木霉[6],每个PDA 培养基平板上均匀涂布100 μL 土壤稀释液。培养4~5 d,在稀释液平板上挑取单菌落在PDA 培养基上进行纯化培养,重复3~4 次后得到纯化菌株,编号WF2。
1.3 哈茨木霉的系统分类学鉴定
1.3.1 木霉菌株的形态学观察 将分离纯化后的菌株WF2 接种于PDA 培养基上,28 ℃恒温避光培养7 d,每24 h 观察菌落形态(包括颜色、质地等)[7]。
1.3.2 木霉菌株的分子生物学鉴定 对分离到的菌株进行ITS-PCR 扩增,所用引物为通用引物ITS1(5'TCCGTAGGTGAACCTGCCG3')和ITS4(5'TCCT CCGCTTATTGATATGC3')。PCR 扩增体系为:DNA模板1 μL、2×PCR Master Mix 25 μL、引物ITS1 和ITS4 各1 μL、ddH2O 22 μL。扩增条件为:94 ℃预热5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃复性10 min,扩增产物在4 ℃条件下保存。取5 μL扩增产物与1 μL Loading buffer混匀,加入1%琼脂糖凝胶孔中,用DNA Marker 作对照,在1×TAE 电泳缓冲液中电泳,以凝胶成像系统检测PCR 扩增产物,委托测序公司测序。运用MEGA 11 软件,使用邻接法(Neighbor-Joining,NJ法)构建系统发育树,同时计算遗传距离。
1.4 哈茨木霉WF2 离体抑菌活性测定
参考田淼等[8]的研究方法,使用无菌打孔器(直径5 mm)在WF2 菌株和病原真菌的菌落边缘打取菌饼,用于对峙培养。处理组,将菌株WF2 的菌饼和病原真菌的菌饼分别接种至PDA 平板(直径90 mm)上,二者之间的距离为45 mm。对照组,只接种病原真菌。28 ℃恒温避光培养,每组3 次重复。10 d 时观察并用十字交叉法测量菌落直径,计算抑菌率,计算式如下。
竞争作用测定。使用覆盖度表示木霉菌株对目标病原真菌的寄生能力,参照陈书华等[9]的方法对木霉拮抗系数进行分级,Ⅰ级:木霉菌菌丝覆盖率100%;Ⅱ级:木霉菌菌丝覆盖率≥2/3;Ⅲ级:1/3≤木霉菌丝覆盖率<2/3;Ⅳ级:木霉菌菌丝覆盖率<1/3;Ⅴ级:病原菌菌丝覆盖率100%。
1.5 木霉对烟草疫霉的盆栽防效试验
1.5.1 木霉菌剂的制备 使用无菌打孔器(直径5 mm)在WF2 菌株的菌落边缘打取菌饼,在每瓶PDB 培养基中放置1 块菌饼,于28 ℃、150 r/min 摇床振荡培养48 h,获得WF2 种子液。以10%的接种量将WF2 种子液接种于发酵培养基中,于28 ℃培养箱中培养15 d。将发酵完成的培养基于45 ℃烘箱烘干水分后,粉碎机打碎成粉剂备用,即得WF2 菌剂。
1.5.2 病原真菌菌悬液的制备 将活化好的烟草疫霉菌饼转接于V8 培养基平板中,光照培养14 d,用无菌水将病原菌菌丝及孢子从平板上洗脱下来,按照李小杰等[10]的方法,放入4 ℃冰箱中处理30 min,再在常温下放置20 min,促进菌丝释放孢子,调节成1×106CFU/mL 孢子悬浮液备用。
1.5.3 烟草黑胫病防治试验设计 将烟草种子(云烟87)播种于装有基质(草炭∶蛭石=3∶1,质量比)的育苗钵中[11],待生长至6 叶期备用。挑选长势一致的烟苗分为4 个处理组,每处理3 个重复,每个重复15 株烟苗。即CK,清水;T1,WF2 菌剂稀释150 倍;T2,WF2 菌剂稀释300 倍;T3,太抗木每灵水分散粒剂稀释300 倍。采用生防菌菌液灌根处理的方式测定其对烟草黑胫病的防效,处理前先将每株烟苗接种20 mL 菌液。施药24 h 后,接种烟草疫霉孢子悬浮液5 mL/钵。14 d 后调查病情指数与防治效果。
1.5.4 病情指数与防治效果 烟草黑胫病分级标准参照《烟草病虫害分级及调查方法》[12](GB/T 23222—2008),0 级,全株无病;1 级,茎部病斑不超过茎围的1/3,或1/3 以下叶片凋萎;3 级,茎部病斑环绕茎围1/3~1/2,或1/3~1/2 叶片轻度凋萎,或下部少数叶片出现病斑;5 级,茎部病斑超过茎围的1/2但未全部环绕茎围,或1/2~2/3 叶片凋萎;7 级,茎部病斑全部环绕茎围,或2/3 以上叶片凋萎;9 级,病株基本枯死。
1.6 数据处理
使用SPSS 26.0 软件进行统计学分析,在0.05 水平上采用LSD法对数据进行差异显著性检验。使用MEGA 11 软件进行系统发育树分析。
2 结果与分析
2.1 木霉菌株的形态学观察
菌株在PDA 培养基上生长迅速,培养3 d 时出现白色絮状菌丝且铺满整个平板,之后菌丝逐渐变为绿色,培养7 d 时菌丝变为暗绿色,无明显气味,菌落形态特征与哈茨木霉菌株基本一致(图1)。
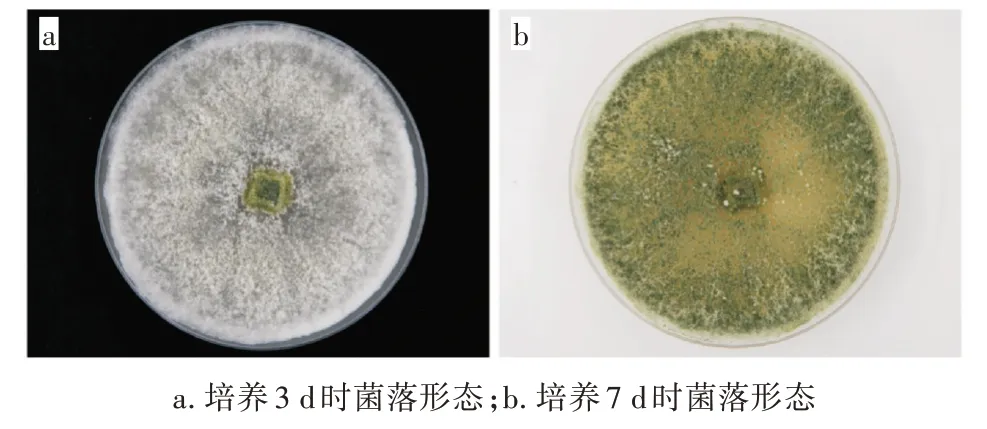
图1 菌落的形态学观察
2.2 木霉菌株的分子生物学鉴定
将WF2 的测序结果经过BLAST 后,ITS 片段与Trichoderma harzianumQT2209(KY225652.1)序列相似度达99.85%。应用MEGA 11 软件与BLAST 比对相近菌株的序列,利用邻接法构建系统发育树。结果表明,WF2 与Trichoderma harzianumQT2209(KY225652.1)为同一个分支(图2)。综合形态学观察和系统发育树结果,确定菌株WF2 为哈茨木霉。

图2 菌株WF2 系统发育树
2.3 哈茨木霉WF2 离体抑菌活性测定
哈茨木霉WF2 与两种病原真菌的对峙培养结果表明,WF2 在PDA 平板上生长迅速,培养3 d 时即对两种病原真菌产生明显抑制效果,培养10 d 时,WF2 的菌丝已完全覆盖在病原真菌的菌丝上,对两种病原真菌的覆盖度均为Ⅲ级(图3、表1)。
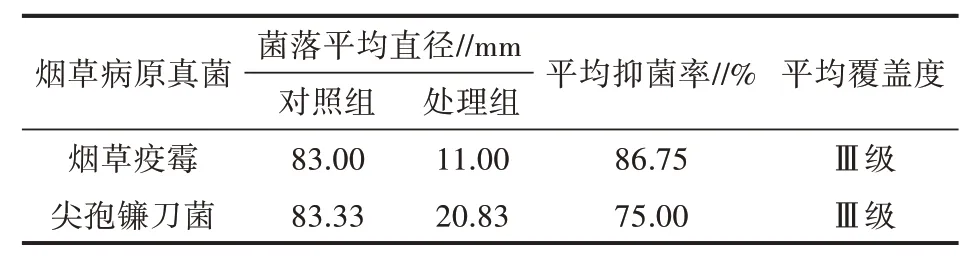
表1 木霉菌株WF2 对两种烟草病原真菌的抑制效果

图3 哈茨木霉WF2 与两种病原真菌的对峙培养
通过测量培养10 d 时各处理的菌落直径,计算出木霉菌株WF2 对两种烟草病菌的抑制率和覆盖度。通过表1 可以看出,WF2 对烟草疫霉和尖孢镰刀菌具有较强的抑制效果。对烟草疫霉的平均抑制率达到86.75%,对尖孢镰刀菌的平均抑制率达到75.00%。
2.4 木霉对烟草疫霉的盆栽防效试验
室内盆栽结果表明,与CK 相比,WF2 菌株和商品菌剂太抗木每灵均能显著降低烟草黑胫病的病情指数,使用WF2 菌株处理过的烟苗生长情况良好(图4)。T1 的烟草黑胫病病情指数仅为12.28%,防效达到80.23%;T2 的烟草黑胫病病情指数为19.40%,防效达到68.77%;T3 的烟草黑胫病病情指数仅为6.25%,防效达到89.94%。商品菌剂太抗木每灵防治效果优于木霉菌株WF2,但两者均具有明显的防治烟草黑胫病的能力(表2)。

表2 木霉菌株WF2 对烟草疫霉的盆栽防治效果(单位:%)

图4 木霉菌株WF2 对烟草疫霉盆栽防治效果
3 小结与讨论
在农业生产中,由于化肥农药的大量使用,导致环境污染、生态失衡、农产品品质下降及农残超标等问题日益严重。木霉菌因其应用广泛、防病效果显著被越来越多地应用在生物防治中。木霉对多种植物病原真菌都有防治效果。据统计,木霉至少对18 个属29 个种的植物病原真菌有拮抗作用。包括水稻纹枯病菌(Rhizoctonia solani)[13]、镰刀菌属(Fusariumspp.)[14]、核盘菌(Sclerotinia sclerotiorum)[15]、黄曲霉(Aspergillus flavus)[16]、炭疽菌属(Colletotrichum)[17]等。它能够通过直接作用机制(真菌寄生、产生裂解酶、抗生物质、争夺空间或养分)或间接作用机制(诱导植物防御)来减少病原体引起的植物疾病。
本研究从湖北省五峰烟田土壤中分离获得1 株木霉WF2,结合形态学特征和分子学(ITS 序列)比对,鉴定为哈茨木霉。通过对峙试验分析,发现该菌株对烟草病原菌(烟草疫霉、尖孢镰刀菌)具有显著抑制效果。抑制率分别达到86.75%和75.00%,且对两种病菌的覆盖度均达到Ⅲ级,寄生效果优良,可完全抑制病原真菌的生长。后续进行了盆栽试验,发现该菌株对烟草黑胫病防治效果显著,其150 倍孢子稀释液(T1)防治效果达到80.23%,接近商品菌剂太抗木每灵的防治效果。后续将利用该菌株进行田间病害的相关研究,进一步验证该菌株对烟草病害的防治效果。
