UPLC-MS/MS法同时测定中药注射液中5种生物胺的含量
2023-12-08鄢长余赵月然
齐 越 鄢长余 矫 建 赵月然▲
1.徐州医药高等职业学校药学技术系,江苏徐州 221116;2.大连市检验检测认证技术服务中心,辽宁大连 116021
生物胺是一类具有生物活性、含氨基的低分子质量化合物,广泛存在于动植物体内,常见的生物胺类化合物有组胺、色胺、腐胺、尸胺、精胺、亚精胺及酪胺等。研究发现,摄入适量的生物胺具有促进动植物生长、增强代谢活力、增强免疫力和清除自由基的作用,但是生物胺的过量摄入则可对机体产生伤害,如头痛、恶心、呕吐、腹泻、心悸及呼吸紊乱等过敏反应,甚至危及生命[1-3]。生物胺常被看作是代表产品质量和安全的标志[4-7]。因此,建立灵敏便捷的生物胺检测技术对人体健康风险预警和防范十分必要,尤其对于中药注射剂(traditional chinese medicine injection,TCMI)中生物胺的安全评估具有非常重要的意义。经查阅相关文献[8-16],中药对生物胺的相关研究主要集中在中药材,对TCMI的研究几乎空白,因此本文参考相关文献[17-18],建立了采用液质联用同时测定TCMI中5种生物胺含量的检测方法,对TCMI的安全性监测提供参考。
1 仪器与试药
1.1 仪器
Agilent 1290/Agilent 6460超高效液相色谱-质谱联用系统,配有QQQ Quantitative Analysis工作站和Quantitative Analysis B.05.00工作站(Agilent公司);BP211D型和LE244S型电子天平(satorius公司)。
1.2 试药
组胺(批号:BCCD9621,纯度100.0%)、腐胺(批号:BCCG9566,纯度100.0 %)、酪胺(批号:BCCG2965纯度,99.3%)、色胺(批号:BCCF9479,纯度99.2%)、亚精胺(批号:BCCF5855纯度99.7%)5种对照品均购自美国Sigma-Aldrich公司。乙腈、甲酸、甲酸铵为色谱纯,水为超纯水。收集中药注射液样品9批次,见表1。
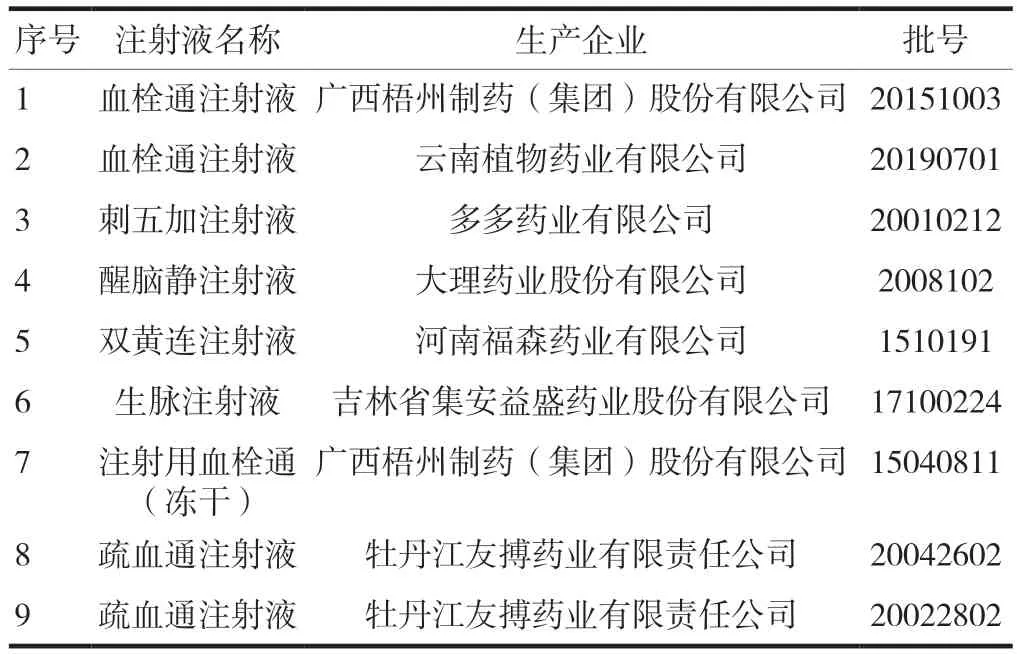
表1 9批中药注射液样品
2 方法与结果
2.1 色谱及质谱条件
色谱条件:色谱柱为Waters ACQUITY UPLC BEHHILIC 柱(100 mm×2.1 mm,1.7 μm),流动相,A:20 mmol/L甲酸铵(甲酸调pH为4.0),B:乙腈,梯度洗脱程序:0~2 min,90%~80% A,2~5 min,80%~75%A,5~6 min,75%~40%A,6~9 min,40% A,9~12 min,40%~90% A。流速:0.3 ml/min,温度:40℃,进样量1 μl。
质谱条件:采用电喷雾离子源,正离子扫描方式(ESI+);多反应监测模式(MRM);喷雾压力45 psi;干燥气流速6 L/min;毛细管电压3500 V;干燥气温度350℃。质谱检测参数见表2。

表2 5种化学成分的质谱检测参数
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取组胺5.10 mg、腐胺6.01 mg、酪胺6.05 mg、色胺7.50 mg、亚精胺5.99 mg,分别置20 ml量瓶中,加甲醇溶解至刻度,摇匀;再分别精密量取1 ml,置20 ml量瓶中,加甲醇至刻度,摇匀,作为对照品溶液。5种生物胺对照品提取的MRM质谱图见图1。
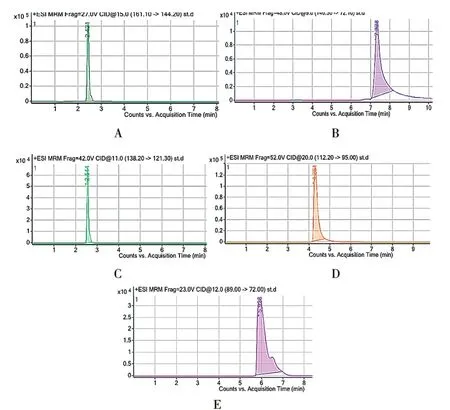
图1 5种生物胺对照品提取的MRM质谱图
2.2.2 供试品溶液 精密量取疏血通注射液供试品(样品9)5 ml,置10 ml量瓶中,加乙腈定容至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,取续滤液,作为供试品溶液。疏血通注射液供试品(样品9)提取的MRM质谱图见图2。

图2 疏血通注射液供试品(样品9)提取的MRM质谱图
2.3 方法学考察
2.3.1 线性范围 分别精密称取5种对照品,加甲醇制成每毫升含1、5、10、20、50、100 ng的混合溶液,按“2.1”项下色谱、质谱条件分别进样测定。以对照品的质量浓度X(ng/ml)为横坐标,峰面积Y为纵坐标,绘制标准曲线,计算回归方程。见表3。

表3 线性关系
2.3.2 检出限与定量限 以信噪比3(S/N)为方法的检出限,信噪比10(S/N)为方法的定量限,经实验得出组胺、腐胺、酪胺、色胺、亚精胺五种生物胺的检出限分别为1.0、2.0、1.5、3.0和2.0 μg/L,定量限分别为3.0、6.0、5.0、6.0和5.0 μg/L。
2.3.3 加样回收率 精密称取组胺、腐胺、酪胺、色胺、亚精胺对照品,加甲醇制成每毫升含10 ng的混合溶液,作为回收率试验的加标溶液。取已知含量的样品9份,分别每3份加入上述对照品加标溶液1.0、2.0、3.0 ml,进样测定,计算加样回收率。回收率在93.5%~98.2%,RSD均在1.0%以内,见表4。

表4 加样回收率试验结果(n=9)
2.3 样品的测定结果
取10批注射液样品各2份,按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下条件进样,记录峰面积以并计算含量。血栓通注射液(151003)和醒脑静注射液中五种生物胺均未检测到,疏血通注射液中腐胺、酪胺及亚精胺含量较高。见表5。

表5 样品含量测定结果(μg/ml)
3 讨论
随着中药注射剂在临床的广泛应用,其不良反应的发生率逐渐增多,而过敏反应主要是由生物胺类物质引起的。组胺是常见的生物胺,其主要的表现为外周阻力降低,血压快速下降[19-20];酪胺、色胺能够刺激血管平滑肌,使血压上升[21];腐胺是亚精胺的前体,可减少组胺代谢,增强毒性[22]。
本试验建立了一种在正离子多反应监测(MRM)模式下快速测定中药注射液中5种生物胺的UPLC-MS/MS测定方法。流动相为乙腈-20 mmol/L甲酸铵,梯度洗脱,流速0.3 ml/min。采用强极性色谱柱HILIC柱,样品无需前处理。结果显示组胺、腐胺、酪胺、色胺、亚精胺出峰时间短,分离效果较好,梯度洗脱可以兼顾以上5种生物胺的保留行为,对照品及供试品中生物胺的质谱相应值较好。
本试验考察了丹磺酰氯衍生化和直接稀释两种样品前处理方法。生物胺衍生化操作复杂,对照品及样品均需柱前衍生化操作,试验重复性较差,且丹磺酰氯毒性较大,试验危险性较高。故本试验采用直接稀释法对样品进行前处理。
由于生物胺的极性比较强,对于极性强的化合物,在十八烷基键合相的色谱柱中,保留时间较短,极易流出,故采用强极性色谱柱HILIC柱,对生物胺的分离及保留效果较好。
本实验考察了乙腈-水,乙腈-甲酸铵,乙腈-甲酸铵(含0.02 mol/L甲酸)等多种流动相系统,由于甲酸可以提供质子,所以离子化的效率也得到提高,同时质谱的响应也得到了优化。故选择乙腈-含0.02 mol/L甲酸铵(甲酸调pH=4)为流动相。
此种检测方法,在柱温40℃下,可满足TCMI中生物胺的分析检测要求。组胺、腐胺、酪胺、色胺、亚精胺均可在10 min内得到良好分离,线性范围为1~200 ng/ml(r> 0.999),组胺、腐胺、酪胺、色胺、亚精胺五种生物胺的检出限分别为1.0、2.0、1.5、3.0和2.0 μg/L。通过对9批次的TCMI样品进行检测,其生物胺总量在0~31.5825 μg/ml。
在们检测的9批中药注射液中均未检出色胺,其中1号和4号样品中五种生物胺均未检出,可能与其制备工艺有关。样品8号和9号均为同一厂家生产的不同批号的疏血通注射液,主要原料为动物药水蛭、地龙,结果显示,五种生物胺中除色胺未检出外,余下的四种生物胺含量均较高;而在植物药来源的2号、3号、5号、6号、7号注射液的检测中,生物胺含量远低于样品8号和9号。以上原因的出现可能与样品8号和9号中动物药中氨基酸含量较高,游离氨基酸均极易通过脱羧反应降解为生物胺有关。
由于本方法为直接测定法,生物胺中组胺及腐胺的稳定性较差,需要在12 h内测定完成。目前,可用于中药注射液的生物胺测定。本方法简单方便,样品无须前处理,可为TCMI中生物胺的检测提供有效的实验支持,也可以为TCMI的安全性评估、临床安全用药提供一定的数据支持。
