基于RPA/CRISPR-Cas12a技术的单核细胞增生李斯特菌快速检测方法建立
2023-12-05陈大伟李兵兵魏明月李双姝杨鹏飞刘靓
陈大伟 李兵兵 魏明月 李双姝 杨鹏飞 刘靓

摘 要:建立基于RPA/CRISPR-Cas12a技术单核细胞增生李斯特菌的快速检测方法。选取单增李斯特菌溶菌素毒力基因hly(GeneID:987033),设计重组酶聚合酶扩增(recombinase polymerase amplification,RPA)引物结合CRISPR-Cas12a蛋白研制两步法单增李斯特菌快速检测试剂盒,并对其灵敏度、特异性以及反应速率进行分析。结果表明:该法检测速率快,30 min内可检出单核细胞增生李斯特菌,同时具有较高的灵敏度,20 μL体系可检测到最低0.0015 ng靶标核酸。将该试剂盒进一步用于检测人工模拟污染食品三文鱼肉片,检测限可达10 CFU/mL。本方法检测30 份实际样本,结果均与荧光定量聚合酶链式反应法阳性检出率一致。RPA/CRISPR-Cas12a技术是快速检测食源性单增李斯特菌的可行方法。
关键词:单核细胞增生李斯特菌;重组酶聚合酶扩增;CRISPR-Cas12a;快速检测
Development of a Rapid Detection Method for Listeria monocytogenes Based on Recombinase Polymerase Amplification Combined with CRISPR-Cas12a Technology
CHEN Dawei, LI Bingbing, WEI Mingyue, LI Shuangshu, YANG Pengfei, LIU Liang*
(Huai’an Center for Disease Control and Prevention, Jiangsu Provincial Key Laboratory for Food Safety Risk Monitoring
(Pathogenic Bacteria), Huai’an 223003, China)
Abstract: Objective: To develop a rapid detection method for Listeria monocytogenes based on clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR associated protein 12a (Cas12a) combined with recombinase polymerase amplification (RPA). Methods: The virulence gene hly (GeneID: 987033) of L. monocytogenes was selected to design RPA primers, and a two-step rapid detection kit for L. monocytogenes was developed using RPA combined with CRISPR-Cas12a. The sensitivity, specificity, and reaction rate of the kit were analyzed. Results: This method was rapid and sensitive; it could detect L. monocytogenes within 30 minutes, and the minimum level of the target nucleic acid of 0.0015 ng
was detected using 20 μL of the system. Furthermore, when this kit was applied to detect artificially contaminated salmon fillets, the limit of detection was 10 CFU/mL, and the results for 30 actual samples were consistent with the positive detection rate obtained by fluorescence quantitative PCR. Conclusion: RPA combined with CRISPR-Cas12a is a feasible method for rapid detection of foodborne L. monocytogenes.
Keywords: L. monocytogenes; recombinase polymerase amplification; clustered regularly interspaced short palindromic repeats (CRISPR)-CRISPR associated protein 12a; fast detection
DOI:10.7506/rlyj1001-8123-20230710-066
中圖分类号:Q783.1 文献标志码:A 文章编号:1001-8123(2023)09-0046-06
引文格式:
陈大伟, 李兵兵, 魏明月, 等. 基于RPA/CRISPR-Cas12a技术的单核细胞增生李斯特菌快速检测方法建立[J]. 肉类研究,
2023, 37(9): 46-51. DOI:10.7506/rlyj1001-8123-20230710-066. http://www.rlyj.net.cn
CHEN Dawei, LI Bingbing, WEI Mingyue, et al. Development of a rapid detection method for Listeria monocytogenes based on recombinase polymerase amplification combined with CRISPR-Cas12a technology[J]. Meat Research, 2023, 37(9): 46-51. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230710-066. http://www.rlyj.net.cn
李斯特菌属是一种广泛分布于食品和自然环境中的革兰阳性菌。李斯特菌属包含单核细胞增生李斯特菌(以下简称单增李斯特菌)、英诺克李斯特菌、伊氏李斯特菌、斯氏李斯特菌、威尔士李斯特菌、格氏李斯特菌等[1],其中单增李斯特菌和伊氏李斯特菌对人和动物具有致病性[2-3]。这类致病菌对易感人群可引起自然流产、新生儿败血症、脑膜脑炎等疾病[4]。李斯特菌分布广泛,同时对极端环境的耐受性较强,因此在食品生产以及运输的多个环节均可引起食品污染[5-6]。近年,国内外关于李斯特菌引起的食品污染事件也时有发生,因此,对李斯特菌进行有效监测对于保障人类健康、减少经济损失、提高经济效益具有重要的意义。
目前,用于李斯特菌的检测方法主要有:1)培养法[7];2)免疫分析法,如酶联免疫吸附和胶体金免疫层析法[8-9];3)基于聚合酶链式反应(polymerase chain reaction,PCR)技术的方法,如荧光定量PCR[10-11];
4)等温扩增法,如环介导等温扩增法[10]。培养法是“金标准”,准确度高但耗时费力,适用于对检出速率要求低的场景。免疫法检测速率相对较快,但是灵敏度相对较低,单克隆抗体的制备成本也较高,适用于实验室内的快速筛查。PCR法以及等温扩增法属于核酸检测方法,灵敏度高,但是PCR法需要特定的PCR仪器,等温扩增法速率快不需要专门的PCR仪,但是等温扩增由于扩增温度相对较低,易产生非特异性扩增。规律成簇间隔短回文重复(clustered regularly interspaced shortpalindromic repeats,CRISPR)检测是一种速率快、灵敏度高、不易产生非特异性,且不依赖于昂贵仪器的方法,更适用于现场的及时检测。
CRISPR/CRISPR-associated protein(Cas)检测技术是近年来发展迅速的核酸检测技术,因其检测速率快、特异性强、便捷性高,受到极大关注[12-14]。近年来,将CRISPR-Cas检测技术与等温扩增技术相结合用于各类细菌和病毒的检测已有大量报道[15-16],两种技术的结合既利用CRISPR-Cas检测的高特异性和高灵敏度,又利用了等温扩增的便捷性,非常适用于现场及时检测。目前,将CRISPR-Cas检测技術应用于单增李斯特菌的研究相对较少。李焓笑[17]以iap基因转录的RNA为靶标利用Cas13蛋白检测单增李斯特菌;李凡[18]以LMOSLCC2755_0090基因为靶标进行重组酶聚合酶扩增(recombinase polymerase amplification,RPA)和CRISPR-Cas12a结合,利用电化学以及芯片等方法于一管内检测单增李斯特菌。以RNA为靶标在实际应用中可能存在易降解的问题,且RNA的检测环境要求较DNA高很多,不利于开展现场及时检测。电化学以及芯片等方法是较前沿检测方法,但也存在成本高、操作要求高等问题,用于现场及时检测存在一定困难。
本研究基于CRISPR-Cas12a蛋白和RPA技术以单增李斯特菌特异性溶血酶毒素基因hly为靶标,建立二步法快速检测单核细胞增生李斯特菌的检测体系,将RPA和CRISPR检测分开,结合可视化荧光报告探针,旨在提高检测的灵敏度和节约成本,更合适于现场的快速检测。
1 材料与方法
1.1 菌株与试剂
单增李斯特菌ATCC 19115、英诺克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威尔斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、肠炎沙门氏菌ATCC 14028、金黄色葡萄球菌ATCC 29213、大肠杆菌MG1655均为本实验室保存。
单增李斯特菌荧光定量检测试剂盒(50 rxn) 上海伯杰医疗科技有限公司;TwistAmp Liquid Basic Kit(100 rxn) 英国TwistDx公司;转录试剂盒T7 High Yield RNA Transcription Kit(50 rxn) 南京诺唯赞生物科技股份有限公司;CRISPR-Cas12a蛋白(5 pmol/μL) 上海惠诚生物科技有限公司;NEB Buffer 3.1、NEB Buffer 4、NEB CutSmart Buffer、Buffer(均为10×) New England Biolabs(北京)有限公司。
1.2 仪器与设备
3K15离心机 德国默克公司;ABIQ5实时荧光定量PCR仪、Qubit2.0荧光定量PCR仪 美国应用生物系统公司;DH209L电热恒温培养箱 天津泰斯特仪器有限公司;GelDoc XR Biorad凝胶成像系统 伯乐生命医学产品(上海)有限公司;DK-320S三用恒温水槽 上海精宏实验设备有限公司。
1.3 方法
1.3.1 菌株活化和菌液制备
将冻存的单增李斯特菌菌种在常温下解冻,并通过平板划线法,在胰酪大豆胨琼脂培养基上对其进行活化(37 ℃下恒温培养18 h)。然后,选取单个典型菌落接种于胰蛋白胨大豆肉汤培养基中,在37 ℃下180 r/min恒温振荡培养24 h。吸取1 mL培养后的菌液于1.5 mL无菌离心管中,10 000 r/min离心3 min,除去上清液,用0.9%生理盐水洗涤2 次并重悬,通过平板计数法确定菌落数。
1.3.2 引物合成
RPA引物用于扩增单增李斯特菌特异性毒力基因hly[19],转录引物用于将DNA转录成靶标crRNA,荧光探针ssDNA用于指示反应,引物均由生工生物工程(上海)股份有限公司合成。RPA引物和crRNA设计在https://ezassay.com/primer完成。转录引物合成后参照转录试剂盒T7 High Yield RNA Transcription Kit方法将DNA转录成crRNA备用。所用引物序列如表1所示。
1.3.3 RPA/CRISPR-Cas12a检测体系的构建
利用水煮法提取单增李斯特菌的DNA,根据TwistAmp Liquid Basic Kit说明方法扩增单增李斯特菌DNA;扩增体系:5 μL 5×反应缓冲液、1.25 μL醋酸镁溶液(280 mmol/L)、引物各1 μL、模板5 μL、11.75 μL RNase-free ddH2O2,于37 ℃恒温扩增15 min,扩增产物备用。20 μL检测体系[21]:1 μL CRISPR-Cas12蛋白溶液(5 pmol/μL)、2 μL crRNA (2 pmol/μL)、5 μL RPA扩增产物、2 μL NEB Buffer 4、2 μL ssDNA(10 pmol/μL)、8 μL RNase-free ddH2O2。根据实验需求在此检测体系基础上进行优化。
1.3.4 人工污染样品检测
取10 g三文鱼肉样品切碎后与90 mL无菌生理盐水(0.9 g/100 mL NaCl)混合,然后以中速均质15 min。在900 μL匀浆中加入不同浓度的单增李斯特菌,振荡混匀,使其终浓度分别达到101、102、103、104 、105 CFU/mL。配制的加标样品以500 r/min低速离心30 s,以去除大颗粒食品颗粒,上清液通过煮沸法提取核酸,用RPA/CRISPR-Cas12a检测体系进行检测,每个样品设置3 个平行。
1.3.5 市售样品的检测
考虑到市售样品检出单增李斯特菌的可能性较小,设置加标样。市售30 份三文鱼样品随机抽取3 份分别接种一定量的单增李斯特菌、大肠杆菌和肠炎沙门氏菌。参照GB 4789.30—2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》[22]的方法进行增菌处理,然后按照1.3.3的方法提取核酸用于检测,一组检测的控温过程在三控恒温水浴锅中完成进行PA/CRISPR-Cas12a检测,另一组在荧光定量PCR仪内完成。
1.4 数据处理
使用Origin 8.0软件作图,使用SPSS 24.0软件进行统计学分析。涉及荧光检测实验部分均重复3 次,使用配对χ2检验(McNemar检验),当双尾P<0.05判定差异有统计学意义。
2 结果与分析
2.1 RPA引物特异性验证
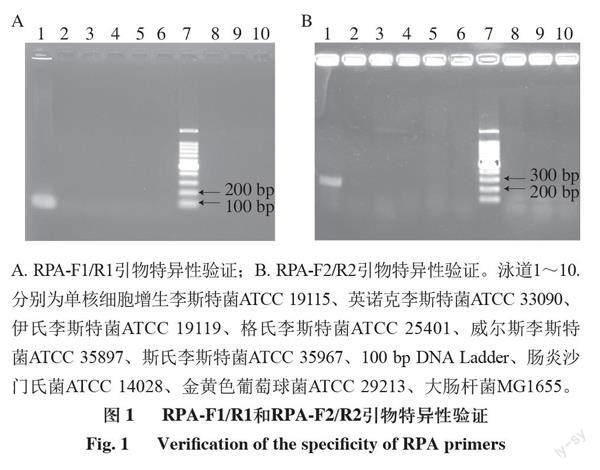
鉴于李斯特菌属包含多种李斯特菌,而引起人类致病的只有单增李斯特菌,因此根据单增李斯特菌已报道的毒力基因hly序列和LMOSLCC2755_0090基因設计单增李斯特菌特异性扩增引物RPA-F1、RPA-R1和RPA-F2、RPA-R2。常见的食源性致病菌除单增李斯特菌,还有大肠杆菌、沙门氏菌、金黄色葡萄球等,所以选取单增李斯特菌ATCC 19115、英诺克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威尔斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、肠炎沙门氏菌ATCC 14028、金黄色葡萄球菌ATCC 29213、大肠杆菌MG1655标准菌株作为检测对象。由图1A、B可知,当DNA模板为单增李斯特菌时,RPA-F1/R1引物对和RPA-F2/R2引物对才显示出111 bp和247 bp DNA扩增条带,同时其他李斯特菌以及大肠杆菌、沙门氏菌和金黄色葡萄球菌无扩增条带,说明hly基因和LMOSLCC2755_0090基因是单增李斯特菌所特有,且引物特异性良好,可以用于富集单增李斯特菌特有DNA片段。鉴于hly基因扩增片段相对较短,等温扩增时间较短,所以选用RPA-F1/R1引物用于后续实验。
A. RPA-F1/R1引物特异性验证;B. RPA-F2/R2引物特异性验证。泳道1~10.分别为单核细胞增生李斯特菌ATCC 19115、英诺克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威尔斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、100 bp DNA Ladder、肠炎沙门氏菌ATCC 14028、金黄色葡萄球菌ATCC 29213、大肠杆菌MG1655。
2.2 RPA/CRISPR-Cas12a检测体系的优化
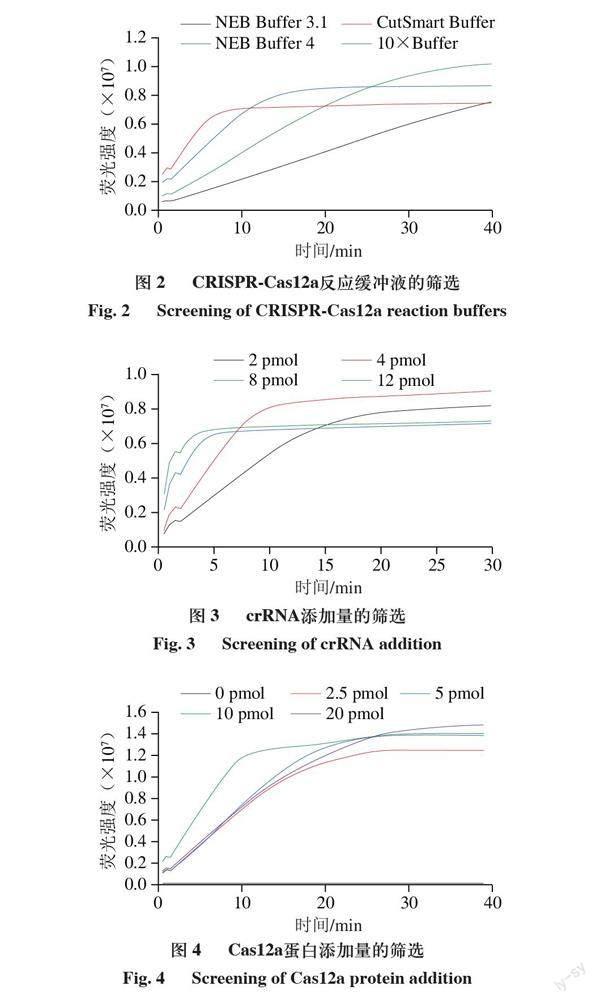
转录出crRNA对整个检测体系的可行性进行验证,取5 μL RPA扩增产物加入CRISPR-Cas12a检测体系,通过预实验发现该方法可以检测单核细胞增生李斯特菌。在此基础上对检测体系的反应缓冲液、crRNA浓度、蛋白浓度作适当优化。由图2可知,在NEB Buffer 3.1、NEB Buffer 4、NEB CutSmart Buffer、Cas12a酶自带的反应缓冲液10×Buffer中,在NEB Buffer 4中反应速率较快,同时荧光信号强度也较高。由图3可知,20 μL检测体系中加入2、4、8、12 pmol的crRNA,观察反应速率和信号强度,当Cas12a蛋白与crRNA的浓度比约为1∶1时,体系中加入4 pmol crRNA时反应速率和信号强度较好。由图4可知,Cas12a蛋白浓度对检测体系影响较小,选择与crRNA浓度接近1∶1的添加量,即5 pmol/μL。由于体系在蓝光下有肉眼可见的荧光,因此未对荧光探针量进行优化。实验确定最佳的检测体系为5 μL RPA产物、2 μL 10×NEB Buffer 4、4 pmol crRNA、5 pmol Cas12a蛋白、20 pmol荧光探针。
2.3 RPA/CRISPR-Cas12a检测特异性和灵敏度验证
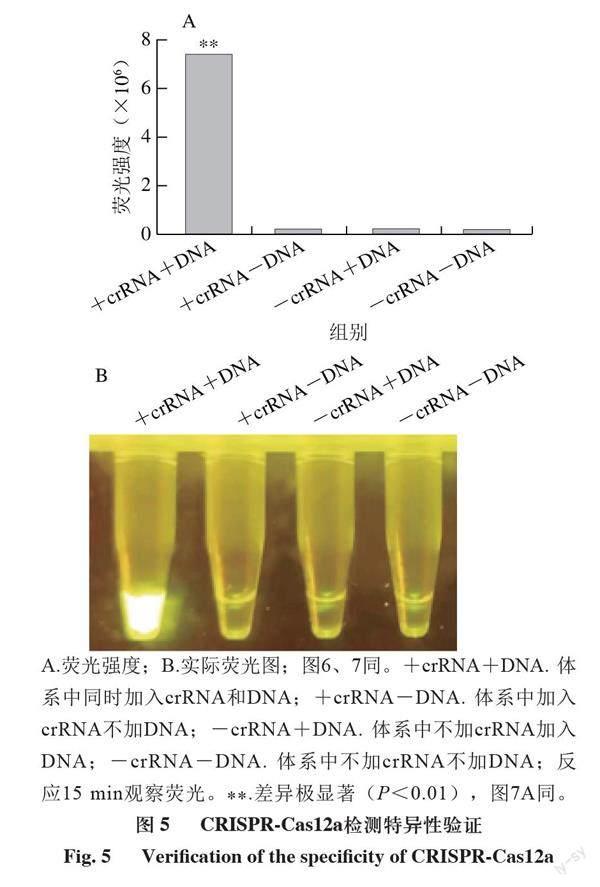
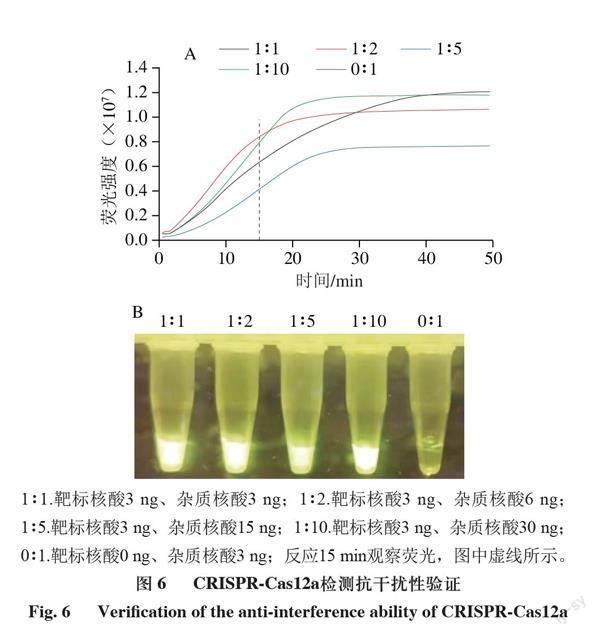
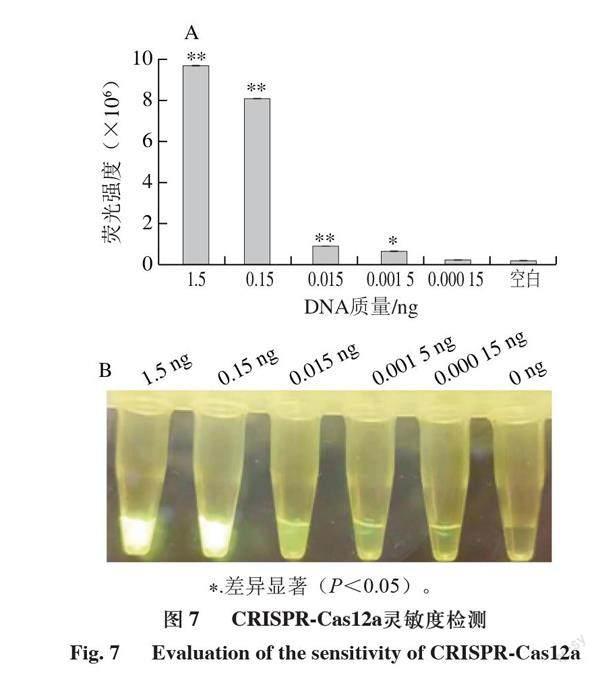
进一步测试该检测体系的特异性和灵敏度。由图5可知,只有当靶标DNA和crRNA同时存在时体系才能产生荧光,说明检测体系特异性高;由图6可知,在体系中加入不同浓度的干扰核酸不影响检测体系识别靶标DNA,说明检测体系抗干扰能力强。由图7可知,向体系内加入最低0.0015 ng DNA时仍能检测出荧光值的变化,说明该体系具有很高的灵敏度。
A.荧光强度;B.实际荧光图;图6、7同。+crRNA+DNA. 体系中同时加入crRNA和DNA;+crRNA-DNA. 体系中加入crRNA不加DNA;-crRNA+DNA. 体系中不加crRNA加入DNA;-crRNA-DNA. 体系中不加crRNA不加DNA;反应15 min观察荧光。**.差异极显著(P<0.01),图7A同。
2.4 实际样品的检测
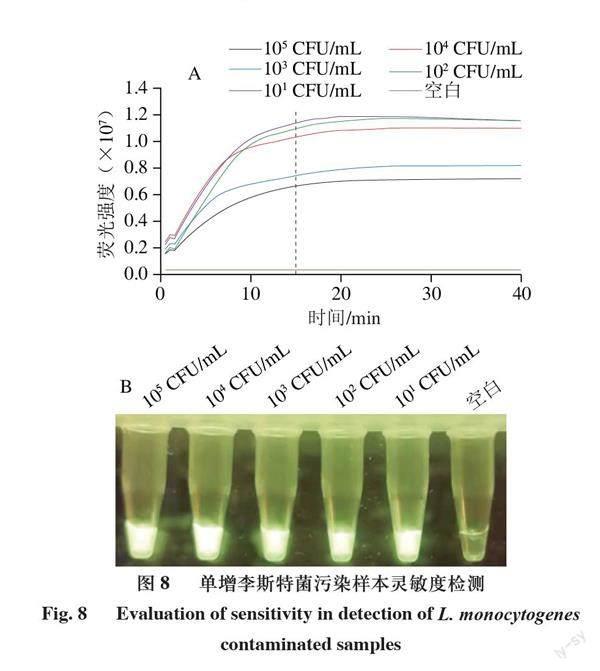
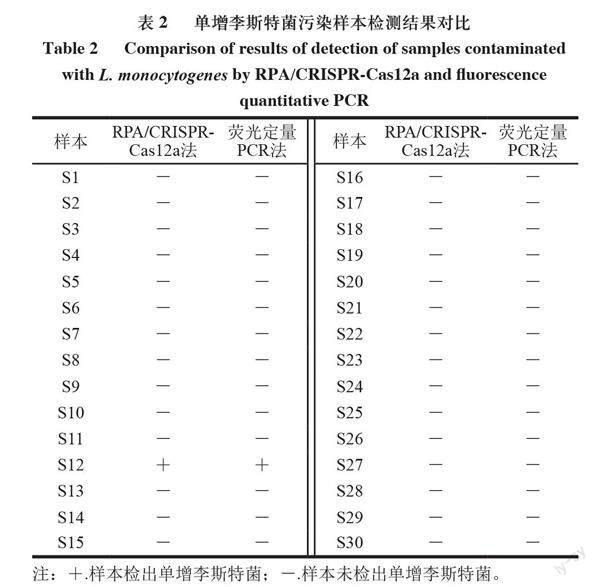
单增李斯特菌不耐高温,生肉及肉制品较易污染。用已建立的单增李斯特菌RPA/CRISPR-Cas12a检测体系检测了人工模拟污染李斯特菌的生三文鱼肉片,由图8可知,污染105、104、103、102、10 CFU/mL单增李斯特菌的三文鱼肉片在检测体系中反应15 min时均显示出肉眼可见的强荧光。说明该检测体系可检测低至10 CFU/ml单增李斯特菌污染的三文鱼肉片。以荧光定量PCR为对照检测30 份盲样,结果如表2所示。RPA/CRISPR-Cas12a法检出其中1 份阳性样本,与荧光定量PCR方法检出结果一致,添加了大肠杆菌和肠炎沙门菌的样本两种方法均没有荧光信号,表明方法的检测特异性很强。结果表明建立的单增李斯特菌检测体系可以用于检测实际污染单增李斯特菌样本。
3 结 论
本研究建立一种基于RPA和CRISPR-Cas12a蛋白的单增李斯特菌检测体系,只需在水浴锅中RPA反应
15 min,然后取5 μL产物加入CRISPR-Cas12a检测体系中反应15 min,富集扩增和检测共需要30 min,非常适用于现场的快速检测。人工污染样本中,本研究建立的方法可检测低至10 CFU/mL的样本,能够保证在污染初期即可检出。在30 份盲样检测中,荧光定量法出现1 份较弱的非特异性扩增,而本研究方法没有,可能是RPA扩增特异性和CRISPR-Cas12a检测的特异性叠加更不易产生假阳性。添加大肠杆菌和沙门氏菌的盲样两种方法均未检出,说明实际样本检测中两种方法均不会受到其他食源性致病菌的影响。
RPA与CRISPR技术相结合的检测方法由于其不需要昂贵的仪器、速率快、特异性强等特点近年来被广泛研究[23-25]。RPA富集扩增靶标利用了其扩增的便捷性,CRISPR检测技术特异性强,将两种方法结合实现了检测的便捷性和特异性。该方法虽具有很多优点,但仍存在需要改进的地方,如本研究中仍需借助扩增的方法富集核酸,核酸浓度过低时体系信号无法被足够的放大,以及不能在一个体系中实现多重靶标的检测等。目前关于该方法的一些问题,一些学者已尝试改进,如不用核酸扩增富集,而是利用电化学方法[26-28]、数字PCR方法[29]、检测信号放大等进行原位检测[30-31]。这些方法在一定程度解决了上述问题,但在实际应用中还存在处理步骤繁琐、成本过高等问题,还需进一步优化和研究。
参考文献:
[1] Vitullo M, Grant K A, Sammarco M L, et al. Real-time PCRs assay for serogrouping Listeria monocytogenes and differentiation from other Listeria spp.[J]. Molecular and Cellular Probes, 2013, 27: 68-70. DOI:10.1016/j.mcp.2012.10.001.
[2] 郝歌, 钱映, 李蓉, 等. 单核细胞增生李斯特菌毒力基因及其致病机制的研究进展[J]. 中国食品卫生杂志, 2023, 35(3): 481-486. DOI:10.13590/j.cjfh.2023.03.026.
[3] 甘霖. 中国红嘴鸥中单增李斯特菌及野生啮齿动物中伊氏李斯特菌的研究[D]. 北京: 中国疾病预防控制中心, 2021: 78-90. DOI:10.27511/d.cnki.gzyyy.2020.000013.
[4] 焦颖, 张巍. 李斯特菌生物学特征与临床相关性[J]. 中国感染与化疗杂志, 2015, 15(5): 491-495. DOI:10.16718/j.1009-7708.2015.05.005.
[5] 杨超, 于涛, 姜晓冰. 绿色魏斯氏菌发酵液对单核细胞增生李斯特菌的抑制及其在冷却猪肉保鲜中的应用[J]. 肉类研究, 2021, 35(4): 51-56. DOI:10.7506/rlyj1001-8123-20210323-079.
[6] 张园园, 周聪, 郭依萍, 等. 肉及肉制品中单核细胞增生李斯特菌交叉污染的研究进展[J]. 食品科学, 2022, 43(11): 293-300.DOI:10.7506/spkx1002-6630-20210505-026.
[7] 吴瑞英, 黄宝明, 梁均和. 单增李斯特菌选择性增菌培養分离的初步探讨[J]. 中国卫生检验杂志, 2007, 17(5): 854-855. DOI:10.3969/j.issn.1004-8685.2007.05.041.
[8] 黄伟华, 李伦, 陈超超, 等. 荧光免疫吸附法定量检测单核细胞增生李斯特菌[J]. 卫生研究, 2019, 48(2): 279-283. DOI:CNKI:SUN:WSYJ.0.2019-02-018.
[9] 刘珊娜, 葛怀娜, 孟繁桐, 等. 李斯特菌免疫检测用胶体金的制备及抗体标记[J]. 食品科技, 2016(1): 321-324. DOI:CNKI:SUN:SSPJ.0.2016-01-069.
[10] 林玉双, 蓝福胜, 廖燕萍, 等. 实时荧光PCR法和国标法检测乳粉中单增李斯特菌的比较研究[J]. 食品安全质量检测学报, 2020, 11(24): 9425-9429. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.24.061.
[11] 刘芳, 徐振娜, 洪伟彬, 等. 食品中单增李斯特菌荧光PCR检测方法的建立[J]. 农村经济与科技, 2017, 28(17): 84-85. DOI:CNKI:SUN:NCJI.0.2017-17-033.
[12] 陈欢, 王宇, 黄钰, 等. 基于CRISPR/Cas系统的病原微生物检测体系构建研究进展[J]. 微生物学报, 2022, 62(9): 3271-3288. DOI:10.13343/j.cnki.wsxb.20220023.
[13] GOOTENBERG J S, ABUDAYYEH O O, KELLNER M J, et al. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6[J]. Science, 2018, 360: 439-444. DOI:10.1126/science.aaq0179.
[14] 周旭, 王思文, 王秀荣. CRISPR-Cas12a在病原快速检测中的应用[J]. 中国兽医科学, 2022, 52(8): 1031-1037. DOI:10.16656/j.issn.1673-4696.2022.0145.
[15] 葛以跃, 苏璇, 张倩, 等. CRISPR-Cas13a结合重组酶介导的扩增快速检测副溶血性弧菌方法的建立[J]. 现代预防医学, 2019, 46(20): 3777-3781. DOI:CNKI:SUN:XDYF.0.2019-20-030.
[16] LEI Rong, LI Limei, WU Pinshan. RPA/CRISPR/Cas12a-based on-site and rapid nucleic acid detection of Toxoplasma gondii in the environment[J]. ACS Synthetic Biology, 2022, 11(5): 1772-1781. DOI:10.1021/acssynbio.1c00620.
[17] 李焓笑. 基于CRISPR/Cas13a及RPA单增李斯特菌检测方法的建立和应用[D]. 长春: 吉林大学, 2022: 40-60. DOI:10.27162/d.cnki.gjlin.2021.001736.
[18] 李凡. 致病性李斯特菌全基因组数据库构建及基于CRISPR/Cas核酸检测新技术研究[D]. 广州: 华南理工大学, 2022: 140-180. DOI:10.27151/d.cnki.ghnlu.2021.003509.
[19] TANG Mengjun, ZHOU Sheng, ZHANG, Xiaoyan, et al. Rapid and sensitive detection of Listeria monocytogenes by loop-mediated isothermal amplification[J]. Current Microbiology, 2011, 63(6): 511-516. DOI:10.1007/s00284-011-0013-3.
[20] LI Fan, YE Qinghua, CHEN Moutong, et al. Multiplex PCR for the identification of pathogenic Listeria in Flammulina velutipes plant based on novel specific targets revealed by pan-genome analysis[J]. Frontiers in Microbiology, 2021, 11: 634255. DOI:10.3389/fmicb.2020.634255.
[21] LÜ Hailong, WANG Jin, ZHANG Jian, et al. Definition of CRISPR Cas12a trans-cleavage units to facilitate CRISPR diagnostics[J]. Frontiers in Microbiology, 2021, 12: 766464. DOI:10.3389/fmicb.2021.766464.
[22] 國家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验: GB 4789.30—2016[S]. 北京: 中国标准出版社, 2016: 3-8.
[23] 张徐俞, 黄俊, 杨稳, 等. 重组酶聚合酶扩增结合CRISPR-Cas12a快速检测十足目虹彩病毒1方法的建立[J]. 微生物学通报, 2021, 48(12): 4980-4988. DOI:10.13344/j.microbiol.china.210331.
[24] ZHI Shuai, SHEN Jinling, LI Xingang, et al. Development of recombinase-aided amplification (RAA)-exo-probe and RAA-CRISPR/Cas12a assays for rapid detection of Campylobacter jejuni in food samples[J]. Journal of Agricultural and Food Chemistry, 2022, 70(30): 9557-9566. DOI:10.1021/acs.jafc.2c02581.
[25] 雷荣, 孙夕雯, 江丽, 等. 丁香疫霉菌RPA/CRISPR-Cas12a快速检测方法的建立[J]. 植物检疫, 2022, 36(3): 31-38. DOI:10.19662/j.cnki.issn1005-2755.2022.03.006.
[26] 李凡, 韩尧, 李浩, 等. 基于CRISPR均相电化学生物传感器检测SARS-CoV-2和HIV-1方法的建立[J]. 军事医学, 2023, 47(5): 371-377. DOI:10.7644/j.issn.1674-9960.2023.05.009.
[27] 卜胜君. 新型电化学生物传感器快速检测大肠杆菌及沙门菌技术研究[D]. 北京: 军事科学院, 2023: 48-60. DOI:10.27193/d.cnki.gjsky.2022.000025.
[28] SUEA-NGAM A, HOWES P D, DEMELLO A J. An amplification-free ultra-sensitive electrochemical CRISPR/Cas biosensor for drug-resistant bacteria detection[J]. Chemical Science, 2021, 12(38): 12733-12743. DOI:10.1039/d1sc02197d.
[29] SHINODA H, TAGUCHI Y, NAKAGAWA R, et al. Amplification-free RNA detection with CRISPR-Cas13[J].Communications Biology, 2021, 4(1): 476-482. DOI:10.1038/s42003-021-02001-8.
[30] HE Dalin, LIU Gang, YANG Jing, et al. Specific high-sensitivity enzymatic molecular detection system termed RPA-based CRISPR-Cas13a for duck Tembusu virus diagnostics[J]. Bioconjugate Chemistry, 2022, 33(6): 1232-1240. DOI:10.1021/acs.bioconjchem.2c00200.
[31] 马驰虹. 基于界面信号增强策略的CRISPR电化学生物传感器用于肿瘤生物标志物的检测[D]. 郑州: 鄭州大学, 2022: 14-30. DOI:10.27466/d.cnki.gzzdu.2022.004348.
收稿日期:2023-07-10
基金项目:淮安市卫生健康科研项目(HAWJ202122);江苏省预防医学科研课题(Y2018047)
第一作者简介:陈大伟(1991—)(ORCID: 0009-0008-2869-3511),男,助理研究员,硕士,研究方向为微生物检验。
E-mail: 1832324965@qq.com
*通信作者简介:刘靓(1982—)(ORCID: 0009-0004-5929-9040),女,副主任技师,硕士,研究方向为微生物检验。
E-mail: 410043363@qq.com
