Impella或主动脉内球囊反搏对高危经皮冠状动脉介入治疗及心源性休克支持治疗的Meta分析
2023-11-25范春雨
林 鑫,范春雨
进行高风险经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)以及急性心肌梗死合并心源性休克(acute myocardial infarction complicated by cardiogenic shock,AMI-CS)的病人通常预后较差,且常常因血流动力学不稳定或心功能差而丧失血运重建的机会[1]。循环辅助是有效维持血流动力学稳定的措施,主动脉内球囊反搏(intra-aortic balloon pump,IABP)具有普及性广、操作和使用简单、安全性较高和费用相对低廉等优点,是我国目前应用最广泛的机械辅助装置[2]。但在Thiele等[3]研究中,IABP组和对照组的30 d死亡率及1年死亡率差异均无统计学意义。IABP无法取得短期生存率获益的原因可能是IABP增加心排血量的能力有限,仅为500 mL/min[4]。Impella是一类微型的轴流泵,通过介入的方式经由股动脉放置在左心室中,将左心室的血液通过导管泵入主动脉,能够有效降低左心室负荷,目前,应用Impella进行支持治疗急性心肌梗死(AMI)心源性休克病人呈上升趋势[5]。因此,本研究通过荟萃分析,对比分析使用Impella或IABP对高危PCI和心源性休克病人的疗效及安全性,并探究可能影响预后结果的相关因素。
1 资料与方法
1.1 文献检索
检索 PubMed、EMbase、the Cochrance Library、Web of Science、中国知网、万方数据库、维普数据库,检索时限为建库至 2022年3月31日。中文检索策略以中国知网为例,检索式:((主题=心源性休克)OR 主题=经皮冠状动脉介入)AND((主题=Impella)AND 主题=IABP)。英文检索以Web of Science数据库为例,检索策略如下:
#1 TS=("mechanical circulatory support" OR "mechanical circulation support " OR "mechanic circulation support" OR "left ventricular assist device" OR "left ventricular assistance device" OR "left ventricular assist devices" OR "Heart Assist Device" OR "heart-assist pump " OR "vascular assist device" OR "artificial ventricle" OR "ventricle assist device" OR "right-sided heart assist devices" OR "LVAD" OR "RVAD")
#2 (TS=(intra-aortic balloon pump))OR TS=(IABP)
#3 TS=(impella)
#4 #3 AND #2
#5 #1 AND #4
#6 (((TS=(cardiac arrest))OR TS=(cardiac shock))OR TS=(heart failure))OR TS=(cardiogenic shock)
#7 ((TS=(high-risk percutaneous coronary intervention))OR TS=(HR-PCI))OR TS=(high risk PCI)
#8 #6 AND #7 AND #5
1.2 文献纳入与排除标准
1.2.1 纳入标准
1)研究对象为接受IABP或Impella支持治疗的心源性休克及拟进行高风险PCI术的病人。心源性休克定义为:收缩压(SBP)<90 mmHg持续30 min及以上,或需要采取支持措施如血管活性药物、正性肌力药物及循环辅助装置以维持SBP≥90 mmHg伴或不伴终末器官灌注不足(四肢冰凉,尿量<30 mL/h,心率≥60次/min)。高风险PCI术目前尚缺乏统一标准的定义,既往研究中有学者将其定义为对左心室功能严重受损及存在支配大量心肌的靶血管狭窄的病人进行的PCI术[6],故在该研究中将其定义为:患有3支冠状动脉病变和/或无保护左主干冠状动脉疾病且左心室射血分数(left ventricular ejection fraction,LVEF)<35%的病人进行的PCI。2)干预措施,试验组及对照组分别在PCI过程中植入Impella及IABP,两组病人皆予常规药物治疗。3)结局指标为术后随访临床结果(如30 d死亡率、主要出血事件、血管并发症、出血及缺血性脑卒中、再次心肌梗死及败血症)。
1.2.2 排除标准
1)重复的文献资料;2)实验对象为动物的研究;3)干预措施不包含Impella与IABP之间对比的文献;4)研究未报告30 d或住院结果中的至少一项,如全因死亡率、大出血(大出血定义为GUSTO评分中度或重度,血红蛋白下降> 50 g/L,或两个及以上单位的输血)或血管并发症(血管并发症定义为需要干预的肢体缺血、假性动脉瘤、动静脉瘘、股动脉闭塞或截肢);5)综述、荟萃分析、信件、社论材料、会议记录等。
1.3 文献筛选
1.4 数据提取及文献质量评价
两位研究者分别独立审查搜索结果,以根据目前的纳入与排除标准选择研究,提取纳入文献的相关信息,并交叉核对。如遇争议时,通过讨论或由第3名研究者裁定,审查者之间关于研究选择、数据提取或质量评估的任何分歧都要与第三方审查者讨论,并通过协商解决。信息提取内容包括基本信息(第一作者、发表时间等)、方法学及文献质量信息、病例特征(样本量、研究类型、年龄等)、结局指标等。使用 Cochrane 系统评价员手册 5.1.0 推荐的偏倚风险评估工具评价纳入的随机对照试验文献的质量,评价内容包括从选择(包括随机序列产生和分配隐藏)、实施(包括对研究者和受试者施盲)、测量(研究结局盲法评价)、随访(结局数据的完整性)、报告(选择性报告研究结果)及其他(其他偏倚来源)这6个方面总计7个条目对偏倚风险进行评价。对每个条目依据偏倚风险评估准则做出“低风险偏倚”“高风险偏倚”和“不清楚”的判定结果[8]。采用纽卡斯尔-渥太华量表(the Newcastle-Ottawa Scale,NOS)评价纳入的非随机对照试验文献,具体包括研究人群选择(selection)、可比性(comparability)、暴露(exposure)评价或结果(outcome)评价。纽卡斯尔-渥太华量表对文献质量的评价采用了星级系统的半量化原则,满分为9颗星[9]。
1.5 终点临床结局指标
主要结局指标包括短期死亡率(30 d死亡率),次要结局指标包括主要出血事件、血管并发症、出血及缺血性脑卒中、再次心肌梗死及败血症。
1.6 统计学处理
对纳入Meta分析的所有研究结果进行可靠性分析[10]。I2和Q检验评估研究的异质性,P≥0.1及I2<50%提示各研究间异质性可接受,采用固定效应模型合并效应量;P<0.1,I2> 50%提示研究间存在异质性,采用随机效应模型合并效应量,并通过亚组分析及敏感性分析探究异质性来源。常用的亚组分类有研究方案、样本量、质量、人群的特征和发表的年代等,探究研究之间异质性的可能来源,并通过敏感性分析寻找异质性的主要来源文献,对其进行合理控制和解释。将统计指标录入Cochrane协作网提供的Review Manager 5.4软件进行Meta分析,采用比值比(OR)描述二分类变量结果,加权均方差(MD)描述连续性变量合并结果,采用 95% 置信区间(confidence interval,CI)描述,以P<0.05为差异有统计学意义。通过绘制漏斗图以评价纳入的文献是否存在发表偏倚,当无偏倚时,将形成对称的倒置漏斗。
2 结 果
2.1 文献检索流程与结果
检索国内外7个数据库初次筛选出文献641篇,剔除重复文献528篇,通过数据库的分类功能,剔除综述、社论材料、信函、会议摘要共54篇。在快速浏览标题及摘要后剔除荟萃分析及动物实验6篇,最后详细阅读全文对照纳入与排除标准复筛排除文献49篇,最终纳入10项[5,11-19]研究进行Meta分析,其中中文文献1篇,英文文献9篇;随机对照试验 4篇,观察性研究6 篇。筛选流程详见图1。

图1 文献筛选流程与结果
2.2 纳入研究的基本情况及质量评价
纳入文献的发表时间为2008-2020年,共涉及观察对象1 377 例,其中 Impella组661例,IABP组716例,文献特征见表1。采用 Cochrane 系统评价员手册5.1.0推荐的偏倚风险评估工具评价纳入的随机对照试验文献的质量,所有研究均被认为是低风险(见图2),但在Ouweneel等[14]研究中,未对分配隐藏状态进行说明,且研究过程中出现交叉。采用纽卡斯尔-渥太华量表评价纳入的非随机对照试验文献的质量,所有的非随机对照研究均获得8分,偏倚风险较低。详见表2。

表1 纳入研究的基本特征

表2 基于纽卡斯尔-渥太华量表对非随机对照研究的质量评估 单位:分

图2 纳入文献偏倚风险评估图
2.3 Meta分析结果
2.3.1 30 d死亡率
本研究纳入的10项[5,11-19]研究均报道了病人30 d死亡率,经过异质性检验:P=0.35,I2=10%,认为各研究间异质性可接受,故使用固定效应模型,Meta分析结果显示:OR=1.13,95%CI(0.87,1.45),P=0.36,提示Impella组与IABP 组病人30 d内死亡率差异无统计学意义(P>0.05)。详见图3。

图3 Impella组与IABP组30 d死亡率比较的Meta分析森林图
2.3.2 主要出血事件
纳入的研究中有8项[11-17,19]研究报道了病人发生的主要出血事件,经过异质性检验:P=0.45,I2=0%,认为各研究之间异质性可接受,故应用固定效应模型,Meta分析结果显示,OR=2.04,95%CI(1.45,2.87),P<0.001,提示Impella组与IABP组相比出现了更多的出血事件。详见图4。

图4 Impella组与IABP组主要出血事件比较的Meta分析森林图
2.3.3 血管并发症
纳入的研究中有8项[11-17,19]研究报道了病人发生的血管并发症,经过异质性检验:P=0.78,I2=0%,认为各研究之间异质性可接受,故应用固定效应模型,Meta分析结果显示:OR=2.92,95%CI(1.59,5.37),P=0.000 5,提示Impella组与IABP组相比出现了更多的血管并发症。详见图5。

图5 Impella组与IABP组血管并发症发生率比较的Meta分析森林图
2.3.4 脑卒中
纳入的研究中有8项[5,11,13-17,19]研究报道了病人发生的脑卒中事件,经过异质性检验:P=0.88,I2=0%,认为各研究之间异质性可接受,故应用固定效应模型,Meta分析结果显示:OR =0.65,95%CI(0.31,1.35),P=0.25,提示Impella与IABP对病人脑卒中发作的影响差异无统计学意义。详见图6。

图6 Impella组与IABP组脑卒中发生率比较的Meta分析森林图
2.3.5 再发心肌梗死
纳入的研究中有5项[5,11,14,16,19]研究报道了病人发生的再次心肌梗死事件,Impella组与IABP组的再发心肌梗死发生率分别为7.2%和6.3%,经异质性检验:P=0.70,I2=0%,认为各研究之间异质性可接受,故应用固定效应模型,Meta分析结果显示:OR=1.15,95%CI(0.72,1.84),P= 0.57,提示Impella与IABP对病人再发心肌梗死发作影响相当。
2.3.6 败血症
纳入的研究中有4项[11-12,15-16]研究报道了病人发生的败血症事件,经过异质性检验:P=0.24,I2=29%,认为各研究之间异质性可接受,故应用固定效应模型,Meta分析结果显示:OR=1.64,95%CI(1.11,2.40),P=0.01,提示Impella组与IABP组相比出现了更多的败血症。
2.3.7 LVEF
纳入的研究中有9项[5,11-18]研究报道了病人未植入设备前的LVEF,经过异质性检验:P=0.000 6,I2=71%,认为各研究之间异质性高,故应用随机效应模型,Meta分析结果显示:MD=-3.01,95%CI(-5.14,-0.88),P=0.006,提示Impella组与IABP组病人相比植入设备前LVEF较低。详见图7。
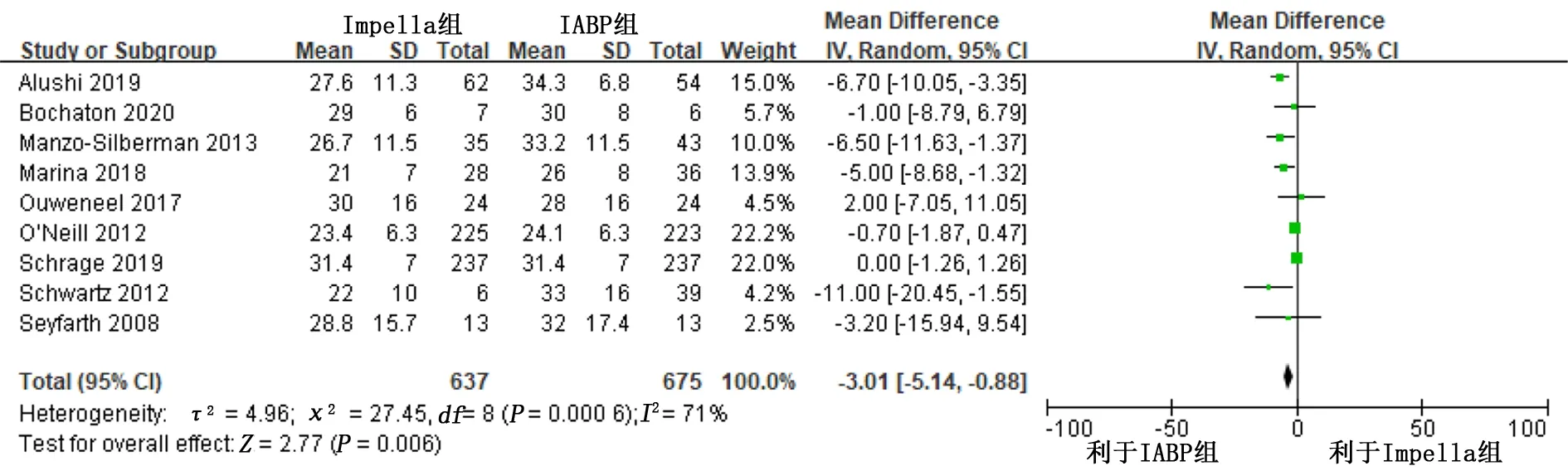
图7 Impella组与IABP组LVEF比较的Meta分析森林图
2.4 亚组分析及敏感性分析
在对上述7个指标进行Meta分析时,发现病人植入设备前射血分数的异质性显著,对该组数据进行按注册地区及研究类型研究亚组分析,欧洲组:P=0.000 04,I2=78%,美国组:P=0.10,I2=57%;随机对照试验组:P=0.92,I2=0%;回顾性研究组:P<0.000 1,I2=84%,提示异质性可能由研究类型与地区的差异产生,这种差异主要体现在欧洲地区组与回顾性研究组之间。详见图8。

图8 LVEF亚组分析的Meta分析森林图
对该组数据进行敏感性分析。逐一剔除需排除的文献后发现,剔除O′Neill等[5]研究与Schrage等[16]研究后异质性下降(P=0.42,I2=1%),其中O′Neill等[5]研究为非紧急植入循环辅助设备,Schrage等[16]研究根据LVEF等因素将研究对象进行匹配,且样本量较其他组内研究量大,具有特殊性[5,16],故将二者剔除,剔除后Meta分析结果:MD=-5.46,95%CI(-7.47,-3.45),P<0.000 01,与之前结果相同,提示Impella组与IABP组病人相比植入设备前LVEF较低。详见图9。

图9 剔除后Impella组与IABP组LVEF比较的Meta分析森林图
2.5 发表偏倚
通过RevMan 5.4软件绘制漏斗图对各研究间是否存在发表偏倚进行评估。30 d死亡率及主要出血事件漏斗图右下角存在独立游离点,提示可能存在小样本IABP不良事件未被报道,猜测可能是因为较重的病人往往选择了Impella作为循环辅助支持,而与干预效果带来的异质性有关。其余各研究在各个评价指标中均位于置信区间内,且漏斗图基本对称,大致均匀分布于效应线左右两侧。详见图10。

图10 30 d死亡率漏斗图
3 讨 论
心脏的机械循环支持是代替或辅助心脏功能、提供血液灌注、改善机体缺氧状态、促进器官功能恢复的人工器械[20]。虽然循环辅助装置广泛应用于心力衰竭程度严重、合并症复杂以及急性心肌梗死或心搏骤停的心源性休克病人,但仍然无法确定哪些群体会在循环支持治疗中获益[21-24]。
本研究计划通过荟萃分析的形式,对Impella及IABP在对心源性休克及高危PCI病人的支持中获益与风险,并对可能影响试验结果的相关因素加以分析。尽管多项研究结果提示,在急性心肌梗死及高风险PCI病人中使用Impella是安全的,且能够有效降低心肌耗氧量及提供更为稳定的血流动力学支持并有效地降低了病人的血清乳酸水平[25],但本研究结果表明,与IABP相比,Impella并不能降低短期全因死亡率,这与其他学者的结论[26-27]是相同的。此外,Impella组较IABP组出现主要出血事件、血管并发症及败血症的风险显著增加。另一方面,Impella组的脑卒中与再发心肌梗死发生率与IABP组差异无统计学意义。Impella组病人LVEF水平较IABP组明显下降,在Marina等[15]研究中也得到Impella组病人较IABP组病情更重,而在O′Neil等[5]研究中,Impella组相比IABP组有更多的病人进行了完全血运重建与血管旋磨术,这提示Impella组未能展示出更多的获益可能与Impella组病人基础更差,更多的操作如反复注射造影剂、球囊扩张、动脉斑块切除术通过,导致短暂阻断流向目标冠状动脉的血液流动而使冠状动脉缺血加剧有关[5]。
IABP对急性心肌梗死心源性休克病人预后的改善在此前的一项多中心随机对照试验中未能得到证实[28],这被认为是因为IABP增加心排血量能力有限,仅有500 mL/min[29]。而Impella可提供多种不同的心排血量,如Impella 2.5可以提供2.5 L/min的心输出量,Impella CP可以提供3.7 L/min的心输出量,Impella 5.0将这一数值提高至5 L/min,使用Impella与心排血指数的改善、更好的心肌修复和更快的停用儿茶酚胺相关[11,13,15,30];另一方面,在Kapur等[31]动物实验提示在急性心肌梗死中应用轴流泵能够明显减少心肌梗死面积。本研究提示,Impella未能得到理想的获益,其原因可能在于,Impella组病人病情更重,心功能更差,更多的操作导致的冠状动脉缺血与血栓负荷加重有关。此外,部分病人设备植入发生在血运重建后,而据底特律心源性休克计划表明,在没有发生心搏骤停的病人中,在PCI前使用Impella与结果改善相关[32]。出血事件、血管并发症及败血症是使用循环辅助装置的主要不良事件。IABP要求7-8F鞘管,而Impella 2.5、Impella CP分别要求13F、14F鞘管,既往的研究认为Impella血管并发症的风险和较高的出血率与其所需的更大口径的血管通路相关[33]。2020年6月美国食品和药品管理局(FDA)批准Impella ECP可以进行临床试验,这是至今为止世界上最小的血流动力学支持型心脏泵,其直径仅有9F,流量可达到3.5 L/min以上,有望进一步降低相关不良事件发生的风险[34]。而既往的研究认为,败血症的出现不能完全归因于辅助装置的使用,因为需要循环辅助装置的病人往往病情危重,通常有多种潜在的感染源,包括机械通气、动静脉置管术、导尿和额外的外科干预等[35]。本研究纳入的10项研究中仅有3项报道了败血症病例的研究,且样本量集中于回顾性研究,在这些数据中,病人往往因病情较重而选择了Impella作为循环辅助的器械,例如Schrage等[16]研究中尽管使用了倾向匹配评分的方式以增加两组的可比性,但Impella组病人平均动脉压仍显著低于IABP组,因此,对于该项结果应谨慎解释。
本研究存在的局限性有:首先,Impella对比IABP的随机对照试验数量较少,本研究有一半以上的文献为回顾性研究;其次,由于无法获得个体病人的数据,疾病的严重程度及病人基线数据存在差异,对本研究提供的数据应该谨慎地进行解释。第三,纳入研究中未提及对血管通路进行穿刺切开或压迫的装置,这可能影响血管并发症的差异。第四,尽管在纳入的文献中有提及冠状动脉病变数量及位置,但病变的严重及复杂程度少有报道,仅有1篇文献报道了SYNTEX评分[14],此外,仅有少数文献报道在PCI后是否实现完全血运重建及支架类型及数量,这可能影响研究的结果。
本研究表明,尽管Impella组病人的并发症更多,病情更重,但在心源性休克及高危PCI病人中使用Impella进行循环支持,仍获得了与使用IABP相当的疗效。通过更加严格的试验设计及病人筛选标准,发现真正能够从新一代循环辅助装置支持治疗中获益的人群,并通过技术创新降低相关并发症的发生,从而真正体现新一代循环辅助装置的血流动力学优势,是其应用过程亟待解决的重要问题。
