黑果腺肋花楸花青素理化性质及抗氧化活性研究
2023-11-22杨俊峰沈越张耀丹张卉
杨俊峰,沈越,张耀丹,张卉
(沈阳化工大学 制药与生物工程学院,沈阳 110142)
黑果腺肋花楸(Aroniamelanocarpa)属于蔷薇科腺肋花楸属植物[1]。其果实中富含黄酮类成分,主要以花青素、原花青素及其衍生物为主[2—3]。陈彤垚等[4]研究发现,黑果腺肋花楸果实总花青素含量约为(0.35~15.96) mg/g FW,(12.65~23.31) mg/g DW,高于蓝莓等水果。花青素除可作为食用色素应用于食品领域外,近年来因发现其保护心血管系统、抗衰老和抗癌等生物活性而具有在医药、化妆品等领域广泛应用的潜力[5—7]。
目前,黑果腺肋花楸花青素在食品行业主要用于制作果酒、果汁等产品,Gironés-Vilaplana等[8]研究发现将柠檬汁和黑果腺肋花楸果汁混合,在很大程度上保留了花青素含量并使其抗氧化性增强,改善了其风味。Witkowska等[9]对黑果腺肋花楸果酒的成分进行分析,其中总抗氧化能力为34.0 mmol/L,总花青素含量最高为1.39 g/L,总酚含量最高为4.10 g/L,表明黑果腺肋花楸果酒具有较高的营养价值。但是因花青素的稳定性较差,其应用还需进行稳定性及抗氧化活性等方面的深入研究。
近年来,Drózdz等[10]研究了酸性条件(pH 2.0~6.0)下红薯花青素的稳定性,结果表明在强酸性(pH 2.0~4.0)条件下比pH 5.0~6.0条件下更稳定;孙倩怡等[11]的研究显示,蓝莓花青素在避光、低温条件下较稳定,当温度高于60 ℃时,共价键发生破坏,从而导致花青素含量降低。刘军波等[12]研究了黑果腺肋花楸花青素的稳定性,其结果表明在温度低于50 ℃、避光条件下,当pH值小于4时该花青素的稳定性较好,其中Fe3+、Al3+对该花青素稳定性的影响较大。迄今,关于黑果腺肋花楸花青素稳定性等理化性质及生物活性的研究仍然不够系统。因此,全面探究光照、pH、温度、金属离子、常用食品添加剂等对黑果腺肋花楸花青素稳定性的影响,以及进行该色素抗氧化活性的深入研究,将为黑果腺肋花楸深加工产品的开发和资源化利用提供理论基础和应用路径。
1 材料与方法
1.1 实验材料及仪器
1.1.1 实验材料
蔗糖、抗坏血酸、氯化钙、氯化钠、氯化镁、硫酸亚铁、过硫酸钾、水杨酸、铁氰化钾、无水乙醇(均为分析纯):天津市恒兴化学试剂制造有限公司;硫酸铜、氯化铁(均为分析纯):河南万邦化工科技有限公司;柠檬酸(分析纯):天津永大化学试剂制造有限公司;山梨酸钾(分析纯):宁波王龙科技股份有限公司;苯甲酸钠(分析纯):天津东大化工集团有限公司;葡萄糖(分析纯):天津大茂化学试剂厂;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、2,2-联苯基-1-苦基肼基(DPPH)、双氧水(均为分析纯):上海麦克林生化科技股份有限公司。
1.1.2 实验仪器
BS-124S分析天平 赛多利斯仪器有限公司;PHS-300 pH计 上海天达仪器有限公司;SCIENTZ-Ⅱ型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HZP-150全温振荡培养箱 上海阳光实验仪器有限公司;HHS-S电子恒温水浴锅 上海康路仪器设备有限公司;H1650离心机 湘仪离心机仪器有限公司;RE52CS旋转蒸发仪 上海亚荣仪器有限公司;FD-1C-50真空冷冻干燥机 上海乔越电子有限公司;Spark 20M Tecan酶标仪 勒菲生物科技(上海)有限公司。
1.2 实验方法
1.2.1 黑果腺肋花楸花青素制备
黑果腺肋花楸果实经洗净、匀浆;果浆与体积分数为40%的酸化甲醇按照料液比1∶5比例混匀,50 ℃恒温振荡1.2 h后抽滤,得到色素溶液,再将该溶液在真空度-0.09 MPa、50 ℃条件下旋蒸得到花青素粗提液。
1.2.2 黑果腺肋花楸花青素纯化
将花青素粗提液加入经预处理的HPD-100大孔树脂柱中,当花青素充分吸附在树脂上后,加入蒸馏水冲洗树脂柱,除去花青素粗提液中的蛋白质、多糖等杂质。除杂后,将体积分数60%的乙醇溶液加入到树脂柱中进行洗脱,收集洗脱流分,50 ℃下旋蒸得到花青素纯化液,冷冻干燥后得到花青素纯化产物。
1.2.3 黑果腺肋花楸花青素理化性质
1.2.3.1 黑果腺肋花楸花青素溶解性
取蒸馏水、无水乙醇、乙酸乙酯、四氢呋喃、丙酮、氯仿、石油醚各5 mL,分别加入经纯化的花青素0.05 g,避光静置30 min,观察溶解情况。
1.2.3.2 光照对黑果腺肋花楸花青素稳定性的影响
配制1 mg/mL花青素纯化产物水溶液,根据参考文献[13]所述方法进行测定,以避光作为对照,计算花青素保留率。
1.2.3.3 温度对黑果腺肋花楸花青素稳定性的影响
同1.2.3.2方法配制花青素水溶液,分别放置在10,20,40,60,80,100 ℃中,在0,1,2,3,4,5 h测定吸光度,每组重复3次,以室温作为对照,计算花青素保留率[14]。
1.2.3.4 pH值对黑果腺肋花楸花青素稳定性的影响
同1.2.3.2方法配制花青素水溶液,分别取10 mL加入到14支试管中,将pH调至1~14。避光静置30 min,测定吸光度,每组重复3次,计算保留率[15],并观察颜色变化。
1.2.3.5 金属离子对黑果腺肋花楸花青素稳定性的影响
同1.2.3.2方法配制花青素水溶液,分别取10 mL上述水溶液,加入0.1 mol/L Mg2+、Cu2+、Ca2+、K+、Fe3+、Na+各0.3 mL,其中以去离子水作为对照,避光静置,在0,1,2,3,4,5 h测定吸光度,每组重复3次,计算花青素保留率[16]。
1.2.3.6 氧化剂、还原剂对黑果腺肋花楸花青素稳定性的影响
同1.2.3.2方法配制花青素水溶液,配制2%、4%、6%、8%、10% H2O2和2,4,6,8,10 g/L Na2SO3,各取1 mL分别加入到10 mL上述水溶液中,根据参考文献[17]所述方法进行测定。每组重复3次,以去离子水作为空白对照,计算花青素保留率。
1.2.3.7 食品添加剂对花青素稳定性的影响
同1.2.3.2方法配制花青素水溶液,取10 mL上述水溶液分别加入蔗糖、葡萄糖、抗坏血酸、柠檬酸、山梨酸钾、苯甲酸钠,所加入的添加剂按照GB 2760—2014[18]《食品安全国家标准 食品添加剂使用标准》配制成最大使用浓度,根据参考文献[19]所述方法进行测定,以去离子水作为空白对照,计算花青素保留率。
1.2.4 黑果腺肋花楸花青素抗氧化能力测定
1.2.4.1 DPPH自由基清除率测定
配制浓度为0,0.2,0.4,0.6,0.8,1.0 mg/mL的花青素水溶液,根据参考文献[20]所述方法进行测定,以抗坏血酸为阳性对照,每个浓度重复3次。
1.2.4.2 ABTS自由基清除率测定
同1.2.4.1方法配制花青素水溶液,根据参考文献[21]所述方法进行测定,以抗坏血酸作为阳性对照,每个浓度重复3次。
1.2.4.3 羟基自由基清除率测定
同1.2.4.1方法配制花青素水溶液,根据参考文献[20]所述方法进行测定,以抗坏血酸作为阳性对照,每个浓度重复3次。
1.2.4.4 总还原力测定
同1.2.4.1方法配制花青素水溶液,根据参考文献[21]所述方法进行测定,以抗坏血酸作为阳性对照,每个浓度重复3次。
1.3 数据统计与分析
结果以平均值±标准差(x±s)表示,利用IBM SPSS Statistics 26进行数据处理。
2 结果与分析
2.1 黑果腺肋花楸花青素溶解性
由表1可知,黑果腺肋花楸花青素易溶于水、无水乙醇、四氢呋喃,微溶于乙酸乙酯、丙酮、氯仿,不溶于石油醚,即其为水溶性色素。
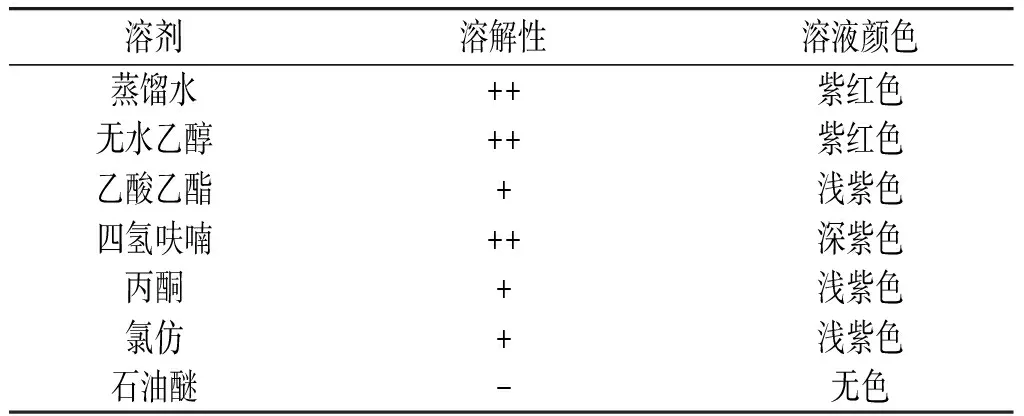
表1 黑果腺肋花楸花青素在不同溶剂中的溶解性及颜色变化Table 1 Solubility and color change of Aronia melanocarpa anthocyanins in different solvents
2.2 黑果腺肋花楸花青素稳定性分析
2.2.1 光照对黑果腺肋花楸花青素稳定性的影响
由图1可知,随着光照时间增加,黑果腺肋花楸花青素的保留率均有所下降。在5 h时,花青素保留率从高到底依次是避光(92.2%)、室内自然光(83.3%)、室外自然光(78.7%)。长时间光照会诱导花青素碳骨架结构改变,导致花色苷被降解,花青素含量降低[22],因此,在贮存或使用过程中应避免花青素长时间暴露在光照环境中。

图1 光照对黑果腺肋花楸花青素稳定性的影响Fig.1 Effect of light on the stability of Aronia melanocarpa anthocyanins
2.2.2 温度对黑果腺肋花楸花青素稳定性的影响
由图2可知,温度越高,花青素保留率越低,在10 ℃条件下,花青素较稳定,5 h后保留率在85%以上;在20~40 ℃条件下,5 h后花青素保留率均在85%。当温度升高到60~80 ℃,5 h后花青素保留率下降到80%以下,稳定性较差。当温度升高到100 ℃时,花青素保留率大幅度下降,5 h后保留率仅剩35%。相关研究表明[23],当温度超过50 ℃时,花青素降解速率加快,促使红色的黄烊盐阳离子向无色的假碱或查尔酮方向转化,从而造成花青素降解、褪色。综上所述,花青素应低温保存。
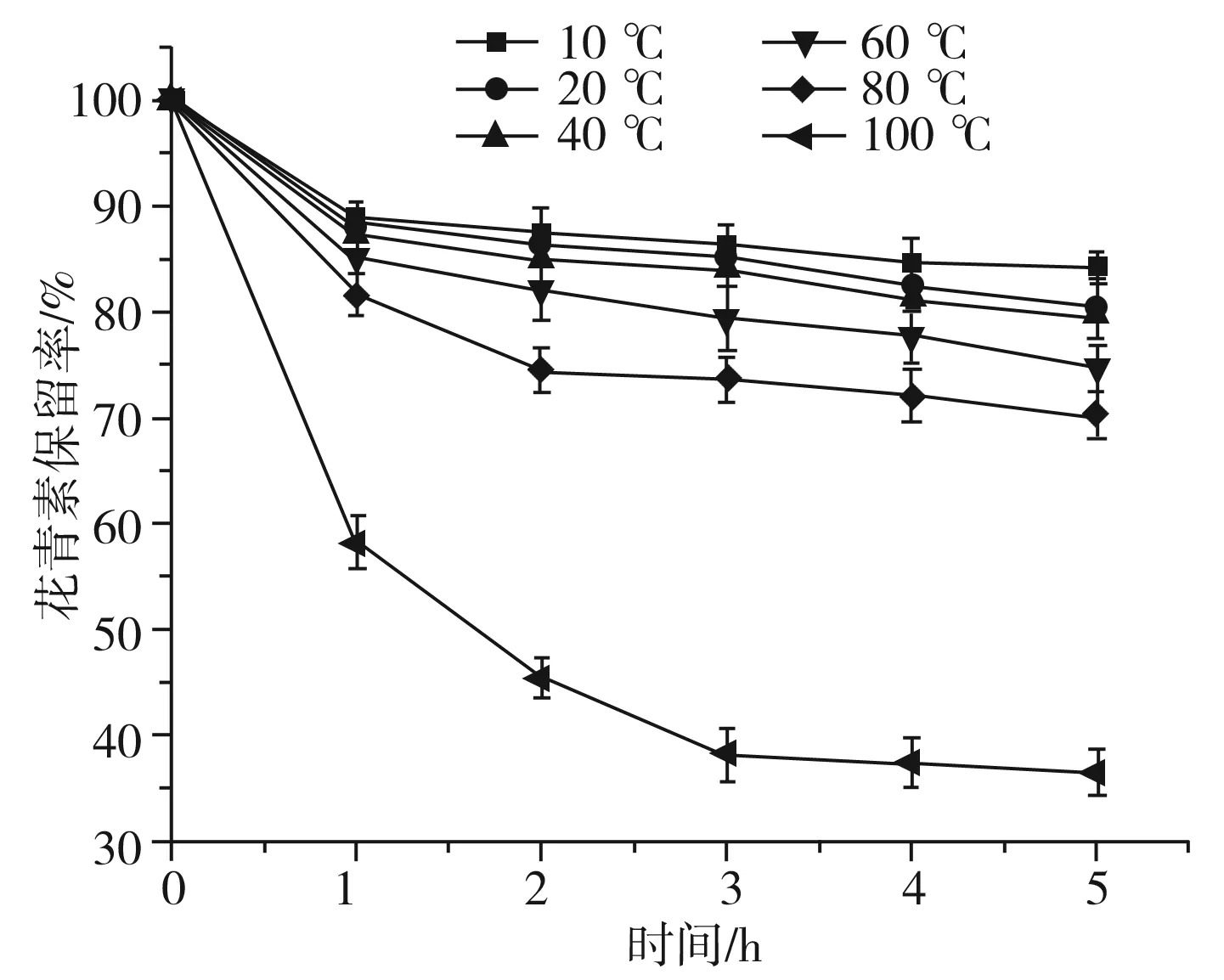
图2 温度对黑果腺肋花楸花青素稳定性的影响Fig.2 Effect of temperatures on the stability ofAronia melanocarpa anthocyanins
2.2.3 pH值对黑果腺肋花楸花青素稳定性的影响
由图3可知,在酸性条件下,花青素pH值为1~3时,随着pH值增大,吸光度缓慢增大;在pH值为3时吸光度达到最大值,此时试管溶液呈红色;当pH值为3~4时,吸光度快速下降;当pH值大于4时,随着pH值的增大,吸光度下降趋于平缓,溶液颜色逐渐变浅。在碱性条件下,当pH值大于8时,溶液颜色变为蓝紫色,且随pH值增大溶液颜色逐渐加深;而在pH值大于11后吸光度稍有回升,溶液颜色由深绿色逐渐变成深棕色。这是由于花青素在不同的酸碱条件下,结构异构化反应发生改变,导致稳定性和颜色发生改变[24—25]。实验表明,黑果腺肋花楸花青素在pH值小于3时相对比较稳定。

图3 pH值对黑果腺肋花楸花青素稳定性的影响Fig.3 Effect of pH values on the stability of Aronia melanocarpa anthocyanins
2.2.4 金属离子对黑果腺肋花楸花青素稳定性的影响
由图4可知,添加Mg2+、Na+、Ca2+、K+的花青素水溶液,5 h后保留率分别为75.1%、77.2%、76.9%、75.4%;添加Fe3+的花青素水溶液呈现深紫色,添加Cu2+的花青素水溶液出现沉淀,5 h后保留率分别为71.9%、70.0%。其原因可能是花青素分子结构中存在一个以上自由的羟基时,易与金属离子发生络合,Fe3+破坏了花青素结构中的酚羟基,而Cu2+催化花青素结构上的酚羟基发生氧化反应,从而产生变化[26—27]。结果表明,添加Mg2+、Na+、Ca2+、K+对花青素稳定性的影响较小,而添加Fe3+、Cu2+对花青素稳定性的影响较大,故该花青素应避免与铁制品、铜制品接触。

图4 金属离子对黑果腺肋花楸花青素稳定性的影响Fig.4 Effect of metal ions on the stability of Aronia melanocarpa anthocyanins
2.2.5 氧化剂、还原剂对黑果腺肋花楸花青素稳定性的影响
由图5可知,随着H2O2浓度的升高,黑果腺肋花楸花青素保留率下降,当加入体积分数2% H2O2后,花青素保留率下降至40%。随着还原剂Na2SO3浓度升高,花青素保留率下降,但下降程度相对于H2O2低。相较于H2O2,花青素对Na2SO3稍具有耐受能力。这可能是因为氧化剂与还原剂能够亲核攻击花青素的C位,致使花青素开环生成查尔酮,发生降解[28]。姚思敏蔷等[29]研究发现,氧化剂H2O2能破坏黑果枸杞中的花青素并使花青素水溶液褪色,这与本实验结果基本一致。因此,黑果腺肋花楸花青素应该避免接触氧化剂、还原剂。

图5 氧化剂H2O2和还原剂Na2SO3对黑果腺肋花楸花青素稳定性的影响Fig.5 Effect of oxidant H2O2 and reducing agent Na2SO3 on the stability of Aronia melanocarpa anthocyanins
2.2.6 食品添加剂对黑果腺肋花楸花青素稳定性的影响
由图6可知,在相同浓度的抗坏血酸和柠檬酸条件下,抗坏血酸对黑果腺肋花楸花青素稳定性的影响明显低于柠檬酸;在0~5 h添加山梨酸钾的花青素保留率下降较小,而添加苯甲酸钠的花青素保留率下降较大,山梨酸钾对黑果腺肋花楸花青素稳定性的影响明显低于苯甲酸钠;蔗糖与葡萄糖相比,蔗糖对花青素稳定性的影响较小。结果表明,上述食品添加剂对黑果腺肋花楸花青素稳定性均有影响,应加入护色剂提高其花青素保留率。

图6 食品添加剂对黑果腺肋花楸花青素稳定性的影响Fig.6 Effect of food additives on the stability of Aronia melanocarpa anthocyanins
2.3 黑果腺肋花楸花青素抗氧化活性测定
2.3.1 DPPH自由基清除率
由图7可知,黑果腺肋花楸花青素和抗坏血酸清除自由基能力均随着花青素浓度的增大而增大,当花青素浓度在1.0 mg/mL时,花青素清除率为94.6%,IC50值为0.398 mg/mL,略低于抗坏血酸(IC50值为0.414 mg/mL)。

图7 黑果腺肋花楸花青素对DPPH自由基清除率的影响Fig.7 Effect of Aronia melanocarpa anthocyanins on the scavenging rate of DPPH radicals
2.3.2 ABTS自由基清除率
由图8可知,黑果腺肋花楸花青素和抗坏血酸对ABTS自由基的清除率均随着花青素浓度的增大而增大,当花青素浓度在1.0 mg/mL时,ABTS自由基清除率为39.1%,IC50值为0.628 mg/mL,低于抗坏血酸(IC50值为0.832 mg/mL)。

图8 黑果腺肋花楸花青素对ABTS自由基清除率的影响Fig.8 Effect of Aronia melanocarpa anthocyanins on the scavenging rate of ABTS radicals
2.3.3 羟基自由基清除率
由图9可知,黑果腺肋花楸花青素对羟基自由基的清除率随着花青素浓度的增大而增大,当花青素浓度为1.0 mg/mL处,花青素羟基自由基清除率为31.9%,IC50值为0.718 mg/mL。表明花青素与抗坏血酸(IC50值为0.907 mg/mL)相比其清除羟基自由基的活性相对较弱。

图9 黑果腺肋花楸花青素对羟基自由基清除率的影响Fig.9 Effect of Aronia melanocarpa anthocyanins on the scavenging rate of hydroxyl radicals
2.3.4 总还原力的测定
铁离子还原能力作为抗氧化性能的一个重要指标,可反映抗氧化剂还原能力的大小,样品对铁离子的还原力越强,其抗氧化能力越强[30]。
由图10可知,随着浓度增大,黑果腺肋花楸花青素和抗坏血酸的总还原力增大,且呈一定正相关。黑果腺肋花楸花青素与抗坏血酸相比总还原力相对较弱,当花青素浓度在1.0 mg/mL时,花青素总还原力为28.6%。

图10 黑果腺肋花楸花青素总还原力测定Fig.10 Determination of total reducing capacity of Aronia melanocarpa anthocyanins
3 结论
黑果腺肋花楸花青素易溶于水、无水乙醇与四氢呋喃,在温度低于60 ℃、避光条件下稳定性更好;在pH值小于4时,花青素水溶液的稳定性较好,溶液呈红色。随着pH值增大,花青素水溶液颜色发生改变,依次为蓝紫色、深绿色、深棕色;食品添加剂蔗糖、葡萄糖、抗坏血酸、柠檬酸、山梨酸钾、苯甲酸钠均影响花青素的稳定性,其中防腐剂山梨酸钾和抗氧化剂抗坏血酸对花青素稳定性的影响较小;金属离子Mg2+、Na+、Ca2+、K+对花青素稳定性的影响较小,金属离子Fe3+、Cu2+对花青素稳定性的影响较大;该花青素对DPPH、ABTS、羟基自由基均具有清除能力,总还原力随其浓度的增大而增强。综上所述,黑果腺肋花楸花青素在医药、功能食品方面具有良好的应用前景。
