橡胶树膜系统酵母双杂交cDNA 文库构建及HbSRPP7互作蛋白筛选
2023-11-11聂智毅康桂娟覃怀德曾日中
聂智毅 康桂娟 覃怀德 曾日中
关键词:橡胶树;HbSRPP7;膜蛋白酵母双杂交系统;cDNA 文库;互作蛋白
中图分类号:S435.661 文献标识码:A
天然橡胶(顺式-聚异戊二烯,橡胶烃)作为重要的工业原料和战略物资广泛应用于人们的日常生活、交通运输、军事装备及航空航天等领域,在我国经济和国防建设中具有重要的战略地位。天然橡胶产业是一种典型的资源约束型产业,在生产地域和产品性能上具有不可替代性。天然橡胶主要来源于巴西橡胶树( Hevea brasiliensis Muell. Arg.,简称橡胶树)乳管细胞细胞质中的橡胶粒子[1]。橡胶粒子是橡胶树乳管细胞中的一种特殊細胞器,作为橡胶树乳管细胞细胞质的主要成分,其体积约占胶乳总体积的30%~45%,是橡胶生物合成及其产物最终贮藏的场所[2]。橡胶生物合成的整个过程涉及乳管细胞产胶代谢的一系列生化反应,其中发生在橡胶粒子上橡胶分子的起始、延长和终止是橡胶生物合成的关键步骤。橡胶粒子上的蛋白质(酶)在这一系列反应过程中起着关键作用,它们直接决定着橡胶烃分子的数量和大小,从而影响着天然橡胶的产量和质量。深入研究橡胶粒子蛋白的功能,分析其与橡胶生物合成之间的关系,对揭示橡胶生物合成及其分子调控机制具有重要意义。DAI 等[3]提取洗涤过的橡胶粒子蛋白并采用“Shotgun(鸟枪法)”质谱分析,鉴别了186 个橡胶粒子蛋白,其中已知参与橡胶生物合成的橡胶粒子蛋白主要有3种,分别是橡胶延伸因子(rubber elongation factor,REF)、小橡胶粒子蛋白(small rubber particleprotein, SRPP ) 和顺式- 异戊烯基转移酶(cis-prenyltransferase, CPT)。除此之外,橡胶粒子上存在调控橡胶生物合成的焦磷酸酶[4]以及其他功能未知的蛋白[3]。REF、SRPP 及CPT 等蛋白可能通过相互作用,形成蛋白复合体[5-8],在橡胶粒子上催化800~20 000 个IPP 分子中的异戊二烯基顺式聚合,形成多聚顺式异戊二烯(即天然橡胶分子),但这些橡胶粒子蛋白的具体功能及作用机制仍有待更深入研究[9]。SRPP 是丰度仅次于REF 的橡胶粒子蛋白组分,与橡胶粒子发育和橡胶生物合成密切相关[10-11]。DAI 等[3]研究表明,橡胶粒子上存在多个SRPP 蛋白,但大部分成员的功能尚未鉴定。进一步鉴定橡胶粒子上SRPP家族其他成员的相互作用蛋白,有助于揭示橡胶粒子上参与橡胶生物合成的蛋白复合体组成,阐明橡胶生物合成及其调控的分子机制。HbSRPP7(GenBank 登录号:XM_021791298.1)是一个在橡胶生物合成活跃度相对较低的大橡胶粒子上表达量较小橡胶粒子高的橡胶粒子蛋白,可能与大、小橡胶粒子的橡胶生物合成活性差异相关[12],但其功能及其参与橡胶生物合成的机制需要进一步深入研究。本研究利用位点特异性重组技术构建高质量膜蛋白酵母双杂交系统(membrane yeasttwo-hybrid system, MYTH)cDNA 文库,使用DUALmembrane system 构建pBT3STE-SRPP7 和pBT3SUC-SRPP7 诱饵载体并进行自激活及表达功能检测。以pBT3STE-SRPP7 诱饵质粒对胶乳MYTH cDNA 文库进行筛选,获得21 个可能与HbSRPP7 互作的蛋白,为了解HbSRPP7 的功能及其功能发挥的机制,阐明橡胶生物合成的分子机理奠定基础。
1 材料与方法
1.1 材料
以2000 年定植于海南省儋州市宝岛新村的热研7-33-97 品系橡胶树胶乳为材料。多糖多酚植物总RNA 快速提取试剂盒购自北京百泰克生物技术有限公司, Oligotex mRNA Kits 购自Qiagen 公司,SuperScript Double-Stranded cDNASynthesis Kit 购自Invitrogen 公司,Trimmer-2cDNA normalization kit 购自Evrogen 公司,限制性内切酶、T4 DNA Ligase 和DNA marker 购自宝生物工程(大连)有限公司,DNA 凝胶回收和质粒提取试剂盒购自Omega 公司,ClonExpress UltraOne Step Cloning Kit 及Phanta EVO HS Super-Fidelity DNA Polymerase 购自南京诺唯赞生物科技有限公司,DUALmembrane starter kit 购自Dualsystems Biotech 公司,酵母缺陷培养基、酵母转化试剂盒购自Clontech 公司,DH5α 大肠杆菌为本实验室保存,其余生化试剂购自生工生物工程(上海)股份有限公司。引物合成及测序委托英潍捷基(上海)贸易有限公司完成。
1.2 方法
1.2.1 橡胶树胶乳RNA 提取和cDNA 合成 根据多糖多酚植物总RNA 快速提取试剂盒说明书提取橡胶树胶乳总RNA,以分光光度计测定RNA纯度及浓度并参照Oligotex mRNA Kits 说明书分离纯化mRNA。参照SuperScript Double-StrandedcDNA Synthesis Kit 试剂盒说明书合成cDNA 第一链以及第二链,–20 ℃保存备用。
1.2.2 橡胶树胶乳MYTH系统cDNA 文库制备及质量检测 (1)cDNA 的均一化处理。将合成的34 μL cDNA 第二链加入以下反应体系:10×T4Ligase buffer 5 μL,1 μg/μL 5'Adapter(序列为5'-GCAGAGTGGCCATTACGGCCACAACTTTGTACAAAAAAGTTGG-3')10 μL,40 U/μL T4 DNALigase 1 μL,混匀后于16 ℃放置16 h。加入10 mmol/L dNTPs 2 μL,T4 DNA Polymerase 2 μL,16 ℃放置20 min,反应结束后经2.5 倍体积无水乙醇沉淀DNA,并用14 μL ddH2O 溶解沉淀物,取其中12 μL 参照Trimmer-2 cDNA normalizationkit 说明书进行均一化处理,切胶回收1000 bp 以上片段,溶解于14 μL ddHO 中。
(2)cDNA 文庫制备。按照DUALmembranestarter kit 以及ClonExpress Ultra One Step CloningKit 说明书,使用位点特异性重组的方式,将14 μL均一化cDNA 与6 μL 线性化的MYTH 系统载体pPR3-N 加入50 μL 2×ClonExpress Mix,30 μLddHO,置于50 ℃反应30 min。反应结束后加入10 μL 10 μg/μL 的Proteinase K 灭活重组酶。并依次加入90 μL ddHO、20 μg/μL Glycogen 2 μL、7.5 mol/L NH4OAc 100 μL、无水乙醇750 μL,混合均匀并置于–80 ℃ 2 h。于4 ℃,16000 r/min离心30 min,去上清,加入150 μL 70%乙醇;4 ℃,16 000 r/min 离心3 min;重复此步骤1 次,小心去除上清,室温晾干10 min。用10 μL ddHO 置冰上重悬沉淀。重组产物每2.5 μL 电转化50 μL大肠杆菌感受态细胞,电击后迅速向电转杯中加入LB 培养基1 mL,合并4 次转化后的菌液,用培养基补足至5 mL,置于37 ℃,以250 r/min 震荡培养2 h 后,取2 μL 培养物梯度稀释10、100、1000、10 000 倍,其余培养物加入甘油至终浓度20%保存于–80 ℃备用。
(3)cDNA 文库质量检测。取转化后的大肠杆菌梯度稀释液10 μL 涂布于氨苄抗性(100 μg/mL)LB 平板,培养16 h 后计数。CFU/mL=平板上的克隆数/10× 稀释倍数×1000 , 文库总CFU=CFU/mL×文库菌液总体积(mL)。以无菌枪尖从原始文库滴度测定平板上随机挑取菌斑克隆,利用3'AD(5'-CTCGAGAGGCCGAGGCGGCC-3')和5'AD(5'-GCAGAGTGGCCATTACGGCC-3')引物进行PCR 扩增。PCR 扩增程序为:95 ℃预扩增5 min;然后94 ℃ 30 s,50 ℃ 1 min,72 ℃2 min,共30 个循环;72 ℃ 10 min。扩增结束后以1%琼脂糖凝胶电泳检测文库插入片段大小。
(4)cDNA 文库的扩增与文库质粒提取。将上步检验合格的原始cDNA 文库,根据其库容量,以每个涂布约3 万个克隆的密度铺板培养于35 cm氨苄抗性(100 μg/mL)LB 培养基平板,37 ℃培养16 h,培养完成后以LB 液体培养基洗脱菌斑克隆,以质粒大抽试剂盒抽提质粒,–80 ℃保存备用。
1.2.3 pBT3STE-SRPP7 和pBT3SUC-SRPP7 诱饵载体构建、自激活检测及功能检测 根据HbSRPP7的开放阅读框(open reading frame, ORF)序列以及ClonExpress Ultra One Step Cloning Kit 说明书设计包含Sfi Ι 酶切位点引物(SRPP7-F:5'-GGATCTTCCAGAGATGGCCATTACGGCCATGGAGATGGAGAAGAAGAACCC-3',SRPP7-R:5'-CTGCCGTTCGACGATGGCGCCTCGGCCCCATCCGAATCTGATGAATCATGTGC-3'。),用于扩增HbSRPP7 的ORF 片段。PCR 反应体系:PhantaEVO HS Super-Fidelity DNA Polymerase 1 μL、稀释50 倍的橡胶树胶乳第一链cDNA 2 μL、5×EVOBuffe 10 μL、10 mmol/L dNTPs 1 μL、10 μmol/L的SRPP7-F 及SRPP7-R 引物各1 μL,以ddHO补至体积50 μL。PCR 扩增程序为95 ℃预扩增5 min;94 ℃ 30 s,60 ℃ 40 s,72 ℃ 50 s,共35个循环;72 ℃ 10 min。PCR 扩增结束后以1%琼脂糖凝胶电泳检测扩增产物,切胶回收扩增条带,–20 ℃保存备用。
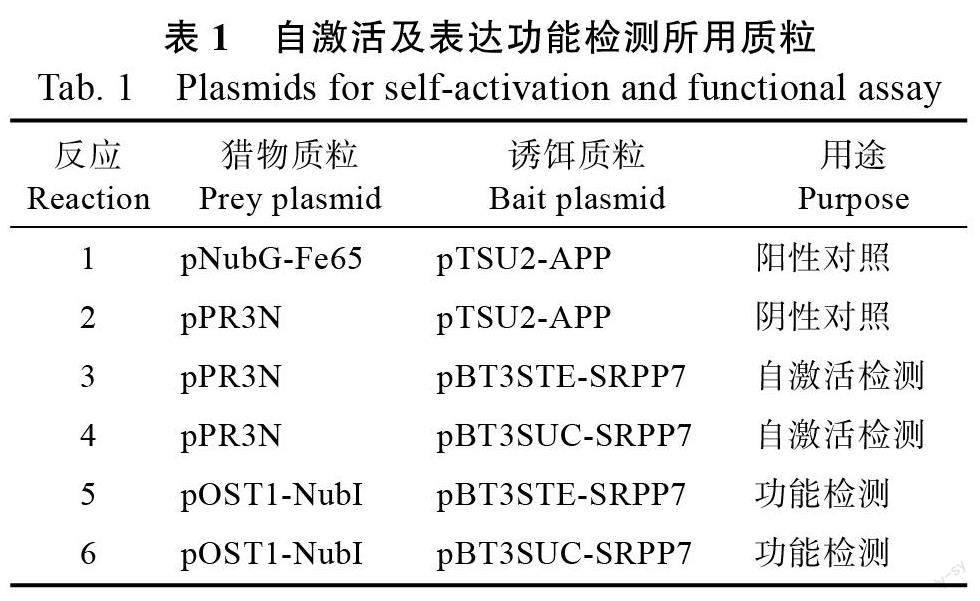
利用Sfi Ι 限制性内切酶酶切诱饵载体质粒pBT3STE 和pBT3SUC,切胶回收线性化载体片段,根据ClonExpress Ultra One Step Cloning Kit试剂盒说明书将HbSRPP7 的ORF 片段克隆至pBT3STE 和pBT3SUC 载体的Sfi Ι 位点中,然后将重组后的质粒转化DH5α 感受态细胞。涂布于含卡那霉素(100 μg/mL)的LB 平板,37 ℃培养16 h。挑取单菌落至LB 液体培养基培养16 h 并提取质粒,以Sfi Ι 酶切鉴定为阳性的克隆送测序。根据测序结果将无移码无碱基突变的重组质粒分别命名为pBT3STE-SRPP7 和pBT3SUC-SRPP7。参照DUALmembrane starter kit 试剂盒说明书,将各种质粒组合(表1)转入受体菌NMY32 中,培养4 d,记录每块筛选平板上的克隆数量,并计算其相对生长率,对构建的诱饵载体进行自激活检测及表达功能检测。
1.2.4 HbSRPP7 互作蛋白筛选及回转验证 使用pBT3STE-SRPP7 诱饵载体参照DUALmembranestarter kit 试剂盒说明书进行互作蛋白筛选及回转验证。
2 结果与分析
2.1 RNA 提取与cDNA 合成
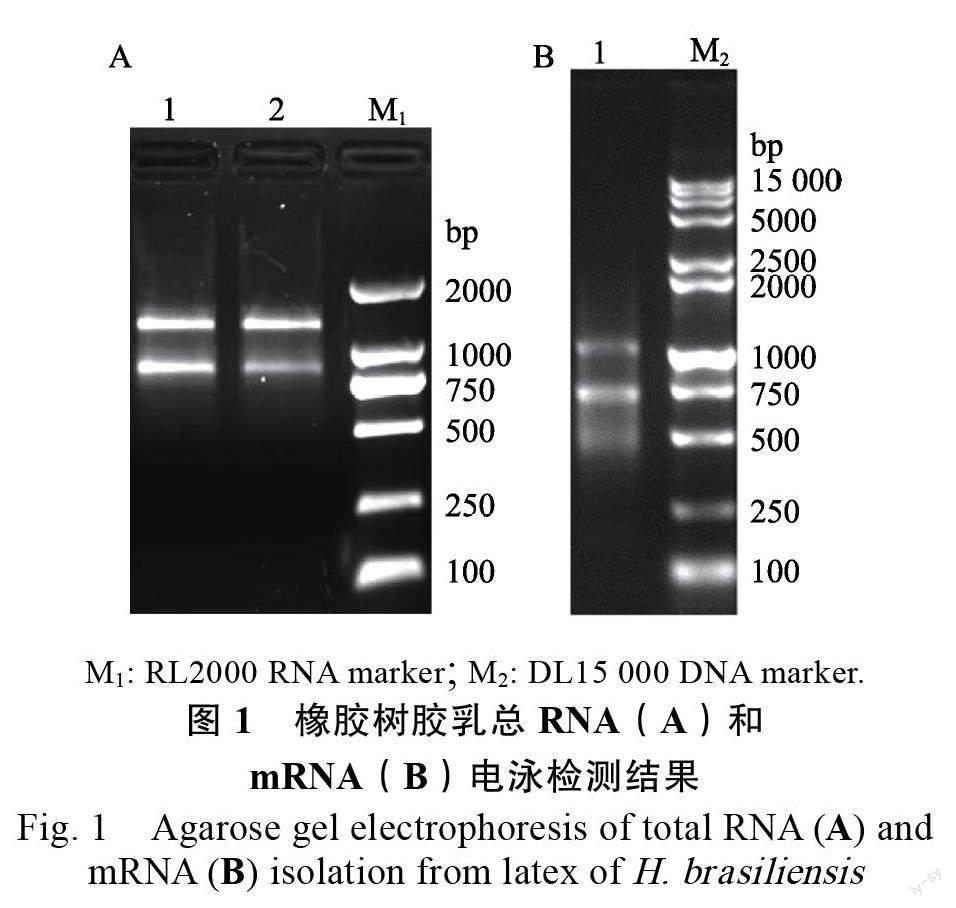
本研究提取的橡胶树胶乳总RNA 的OD/OD为2.10,OD/OD 为1.88,1.5%琼脂糖凝胶电泳结果如图1A 所示,呈现2 条相对集中的亮带,带型完整,边缘清晰,说明RNA 样品的完整性好。分离的mRNA 经1.5%琼脂糖凝胶(图1B)电泳显示呈弥散状分布,条带分布均匀,紫外分光光度测定总量为6.5 μg,OD/OD280 为1.91,表明分离的mRNA 总量及纯度满足建库要求。取5 μg mRNA 合成cDNA 第二链,进行均一化处理后直接用于cDNA 文库的制备。
2 结果与分析
2.1 RNA 提取与cDNA 合成
本研究提取的橡胶树胶乳总RNA 的OD/OD 为2.10,OD/OD 为1.88,1.5%琼脂糖凝胶电泳结果如图1A 所示,呈现2 条相对集中的亮带,带型完整,边缘清晰,说明RNA 样品的完整性好。分离的mRNA 经1.5%琼脂糖凝胶(图1B)电泳显示呈弥散状分布,条带分布均匀,紫外分光光度测定总量为6.5 μg,OD/OD 为1.91,表明分离的mRNA 总量及纯度满足建库要求。取5 μg mRNA 合成cDNA 第二链,进行均一化处理后直接用于cDNA 文库的制备。
2.2 cDNA 文库制备、质量检测及质粒提取
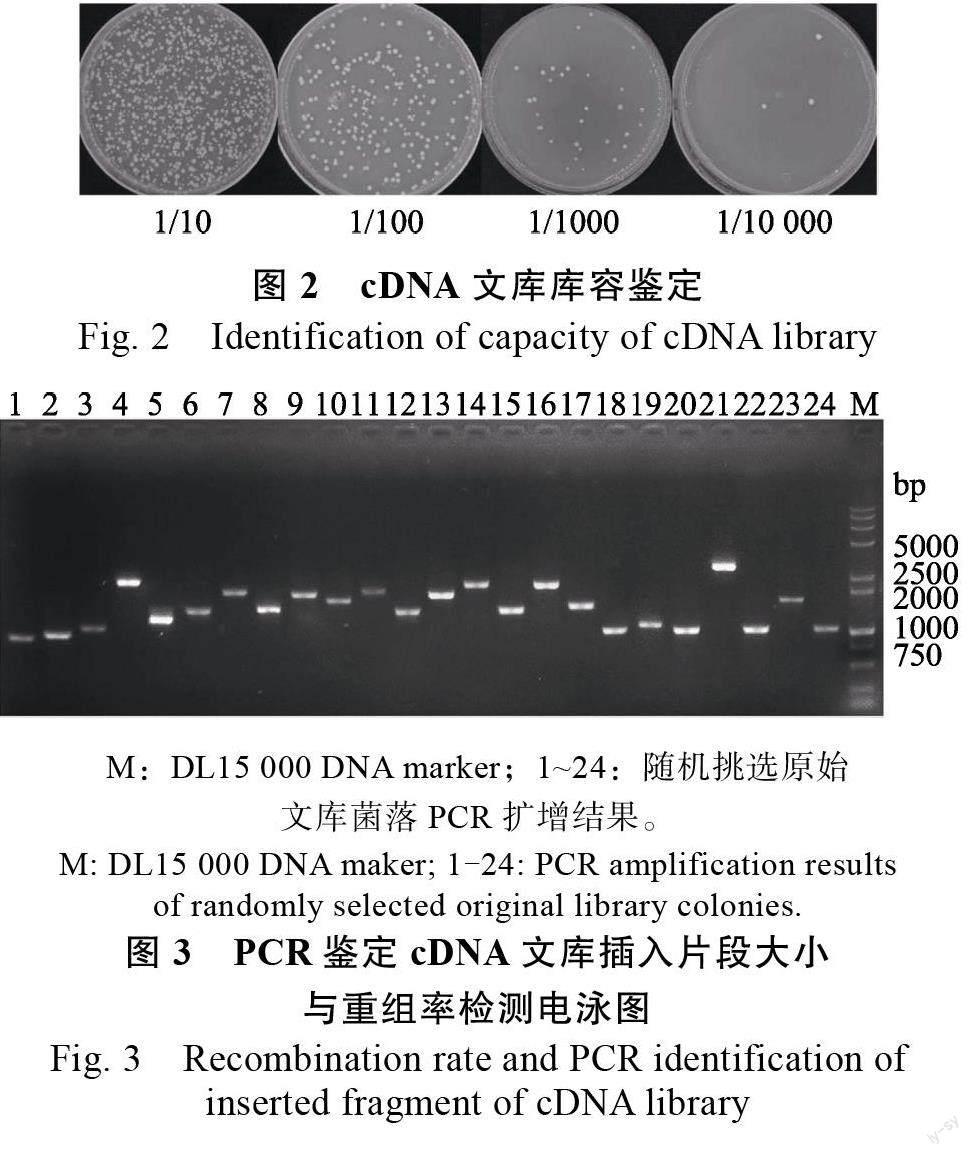
构建的重组产物经电击转化大肠杆菌,稀释100 倍细菌培养物的LB 平板共长了约266 个克隆子,稀释1000 倍的LB 平板共长了约32 个克隆子,稀释1000 倍的LB 平板共长了3 个克隆子(图2),经计算其原始cDNA 文库的滴度约为3.0×10CFU/mL,总库容为1.5×10 CFU,符合筛库要求。通过PCR 鉴定制备的cDNA 文库插入片段多数介于1000~4000 bp 之间(图3),平均插入片段长度约为1500 bp,重组率为100%。将上述经检测的cDNA 文库涂布于500 个35 cmLB 平板,经培养、洗脱及质粒提取后获得库容大于1.0×10 CFU/mL 的文库质粒,用于下一步的筛库实验。
2.3 pBT3STE-SRPP7 和pBT3SUC-SRPP7 诱饵载体的构建
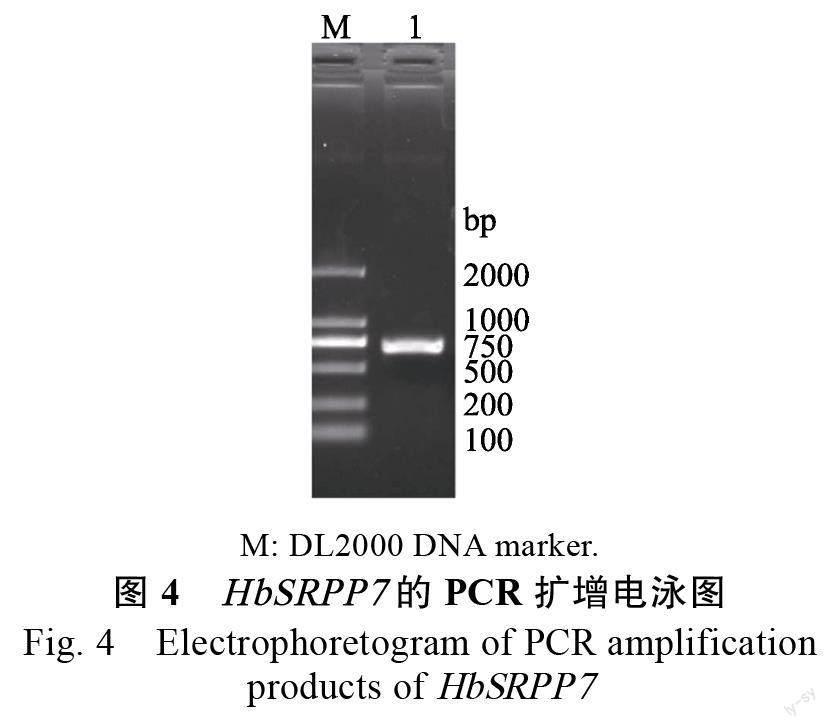
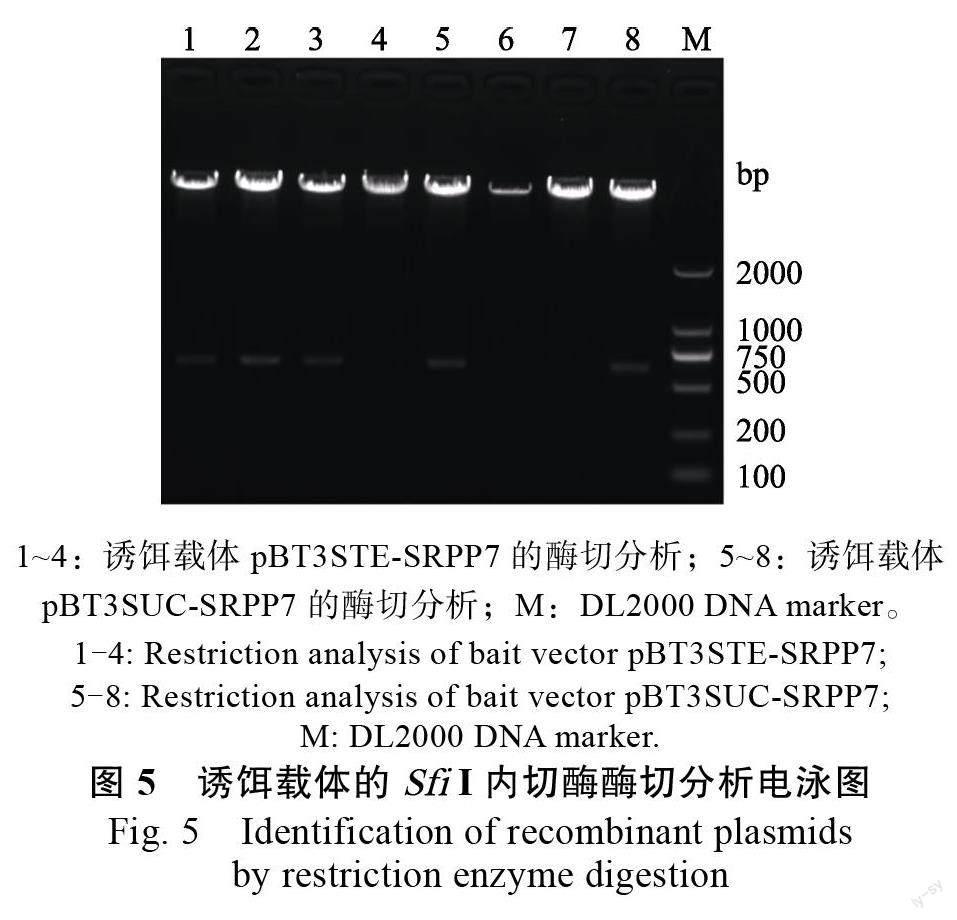
琼脂糖电泳检测显示,PCR 扩增HbSRPP7 的ORF 片段大小正确(图4),构建的诱饵载体经内切酶检测与预计相符(图5)。测序结果显示,目的片段正确插入pBT3STE 及pBT3STE 载体的Sfi Ι 位点中,且序列无移码及碱基突变现象,说明诱饵载体pBT3STE-SRPP7 和pBT3STE-SRPP7 构建成功。
2.4 诱饵载体的自激活检测及功能检测
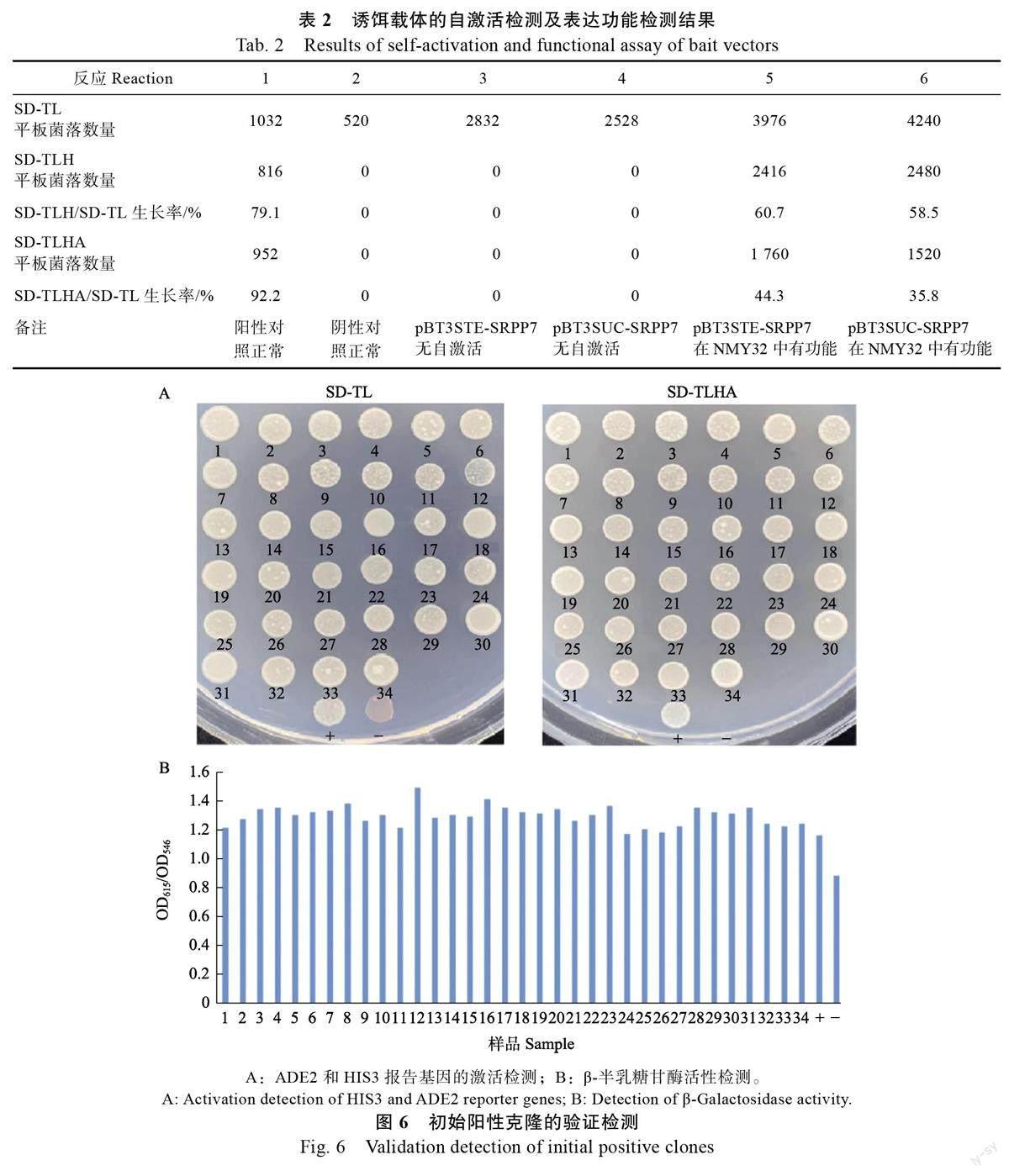
自激活及功能检测结果显示(表2),阳性对照(反应1)在SD/-Trp/-Leu(SD-TL)、SD/-Trp/-Leu/-His ( SD-TLH ) 及SD/-Trp/-Leu/-His/-Ade(SD-TLHA)筛选平板上生长旺盛,阴性对照(反应2)在SD-TL 筛选平板上生长正常,在SD-TLH和SD-TLHA 筛选平板上无生长,与预计相符合,说明实验体系对照成立。而自激活检测的反应3和反应4 在SD-TL 筛选平板上生长正常,在SD-TLH 和SD-TLHA 筛选平板上无生长,说明pBT3STE-SRPP7 和pBT3SUC-SRPP7 诱饵载体对NMY32 酵母无自激活活性。功能检测的反应5和反应6 在SD-TLH 和SD-TLHA 筛选平板上有生长,相对于SD-TL 筛选平板生长率在35%~61%之间,显示pBT3STE-SRPP7 和pBT3SUC-SRPP7均可在酵母中正常表达,皆可应用于下一步的筛库实验,pBT3STE-SRPP7 的相对生长率(60.7%和44.3%)较pBT3SUC-SRPP7(58.5%和35.8%)高,说明pBT3STE-SRPP7 诱饵载体表达功能相对更强,因此后续筛库实验选用pBT3 STE-SRPP7诱饵载体进行。
2.5 HbSRPP7 的互作蛋白筛选及回转验证
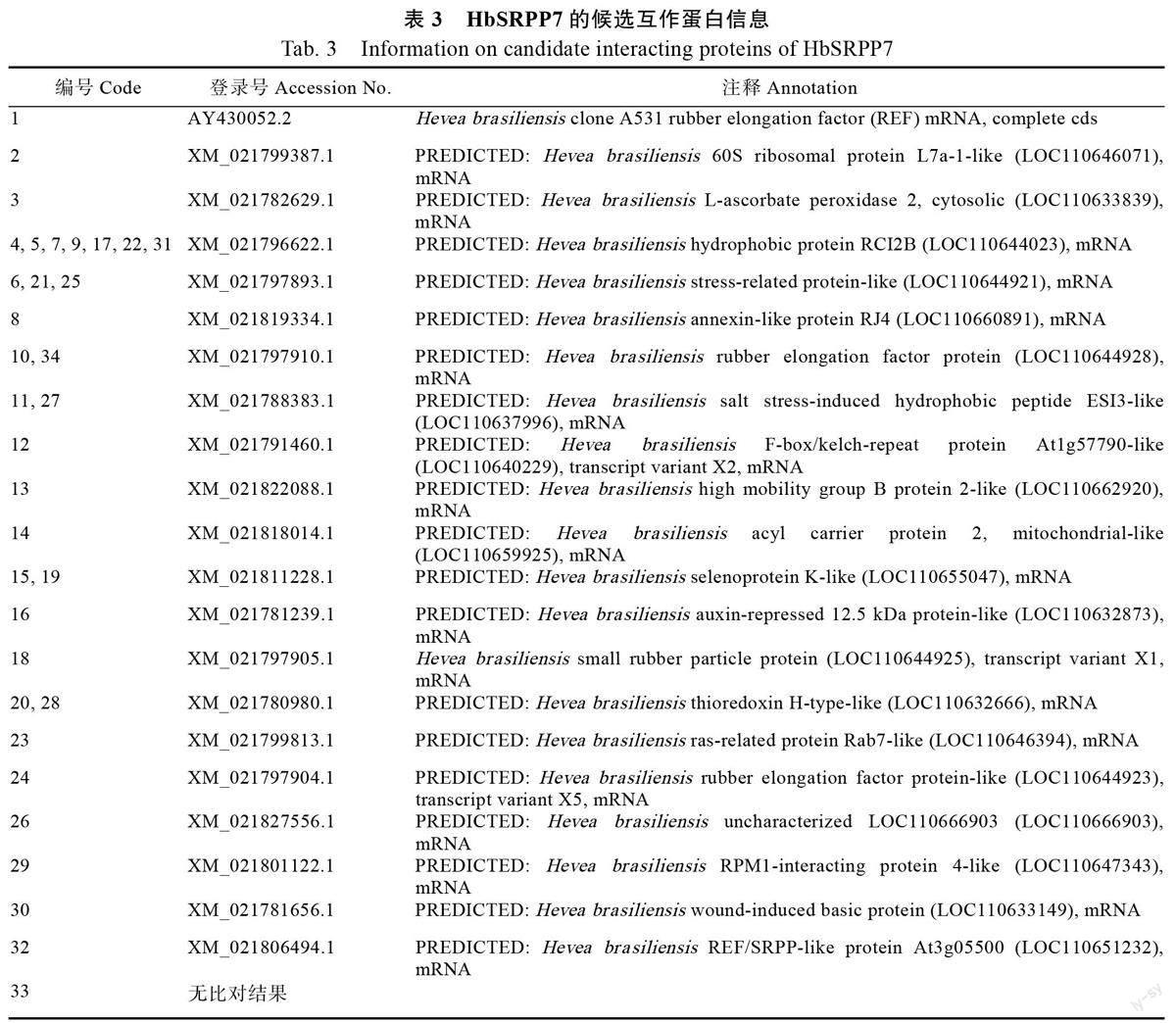
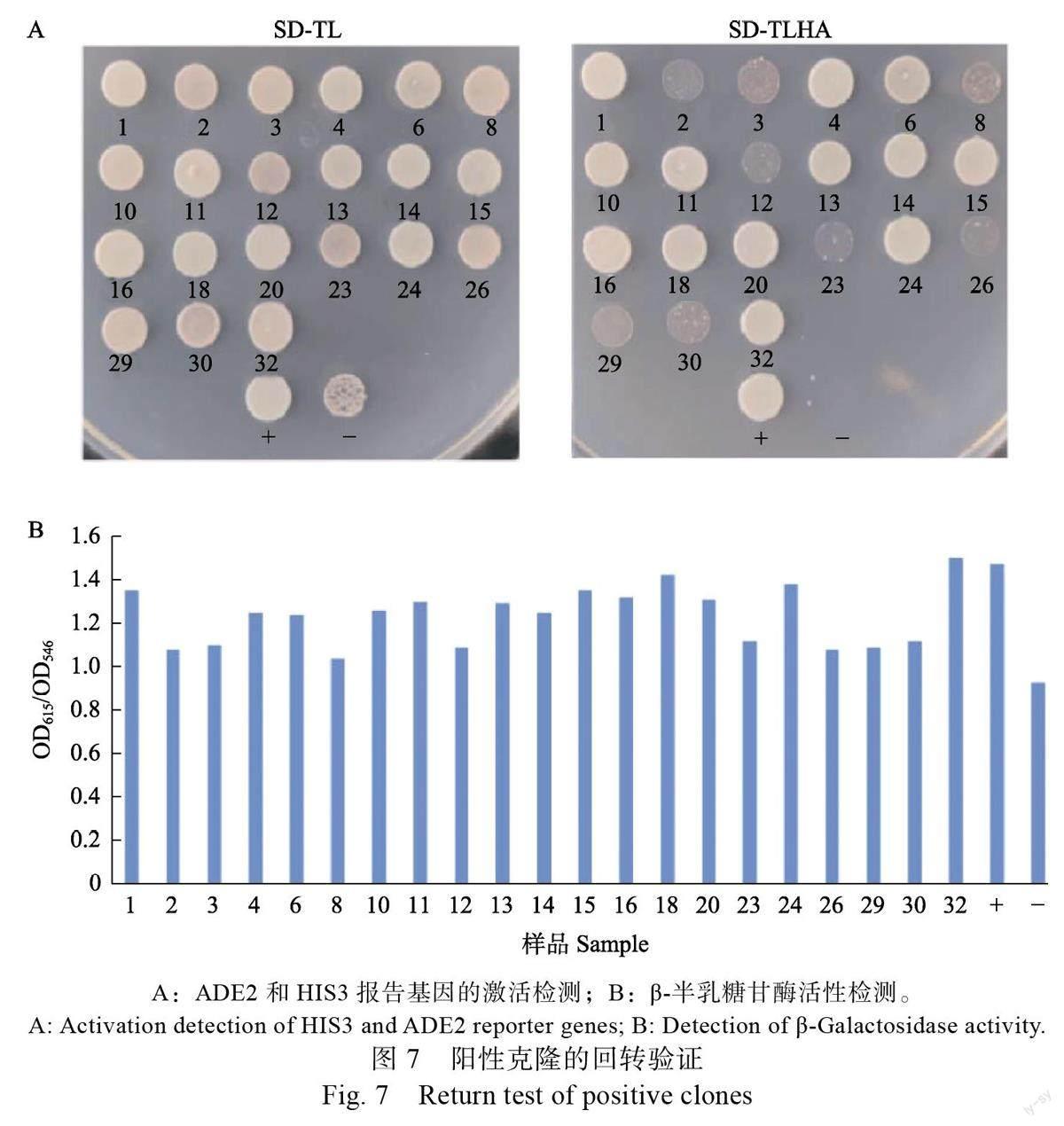
文库筛选共获得34 个可激活ADE2 和HIS3报告基因的初始阳性克隆(图6A)。LacZ 报告基因激活检测显示这34 个初始阳性克隆的β-半乳糖甘酶活性(OD/OD)值皆大于阴性对照值( 图6B ), 表明这些初始阳性克隆均是与HbSR-PP7 存在相互作用的阳性克隆。初始阳性克隆的质粒DNA 经测序及Blastn 比对,结果显示这34 个阳性克隆包含21 种不同编码的基因(表3)。进一步的回转验证结果显示,全部阳性克隆均能通过对ADE2 和HIS3 报告基因激活的回转验证,但其中2、3、8、12、23、26、29 和30 號阳性克隆生长较弱(图7A)且β-半乳糖甘酶活性值较低(图7B),表明这些克隆所包含的相关蛋白与HbSRPP7 间存在的蛋白相互作用可能比较弱。
3 讨论
酵母双杂交技术是目前最经典的蛋白间相互作用研究方法,具有简单高效的特点[13]。但传统的酵母双杂交系统仅限于相互作用发生于细胞核中的2 个或者几个可溶性蛋白的互作分析,并不能对相互作用发生在细胞质中的膜蛋白或可溶蛋白进行研究。MYTH 系统是传统酵母双杂交系统的一种替代方法,无需核定位信号,主要依赖泛素降解途径作为蛋白质相互作用“感应器”,对膜蛋白与膜蛋白、膜蛋白与可溶性蛋白之间相互作用进行研究[14-16],并且可以检测3 个蛋白之间“桥接”的相互作用[7]。此外,因为检测的诱饵和猎物蛋白之间相互作用发生在细胞质或细胞膜,所以可以与传统酵母双杂交系统相互补充,分析更多的互作目标蛋白[17-19]。橡胶生物合成发生于乳管细胞中的橡胶粒子表面[20-21]。SRPP 家族蛋白是主要存在于橡胶粒子上的高丰度蛋白质之一[22],其蛋白相互作用并非发生于细胞核中,使用MYTH系统,可更有效筛选HbSRPP7 的互作蛋白。
MYTH 系统与传统酵母双杂交系统类似,均存在假阳性率较高的缺点。诱饵蛋白在宿主酵母菌中的自激活活性是造成筛选结果假阳性的重要原因之一[23]。本研究所用MYTH 系统诱饵蛋白自激活常见的表现是NMY32 中表达的诱饵(bait)融合蛋白和任意猎物(prey)载体(NubG)结合启动下游的转录[24]。需要比对阳性对照或进一步通过竞争抑制剂3-AT(3-Aminotriazole, 3-氨基三唑)抑制较为轻微的自激活活性,降低干扰背景。此外,诱饵蛋白的正确翻译与定位是本研究所使用MYTH 系统正常运转的前提。因此为保证后续利用MYTH 系统筛选HbSRPP7 的互作蛋白获得较为可靠结果,在文库筛选前,本课题组对诱饵载体的自激活活性以及在酵母中表达的诱饵蛋白功能进行了鉴定。结果显示所构建诱饵载体pBT3STE-SRPP7 和pBT3SUC-SRPP7 在NMY32 酵母中均不存在自激活现象,排除诱饵蛋白自激活活性对筛选结果的干扰。同时功能检测显示pBT3STE-SRPP7 和pBT3SUC-SRPP7 均在NMY32酵母中有功能,确认诱饵蛋白能在NMY32 酵母中正确表达。
本研究利用表达功能相对更强的pBT3STESRPP7诱饵载体对构建的MYTH cDNA文库进行筛选,并通过回转验证最终获得21 个候选的HbSRPP7 互作蛋白。在这21 个候选互作蛋白中,有3 个REF 家族蛋白及2 个SRPP 家族蛋白。其中HbREF1(XM_021797910.1)及HbSRPP1(XM_021797905.1)已被证实与橡胶粒子发育相关[11, 21, 25-27],并通过与CPT 蛋白直接或间接互作参与橡胶生物合成[7-8]。显示HbSRPP7 可能通过与HbREF1 及HbSRPP1 等橡胶粒子互作,在橡胶粒子发育过程中发挥作用,或者作为橡胶生物合成相关蛋白复合体的组分之一参与橡胶生物合成。此外,HbSRPP7 候选互作蛋白中有2 个活性氧清除相关蛋白(thioredoxin H-type-like、L-ascorbateperoxidase 2)[28-29]和5 个胁迫相关蛋白(highmobility group B protein 2-like、RPM1- interactingprotein 4-like、stress-related protein-like、salt stressinducedhydrophobic peptide ESI3-like、F-box/kelch-repeat protein)[30-34],表明HbSRPP7 可能通过蛋白互作参与橡胶树乳管生物和非生物逆境胁迫的响应。橡胶树的胶乳是一种与生物和非生物逆境胁迫的响应关联的保护物质,割胶可以显著促进胶乳中的橡胶生物合成[ 3 5 ] 。因此,HbSRPP7 除了可能通过与橡胶生物合成相关的橡胶粒子蛋白互作参与橡胶生物合成,也可能通过与生物和非生物逆境胁迫相关蛋白互作,响应橡胶树乳管细胞生物和非生物逆境胁迫系统信号,参与橡胶粒子上的橡胶生物合成调控。HbSRPP7与这些蛋白的相互作用在橡胶粒子上的具体功能尚有待确认,下一步以免疫共沉淀(Co-Immunoprecipitation,Co-IP)及雙分子荧光互补技术(bimolecular fluorescence complementation, BiFC)鉴定互作蛋白,并通过橡胶体外合成实验及反向遗传学研究手段对HbSRPP7 及其互作蛋白进行功能研究,将有助于了解HbSRPP7 的功能及其功能发挥的机制,揭示橡胶粒子上参与橡胶生物合成的蛋白复合体组成,阐明橡胶生物合成及其调控的分子机制。
