不同养殖环境下中华圆田螺肠道菌群多样性试验
2023-10-23黄明磊黄凯宿志健王超男杨旭红
黄明磊,黄凯*,宿志健,王超男,杨旭红
(1.广西大学动物科学技术学院,广西 南宁 530004;2.南宁海宝路水产饲料有限公司,广西 南宁 530031)
中华圆田螺(Cipangopaludina cathayensis),俗名田螺、香螺,属软体动物门、腹足纲、田螺科、圆田螺属。分布于我国北方各省区;在国外主要分布于朝鲜和北美等国家。生活于湖泊、河流、水库、池塘及稻田内[1],尤其喜栖息在水草茂盛的水域。其适应性强,对干燥及寒冷有较大的抗御力。足发达,适于水底爬行,常以水生植物和低等藻类为食,是淡水螺的主要养殖品种[2]。其肉质鲜美,营养丰富,高蛋白、低脂肪,具有食用、药用价值[3-5];同时还具有净化水体的功能[6],螺肉、螺壳可作为其他经济动物的饲料原料。
水生动物肠道微生物菌群的结构、功能与水生动物的营养代谢、肠道发育以及免疫系统有密切的关系,维持其机体肠道内环境稳定。在不同养殖环境下,水产动物的肠道菌群也有各自特点,当养殖水环境发生变化或水体中受到某些因素影响时,其肠道菌群结构会发生变化,已适应新环境的细菌会大量繁殖,影响原有菌落平衡。李存玉等[7]研究发现,在池塘养殖与工厂化养殖条件下,牙鲆(Paralichthys olivaceus)肠道菌群丰度与多样性及菌群结构存在显著差异;杨莺莺等[8]研究认为,对虾肠道菌群的定殖性受到外界环境影响时,如水质突变,极易引起对虾肠道菌群平衡失调,被病原菌侵入,暴发疾病。现开展不同养殖环境对中国圆田螺肠道菌群的影响试验。
1 材料与方法
1.1 时间与地点
2022 年11 月。试验地位于广西大学。
1.2 材料
设置A、B 2组。A 组:中华圆田螺来自广西玉林陆川县养殖基地,采用微流水稻田养殖方式,养殖水温26.5 ℃,ρ(溶解氧)为(5.0±0.5)mg/L,pH 值为(7.0±0.4),ρ(氨氮)<0.2 mg/L;B 组中华圆田螺来自邕江江边水池养殖,养殖水温为26.4 ℃,ρ(溶解氧)为(4.5±0.5)mg/L,ρ(氨氮)<0.7 mg/L,pH 值为(6.8±0.3)。
1.3 试验方法
1.3.1 样品处理
随机从A、B 2组选取30 只外壳完好、健康、无机械损伤的中华圆田螺,置于无菌操作台灭菌的冰盘内,破壳取螺肠道置于50 mL 灭菌离心管中,迅速放入液氮中冷冻20 min 后,于-80 ℃超低温冰箱中保存。
1.3.2 样品中总DNA 的提取与纯化
分别取A 组和B 组田螺的肠道内容物(每个平行组随机取5 只田螺的肠道内容物并混合),根据QIAampFast DNA Stool Mini Kit 进行总菌群DNA提取纯化。将提取纯化的DNA,用1%琼脂糖凝胶电泳,电压为120 V,时间30 min,观察DNA 片段完整性及大小,要求目的条带明显,无明显降解。
1.3.3 PCR 扩增及纯化
取纯化后的DNA 30 ng 置于无酶管中,加水稀释为1 mg/L 作为模板。使含有Barcode 的特异引物与高保真酶,对V3—V4 区域进行PCR 扩增,琼脂糖凝胶电泳检测DNA 纯度。
PCR 扩增产物经1%琼脂糖凝胶,在电压170 V条件下进行30 min 凝胶电泳,以检测目的条带的宽度,并用AAMP(Agencourt AMPure XP)核酸纯化试剂盒纯化。PCR 扩增引物序列、拼接结果见表1、表2。
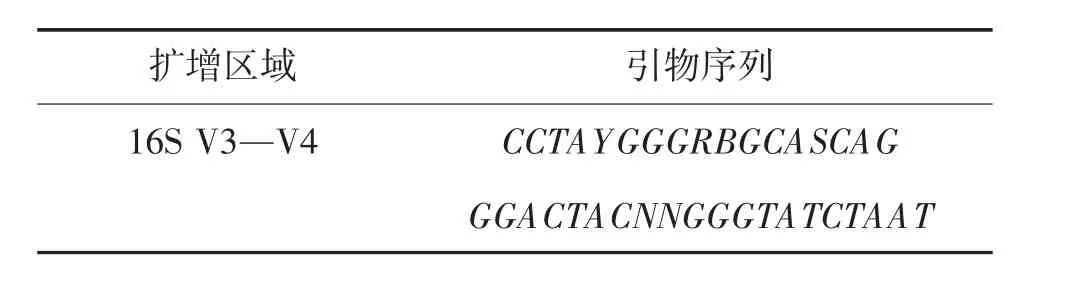
表1 PCR 引物扩增序列
1.3.4 数据处理
肠道菌群通过Silva 与Unite 数据库比对测序结果,并依靠《伯杰氏鉴定细菌学手册》及相关文献进行菌属功能的分类处理。
2 结果与分析
2.1 测序
测序结果见表3。由表3 可见,过滤嵌合体后,最终用于后续分析的Tags 序列平均长度为422 bp。2 个样本共得到131 240 条序列,A 组样本原始序列共87 923 条,B 组样本原始序列共43 317 条。其中质控后可用于后续分析的有效序列共105 319 条,A 组样本剩余序列共71 669 条,B 组样本原始序列共33 650 条。

表3 样品QC 之后序列统计
2.2 物种多样性曲线
将所得有效数据构建稀释曲线和等级聚类曲线,见图1、2。由图1 可见,2 个样本的稀释曲线逐渐趋于平稳,这可表明测序数据量渐进合理,更多的数据量基本上不会再产生较多的OTUs。由图2可见,曲线在水平方向的横轴上跨度较大,说明物种丰富度高;在垂直方向上曲线坡度较大,说明物种分布不均匀。
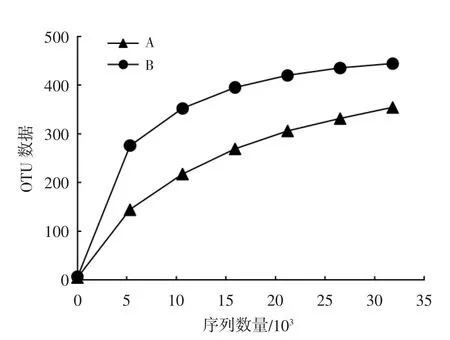
图1 样本稀释曲线
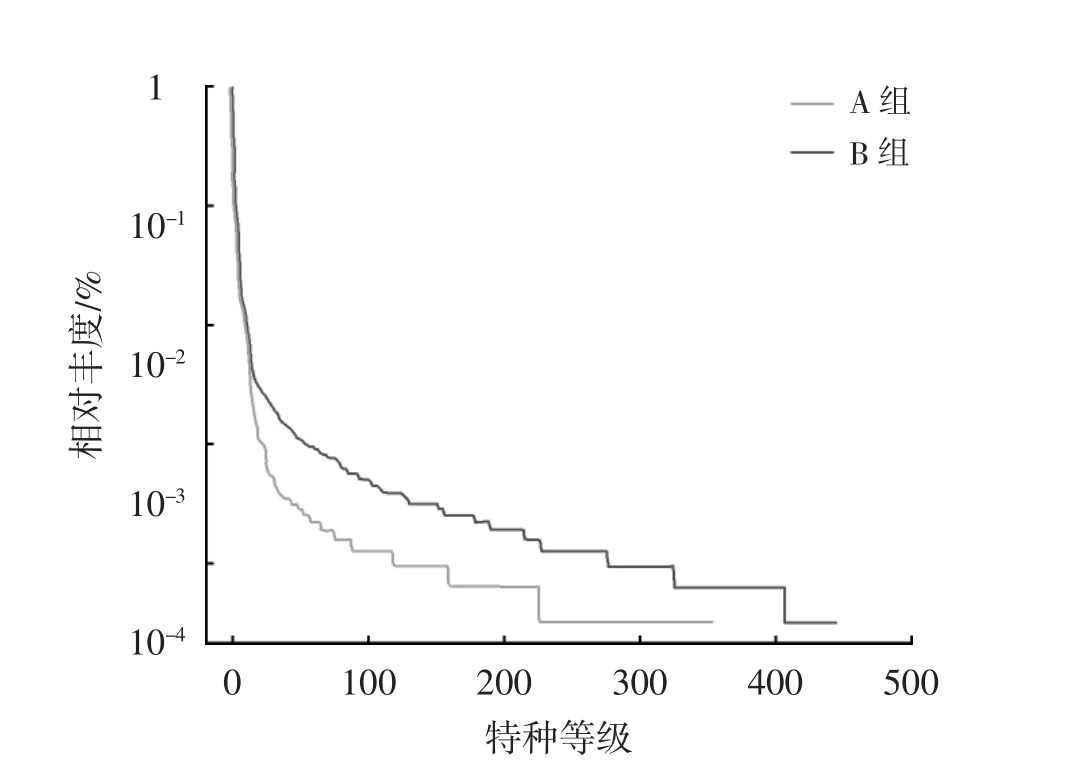
图2 等级聚类曲线
2.3 中华圆田螺样本菌群alpha 多样性
Alpha 多样性指数统计见表4。由表4 可见,2组之间的物种丰富度和均匀度差异较小,其中OTU覆盖率分别为99.6%和99.9%。说明样品中有未被测出的序列的概率较低,测序数量已饱和,能够真正反映中华圆田螺的肠道微生物菌群结构及组成多样性。A 组的chao1 指数最高为471.662,表明A 组的物种丰富度最大,B 组的Shannon 指数比A 组高。由此可见,A、B 2组的肠道群落物种多样性存在差异。
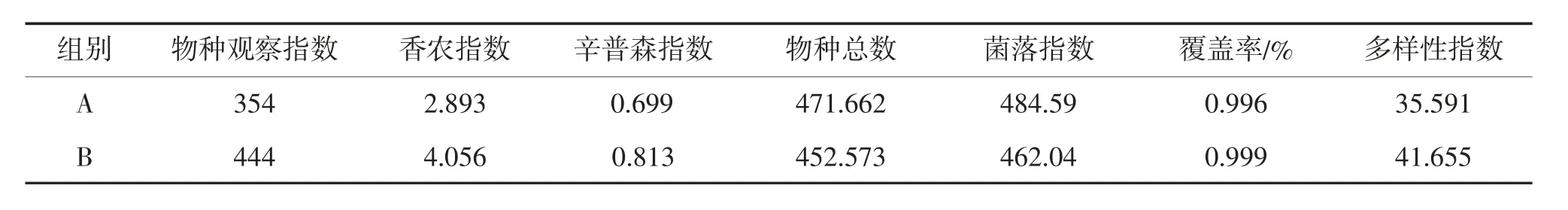
表4 Alpha 多样性指数统计
2.4 中华圆田螺样本菌群OTU 分析
在门和属的分类水平上分别对2种养殖模式下中华圆田螺肠道菌群组成进行鉴定,结果表明不同养殖模式下中华圆田螺肠道中的优势菌种类相同,但同种优势菌的数量分布存在较大差异。基于A 组和B 组样品中全部OTU 做Venn 图(图3),比较2组间的差异。A、B2组共有OTU 数目为289,A组特有的OTU 数量155,B 组特有的OTU 数量为65,A、B2组OTU 数目差异显著(P<0.05)。
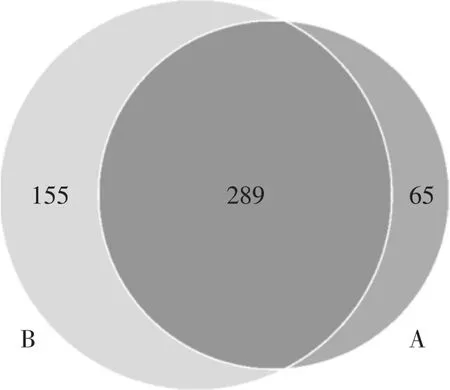
图3 各试验组OTU 数目韦恩图
2.5 中华圆田螺样本菌群物种丰度
选取A、B 2组门(Phylum)水平排名前10 物种,生成物种丰度柱状图(图4)。在A、B2组不同养殖环境下,中华圆田螺中共检测到22 类门水平菌群,选取物种丰度排名前10 的菌门,共菌门有9 门,衣原体菌门(Chlamydiae)为B 组特有门类。拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)在A、B 2组菌群中相对丰度最高,分别占53.32%、32.48%和43.12%、25.12%。但肠道内容物与肠壁样品中厚壁菌门(Firmicutes)的相对丰度则有较大的差异。其中厚壁菌门(Firmicutes)在A 组中的占比(3.01%)远小于B 组(18.57%)。将2组样本肠道共有菌群属在(Genus)水平进行物种相对丰度排名,前30 的菌属设为“主要共有菌属”(图5)。其中A 组中拟杆菌类(Bacteroides)(52.63%)、气单胞菌(Aeromonas)(22.97%)的菌属相对丰度值显著高于B 组,为优势菌种。变形菌属(Proteocatella)(10.8%)显著低于B 组。其他所占比例较少。

图4 门(Phylum)水平上物种相对丰度堆积柱状图

图5 2 个试验组肠道主要共有菌属相对丰度
3 讨论
采用了高通量测序技术,选取了不同环境下的2组各10 只中华圆田螺作为样本,提取其肠道内容物中微生物DNA,并进行肠道微生物的多样性分析。通过对稀释曲线的测定可见,稀释曲线已达到饱和,说明样品测序量足够且合理,能够反映其肠道微生物多样性及结构组成。2组样本共得到131 240 条序列,共涉及25 门215 属,其中共有菌属169种,特有菌属各23种。基于97%的样本相似度,样本优化聚类为609 个OTU。本试验的A 组和B 组Chao1、ACE 指数标准差较大,表明2组物种丰富度在不同环境下会造成差异;Shannon 和Simpson多样性指数的标准差较小,表明2组样品的微生物菌落的均匀度基本一致。微生物菌落多样性,对于维持生态具有重要作用,环境多样性的高低,可表示微生物菌落性能的高低,即多样性低菌落稳定性差,患病风险增大。孙笑非等[9]研究表明,动物肠道菌群的多样性与肠道菌群稳定性成正比;黄雪敏等[10]研究发现,当养殖水体中有更高的Alpha多样性时,水体环境的稳定性更高,水产动物健康生长,反之则发病;杜世聪等[11]研究发现,Shannon指数下降,可作为对虾健康出现分化的标志。
本试验在不同养殖环境下,中华圆田螺肠道主要菌群(3%以上)为:拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、软壁菌门(Tenericutes)4 类,其中Bacteroidetes 菌门含量最高,A 组含量为53%,B 组含量为43%:其次为Proteobacteria,A 组含量为32%,B 组含量为25%。研究其他水生动物的肠道优势菌群后,发现在不同养殖环境下,中华绒蟹(Eriocheir sinensis)肠道细菌,大多数种系型属于变形菌门或拟杆菌门[12];分析凡纳滨对虾的养殖环境及肠道微生物群落特征后,发现其所有样本中优势门类为变形菌门、拟杆菌门和放线菌门,其中变形菌门占绝对优势[13];而在研究健康与患病的凡纳滨对虾肠道主要菌群差异后,发现其肠道主要菌群为变形菌门(51.2%)和放线菌门(27.2%),并无显著差异[14];罗氏沼虾(Macrobrachium rosenbergii)[15]与日本沼虾[16]肠道中,变形菌门和厚壁菌门为主要优势菌群。本试验中华圆田螺肠道优势菌群为拟杆菌门、变形菌门、厚壁菌门,与其他水生动物的肠道优势菌群基本一致。
文献[17-19]研究表明,在动物的肠道中,α-变形杆菌(Alpha proteobacteria)或者γ-变形菌(Gamma proteobacteria)占优势地位,而变形菌门、纲细菌不占主要地位。本试验中,拟杆菌门在中华圆田螺肠道中含量最高,拟杆菌门同时也是人体肠道细菌的主要组成部分,拟杆菌门能与DNA、脂肪及蛋白质等有机物质进行密切的转换,有机物的吸收和利用,是水环境中碳循环的重要组成部分。厚壁菌门和拟杆菌门在水产动物肠道的相对比例与宿主的食性和代谢成正比[20-21],本试验中,A 组中相关菌群丰富度远大于B 组,推测稻田环境下的中华圆田螺肠道菌群,比池塘环境中的更有优势。
本试验共检测出215 个菌属,这其中A、B2组中华圆田螺肠道共有菌属169种,特有菌属各23种,特有菌属其含量均低于0.01%。丰富度前10 中共检测出,拟杆菌属(Bacteroides)、气单胞杆菌属(Aeromonas)、蛋白乳杆菌属(Proteocatella)、乳酸菌属(Cetobacterium)、支原体属(Mycoplasma)、未鉴定的梭状芽孢杆菌属(unidentified_Clostridiales)、葡萄皮杆菌属(Epulopiscium)、柠檬酸杆菌属(Citrobacter)、乙酰拟杆菌属(Acetobacteroides)、不动杆菌属(Acinetobacter)。其中共检测到3种益生菌属:芽孢杆菌属(Bacillus Cohn)、蛭弧菌属(Bdellovibrio)、拟杆菌属(Bacteroides);检测出4种致病菌属:气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、黄杆菌属(Xanthomonas),与孙振丽等[22]对南美白对虾养殖环境及其肠道细菌多样性研究中分离的益生菌一致。文献[23]研究表明,稻田相较于池塘,其多项水质指标得到改善,种类组成更为健全。在本试验中,A 组中益生菌拟属杆菌属(Bacteroides)丰富度显著高于B 组,分别为59.63%与39.97%,致病菌属气单胞菌属(Aeromonas)占比相近,由此推测在稻田环境下的中华圆田螺肠道健康状况优于池塘环境。
研究发现[24],微生物在水产养殖中扮演着重要的角色,其可以通过分解有机物、维持水体稳定性、防止病害发生、促进营养循环、改善水质等多种方式调节养殖水体环境,对水产养殖系统的健康至关重要。水生动物肠道微生物菌群的结构、功能,对水产动物的营养代谢、肠道发育以及免疫系统有密切的关系,是维持机体肠道内环境稳定的重要因素[25]。食物的消化,是通过水生动物消化系统和菌群生物产生的酶共同完成[26]。但是,在不同养殖环境下,水产动物的肠道菌群也有各自特点。本试验通过对不同养殖环境下中华圆田螺肠道菌群的研究,有助于了解中华圆田螺消化生理特性、营养需求,对于维持中华圆田螺的健康养殖、饲料开发、饲料添加剂的研发具有重要意义。同时,一些经肠道疾病,往往与肠道细菌密不可分,研究肠道菌群,有助于了解疾病的发生和病变过程,能将肠道内益生菌与其他有益菌,制成复合菌剂投喂水生动物,可以增强抗病力、免疫力,对生产动物生长繁殖有利[27]。
中华圆田螺肠道微生物菌群特征,与其养殖环境、饵料、自身发育息息相关,密不可分,体现在养殖水域中微生物含量、温度、盐度、饵料发育阶段,这些因素对于中华圆田螺肠道菌群结构均有影响。本试验发现,相对于池塘养殖的中华圆田螺,稻田养殖的中华圆田螺,具有天然饵料丰富、食物丰富的优点,这种养殖模式,造就了稻田养殖型中华圆田螺肠道中更高的细菌多样性、更健康的菌群组成、更高的细菌总数以及更高的物种丰度。
4 结论
根据中华圆田螺肠道16s rRNA 测序结果显示,稻田养殖中华圆田螺肠道菌群比池塘养殖中华圆田螺肠道菌群具有更高的个体差异性、更丰富的物种多样性、更高的菌群丰度。中华圆田螺肠道中的优势细菌为测序文库中高比例Proteobacteria 和Bacteroidetes。
