大分割电离辐射对鼻咽癌细胞共培养后的树突状细胞成熟状态的影响*
2023-10-18龙金华曾宪琳金仙槐
龙金华, 曾宪琳, 金仙槐
(1.贵州医科大学附属肿瘤医院 头颈肿瘤科, 贵州 贵阳 550004; 2.贵州医科大学 生物与工程学院, 贵州 贵阳 550004)
放疗是一种破坏肿瘤细胞DNA、抑制肿瘤细胞增殖的治疗方法,是鼻咽癌(nasopharyngeal carcinoma,NPC)主要的临床治疗手段[1]。研究发现,放疗剂量与肿瘤的治疗效果密切相关[2],大分割放疗可打破机体对肿瘤的免疫耐受,启动特异性抗肿瘤免疫应答[3],但其具体机制不清。树突状细胞(dendritic cells, DCs)作为一种特殊的抗原提呈细胞,具有强大的抗原摄取和提呈能力,发挥着连接先天和适应性免疫应答的作用[4]。DCs获取肿瘤抗原后,从未成熟树突状细胞(immature dendritic cells, imDCs)向成熟树突状细胞(mature dendritic cells, mDCs)分化,并逐渐上调白细胞分化抗原80(cluster of differentiation 80, CD80)、CD83、CD86、人白细胞抗原DR(human leukocyte antigen DR, HLA-DR)以及CC基序趋化因子受体7(C-C motif chemokine receptor 7, CCR7)等分子表达[5]。有研究发现,DCs亚群和浸润数量与NPC患者的生存呈显著相关[6-7],提示DCs介导的抗肿瘤免疫应答在NPC治疗中可能发挥着重要作用[8-10]。目前,NPC放疗分割模式仍采用常规剂量(1.8~2.0 Gy)[11-12],大分割放射(>2.0 Gy)对NPC诱导的免疫应答类型尚不清楚。因此,本文研究经大分割(4 Gy和18 Gy)电离辐射照射的NPC细胞对imDCs的免疫表型分子、迁移能力以及环磷酸鸟苷-腺苷合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase, cGAS)和干扰素基因刺激蛋白(stimulator of interferon genes,STING)表达的影响,以期找到放疗过程中DCs介导抗肿瘤免疫应答的启动机制。
1 材料与方法
1.1 细胞来源、主要试剂与仪器
人5-8F NPC细胞株购于富衡生物,RPMI-1640培养基和胰蛋白酶均购于Gibco,重组人粒-巨噬细胞集落刺激因子(rhGM-CSF)和重组人白介素4(rhIL-4)细胞因子均购于PeproTech,胎牛血清购于Gemini Bio,HLA-DR、CD11c、CD80、CD83、CD86以及CCR7的特异性流式抗体均购于Biolegend,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、cGAS及STING的特异性抗体均购于Abcam,直线加速器购于医科达,核磁共振扫描仪购于西门子,流式细胞仪购于BD。
1.2 研究方法
1.2.1研究对象 选取2021年1月—2023年1月收治的134例NPC患者为NPC组,纳入标准:(1)病理学确诊的 NPC 患者,按 第 8 版美国癌症联合会/国际抗癌联盟(American Joint Committee on Cancer/ Union for International Cancer Control, AJCC/UICC)肿瘤淋巴结转移(tumor node metastasis, TNM) 分期标准分期(Ⅰ—Ⅵb);(2)治疗前签署放疗知情同意书,无放疗禁忌症;(3)既往无头颈部放射治疗史;(4)预计生存期 6 个月以上,卡诺夫斯基的功能状态(Karnofsky performance scale, KPS)评分≥70分;(5)患者对接受治疗和随访有良好的依从性。排除标准:有严重感染或出血倾向者、合并严重且未控制的内科疾病、出现主要器官功能衰竭。健康对照组为153名健康志愿者,均排除鼻咽部相关疾病,无心肺等脏器疾病。本研究经医院伦理委员会批准(批注号2020162),所有志愿者及患者签署知情同意书。
1.2.2鼻咽部核磁共振检查和流式外周血DCs数量分群 所有患者均按照ICRU 62号规范勾画靶区,制定三维适形调强放疗治疗计划,射线能量为 6 Mv X线,靶区的剂量为PGTVnx 72.6 Gy/33 f。放疗结束后1周,对患者行鼻咽部核磁共振检查。外周血流式细胞检测外周血DCs数量分群[髓系DCs(CD11c+myeloid DCs,MDCs)和浆系DCs(CD123+plasmacytoid DCs,PDCs)]。
1.2.3细胞培养和放射处理 5-8F人NPC细胞:用含10%FBS的RPMI-1640培养基培养于37 ℃、5%CO2的细胞培养箱中,待细胞密度生长至80%~90%,进行传代培养或使用辐照仪进行放射处理,放疗剂量为4 Gy和18 Gy。imDCs的分离培养:密度梯度离心法从健康人外周血中分离单核细胞,用含10% FBS、150 μg/L rhGM-CSF和100 μg/L rhIL-4的RPMI-1640培养基培养5 d,将其诱导分化为imDCs。
1.2.4NPC细胞与imDCs共培养 5-8F NPC细胞照射后继续常规培养48 h,收集其培养上清,制成条件培养基。收集imDCs,用含20% FBS的RPMI-1640培养基调节细胞密度为2×106个/mL,每孔加入细胞悬液1 mL和条件培养基1 mL (imDCs+4 Gy、imDCs+18 Gy)设为imDCs+4 Gy组和imDCs+18 Gy组,阴性对照(imDCs组)为细胞悬液1 mL和PBS 1 mL ,阳性对照(mDCs组)为细胞悬液1 mL和1mL含100 ng/mL脂多糖的完全培养基,放入37 ℃培养箱中继续培养48 h。
1.2.5流式检测DCs免疫表型分子的表达 收集共培养后的DCs,加入4%多聚甲醛固定10 min,用PBS洗涤2次,弃上清。加入相应抗体混匀后,室温避光孵育20 min。孵育结束后,用流式细胞仪检测DCs表面分子HLA-DR、CD11c、CD80、CD83、CD86及CCR7的表达情况。
1.2.6DCs迁移能力的检测 收集共培养后的DCs,调整细胞密度为1×106个/mL。取24孔板,在Transwell下室加入完全培养基0.6 mL,上室加入0.2 mL细胞悬液,放入37 ℃, 5%CO2的培养箱中继续培养24 h。迁移结束后,对迁移至下室的细胞进行计数并计算迁移率。
1.2.7蛋白印迹试验(Western blot)检测cGAS及STING蛋白表达 收集共培养后的DCs,提取细胞总蛋白,BCA法测定蛋白浓度后,取50 μg总蛋白进行SDS-PAGE电泳,转膜和封闭。TBST洗涤3次,加入GAPDH、cGAS及STING的特异性抗体,4 ℃孵育过夜,TBST洗涤3次后加入HRP标记的山羊抗兔IgG二抗,室温孵育1 h,TBST洗涤3次,用ECL试剂盒检测蛋白条带。
1.3 统计学分析
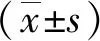
2 结果
2.1 放疗对NPC患者DCs亚群的影响
核磁共振影像显示(图1),放射治疗前,NPC组患者肿瘤沿鼻咽壁凸向鼻咽腔,侵及周围肌肉组织及骨质结构,核磁共振增强扫描显示有明显强化、信号不均。放射治疗后,鼻咽黏膜稍增厚,肿瘤明显退缩,增强后周围组织强化减弱。外周血流式细胞检测结果发现(表1、表2),与健康对照组相比,NPC患者外周血中MDCs和PDCs显著减少(t=-4.041,t=-5.674;P<0.001);放射治疗后,NPC患者外周血中MDCs的数量明显减少(P<0.001),但PDCs的数量略有增加,但差异无统计学意义(P>0.05)。

表1 两组被检者血液中不同DCs亚群比例

表2 治疗前与放疗结束后NPC患者外周血中DCs亚群的数量变化

图1 放疗前后NPC患者鼻咽部肿瘤的核磁共振影像
2.2 大分割电离辐射照射后的NPC细胞促进imDCs成熟
结果发现(图2),与imDCs组比较,imDCs+4 Gy组以及imDCs+18 Gy组中imDCs的免疫表型分子HLA-DR、CD80、CD83、CD86及CCR7的表达显著上调(P<0.001),表明imDCs向mDCs分化;Transwell实验结果显示(图3),DCs迁移能力随着电离辐射剂量的增加而增强(P<0.05)。

注:A、B分别为HLA-DR、CD11c、CD80、CD83、CD86及CCR7的流式细胞仪检测结果及对应的统计结果;(1)与imDCs组比较,P<0.05;(2)与mDCs组比较,P<0.05;(3)与imDCs+4 Gy组比较,P<0.05。

注:(1)与imDCs组比较,P<0.05;(2)与imDCs+4 Gy组比较,P<0.05。
2.3 大分割电离辐射对NPC细胞与imDCs共培养后cGAS-STING信号通路的影响
Western blot的结果发现(图4),与imDCs组相比,imDCs+4 Gy组和imDCs+18 Gy组能上调共培养的imDCs中cGAS和STING蛋白的表达水平(P<0.05)。

注:A、B分别为cGAS和STING蛋白的Western blot结果及对应的统计结果;(1)与imDCs组比较,P<0.05。
3 讨论
NPC是由鼻咽粘膜内膜引起的上皮癌,具有较好的放疗敏感性。放疗后,非转移性NPC患者的5年生存率可达到67%[13]。本研究发现,放疗后NPC患者肿瘤明显缩小,提示NPC患者对放疗敏感,这与Sham等[14]的研究结果一致。现已知道,电离辐射不仅可以杀伤肿瘤细胞,还可以在一定条件下将免疫抑制的肿瘤微环境转化为免疫原性肿瘤微环境[15],促进肿瘤抗原提呈和促进炎性细胞因子的分泌,启动抗肿瘤免疫应答[11-12,16]。DCs作为一种特殊的抗原提呈细胞[4],在NPC治疗中发挥着重要作用[8-10]。有研究表明,不同的DCs亚群和DCs浸润数量与NPC患者的生存显著相关[6-7]。DCs中cGAS-STING通路的激活可促进imDCs向mDCs分化[17]。本研究发现,与健康人相比,NPC患者血浆中MDCs和PDCs的数量显著减少,说明NPC患者的免疫功能受到损害。放疗后,NPC患者外周血中MDCs的数量减少,PDCs的数量略有增多,说明NPC患者的免疫系统正逐步恢复,放疗可一定程度改善NPC患者的免疫抑制性肿瘤微环境。
有研究发现,电离辐射不仅能激活DCs中NF-κB信号通路,还能增强DCs的迁移以及对白细胞介素-12(IL-12)的分泌[3, 18],且大分割电离辐射照射后的DCs上调CD40、CD80、CD86及CCR7等免疫表型分子的表达[19]。本研究将imDCs与经大分割电离辐射照射的NPC细胞共培养,结果发现imDCs的免疫表型分子HLA-DR、CD80、CD83、CD86以及CCR7的表达显著上调,且其迁移能力随着电离辐射分割的增加而增强,表明imDCs向mDCs分化,可能有利于肿瘤抗原的提呈和特异性抗肿瘤免疫应答的启动。
cGAS是细胞主要的DNA感受器,能够识别病原体的双链DNA后上调STING信号通路,诱导Ⅰ型干扰素的表达,启动抗原特异性的T细胞应答[1, 5]。本研究发现,与imDCs组相比,与经18 Gy电离辐射照射后的NPC细胞共培养后,imDCs的cGAS和STING表达水平显著上调,意味着cGAS-STING信号通路的启动可能与大分割电离辐射破坏了更多的NPC细胞DNA结构有关。
综上所述,大分割电离辐射放疗除了能够直接杀死NPC细胞外,还可通过cGAS-STING信号通路诱导imDCs向mDCs分化,进而启动特异性的抗肿瘤免疫应答,这对深入理解NPC的临床治疗模式具有重要意义。
