重金属污染物的微生物修复策略
2023-10-08王永刚朵建文冷非凡陈吉祥孙尚琛
王 瑾,王永刚,朵建文,冷非凡,陈吉祥,孙尚琛*
(1.兰州资源环境职业技术大学,甘肃兰州 730030;2.兰州理工大学,甘肃兰州 730050)
目前,由于快速发展的工业活动、矿山开采、高价态金属废弃物倾倒、化肥的过度使用等,重金属在环境中的迁移加剧、迁移速度大大加快,越来越多的含金属残留物被排放到地表进入土壤系统和地下水,并通过食物链富集在人体中,进而对人体和生态系统造成严重危害[1-2]。当重金属在土壤中的积累量超过土壤的自净能力后会改变陆地生态系统中栖息动植物的种类、分布及数量,影响植物根系微生物的群落结构和酶活性,阻碍植物的光合作用、呼吸作用等[3]。当过量的重金属进入水生系统后,会严重阻碍水生动物DNA的合成,导致胚胎畸变、影响性别和身长等[2]。而水生藻类一旦积累了过量的重金属会导致其代谢和生理功能紊乱,光合作用被抑制,更有甚者导致藻类死亡,改变天然环境中藻类的数量和分布[3]。另外,进入人体的重金属借助体内某些有机成分可结合成金属络合物或螯合物富集在人体内,当积累量超过人体新陈代谢最大限值后,会严重损害人体的呼吸系统、消化系统、生殖系统等,甚至造成人体癌变和死亡[3-5]。
基于过量重金属对生态系统的诸多危害,重金属已被公认为是对自然动植物群造成严重危害的最持久和最复杂的污染因子。目前,对于重金属污染环境的防治与治理,已发展起来的方法有包括离子交换法、吸附法和膜分离法在内的物理法,沉淀法、氧化还原法等在内的化学法和依赖于微生物的生物法。因微生物具有可培养性强、环境友好、操作简单等特点,微生物修复策略被认为是在重金属污染物治理方面最有前景的方式之一。一方面,微生物对某些特定的金属具有强选择性,且因其体积小的特点可以为重金属的高效结合提供大的比表面积[5]。另一方面,微生物吸附是一个独立和可逆的过程,存活的和死亡的微生物都可以用作金属吸收的生物吸附剂[6]。此外,微生物还可以通过离子交换、氧化还原、电化学处理、化学沉淀等方式对重金属进行固定和解毒[1]。所有这些改变重金属迁移性和毒性的转变都具有巨大的生物地球化学意义并具有生物修复潜力。另外,在重金属胁迫下,微生物的聚集和生物膜的形成使微生物能够维持更长的时间,进一步表明微生物修复机制比传统方法更经济和有效。
“微生物-重金属”是一个较为复杂的生物学命题,该研究从重金属对微生物的毒性作用、微生物对重金属胁迫的响应等多方面进行综述,以期为“微生物-重金属”的相互作用提供更为全面的理解,为生物修复策略的进一步应用奠定理论基础。
1 重金属对微生物的影响
重金属通常对微生物产生双向作用,如某些低浓度的重金属在微生物蛋白质的合成、酶活性构型的维系、氧化还原等过程中发挥作用[7]。但当重金属的浓度超过微生物生长代谢所需的阈值后会对微生物产生不利影响。
从宏观角度来讲,重金属会影响微生物的群落结构和生物多样性,这主要取决于重金属和微生物的类型。张瀚丹等[8]研究发现,Cr和Ni的浓度与放线菌门(Actinobacteria)和奇古菌门(Thaumarchaeota)的丰度呈负相关,但与拟杆菌门(Bacteroidetes)的丰度呈正相关,Cd、Pb和Hg的浓度与芽单胞菌门(Gemmatimonadetes)呈正相关,但总体上重金属会导致微生物生物多样性的下降。何一凡等[9]的研究表明,在受Cr、Pb和Zn污染的土壤中,硝化菌(Nitrobacterium)、拟杆菌(Bacteroidetes)和疣微菌(Verrucomicrobia)的丰度与重金属浓度呈负相关,但绿弯菌(Chloroflexi)的生长却受显著的促进。另外,受低浓度的Cd、Cu、Zn、Pb复合污染的土壤中,细菌、真菌和放线菌的生物量均较污染前显著增加,表明低浓度的重金属会刺激微生物群落结构的增加。但随着重金属浓度的增加,其对微生物群落结构的影响由刺激变为毒害作用,相应微生物的群落结构相应降低。
从微观角度来讲,高浓度的重金属离子会破坏微生物细胞壁的完整性、干扰DNA和RNA的合成、诱导部分酶的构型发生变化、阻碍辅因子与生物分子的结合,甚至导致细胞死亡(图1)[10]。Ranquet等[11]研究发现,随着大肠杆菌(E.coli)细胞内的Co2+浓度增加,tRNA甲基硫转移酶、乌头酸酶和铁还原酶3种Fe-S酶的活性逐渐降低。另外,Co2+还会干扰微生物细胞的氧化还原及酶的水解过程、抑制细胞分裂。Das等[12]研究发现,在低浓度(<130 μmol/L)的Au4+环境中,米根菌(Rhizopusoryzae) 会通过合成金属还原硫蛋白对Au4+进行解毒,以维持细胞的正常生长,但当Au4+的浓度超过130 μmol/L后,米根菌的生长受到明显抑制。另有研究表明,高浓度的Cr6+会通过静电结合的方式与大肠杆菌和枯草芽孢杆菌(Bacillussubtilis)DNA中的磷酸基团结合,阻碍转录和复制过程,导致细菌发生诱变[13]。
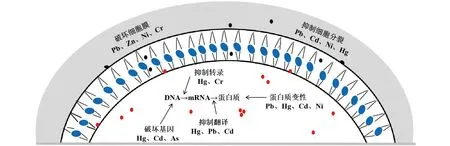
图1 重金属对微生物的影响示意Fig.1 Schematic diagram of the effect of heavy metals on microorganisms
2 微生物对重金属胁迫的响应
尽管重金属胁迫会显著降低微生物的多样性和丰度,及对微生物的生长代谢造成一定毒害,但在长期的重金属环境中,微生物会形成一定的抗性机制来响应重金属的胁迫,以维持自身正常的生长代谢。如微生物细胞可利用细胞壁表面的负电荷官能团对重金属离子进行螯合,以避免过量的重金属进入细胞质[14]。其次,在重金属的刺激下,微生物的谷胱还原蛋白和硫氧还原蛋白基因被激活,进而可实现对重金属离子的氧化还原。另外,微生物细胞还可利用一些存在于细胞膜上的转运蛋白实现对重金属离子的吸附、转运及外排等。总体来说,微生物对重金属胁迫的响应机制可分为细胞外屏障、细胞外螯合、细胞内络合、细胞内外排、金属离子还原5类。
2.1 细胞外屏障通常,重金属离子必须先穿透细胞壁才可进入细胞膜,但因细胞壁独特的生理结构,尤其是革兰氏阳性菌细胞壁肽聚糖层厚而致密,且镶嵌有磷壁酸的特点,细胞壁在抵御外界刺激过程中发挥分子筛的功能,其可阻止分子量大于600 Da的化合物进入细胞质[15]。另外,一些革兰氏阳性菌如括红球菌(Rhodococcus)、分枝杆菌(Mycobacterium)、诺卡氏菌(Nocardia)、棒状杆菌(Corynebacterium)、戈登氏菌(Gordonia)等由于其细胞壁中富含霉菌酸,使得微生物细胞表面疏水性和渗透性极差,进而阻止了重金属离子的渗透[16]。而革兰氏阴性菌由于存在于其细胞外膜的磷脂和脂多糖不断地旋转和侧移,且脂多糖的酰基链比磷脂链更硬,排列更紧密,致使其对疏水性化合物的渗透性更低,从而使得革兰氏阴性菌在细胞外对重金属有较强抗性[17]。
细胞质膜的通透性在阻止重金属离子进入细胞质的过程中亦发挥重要作用。当微生物细胞受重金属胁迫后,细胞膜的脂肪酸组成、链长和磷脂组成会发生相应的变化以调整细胞膜的通透性,进而保证了细胞膜的活力[16-17]。在研究不同浓度的Cu2+、Pb2+、Zn2+和Cr6+对嗜根寡养单胞菌(Stenotrophomonasrhizophila)活性和细胞膜通透性的影响时发现,0~120 mg/L的金属离子对细菌的生长均无影响,在Cu2+、Pb2+和Zn2+环境中的细菌的细胞膜通透性随着金属离子浓度的增加而增加,但当Cr6+浓度超过80 mg/L后,细胞膜通透性逐渐降低[15]。另外,细胞膜上大量脂肪酸链的存在也会阻碍重金属离子进入细胞质[17]。细胞荚膜作为一些细菌表面的特殊结构,在微生物细胞响应重金属的刺激中同样发挥重要作用,其可作为一种扩散屏障抵抗重金属进入细胞质。
2.2 细胞外螯合利用微生物在生长代谢过程中分泌的螯合蛋白将重金属在细胞外进行螯合是降低重金属毒性,维持细胞正常生长的方式之一。目前,已证明可胞外螯合重金属的蛋白有铁载体、草酸盐、磷酸盐和硫化物等,而细菌只产生细胞外铁载体,是一种含有异羟肟酸盐、儿茶酚酸盐、羧酸盐的多肽[18]。研究发现,铜绿假单胞菌(P.aeruginosa)分泌2种铁载体,其中绿脓杆菌螯铁蛋白pyochelin可以螯合Cd2+、Co2+、Cu2+、Pb2+、Ga3+、Hg2+、Zn2+、Mn2+、Ni2+、Sn2+、Tb3+等金属离子[19],另一种铁载体荧光嗜铁素pyoverdines可螯合U6+、Np5+等金属离子[20]。另外,铁载体还可以促进部分植物对重金属离子的吸收,Dimkpa等[21]的研究证明,唐德链霉菌(Streptomycestendae)F4分泌的铁载体去铁胺desferrioxamineB、coelichelin和desferrioxamine E可使向日葵对Cd2+的吸收能力显著增加,来源于铜绿假单胞菌(P.aeruginosa)的荧光嗜铁素pyoverdine和绿脓杆菌螯铁蛋白pyochelin能显著促进玉米对Cr6+和Pb2+的吸收[22]。
另外,通过一些硫酸盐还原菌在胞外与重金属形成硫化物沉淀是实现细胞外螯合的另一种途径。如有研究证明,硫还原泥土杆菌(Geobactermetallireducens)可将Mn4+还原为Mn2+,将U6+还原为U4+,进而使两种金属离子的毒性减弱[23]。金属还原地杆菌(Geobactersulfreducens)可将强度性的Cr6+还原为弱毒性的Cr3+[24]。
2.3 细胞内络合微生物细胞经外界刺激后,可在胞内分泌大量的金属硫蛋白(MTs)、金属伴侣蛋白和谷胱甘肽(GSH)等活性大分子物质,这类物质因其结构特点对重金属有极强的结合能力(图2)[4]。其中MTs是一类富含Cys的金属结合蛋白,其高级结构由含4个金属离子结合位点的羧基端和含3个金属离子结合位点的氨基端组成,能高效结合不同类型的金属离子[24]。研究发现,Cd和Zn可诱导聚球藻(Synechococcus)smtA和smtB基因编码的MT的合成,其中smtA基因编码的MT中的半胱氨酸残基几乎可以结合所有类型的金属离子,而smtB基因编码的MT含有4个Zn2+结合位点,负责对Zn2+的特异性结合[25]。Su等[26]通过将人MT基因hMT-1A克隆至大肠杆菌JM109中后发现,与原始菌株相比,表达hMT-1A基因的大肠杆菌突变株对As3+的吸附效率提高了3倍。Zhao等[27]将豌豆的金属硫蛋白表达基因表达至大肠杆菌JM109中后发现,重组大肠杆菌对Hg2+的吸附效率提高了6.4倍。

图2 微生物对重金属的胞内络合机理示意Fig.2 Schematic diagram of intracellular complexation mechanism of heavy metals by microorganisms
谷胱甘肽(GSH)是由Glu、Cys和Gly组成的含有γ-酰胺键和巯基的三肽,在微生物抵抗外界刺激中同样发挥重要作用。其中Cly上的羧基和Cys上的巯基是谷胱甘肽能稳定的结合金属离子的主要原因[13]。任吉民等[28]研究发现,在水溶液中,GSH通过其Gly两端的羧基与Dy3+、Ho3+、Yb3+等稀土离子可形成稳定的遥爪配位结构,进而减弱金属离子的毒性,该结论亦被Podanyi等[29]证实。另外,刘建华等[30]的研究发现,Cr2+和Cr3+可与GSH中的S原子结合形成9种稳定的配位化合物,而Wang等[31]利用EDS研究Cd2+胁迫对路德维希肠杆菌(E.ludwigii)LY6的影响时发现,菌株表面形成的颗粒物为CdS沉淀,进一步表明GSH在微生物吸附重金属中具有重要作用。
2.4 细胞内外排许多微生物可通过主动运输或外排系统将存在于细胞质中的金属离子排出至细胞外,以避免重金属对微生物造成毒害。目前,对于重金属的外排公认的是CDF、RND和ATPase三大外排系统,其家族成员可特异性或非特异性地将重金属离子通过跨膜转运运输至细胞外(图3)[4]。其中CDF家族成员广泛存在于细菌、古生菌和真核生物,蛋白结构主要由300~550个氨基酸组成,包括6个跨膜结构域、1个C-端结构域和1个富含组氨酸的结构域[30]。研究发现,嗜根寡养单胞菌JC1基因组中含有2个CDF家族的成员,其中czcD/zitB被预测可能参与Co2+、Cd2+、Zn2+的转运和外排[15],而其在Ralstoniametallidurans中的同源物已被证明参与Ni2+和Cu2+的转运[32]。嗜根寡养单胞菌中的另一个CDF家族成员是一个膜蛋白,该蛋白在Achromobacterxylosoxidans中被证明参与Pb2+的转运[33]。另外,Von Rozycki等[34]的研究表明,CupriavidusmetalliduransCH34基因组中存在3个CDF家族的成员,主要参与Fe2+、Co2+、Ni2+、Zn2+和 Cd2+的转运。RND家族的蛋白质是位于细胞质膜上的三聚体蛋白,它们与1个三聚体外膜因子OMF和周质蛋白MFP形成蛋白复合物。依据可转运蛋白的类型和作用机理,Nies将负责重金属转运的RND家族成员分为Zn2+/Co2+/Cd2+转运蛋白 (HME1)、Ni2+/Co2+转运蛋白(HME2)、Zn2+(HME3a)转运蛋白、Co2+(HME3b)转运蛋白和 Cu+/Ag+(HME4)转运蛋白5类,但研究发现嗜根寡养单胞菌基因组中的RND成员中不含特异性负责Ni2+/Co2+转运的蛋白质,预测到1个参与Mg2+/Co2+转运的蛋白质[15],这可能与微生物的进化与遗传背景有关。P-ATPase是一种重要的转运蛋白家族,可携带多种重金属的底物,从结构上考虑P-ATPase具有多个严格保守的Cys序列的残基用于识别和螯合亲水性重金属离子。研究发现,海氏肠球菌(Enterococcushirae)使用称为CopA和CopB的CPx型 ATP 酶转运Cu+和Ag+,恶臭假单胞菌(Pseudomonasputida)S4通过ATP水解从细胞质中输出Cu2+,随后在细胞周质中螯合Cu2+。
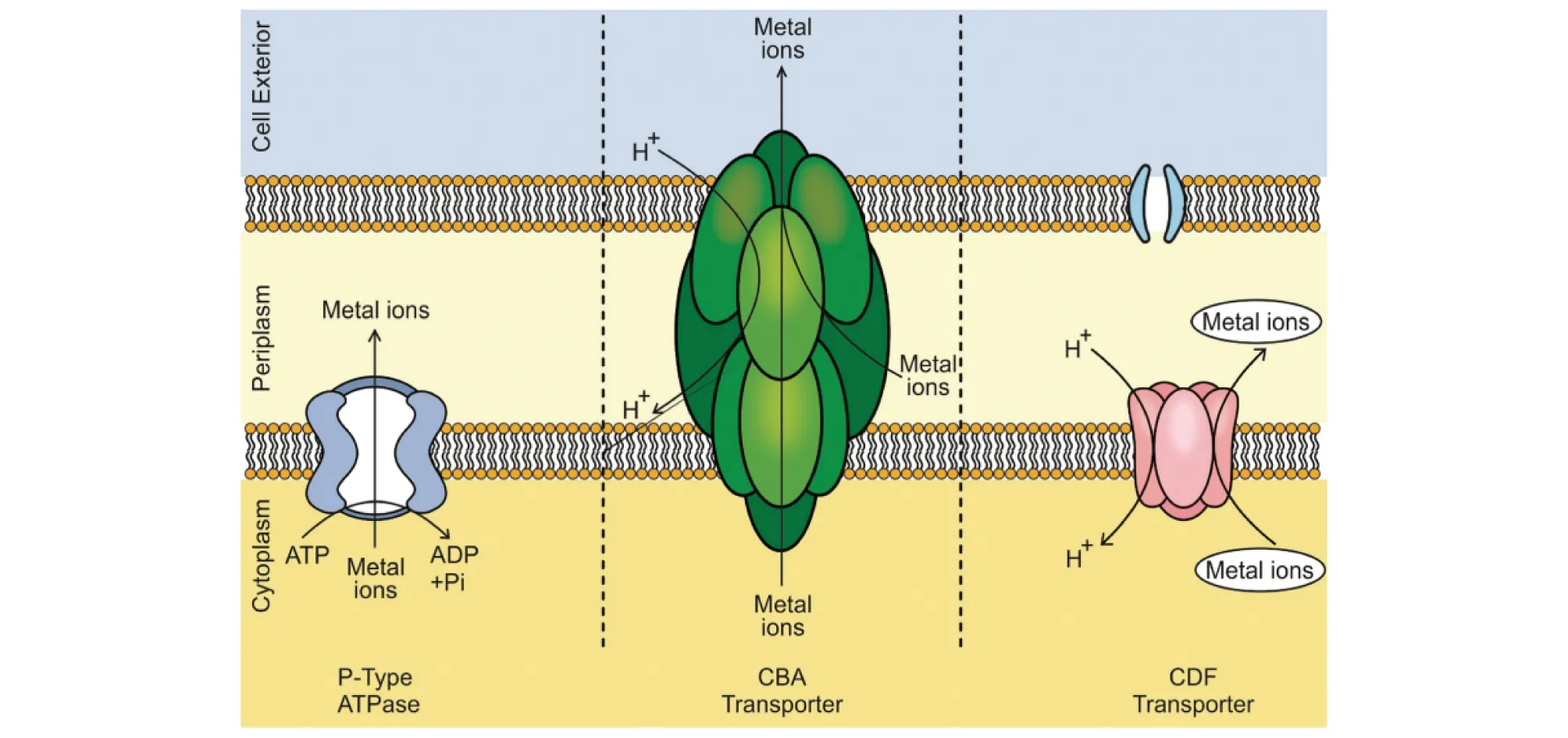
图3 三大外排系统的作用示意Fig.3 Function diagram of the three efflux systems
除上述3种外排系统外,CHR蛋白、NreB和CnrT系统在解毒Cr6+、Ni2+和Co2+方面也发挥重要作用。CHR介导铬酸盐流出并由化学渗透梯度驱动,而CnrT和NreB样蛋白则由质子动力和CDF蛋白驱动[35]。
2.5 金属离子的生物还原通过生物还原的方法,降低高价态重金属离子的化合价,使其呈弱毒性或无毒性,并降低其在自然界中的迁移速率是微生物解毒重金属的另一途径。研究表明大多数细菌如地杆菌(Geobacter)、脱硫单胞菌(Desulfuromonas)、微弧菌(Vibrio)等均可利用金属元素作为终端电子受体。如Thamdrup[35]的研究发现,Geobactermetallireducens可利用Fe(III)、Cr(VI) 和 Mn(IV)作为终端电子受体来保存能量和维持正常生长。Prabhakaran 等[24]的研究表明,砷酸还原菌能将土壤中的As5+还原为As3+,进而使植物根系中的As5+含量减少11.5%左右。此外,细胞色素、氢、乙醇、乳酸盐等亦可作为电子供体参与微生物对重金属的还原。研究表明,细胞色素a参与硫酸盐还原菌对Cr6+的还原,细胞色素c和细胞色素b分别参与阴沟肠杆菌和大肠杆菌对Fe3+和Mn4+的还原。白杆菌属利用氢、乙醇、乳酸盐、甲酸盐等作为电子供体对Fe3+和Mn4+进行还原。
3 展望
微生物具有可培养性强、环境友好、操作简单等优势,微生物修复技术目前被认为是重金属污染场地的修复中最有潜力的方式。现阶段,已较清晰地掌握了微生物解毒重金属的生理机制,这将为微生物修复技术的广泛应用奠定理论基础。但目前报道的大多数微生物对重金属高效的解毒能力均基于实验室理想的条件下,而一旦应用于工程化,受外界诸多不确定因素的影响,其解毒效率将大幅降低。为此,后期需着力挖掘可广泛应用于工程化的微生物资源。另外,工程菌的构建是实现微生物修复技术高效、可持续应用的有效途径,为此在后期的工作中需通过基因组、转录组和代谢组结合的方式,挖掘相关微生物基因组中参与重金属解毒的基因资源,为工程菌的构建提供基因资源。
