仔貉腹泻性奇异变形杆菌分离鉴定、致病性及耐药性检测
2023-10-07石建存张召兴高桂生史秋梅
石建存,刘 冬,张召兴,高桂生,史秋梅
(1. 石家庄市栾城区职业技术教育中心,河北 石家庄 051430;2. 沧州职业技术学院农牧工程系,河北 沧州 061001;3. 河北旅游职业学院畜牧兽医系,河北 承德 067000;4. 河北科技师范学院/河北省预防兽医学重点实验室,河北 秦皇岛 066604)
变形杆菌(Proteus)属于肠杆菌科变形杆菌属的革兰氏阴性杆菌,该菌不形成荚膜、芽孢,临床中变形杆菌主要包括奇异变形杆菌(P.mirabilis)、豪氏变形杆菌(P.hauseri)、产黏变形杆菌(P.viscosus)、普通变形杆菌(P.vulgaris)和潘氏变形杆菌(Proteuspan)5种,其中P.mirabilis对人和动物致病性最强[1-2]。奇异变形杆菌是临床中常见的人和动物感染的重要条件致病菌之一, 该菌主要存在于哺乳动物和人的消化道与黏膜内,可以引起人和动物的腹泻、肺炎、尿道炎及流产等一系列疾病,严重者可以导致死亡[3-6]。近几年,国内关于奇异变形杆菌引起人和多种动物感染的报道越来越多,该菌可以引起鸡、猪、牛、羊、水貂、狐狸、华南虎等多种动物腹泻、肺炎、尿道炎及流产等多种疾病[7-8]。在人医临床中,变形杆菌感染仅次于大肠杆菌,成为第二位肠道杆菌病原菌,该菌可以在人与动物之间传播[9-10]。因此,对奇异变形杆菌综合防控具有重要的公共卫生意义。
奇异变形杆菌编码的基因组中主要包括溶血素、菌毛、鞭毛、外膜蛋白及铁获得物等多种毒力基因,这些毒力基因在该菌致病过程中起着重要作用,其菌株的致病性与其存在的毒力因子密切相关[11-12]。由于临床中抗生素的不合理使用,导致奇异变形杆菌耐药菌株不断增多,其耐药性增强,给该病的治疗带来一定困难,同时该菌通过多种途径获得耐药基因,且不同种属细菌之间可以转移与传播,严重威胁着人类健康[13]。目前,国内关于貉感染P.mirabilis报道较少。本研究采集患腹泻病仔貉的肛拭子、粪便以及死亡仔貉肝脏、肺脏等病料组织283份进行奇异变形杆菌的分离鉴定,并进行致病性、毒力基因、耐药性及耐药基因检测等生物特性研究,为该地区仔貉腹泻性奇异变形杆菌病的综合防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 2017年-2020年采集秦皇岛、唐山、石家庄、沧州地区患腹泻病仔貉的肛拭子、粪便以及死亡的仔貉肝脏等病料组织283份。
1.1.2 主要试验材料 BHI培养基、SS培养基、木糖赖氨酸脱氧胆酸钠培养基(XLD)、营养肉汤,购自北京双旋微生物培养基制备科技公司;药物纸片购自杭州天和微生物制剂有限公司;32E肠杆科菌生化鉴定试纸条,购自法国生物梅里埃公司;DL 2000Marker购于中科瑞泰生物科技有限公司;2×Taq Marker Mix购于宝生物工程(大连)有限公司;
1.1.3 试验动物 22~25 g左右健康昆明系小鼠550只购自北京维通利华实验动物技术有限公司,饲养于河北省预防兽医学重点实验室。
1.2 方法
1.2.1 细菌分离鉴定 对采集肛拭子、粪便以及死亡的仔貉肝脏、肺脏等病料组织进行处理后,无菌的条件下接种于XLD和SS培养基进行鉴别培养, 37 ℃恒温培养18~24 h,挑取单个菌落接种于营养肉汤纯化培养后进行革兰氏染色镜检。
1.2.2 细菌生化试验 按照32E肠杆科菌生化鉴定试纸条说明书,将分离菌株调整菌液浓度为0.5个麦氏浊度,接种于32E肠杆科菌生化鉴定试纸条,37 ℃恒温培养18~24 h后,进行生化鉴定。
1.2.3 细菌的PCR检测 根据细菌16S rRNA 基因序列,设计细菌通用的16S rRNA鉴定引物,27F:5'-AGAGTTTGATCCTGGCTCAG-3',1429R:5'-TACGGCTACCTTGTTACGACTT-3',目的片段约为1 500 bp,由生工生物工程(上海)股份有限公司合成。利用水煮法提取分离菌基因组DNA,进行PCR鉴定,将鉴定阳性的PCR产物送生工生物工程(上海)股份有限公司测序,分离菌株的测序结果与GenBank中登录的奇异变形杆菌参考株进行同源性比对,参照同源性>97%进行鉴定。
1.2.4 人工感染致病性试验 参照张香斋等[14]报道的方法,将分离菌株培养至对数期,用平板计数法进行菌落计数,每1株分离菌株腹腔注射5只昆明系小鼠(0.25 mL/只 (108cfu/mL)),对照组给予等量的无菌PBS,试验期为7 d,试验期间观察其发病情况,对发病的昆明系小鼠进行细菌分离鉴定。
1.2.5 细菌毒力基因的检测 参照葛强等[11]、 曹艳丽等[15]报道的P.mirabilis的毒力基因,设计P.mirabilis8种毒力基因(ureC、zapA、mrpA、ucaA、rsbA、pmfA、atfA、ireA、ptA)引物序列,用1.2.3提取的分离菌株模板,对分离菌株进行毒力基因 PCR 检测。
1.2.6 药敏试验 分离菌株参照K-B药物纸片进行操作,根据美国临床实验室标准化协会(CLSI)推荐(2020年)的标准进行试验结果判断。
1.2.7 耐药基因的检测 参照曹艳丽等[15]、杨睿等[16]报道的P.mirabilis的耐药基因,β-内醜胺类耐药基因3种(tem、cmy、shv),磺胺类耐药基因2种(Sul1、Sul2),氨基糖苷类耐药基因2种(aadA、aac(6')-Ib-cr),喹诺酮类耐药基因3种(gyrA、gyrB、qurS),四环素类2种(TetA、TetM),酰胺醇类耐药基因 1种(floR),多肽类1种(mcr-1),14个耐药基因引物由生工生物工程(上海)股份有限公司合成,以1.2.3中制备分离菌株的DNA模板,进行耐药基因PCR检测,并分析耐药表型与耐药基因之间的相关性。
2 结果与分析
2.1 细菌分离培养结果
疑似P.mirabilis分离菌株在XLD培养基上长出圆形的、边缘光滑的、凸起的中心带有黑心的淡黄色菌落(图1A);在XLD培养基上长出圆形的、光滑的且中间呈黑色的圆形菌落(图1B),在BHI培养基中培养24~48 h可以观察迁移性生长现象(图1C);革兰氏染色镜检可见分离菌株无荚膜、无芽孢,两端呈钝圆杆状,形态呈明显的多形性,为阴性菌(图D)。

图1 分离菌株在不同培养基上的菌落形态及染色形态学A:在XLD 培养基菌落形态; B: SS培养基菌落形态;C:BHI培养基迁移性生长;D: 2革兰染色镜检结果(1000×)Fig. 1 Colony morphology and staining morphology of isolated strains on different mediaA: Colony morphology in XLD medium;B: Colony morphology of SS medium;C: Migration growth in BHI medium;D: Microscopic examination results of Gram staining (1000×)
2.2 细菌的生化特性鉴定结果
分离菌株纯化培养后,32E肠杆科菌生化鉴定试纸条经 ATB全自动细菌鉴定系统分析,结果显示分离的109株与奇异变形杆菌生化特性符合率在97%~99%之间,分离的109株初步判定为P.mirabilis。
2.3 细菌的PCR检测结果
对初步鉴定的109株PM分离株,用16S rRNA 通用引物进行 PCR鉴定。结果显示,分离菌株的目的条带约为 1 500 bp,与预期结果相符(图2)。分离菌株测序后与 NCBI 中报道的PM 的16S rRNA 序列同源性均在97.9%~99.9%之间,根据判定标准,109株分离株均为PM。
图2 分离菌株的PCR检测结果 Fig. 2 PCR detection results of isolated strains
2.4 致病性检测结果
攻毒的小鼠在攻毒后的2~6 d出现精神沉郁、采食量减少、嗜睡及腹泻等临床症状,且个别的小鼠出现急性死亡。剖检死亡的小鼠可见肺脏、肝脏、脾脏及肾脏出现出血、淤血肿大,肠道充血严重,肠粘膜脱落且肠道内有黏液性内容物,剖检死亡的小鼠分离得到P.mirabilis;直到试验结束,对照组的小鼠健康存活。通过统计,78株P.mirabilis对小鼠具有不同致病性,至少引起2只小鼠死亡,其死亡率在40%~100%之间。
2.5 细菌毒力基因的检测结果
采用PCR方法检测78株致病性P.mirabilis的 10种毒力基因,结果显示,78株致病性PM携带10种不同的毒力基因,其中毒力基因ureC、zapA、mrpA、ucaA、rsbA、pmfA、atfA的检出率在79.5%~100%,其它毒力基因ireA、ptA、hpmA的检出率在43.6%~47.4%(表1)。说明该地区分离的78株致病性PM携带多种基因。

表1 78株致病性PM毒力基因检测结果Table 1 Detection results of virulence genes of 78 pathogenic PM strains
2.6 耐药性分析
分离的78株致病性P.mirabilis耐药性严重,对阿莫西林、氨苄西林、新霉素、庆大霉素、链霉素、大观霉素、多西环素、土霉素、磺胺间甲氧嘧啶9种药物耐药性较严重,耐药率在41.0%~98.7%之间,其它药物的耐药率在5.1%~30.8%(表2);分离的78株致病性P.mirabilis呈现多重耐药性,耐 16种药物有 1 株、耐 15种药物3株、耐 14、8种药物各有5 株,耐13、7种药物各6株,耐9种药物有7株、耐8种药物有5株、耐6种药物有4株,耐5种药物有2株,耐药10、11、12种药物的分离菌株最多,分别占致病菌株的19.2%、16.7%和14.1 %(表3)。

表2 株致病性PM的药敏试验检测结果Table 2 Drug sensitivity test results of pathogenic PM strains
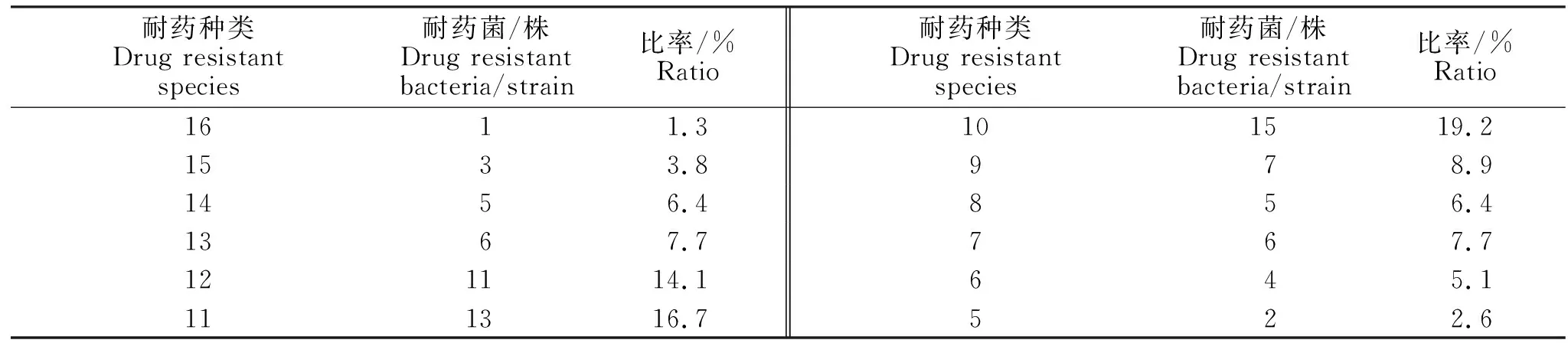
表3 78株致病性PM的多重耐药性检测结果Table 3 Multiple drug resistance test results of 78 pathogenic PM strains
2.7 细菌耐药基因的检测结果
将分离的78株致病性P.mirabilis进行7类药物的14个耐药基因PCR。结果显示,耐药基因Sul1、Sul2、adA、aac(6') -Ib、TetA、TetM检出率在48.7%~79.50%;耐药基因tem、cmy、gyrA、gyrB、floR、mcr-1检出率在2.6%~16.7%。耐药基因tem、qurS未检出(表4)。说明分离的78株致病性P.mirabilis携带多种耐药基因。通过分析分离的78株致病性P.mirabilis耐药表型与耐药基因型之间的相关性,结果显示β-内酰胺类、喹诺酮类、四环素类、磺胺类、氨基糖苷类5类药物的耐药表型与耐药基因型符合率在50%~100%,多粘菌素类的耐药表型与耐药基因型符合率为10.5%(表5)。表明分离的78株致病性P.mirabilis耐药表型与耐药基因型之间具有相关性。

表4 78株致病性PM的耐药基因检测结果Table 4 Detection results of drug resistance genes of 78 pathogenic PM strains

表5 分离菌株耐药表型与耐药基因相关性分析结果Table 5 Correlation analysis between drug resistance phenotype and drug resistance gene of isolated strains
3 讨 论
奇异变形杆菌(P.mirabilis)为广泛存在于自然界中的一种人畜共患的条件致病菌,在宿主体内定植并持续繁殖,导致多种动物患病,可以引起消化道、呼吸道及泌尿生殖道等一系列急性传染病,其发病率和死亡率较高,给养殖业造成巨大经济损失[17]。 近几年,国内关于奇异变形杆菌感染禽类、哺乳动物及野生动物等的报道逐渐增多,其中水貂、狐狸等特种经济动物感染奇异变形杆菌也有报道,同时该菌引起人食物中毒的报道也日趋增多[18]。因此,对奇异变形杆菌防控具有公共卫生安全意义。本研究从患腹泻病仔貉的肛拭子、粪便以及死亡的仔貉肝脏病料组织中分离得到109株P.mirabilis,其中78株对小鼠具有不同致病性,死亡率在40%~100%之间,说明该菌是引起仔貉腹泻的主要病原菌,且发病都是仔貉,可能与仔貉抵抗力低、易受病害侵袭有关。2016年本课题组首次从貉的肺炎中分离得到奇异变形杆菌,该菌可能对貉在养殖方面存在潜在的威胁,应该采取有效措施进行防控。
P.mirabilis基因组中编码外膜蛋白、菌毛、鞭毛、铁获得物、溶血素、尿素酶及溶血素等多种毒力基因,该菌的菌毛黏附宿主,破坏其细胞表面保护性蛋白,入侵至细胞内部,同时释放毒素导致宿主发病,毒力基因可调控相关因子表达,增强其黏附性,促进感染的扩散,引起相应的病理变化,该菌致病性与其携带的毒力基因相关[12,15,19]。本研究表明,分离的78株致病性P.mirabilis携带10种毒力基因,ureC、zapA、mrpA、ucaA、rsbA、pmfA、atfA7种毒力基因检出率在79.5%以上,其它毒力基因检出率在43.6%~47.4%之间,说明毒力基因在致病性菌株中流行,与其对宿主的致病性具有一定相关性。葛强等[11]报道的猪源奇异变形杆菌携带多种毒力基因。孙世浩[12]报道分离的牛源奇异变形杆菌菌株也携带多种毒力基因。本研究与以上报道一致,该菌的毒力基因的作用尚未明确,有待进一步研究。
临床中分离的奇异变形杆菌对β-内酰胺类、氨基糖苷类、氟喹诺酮类、四环素类等多种药物产生耐药性,从不同宿主分离的菌株其耐药性也存在一定的差异性,其主要原因可能与动物来源、生存的环境及抗生素使用情况有关[11-13]。本研究表明,分离的78株致病性P.mirabilis对常用的抗生素产生很强的耐药性,且呈现多重耐药性。与曹艳丽等[15]报道的从山东地区毛皮动物体内分离的奇异变形杆菌对常用抗生素产生很强的耐药性一致。因此,在临床中应该选择敏感的抗生素合理使用,减少耐药性产生,提高治疗效果,同时注意环境的消毒。相关研究表明,不同宿主源的P.mirabilis获得耐药基因且能够在不同菌株传递耐药基因,主要通过整合子等移动的基因元件在细菌耐药性扩散过程起着重要的作用,该菌的耐药菌株可通过动物途径传递给人,同时威胁人类的健康[15-16,20]。本试验表明,分离的78株致病性P.mirabilis携带12种不同的耐药基因,其中四环素类、磺胺类、氨基糖苷类耐药基因检出率较高,其它类药物耐药基因检出率较低,且β-内酰胺类、喹诺酮类、四环素类、磺胺类、氨基糖苷类5类药物的耐药表型与耐药基因型符合率在50%~100%之间,说明分离菌株对β-内酰胺类、喹诺酮类、四环素类、磺胺类、氨基糖苷类5类药物的耐药产生可能与携带的耐药基因有关,其中多粘菌素类药物的耐药表型与耐药基因的符合率较低,可能还存在其它的耐药机制。致病性P.mirabilis的耐药性产生机理是否与携带耐药基因有关,有待进一步研究。本研究对该地区仔貉腹泻性奇异变形杆菌病防控提供了参考依据。
4 结 论
2017年-2020年采集秦皇岛、唐山、石家庄、沧州地区患腹泻病仔貉的肛拭子、粪便以及死亡的仔貉肝脏病料组织283份,分离得到78株致病性的P.mirabilis,且这些致病性P.mirabilis携带多种毒力基因,可以对临床中常用药物产生不同的耐药性,其耐药性与耐药基因相关。
