气氢/气氧催化着火机理研究
2023-08-21王秀珍王双峰
王秀珍,朱 凤,王双峰, 3
气氢/气氧催化着火机理研究
王秀珍1, 2,朱 凤1,王双峰1, 2, 3
(1.中国科学院力学研究所,中国科学院微重力重点实验室,北京 100190;2.中国科学院大学工程科学学院,北京 100049;3.中国科学院力学研究所高温气体动力学国家重点实验室,北京 100190)
通过实验和数值模拟对气氢/气氧在蜂窝结构陶瓷载铂催化剂中的催化着火特性开展研究,分析了反应动力学和分子扩散对催化着火特性的影响.结果表明,气流速度和混合物组分共同决定催化反应的控制机理,气流速度或当量比较大时,催化着火由反应动力学控制;气流速度和当量比较小时,催化着火由分子扩散控制;气流速度和当量比适中时,存在一个过渡区,过渡区内催化着火由分子扩散和反应动力学共同控制,反应体系既可以达到较高温度又不会发生回火.敏感性分析表明,催化反应中关键的基元反应为氢和氧的吸附反应以及氢的脱附反应,气相反应中关键的基元反应为含有自由基O、H和OH的链式反应以及HO2的生成反应.
气氢/气氧;蜂窝型催化剂;机理分析;控制分区;敏感性分析
随着水分解制氢技术的发展[1],空间长期储氢问题得到了有效解决.与肼类推进剂相比,气氢/气氧推进剂具有无毒、比冲高、产物清洁等优点,可替代肼类推进剂应用于小推力系统中[2-5].空间卫星上的小推力器应具备可多次重复启动、灵敏度高和质量轻等特点[4,6],采用催化点火方式可有效减轻点火装置的重量[5].气氢/气氧能够在常温下发生催化反应,因此气氢/气氧催化燃烧是成为小推力器点火源和稳燃源的优选方式.
氢气/空气催化燃烧的数值模拟研究,主要涉及燃烧器结构、入口速度、温度、当量比以及催化剂几何参数等因素对催化燃烧特性的影响.Appel等[7]研究发现当量比为0.28~0.32、入口速度大于1.6m/s时,氢气/空气可在铂催化剂作用下发生气相着火.Pan等[8]对当量比为0.4~1.4、入口速度为0.5~2.5m/s的H2/O2进行催化燃烧数值模拟,研究结果表明反应区随入口速度的增加向下游移动,当量比为1时,催化反应强度最高,此时催化反应对气相反应的抑制性最强.Yedala等[9]对3D螺旋式微燃烧室内当量比为0.3和0.65、入口速度为0.2~10m/s的氢气/空气进行催化燃烧数值模拟,研究发现当量比和入口速度较低时,主要发生催化反应,此时气相反应的作用可以忽略.Mento等[10]研究了H2添加量对甲烷/氧气催化燃烧特性的影响,结果表明H2添加量越高,发生催化反应所需要的初始温度越低.考虑到气氢/气氧催化点火的优点,美国、日本和欧洲等国家尝试将H2/O2催化点火应用于推力器中,并取得了一定成果[2-3,10-13].美国最先设计了气氢/气氧催化点火的1N推力器,并在30480m高空中成功进行了点火实验[2].日本和德国先后设计了气氢/气氧催化点火的1N推力器[3,11],但所选用工况没有在常温下实现催化点火.林震等[4]进行了气氢/气氧催化点火实验,结果发现采用铂丝作为催化剂时无法在常温下催化点火成功,采用钯炭作为催化剂时虽然能够在常温下催化点火成功,但是催化剂本身也参与了燃烧.
总的来看,关于当量比和入口速度对催化燃烧特性影响的研究工作中,选取的当量比和入口速度范围较窄,无法全面认识气氢/气氧催化燃烧特性.如果当量比或者入口速度较小,则在催化反应过程中可能出现回火,给实际应用带来严重的安全隐患.而如果当量比或者入口速度很大,催化反应放出的热量很少,则难以成功点火.因此选取合适的当量比和入口速度对气氢/气氧能否成功进行安全的催化点火至关重要,对推力器的设计具有直接的指导作用.
本文探究反应动力学和分子扩散等因素对气氢/气氧催化着火特性的影响,研究参数为气氢/气氧当量比和催化区进口的流动速度,揭示气氢/气氧催化燃烧控制机理.利用CHEMKIN PRO软件进行数值模拟,全面掌握当量比和入口速度对催化燃烧特性的影响.采用敏感性分析,得到影响催化着火的关键基元反应.根据数值模拟结果,得到当量比和入口速度对催化着火的综合影响.同时,开展催化燃烧实验,一方面为数值模拟提供所需要的参数,另一方面对不同控制机理区域的典型工况进行研究,与数值模拟结果进行对比,验证数值模拟结果的可靠性.该研究可为气氢/气氧催化点火的小推力器的设计提供指导.
1 研究方法
1.1 计算模型及反应机理
蜂窝型陶瓷载铂催化剂在工业上的应用十分广泛,本文利用CHEMKIN PRO软件中的蜂窝结构反应器(honeycomb monolith reactor)模拟气氢和气氧在铂(Pt)催化剂表面的催化燃烧过程,该反应器的几何结构如图1所示.蜂窝结构反应器是一种特殊的一维柱塞流反应器(1-D plug-flow reactor),根据蜂窝结构反应器相关参数(表1),可转换得到等效的一维柱塞流反应器中的单位长度催化剂活性内表面积、单位长度催化剂外部传热面积、横截面积等参数[14],表1中孔密度表示横截面上每平方英寸的孔道数.结合边界条件(表2)求解一维连续性方程、能量方程、动量方程以及组分方程,可得到各基元反应对温度的敏感性系数、气流温度、各组分摩尔分数等沿催化剂轴向距离的变化.
数值模拟中用到的催化活性密度结合实验确定,并考虑详细的气相反应和催化反应机理.Appel等[7]对4种氢气/空气气相反应机理和3种氢气/空气催化反应机理进行数值模拟,结果表明Warnatz等[15]建立的气相反应机理与实验数据吻合效果最好.因此本文选用Warnatz等[15]提出的氢气和氧气的气相反应动力学机理,该机理包括8种组分和19个基元反应.采用Deutschmann等[16]给出的氢气和氧气在铂催化剂表面的催化反应机理,该反应机理包括5种表面组分、6种气相组分和13个基元反应.热力学文件和组分输运文件均来自于CHEMKIN PRO数据库. 数值模拟中分别对催化剂长度为3cm和10cm两种情况进行研究,其中3cm与实验中催化剂长度相一致,而10cm的结果用于分析催化剂长度的影响.

图1 蜂窝结构反应器结构示意
表1 蜂窝结构反应器相关参数

Tab.1 Related parameters of honeycomb structure reactor
表2 模型计算边界条件

Tab.2 Boundary conditions for the monolith reactor
1.2 实验系统
选用与数值模拟中蜂窝结构反应器参数基本一致的催化剂在催化燃烧实验平台上进行实验.该实验平台包括气体供给与控制子系统和催化反应室.气体供给与控制子系统为催化反应室提供H2(99.99%)、O2(99.99%)和N2.正式进行催化燃烧实验前用N2对催化反应室进行吹扫以保证燃烧室内无残留的空气,实验后再次用N2进行吹扫,排除剩余的H2和O2,以保证实验的安全.催化反应室内径为2cm,长度为8.5cm,由混合室(长2.5cm)和催化室(长6cm)组成,如图2所示.气体混合室中填充玻璃珠和不锈钢丝以保证气体充分混合.在正式实验之前,选取不同催化剂长度进行了预实验,发现催化剂长度太短,催化反应速率慢,温升小.催化剂长度太长,在所研究工况下催化反应主要发生在催化剂上游.因此催化剂长度太短或者太长都无法保证催化室出口处气流温度达到相对较高的值,这与本文研究目标不符,最终确定催化剂长度为3cm.在距催化室下游边缘1cm处放置直径为2cm、长为3cm的蜂窝型陶瓷载铂催化剂.在距催化剂下游边缘0cm、2cm、3cm和4cm处的催化室中心轴线上放置4个K型热电偶用于测量气流温度.利用数据记录仪(HIOKO LR8431-30)采集热电偶数据,采集频率为50Hz.实验与数值模拟配合,选用的当量比范围为0.15~15,入口速度范围为0.37~2.5m/s.共计100组实验,每组实验重复进行3次.

图2 催化反应室剖面示意
催化剂的催化活性密度在进行催化反应时是一个非常重要的参数,催化剂的催化活性密度大小受很多因素的影响,比如负载材料和加工工艺.为了得到实验中催化剂的催化活性密度,参考文献[18]中催化剂活性密度的确定方法.通过实验测量了催化剂中心轴线上3个测点处的温度随时间的变化,并取稳定时的温度与不同催化剂活性密度下气流温度的数值模拟结果进行对比,如图3所示.从图中可以看出当催化剂活性密度等于6×10-8mol/cm2时,数值模拟结果与实验测量结果较为吻合.因此本文计算过程中催化剂活性密度值均选用6×10-8mol/cm2.

图3 不同催化剂活性密度下气流温度的数值模拟结果与实验测量结果对比(Φ=8.5,Vin=2.5m/s)
2 结果与讨论
2.1 当量比的影响
图4为不同当量比下的气流温度沿催化剂轴向距离的变化.进行当量比(0.395≤≤14.0)对催化着火特性影响的数值模拟研究时,固定入口速度为2.75m/s.通常认为温度发生突跃时即发生了气相着火[10],本文将温度发生突跃的位置定义为气相着火距离,发生突跃的温度定义为气相着火温度.由图可以看出,0.395≤≤4.0时,会发生气相着火,且随当量比的增加,气相着火温度也逐渐增加,而最大气流温度先增加后减小.>4.0时,不会发生气相着火.文中以=0.5和=9.0两个典型工况为例进行分析.

图4 催化剂轴向气流温度的变化
图5给出了不同当量比时反应物H2和O2、产物H2O、中间产物Pt(s)和H(s)的摩尔分数以及OH(s)位点分数沿催化剂轴向距离的变化.相关研究表明,微尺度燃烧中催化剂上游主要发生催化反应,而气相反应一般在催化剂下游发生,且气相反应的发生需要较高温度[19-21].因此如果上游催化反应释放的热量能够满足气相反应动力学机理中的初始激发反应的发生条件,则会发生气相着火现象,且催化反应由受化学反应动力学控制向受分子扩散控制转变[22].气相反应主要靠OH来维持,而催化反应主要靠OH(s)来维持[8],因此OH和OH(s)的摩尔分数随催化剂长度的变化情况可以分别用来判别气相着火的发生[7]和催化反应的强弱.从图5(a)中可以看出在气相着火距离之前,OH的摩尔分数基本为0,对应OH(s)位点分数数量级为10×10-5.对比图5(a)和(b)可知,=0.5时,在3cm长催化剂内催化反应较为充分,释放的热量足以引起气相反应的发生,该工况下既有催化反应又有气相反应;=9.0时,在3cm长催化剂内催化反应释放的热量不足以引起气相反应,因此该工况下仅有催化反应.
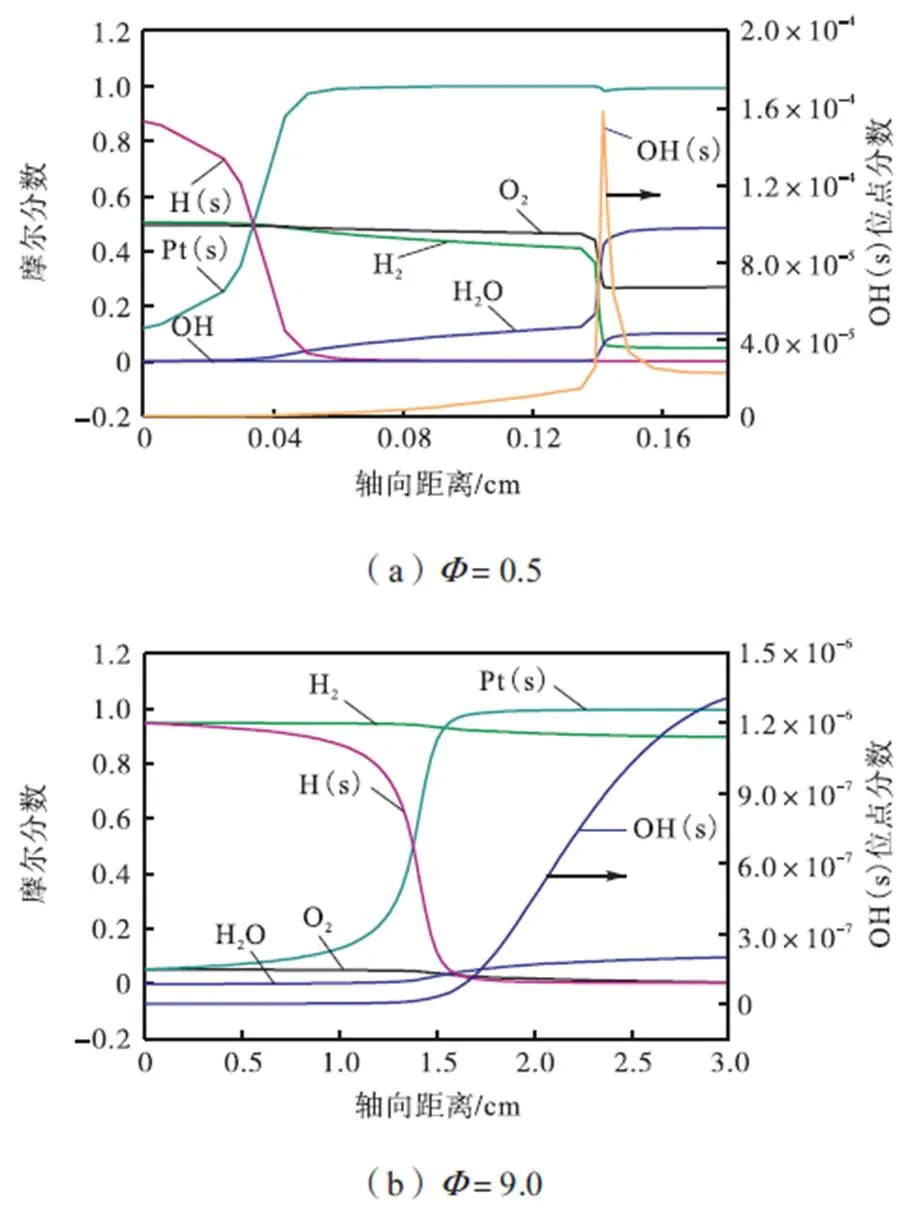
图5 不同当量比下主要组分摩尔分数和位点分数沿催化剂轴向的变化
CHEMKIN PRO中可以进行敏感性分析,通过敏感性分析可得各个基元反应对数值模拟结果的影响程度.本文对为0.5、9.0时各催化反应和气相反应对温度的敏感性系数进行分析,以了解当量比如何影响化学反应的发生.若基元反应的温度敏感性系数为正值,则说明提高该基元反应速率会使得反应体系的温度升高,反之,则说明提高该基元反应速率会使得反应体系的温度降低.基元反应的温度敏感性系数越大说明提高该基元反应速率对温度升高或降低的影响程度越大.选取为0.5、9.0时催化反应机理中温度敏感性系数较大的基元反应,并在图6中绘制所选基元反应对温度的敏感性系数沿催化剂轴向距离的变化.从图6(a)可以看出,=0.5时,温度的敏感性系数较大的基元反应是氢的吸附反应(R1:H2+Pt(s)→2H(s))、氧的吸附反应(R2:O2+Pt(s)→2O(s))和氢的脱附反应(R7:2H(s)→H2+Pt(s)),其绝对值的最大值分别约为14、30和4.从图6(b)可以看出,=9.0时,基元反应(R1)、(R2)和(R7)的温度敏感性系数绝对值的最大值分别约为3、3.8和2.8,当量比为9.0比0.5时基元反应(R1)、(R2)和(R7)的温度敏感性系数分别缩小了4.7倍、7.9倍和1.4倍.这说明随着当量比的增加,提高基元反应(R1)、(R2)和(R7)的反应速率,表面基元反应(R1)、(R2)和(R7)对气流温度升高或降低的作用减弱.相同入口速度下,提高当量比使得混合物中H2的含量增多,O2的含量减少,使得基元反应(R1)的反应速率变快,基元反应(R2)和(R7)的反应速率减慢,从而气流温度上升较慢.
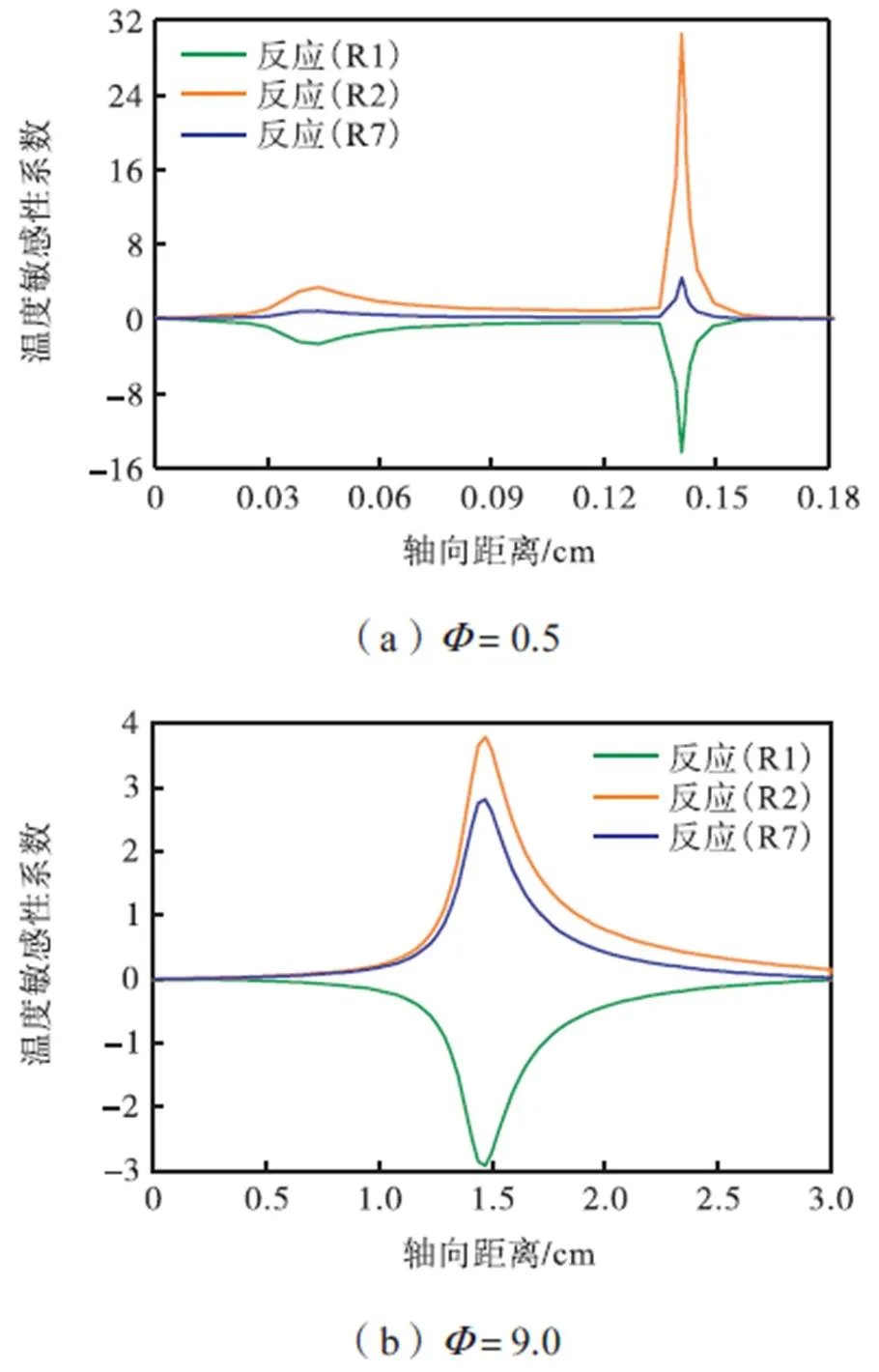
图6 不同当量比下表面基元反应(R1)、(R2)和(R7)对温度的敏感性系数沿催化剂轴向的变化
图7给出了=0.5时,温度敏感性系数较大的气相基元反应沿催化剂轴向距离的变化.结合图6(a)和图7可知,气相反应的发生使得催化反应对温度的敏感性系数变得更大,且气相反应速率很快,放热量较大,从而发生温度的突跃.从图7可知,温度敏感性系数较大的气相反应包括H2和O2的链式反应(式(1):H2+OH=H+H2O;式(2):O2+H=O+OH;式(3):H2+O=H+OH),HO2的生成反应(式(8):H+O2+M=HO2+M).由于气相反应速率明显大于催化反应速率,该当量比下一旦发生气相反应,在很短距离内便消耗了大量氢气,此时催化反应受分子扩散控制.在发生气相着火的下游气相反应强度减弱,且强迫对流热损失的存在使得温度有所降低,如图4所示温度下降段,这种现象在实验过程中表现为回火.

图7 气相基元反应式(1)、式(2)、式(3)和式(8)对温度的敏感性系数沿催化剂轴向的变化(Φ=0.5)
2.2 入口速度的影响
图8为不同入口速度时气流温度沿催化剂轴向距离的变化.进行入口速度(0.8m/s≤in≤25m/s)对催化着火特性影响的数值模拟研究时,固定当量比为8.5.随着in的增加,温度最大值位置逐渐向催化剂下游移动,温度最大值先保持基本不变后逐渐降低.in较小时,停留时间长,反应物能够充分发生催化反应,温度最大值基本相同;随着入口速度的增加,催化反应起始点向下游移动,使得催化表面活性位点没有被完全利用而无法进行充分的催化反应,因此温度最大值会下降.由于图8中没有发生温度的突跃,可知本节所研究工况仅发生催化反应,不发生气相反应.
图9(a)~(c)分别是不同入口速度时反应物H2和O2、产物H2O以及中间产物Pt(s)和H(s)的摩尔分数沿催化剂轴向距离的变化.Pt(s)摩尔分数的增加或H(s)摩尔分数的减少意味着催化反应的发生[10],从图9(a)中可以看出,Pt(s)摩尔分数在0.48cm处发生突跃,直到约3cm处开始逐渐减小.这说明0.48~3.0cm区域内发生较强烈的催化反应,可获得较高气流温度,但是仍未达到气相着火温度,此时催化反应受分子扩散和化学反应动力学共同控制.从图9(b)中可以看出5~10cm区域内发生较为强烈的催化反应.从图9(c)中可以看出,Pt(s)的摩尔分数最大值只有0.25,说明该工况下催化反应强度非常微弱,此时催化反应受化学反应动力学控制.

图8 不同入口速度下的气流温度沿催化剂轴向的变化

图9 不同入口速度下主要组分摩尔分数沿催化剂轴向的变化
相关研究表明,随着入口速度的增大,催化反应区会向下游移动[8-10,23-24].图10是不同入口速度时主要基元反应(R1)、(R2)和(R7)对温度的敏感性系数沿催化剂轴向距离的变化.in=20m/s时基元反应(R1)、(R2)和(R7)对温度的敏感性系数绝对值的最大值与in为1.0m/s和10m/s时的结果基本相等,但是达到最大值时所需的催化剂长度变长.这说明in越大时进入催化室的反应物越多,需要更长的催化剂才能保证反应物完全反应.但是in=25m/s时,表面基元反应对温度的敏感性系数沿催化剂长度方向上一直处于上升趋势,由于催化剂长度有限,催化反应不充分,温度敏感性系数并未达到峰值.结合不同入口速度下表面基元反应对温度的敏感性系数可知,气流温度上升阶段沿催化剂长度方向催化反应速率随入口速度的增加上升变慢.

2.3 当量比和入口速度综合影响
根据2.1和2.2节中对数值模拟结果的分析可知,当量比或入口速度较大时,催化反应受到反应动力学控制;当量比或入口速度较小时,催化反应主要受分子扩散控制;在当量比和入口速度适中时,存在一个狭窄的过渡区,在这个区域内,化学反应动力学和分子扩散共同控制催化着火过程.在当量比一定时,随着入口速度的增加,过渡区的范围逐渐缩小.当量比和入口速度对催化着火控制机理分区如图11所示.选择数值模拟中的典型工况,开展了催化燃烧实验,研究发现实验结果与数值模拟结果分区基本一致.

图 11 当量比和入口速度决定的气氢/气氧催化着火反应控制机理分区
图12(a)~(c)分别是图11中3个控制区内典型工况的实验测点(1~4)处的气体温度随时间的变化.从图12(a)中可以看出,3和4达到一定温度时,1和2突然升高并迅速超过3和4.可以判断催化室内发生气相着火并产生回火,该过程中催化反应受分子扩散控制[19].从图12(b)中可以看出,1和2随时间的增加基本保持不变,3和4随时间的增加上升速度较快,且趋于平稳,平稳时的温度定义为该工况下的稳定温度(w),采用稳定温度进行下面的实验结果讨论与分析.该过程中催化反应剧烈,可获得较高气流温度,但是温度并未达到气相着火温度,不会发生回火,该过程中的催化反应受分子扩散和反应动力学的共同控制.从图12(c)中可以看出,1和2随时间的增加基本保持不变,3和4随时间的增加趋于平稳,平稳时的温度很低,远小于氢气和氧气燃烧的气相着火温度,该过程中化学反应速率非常缓慢,催化反应受反应动力学控制.

图12 不同位置处气流温度随时间的变化
图13(a)和(b)分别是1~4的稳定温度随当量比和入口速度的变化曲线,从图中可以看出3和4随当量比的增大而减小,随入口速度的增大而增大.从图13(a)中可以看出,8<<11时,3均大于4,当11<<15时,实验测量结果与数值模拟结果差别较大,这与实验中所选用的催化剂活性会随着当量比的增加而减弱有关,即对应的催化剂活性密度小于数值模拟中设定的值.但是均体现了随着当量比的增大,催化反应区向下游移动.从图13(b)中可以看出,数值模拟结果与实验测量结果具有很好的一致性,这也验证了数值模拟结果的可靠性.1.5m/s<in<2.25m/s时,3>4,当2.25m/s<in<2.5m/s时,4>3,这说明随着入口速度的增大,催化反应区向下游移动.

图13 不同位置处气流稳定温度随当量比和入口速度的变化
3 结 论
(1)催化反应器中反应物的气流速度和混合物组分决定催化反应的控制机理,气流速度或者氢气浓度太大时,催化着火由反应动力学控制;气流速度或者氢气浓度太小时,催化着火由分子扩散控制;气流速度或氢气浓度适中时,存在一个过渡区,在该区域内分子扩散和反应动力学共同控制催化着火.
(2)过渡区边界处的氢气浓度随着气流速度的变化而变化,该过渡区内既可以达到较高温度又不发生回火,是应当选择的催化点火范围.
(3)均相反应和气相反应紧密耦合,影响催化反应温度升高的关键基元反应是氢和氧的吸附反应 (H2+Pt(s)→2H(s),O2+Pt(s)→2O(s))以及氢的脱附反应(2H(s)→H2+Pt(s));影响气相温度升高的关键基元反应是包含自由基H、O和OH的链式反应(H2+OH=H+H2O;O2+H=O+OH;H2+O=H+OH)以及HO2的生成反应(H+O2+M=HO2+M).
[1] Li D,Park E J,Zhu W,et al. Highly quaternized polystyrene ionomers for high performance anion exchange membrane water electrolysers[J].,2020,5(5):378-385.
[2] Jensen K,Heinitz D,Humble R,et al. Warm-gas thruster development using gaseous hydrogen and oxygen with catalytic ignition[C]//36. Reston,Virigina,2000,2000-3163.
[3] Hashimoto Y,Tanaka K,Toki K,et al. Studies of water-energy-cycle space propulsion system-experimen-tal study[C]//43. Cincinnati,Ohio,2007,2007-5438.
[4] 林 震,王长辉,刘 宇. 催化点火气氢气氧推力器试验研究[J]. 推进技术,2012,33(6):897-901.
Lin Zhen,Wang Changhui,Liu Yu. Experimental investigation on catalytic hydrogen and oxygen thruster[J].,2012,33(6):897-901(in Chinese).
[5] Harmansa N E,Herdrich G,Fasoulas S,et al. Development of a satellite propulsion system based on water electrolysis[J].,2019,18(3):185-199.
[6] 攸兴杰,沈 岩,耿金越,等. 微纳卫星水分解推进系统研究进展[J]. 载人航天,2018,24(6):838-844.
You Xingjie,Shen Yan,Geng Jinyue,et al. Research progress of water electrolysis propulsion system in micro-nano satellites[J].,2018,24(6):838-844(in Chinese).
[7] Appel C,Mantzaras J,Schaeren R,et al. An experimental and numerical investigation of turbulent catalytically stabilized channel flow combustion of hydrogen/air mixtures over platinum[J].,2002,29(1):1031-1038.
[8] Pan Jianfeng,Liu Qisheng,Lu Qingbo,et al. Combustion characteristic of premixed hydrogen/oxygen mixture in catalytic micro-combustor[J].,2016,47(2):357-363.
[9] Yedala N,Raghu A K,Kaisare N S. A 3D CFD study of homogeneous-catalytic combustion of hydrogen in a spiral microreactor[J].,2019,206:441-450.
[10] Mento C A,Sung C J,Ibarreta A F,et al. Catalytic ignition of methane/hydrogen/oxygen mixtures for microthruster applications[C]//42///. Sacramento,California,2006,2006-4871.
[11] Papale W,Roy R. A Water-based propulsion system for advanced spacecraft[C]//. Reston,Virigina,2006,2006-7240.
[12] Boyarko G A,Sung C J,Schneider S J. Catalyzed combustion of hydrogen–oxygen in platinum tubes for micro-propulsion applications[J].,2005,30(2):2481-2488.
[13] Amrousse R,Keav S,Batonneau Y,et al. Catalytic ignition of cold hydrogen/oxygen mixtures for space propulsion applications[J].,2011,10(3):217-230.
[14] CHEMKIN-PRO Release 15112.[M]. America:San Diego,2012.
[15] Warnatz J,Maas U,Dibble R W,et al.:[M]. Berlin Heidelberg:Springer-Verlag,2006.
[16] Deutschmann O,Schmidt R,Behrendt F,et al. Numerical modeling of catalytic ignition[J].(),1996,26(1):1747-1754.
[17] Kothandaraman C P.[M]. America:Adrienne Lavine,2006.
[18] Hwang C H,Lee C E,Lee K O. Numerical investigation on combustion characteristics of methane in a hybrid catalytic combustor[J].,2004,83:987-996.
[19] 伍 亨,钟北京. 空间反应和入口速度对甲烷催化反应的影响[J]. 清华大学学报,2005,45(5):670-672,676.
Wu Heng,Zhong Beijing. Influence of the gas-phase reaction and the inlet velocity on the catalytic reaction of CH4[J].,2005,45(5):670-672,676(in Chinese).
[20] Dogwiler U,Benz P,Mantzaras J. Two-dimensional modelling for catalytically stabilized combustion of a lean methane-air mixture with elementary homogeneous and heterogeneous chemical reactions[J].,1999,116(1/2):243-258.
[21] Davis M B,Pawson M D,Veser G,et al. Methane oxidation over noble metal gauzes:An LIF study[J].,2000,123(1/2):159-174.
[22] Bond T G,Noguchi B A,Chou C P,et al. Catalytic oxidation of natural gas over supported platinum:Flow reactor experiments and detailed numberical modeling[J].(),1996,26(1):1771-1778.
[23] Chen G B,Chen C P,Wu C Y,et al. Effects of catalytic walls on hydrogen/air combustion inside a micro-tube[J].:,2007,332(1):89-97.
[24] Kumaresh S,Kim M Y. Numerical investigation of catalytic combustion in a honeycomb monolith with lean methane and air premixtures over the platinum catalyst[J].,2019,138:304-313.
Catalytic Ignition Mechanism of Gaseous Hydrogen/Gaseous Oxygen
Wang Xiuzhen1, 2,Zhu Feng1,Wang Shuangfeng1, 2, 3
(1. Key Laboratory of Microgravity,Institute of Mechanics,Chinese Academy of Sciences,Beijing 100190,China;2. School of Engineering Science,University of Chinese Academy of Sciences,Beijing 100049,China;3. State Key Laboratory of High-Temperature Gas Dynamics,Institute of Mechanics,Chinese Academy of Sciences,Beijing 100190,China)
Catalytic ignition mechanism of gaseous hydrogen/gaseous oxygen in a cylindrically shaped honeycomb ceramic coated with platinum was investigated experimentally and numerically. The effects of reaction kinetics and molecular diffusion on catalytic ignition characteristics were analyzed. Results show that the control mechanism of the catalytic reaction is determined jointly by the flow velocity and the composition of the mixture. When the flow velocity or equivalent ratio is relatively large,the catalytic ignition is controlled by reaction kinetics. When the flow velocity and equivalent ratio are small,the catalytic ignition is controlled by molecular diffusion. When the flow velocity and equivalent ratio are moderate,there exists a transition zone in which the catalytic ignition is controlled by both molecular diffusion and reaction kinetics,and the reaction system can reach high temperatures without tempering. Sensitivity analysis shows that the key elementary reactions in catalytic reactions are the adsorption reactions of hydrogen and oxygen and the desorption reactions of hydrogen,and that the key elementary reactions in gaseous reactions are the chain reactions containing O,H,and OH radicals and the formation reactions of HO2.
gaseous hydrogen and gaseous oxygen;honeycomb catalyst;mechanism analysis;control partition;sensitivity analysis
10.11715/rskxjs.R202305028
O643.3
A
1006-8740(2023)04-0435-09
2022-03-15.
中国科学院空间科学战略性先导科技专项资助项目(XDA15012800).
王秀珍(1993— ),女,博士研究生,wangxiuzhen@imech.ac.cn.
王双峰,男,博士,研究员,sfwang@imech.ac.cn.
(责任编辑:隋韶颖)
