野生越南槐组织特异性内生真菌组及体外抗病原菌功能
2023-08-20姚裕群兰可黄荣韶吴炫柯
姚裕群 兰可 黄荣韶 吴炫柯
摘 要: 有益微生物組能帮助宿主植物防御病害。越南槐的根、茎和种子在野外环境下健康发芽生长,而栽培越南槐各组织极易感病。为了探明利用野生越南槐有益内生真菌组防治宿主病害的可能,该文在分离健康野生越南槐根、茎和种子内生真菌的基础上,并结合形态学和ITS序列特征鉴定内生真菌,通过系统发育树、α-多样性指数和β-多样性指数分别分析各内生真菌组的系统进化、多样性和相似性,通过琼脂块法和平板对峙法测试内生真菌组的体外抗病原菌功能。结果表明:(1)从越南槐根、茎和种子内生真菌组分别分离鉴定131株23个分类单元、108株23个分类单元、64株11个分类单元;(2)特有属多且所有种均为特有种显示根、茎和种子内生真菌组在属种进化上具有组织特异性;(3)根-茎/根-种子/茎-种子间极低的β-多样性显示根、茎和种子各内生真菌组间的物种相似性极低;(4)高的α-多样性显示越南槐根、茎和种子均有丰富多样的内生真菌组;(5)各内生真菌组三分之一以上的分类单元在体外均能拮抗供试病原菌,根茎内生真菌组显示了强广谱的体外抗病原细/真菌功能,种子内生真菌组显示了强广谱的体外抗病原真菌功能。该研究结果表明健康野生越南槐根、茎和种子内部均存在有益内生真菌组,其具有生物多样性、组织特异性以及强广谱的体外抗病原菌功能,在宿主各组织的抗病性方面可能发挥重要作用。这些结果将为进一步利用有益真菌组防治栽培越南槐各组织病害提供了材料和实验基础。
关键词: 野生越南槐, 有益内生真菌组, 生物多样性, 组织特异性, 抗病功能
中图分类号: Q939
文献标识码: A
文章编号: 1000-3142(2023)07-1182-11
收稿日期: 2022-06-16
基金项目: 国家自然科学基金(81860671); 广西自然科学基金(2018GXNSFAA281120); 2020年广西高校中青年教师科研基础能力提升项目(2020KY08012); 广西科技大学博士基金(18Z16)。
第一作者: 姚裕群(1979-),博士,副研究员,主要研究药用植物内生真菌-宿主互作机制,(E-mail)yaoyuqun2005@126.com。
通信作者: 吴炫柯,硕士,高级工程师,研究方向为应用气象,(E-mail)wuxuanke@163.com。
Tissue-specificity and pathogen-resistant function
in vitro of endophytic fungal microbiome harbored
in Sophora tonkinensis from wild type
YAO Yuqun1, LAN Ke1, HUANG Rongshao3, WU Xuanke2*
( 1. College of Medicine, Guangxi University of Science and Technology, Liuzhou 545006, Guangxi, China; 2. Liuzhou Agricultural Meteorological
Experimental Station, Liuzhou 545003, Guangxi, China; 3. Guangxi University of Chinese Medicine, Nanning 530200, China )
Abstract: The beneficial microbiome assist the plant in disease defense. The root, stem and seed of Sophora tonkinensis from wild type were germinated and grew healthily, but they in cultivated type were susceptible to insect and pathogen attack. In order to explore the possibility of disease control using beneficial endophytic fungal microbiome harbored in S. tonkinensis from healthy wild type, endophytic fungi were isolated from the root, stem and seed of S. tonkinensis from healthy wild type, and then were further identified based on morphological characters and ITS sequence characters. Phylogenetic tree, α-diversity index and β-diversity index were used to analyze the phylogenetic evolution, diversity and similarity among different endophytic fungal microbiomes. The pathogen-resistant function in vitro of endophytic fungal microbiome was determined by the agar plug method and flat-stand method. The results were as follows: (1) A total of 131 strains with 23 taxa, 108 strains with 23 taxa, and 64 strains with 11 taxa, were respectively isolated and identified from the root, stem and seed of S. tonkinensis; (2) More endemic genera and all endemic species, indicated that endophytic fungal microbiomes harbored in the root, stem and seed had tissue specificity in genus and species evolutionary tree; (3) The extremely low β-diversity between root-stem, root-seed, and stem-seed indicated that species similarity was very low among different endophytic fungal microbiomes; (4) The high α-diversity showed that endophytic fungal microbiomes harbored in the root, stem and seed were abundant biodiversity; (5) More than one third of the taxa antagonized pathogens in vitro. Endophytic fungal microbiome harbored in the root/stem showed strong broad-spectrum pathogenic bacteria/fungi-resistant function in vitro, and endophytic fungal microbiome harbored in the seed showed strong broad-spectrum pathogenic fungi-resistant function in vitro. These results indicated beneficial endophytic fungal microbiome with tissue-specificity, biodiversity structure, and strong broad-spectrum pathogen-resistant function in vitro, harbored in healthy root, stem and seed of S. tonkinensis from wild type, and might play an important role in pathogen resistance in host tissues. Such results will provide material and experimental basis for disease control in different tissues of S. tonkinensis using beneficial endophytic fungal microbiome.
Key words: Sophora tonkinensis from wild type, beneficial endophytic fungal microbiome, biodiversity, tissue specificity, pathogen-resistant function
越南槐(Sophora tonkinensis)是广西著名道地药材山豆根的基源植物。山豆根药材清热解毒、消肿利咽,常用于治疗湿热黄疸、心率失常、膀胱癌等症(国家药典委员会,2020);含有生物碱、黄酮、皂苷等多种化学成分,其中苦参碱和氧化苦参碱为其主要活性成分(Zhang et al., 2020);具有抗肿瘤、抗病毒、抗炎、抗氧化、抑菌、保肝、调节免疫、降血压等药理学作用(彭成, 2011)。随着健康大产业及乡村振兴的深入发展,越南槐在广西百色、靖西、河池等地区推广种植。课题组在越南槐的野生驯化及其推广栽培中发现,栽培越南槐容易感染各种病害,其种子容易霉变影响发芽,根茎时常腐烂,发生炭疽溃疡,引起条斑黑斑,从而影响药材生长。而大量化学农药的使用,容易导致药材农药、重金属等超标,严重影响药材安全(Gu et al., 2013)。因此,发展绿色环保的越南槐病害防治策略对山豆根药材的可持续利用和发展极其重要。植物有先天的免疫系统以响应病原微生物的分子机制及效应物(Jones & Dangl, 2006; Dangl et al., 2013)。植物有益微生物组通过与植物先天免疫系统的互作(Hacquard et al., 2017),使植物系统获得相关抗病性(Pieterse et al., 2014),对植物的健康有重要的作用(Berg et al., 2016)。番茄根系微生物组研究发现,抗病与感病植株根系微生物组的结构、抗菌性功能有很大差异,抗病植株根系微生物组作为有益微生物组转接到感病植株,能激活感病株的抗病性 (Kwak et al., 2018)。植物微生物组包括真菌组和细菌组,根系微生物组主要来源于高度多样性的土壤生物,受土壤类型、植物基因型、植物年龄等影响,茎和种子微生物主要来源于气溶胶、昆虫及根系的迁移(Hacquard et al., 2017)。在植物-有益内生真菌组中,各内生真菌通过与宿主进行复杂而精细的互作以激活植物先天免疫系统使宿主获得抗病性以拮抗病原和害虫的入侵,甚至部分内生真菌自身就可以分泌毒性代谢物以拮抗病原菌的入侵(Kusari et al., 2012; Compant et al., 2019),因此有益内生真菌组有利于宿主防御病害。野生越南槐生长于海拔500~800 m石灰岩山区的石头缝里,周围植被类型多样,局部小气候复杂多变,在这样的生境下,野生越南槐依然能健康发芽生长并形成独特的药性,此外,项目组前期研究工作发现越南槐各组织内有内生真菌(姚裕群,2017)。因此,我们推测独特复杂的野外生境容易使越南槐根、茎和种子形成独特而多样性的有益内生真菌组,这些内生真菌组在拮抗病虫害方面可能发挥重要作用。本研究以相同生长年限不同时期采集的野生越南槐根、茎和种子为研究对象,依托广西科技大学重点实验室、柳州市农业气象试验站,采用组织块法分离内生真菌, 结合形态和ITS序列测序比对鉴定真菌,最大似然法构建内生真菌组系统发育树,R软件计算内生真菌组的α-多样性指数、β-多样性指数,分别采用琼脂块法和平板对峙法体外测定内生真菌组各分类单元对病原细菌、真菌的拮抗活性。通过分析野生越南槐根、茎和种子内生真菌组的属种系统发育、α-多样性、β-多样性及体外抗病原菌功能,拟探讨以下问题:(1)野生越南槐根、茎和种子各有益内生真菌组在属种系统发育上是否有差异;(2)野生越南槐根、茎和种子各有益内生真菌组的多样性和相似性如何;(3)野生越南槐根、茎和种子各有益内生真菌组体外是否具有抗病功能。本研究結果拟为探索利用野生越南槐各有益真菌组防治栽培越南槐各组织病害提供材料及实验基础。
1 材料与方法
1.1 材料
1.1.1 供试药用植物 供试8株野生越南槐(Sophora tonkinensis),4年生,株高约2 m,根直径约1 cm, 茎直径约1.5 cm,种子大小均匀饱满约(0.5 cm × 0.3 cm~1 cm × 0.8 cm,根茎采集期分别为2020年3月、8月、11月,不同成熟度种子采集期分别为2020年7月、8月、9月,均采自靖西市诚良村山上(106°25′26″ E、23°08′49″ N)。采集的越南槐根、茎和种子,分别装袋、贴上标签并立即运往广西科技大学生物化学与分子生物学实验室,并在24 h内处理样品。
1.1.2 供试病原菌 供试病原细菌为细菌性软腐病菌(Pectobacterium carotovorum)、细菌性条斑病菌(Xanthomonas oryzae pv. oryzicola)、细菌性溃疡病菌(X. campestris pv. citri);供试病原真菌为根腐病菌(Fusarium solani)、炭疽病菌(Colletotriehum gloeosporioides)、黑斑病菌(Alternaria panax)。以上菌株均保藏在广西科技大学基础医学部。
1.1.3 培养基、试剂与测序 马铃薯葡萄糖(PDA)培养基、玉米培养基、LA培养基均购自广东环凯微生物科技有限公司,所有培养基在121 ℃,1 × 105 Pa 下湿热灭菌20 min 备用;次氯酸钠、甘油、酒精,均购自成都金山化学试剂有限公司;2xTagMasterMix,购自天根生化科技有限公司;引物ITS1/ITS4合成及PCR产物测序均由南京钟鼎生物技术有限公司完成。
1.1.4 仪器与设备 生物安全柜(Thermo1376)、PCR扩增仪(BIO-RAD C1000)、凝胶成像系统(Bio-Best 200E)、生化培养箱(SPX-250)、超低温冰箱(Thermo 902)、离心机(Sigma 3K15)、显微镜(Olympus IX83)、鼓风干燥箱(DHG-9030)、全自动高压灭菌锅(Tomy XS500)。
1.2 方法
1.2.1 根、茎和种子内生真菌的分离纯化 将越南槐的新鲜健康根段、茎段和种子用流水彻底冲洗表面,晾干后移到超净工作台分别进行表面消毒,即75%酒精1 min,无菌水漂洗3次,5%次氯酸钠1~6 min(根段/茎段,1~2 min; 种子,5~6 min)后,无菌水漂洗3次,无菌吸水纸吸干表面,根段/茎段分别去除两端和表皮后切成1 cm × 0.5 cm大小的组织块,种子分为种皮和胚,均转接至1/2玉米粉培养基(含氯霉素和氨苄青霉素),并于25 ℃培养箱黑暗培养。待各组织边缘长出菌丝后及时挑取单一菌丝至PDA培养基上,长出的菌落,如果外部形态不一致,继续挑取单一菌丝直至长出外部形态一致的菌落。
1.2.2 根、茎和种子内生真菌的分类鉴定 根据菌落的组织来源、培养时间及外部形态,分别将根段、茎段和种子分离到的菌株划分为不同的形态型,采用DNA分子标记鉴定每个形态型的代表菌株。采用通用引物对ITS1/ITS4,从代表菌株基因组DNA扩增ITS序列并测序(ITS1-5.8S rDNA-ITS2)。分别使用软件 ClustalX 1.81 和 BioEdit v7.0分析测序序列,登录GenBank数据库比对,下载最相似(尽量选择正式发表)序列,使用MEGA 6.0软件的邻接法(neighbor-joining)构建系统发育树,经Bootstrap 1 000 次循环检验系统树的可靠性。在系统发育树中,比对测序序列与参考序列之间的相似性,依据真菌鉴定的常用相关阈值鉴定真菌(O′Brien et al., 2005;González & Tello, 2011),即相似性<95%为未鉴定,95%≤相似性<97%为鉴定到属水平,相似性≥97%为鉴定到种水平,在属内比较中,明显高于其他种时则被鉴定为同种。
1.2.3 根、茎和种子各内生真菌组的系统进化 基于真菌分类单元的ITS序列,通过MEGA 6.0软件,采用最大似然法(maximun likelihood)构建系统发育树来分析野生越南槐根、茎和种子各内生真菌组的属种系统进化(González & Tello, 2011)。
1.2.4 根、茎和种子各内生真菌组的多样性和相似性 基于野生越南槐根、茎和种子各内生真菌组的分类单元及其分离株系分别计算各真菌组的α-多样性指数[香农-维纳指数(Shannon-Wiener index)和辛普森多样性指数(Simpsons diversity index)]及β-多样性指数[索伦森指数(Sorensens index)和雅卡尔指数(Jaccards index)]。通过α-多样性指数来分析野生越南槐根、茎和种子各内生真菌组的多样性,通过β-多样性指数来分析野生越南槐根、茎和种子各内生真菌组间的物种相似性(Yao et al., 2017)。使用生物统计软件SPSS 28.0,以及运用方差和多重比较以分析野生越南槐根、茎和种子各内生真菌组的多样性差异。
1.2.5 根、茎和种子各内生真菌组的体外抗病原菌功能 挑选内生真菌组各分类单元的代表菌株用于体外抗病原菌功能筛选。采用琼脂块法(姚裕群等,2017)筛选供试内生真菌对病原细菌的拮抗活性,即将新鲜病原细菌调成0.5麦氏浊度的菌悬液并将其在15 min内用无菌棉签均匀涂布于 LA培养基平板上,将6 mm直径的内生真菌菌块接入风干后的LA培养基筛选平板,每皿接5个菌块, (35±2) ℃培养16~18 h后观察并测量抑菌圈直径;采用平板对峙法筛选(Yao et al., 2017)供试内生真菌对病原真菌的拮抗活性,即将内生真菌和病原真菌均制成6 mm直径菌块,1块内生真菌接种于PDA培养基中央且周围等距接种3块病原真菌为处理,以不接种内生真菌为对照,28 ℃下培养,待对照长至平板中央测量各病原菌块中心至平板中央之间病原菌的生长量,并计算抑菌率。
抑菌率(%)=对照生长量-处理生长量对照生长量×100。
1.3 统计分析
基于野生越南槐根、茎和种子各内生真菌组的分类单元及其分离株系计算相对频率(relative frequency,RF),α-多样性指数(香农-维纳指数和辛普森多样性指数)及β-多样性指数(索伦森指数和雅卡尔指数)(Yao et al., 2017)。使用生物统计软件SPSS 28.0,以及运用方差和多重比较以分析野生与培越南槐内生真菌组多样性差异。
2 结果与分析
2.1 根、茎和种子内生真菌的分离和鉴定
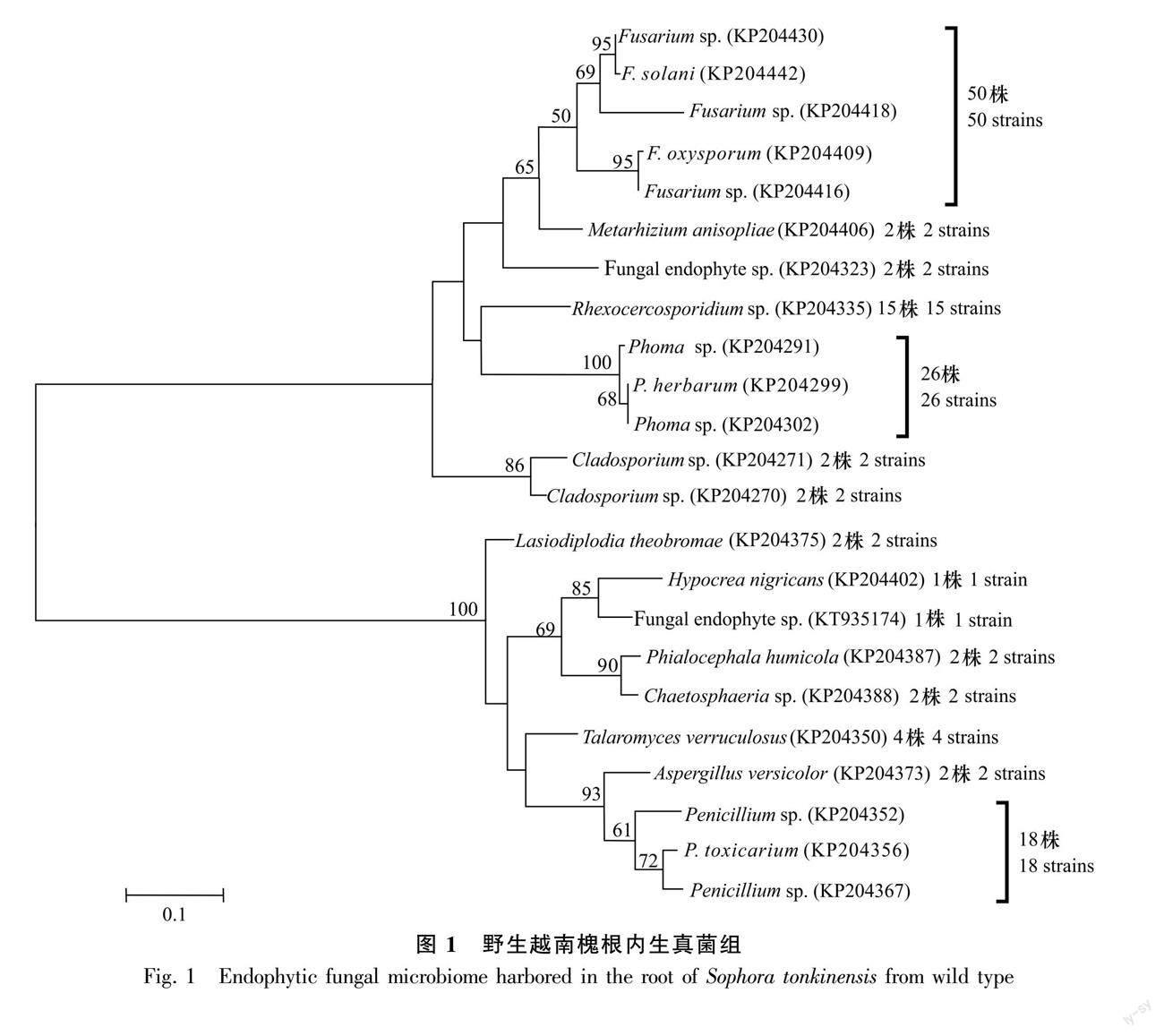
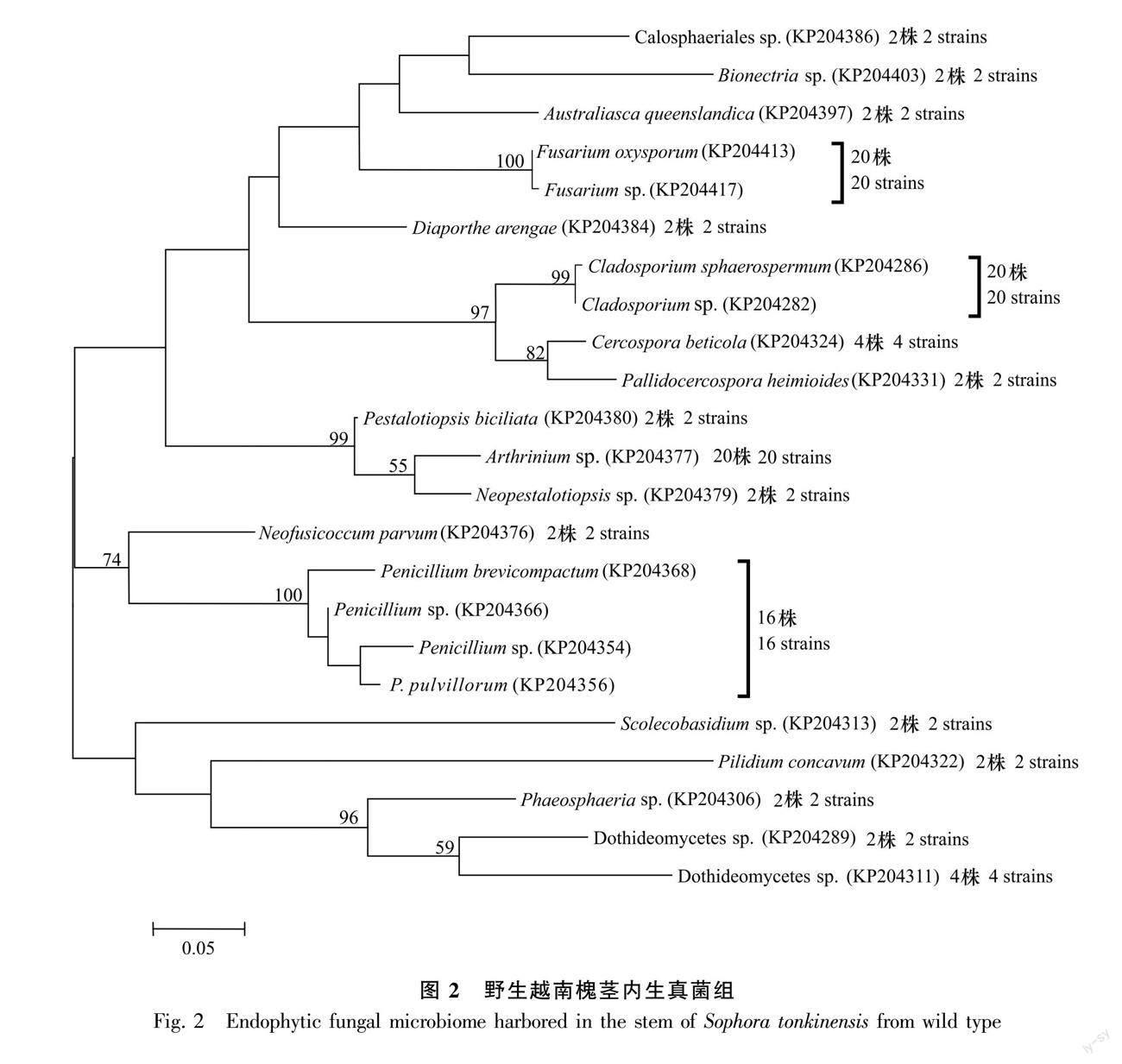
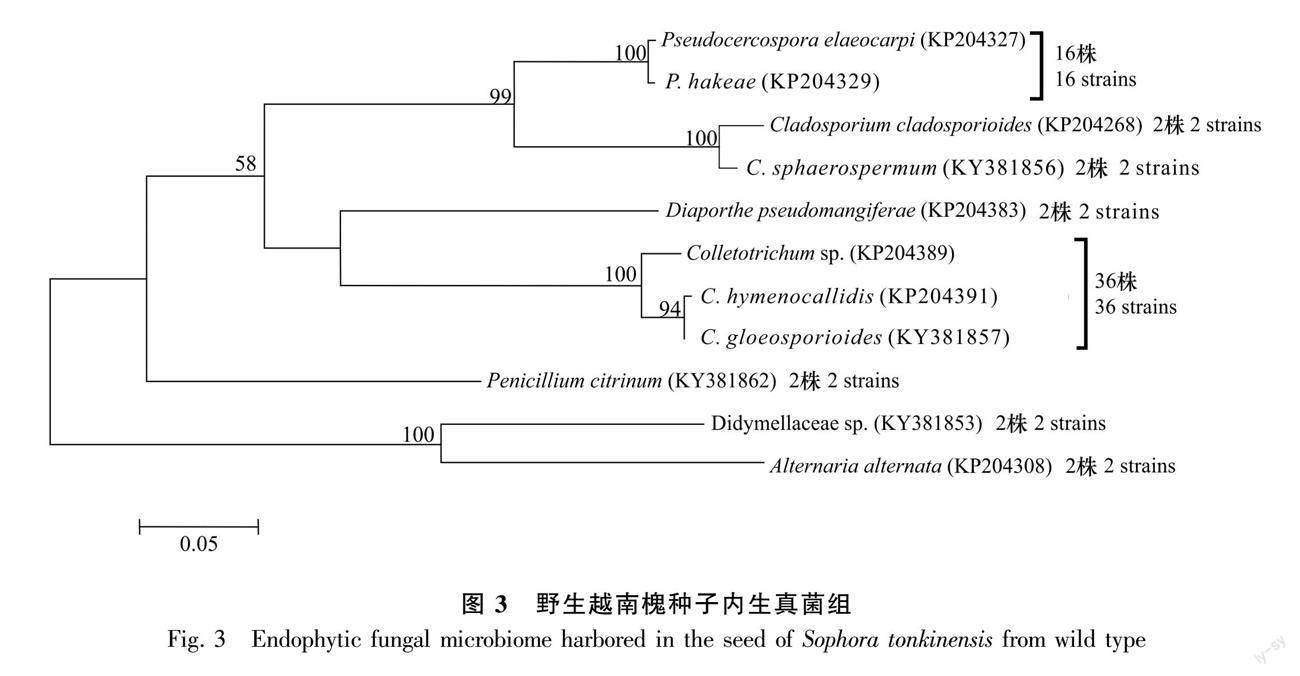
从野生越南槐根段共计60个组织块中分离获得131株内生真菌(图1);从茎段60个组织块共分离获得108株内生真菌(图2);从40粒种子共分离获得64株内生真菌(图3)。首先将分离自根、茎和种子的菌株分开,然后将相同组织来源的菌株分别培养,将相同培养时间内菌落孢子形态一致的菌株划分为同一形态型,最后采用ITS序列分析鉴定每个形态型的代表菌株。结合形态学和ITS序列分析,从根内生真菌组的42个形态型代表菌株中共鉴定23个分类单元,从茎内生真菌组的38个形态型代表菌株中共鉴定23个分类单元,从种子内生真菌组的20个形态型代表菌株中共鉴定11个分类单元且均来自于种皮。每个分类单元为一个特定的真菌物种,依据真菌物种鉴定的常用相关阈值(见方法部分)。根内生真菌组的23个分类单元(物种)中,11个分类单元鉴定到属水平,10个分类单元鉴定到种水平,2个分类单元未鉴定;茎内生真菌组的23个分类单元(物种)中,9个分类单元鉴定到属水平,11个分类单元鉴定到种水平, 3个分类单元未鉴定;种子内生真菌组的11个分类单元(物种)中,1个分类单元鉴定到属水平,9个分类单元鉴定到种水平,1个分类单元未鉴定。相关数据已上传GenBank数据库,登錄号为KP204264-KP204442、KT935174及KR611926。
2.2 根、茎和种子各内生真菌组的系统进化
基于野生越南槐根内生真菌组23个分类单元,茎内生真菌组23个分类单元以及种子内生真菌组11个分类单元的ITS序列,采用最大似然法分别构建了野生越南槐根、茎、种子内生真菌组的系统发育树(图1,图2,图3)。在根内生真菌组的已鉴定分类单元中, 有12个属10个种,其中有4个优势属,镰刀菌属(Fusarium)为最优势属,其次为茎点霉属(Phoma)、 青霉属(Penicillium)、Rhexocercosporidium;在茎内生真菌组的已鉴定分类单元中,有15个属11个种,其中有4个优势属,分别为节孢霉属(Arthrinium)、青霉属、镰刀菌属、枝孢菌属(Cladosporium),其中节孢霉属为最优势属;在种子内生真菌组的已鉴定分类单元中,有6个属9个种,其中有3个优势属,分别为炭疽菌属(Colletotrichum)、枝孢菌属和假尾孢菌属(Pseudocercospora),其中炭疽菌属为最优势属。根、茎和种子3个内生真菌组共有属为2个,即青霉属和枝孢菌属,特有属分别为10个、13个、4个,特有属分别约为共有属的5倍、7倍、2倍;根、茎和种子3个内生真菌组间共有种为0个,所有种均为特有种,特有种分别为10个、11个、9个。研究结果表明,在野生越南槐根、茎和种子内生真菌组中,共有属少而特有属多,且所有种均为特有种,各组织内生真菌组在属种进化上具有组织特性。
2.3 根、茎和种子各内生真菌组的多样性和相似性
基于越南槐根、茎和种子各内生真菌组的分类单元(物种)、分离株系及其共有分类单元(物种)(图1,图2,图3)计算α-多样性指数(香农-维纳指数和辛普森多样性指数)(表1)及β-多样性指数(索伦森指数和雅卡尔指数)(表2),进一步比较野生越南槐根、茎和种子各内生真菌组的α-多样性指数及β-多样性指数。越南槐根、茎和种子各内生真菌组的α-多样性指数结果如表1所示,比较其他药用植物组织内生真菌组(González & Tello, 2011; 李玲玲,2021),野生越南槐根、茎和种子各内生真菌组的物种多样性指数均较大,表明野生越南槐根、茎和种子内均有较丰富多样的内生真菌组,而根茎内生真菌组的α-多样性指数显著高于种子内生真菌组,表明越南槐根茎内生真菌组的物种多样性显著高于种子内生真菌组;越南槐根、茎和种子各内生真菌组间的β-多样性指数如表2所示,即索伦森指数和雅卡尔指数在0~0.148之间,基于相似性系数原理,当β-多样性指数介于0~0.25时为极不相似,0.25~0.50为中等不相似,0.50~0.75为中等相似,0.75~1.00为极为相似,研究结果表明野生越南槐根、茎和种子各内生真菌组间的物种相似性极低。
2.4 根、茎和种子各内生真菌组的体外抗病原菌功能
3种病原细菌(细菌性软腐病菌、细菌性条斑病菌、细菌性溃疡病菌)和3种病原真菌(根腐病菌、炭疽病菌、黑斑病菌)能广泛引起植物根、茎和种子的相应病害,因此以这6种病原菌为靶标菌测试越南槐根、茎和种子各内生真菌组的体外抗病原菌功能。
以上述3种病原细菌为靶标菌,对越南槐根、茎和种子各内生真菌组的分类单元(分别为23个、23个、11个)进行体外抗病原细菌活性测定。由表3可知, 在野生越南槐根内生真菌组中,有3个分类单元 (13%)对靶标菌有不同程度的抑制作用,其中2个分类单元对细菌性软腐病菌有抑菌圈且抑菌圈直径均等于阳性对照,3个分类单元对细菌性条斑病菌有抑菌圈且抑菌圈直径均大于或等于阳性对照,3个分类单元对细菌性溃疡病菌有抑菌圈,1个分类单元的抑菌圈直径等于阳性对照,2个分类单元对3种靶标菌均有抑菌圈,尤其是分类单元黑僵菌(Metarhizium anisopliae)对3种靶标菌的抑菌圈直径均等于阳性对照; 在野生越南槐茎内生真菌组中, 有2个分类单元(9%)对靶标菌有不同程度的抑制作用,其中分类单元Bionectria sp.对3种靶标菌的抑菌圈直径均大于或等于阳性对照;在野生越南槐种子内生真菌组中,没有发现抑制靶标病原细菌的分类单元。
以上述3种病原真菌为靶标菌,对越南槐根、茎和种子各内生真菌组的分类单元(分别为23个、23个、11个)进行体外抗病原真菌活性测定。由表4可知,在野生越南槐根内生真菌组中,有9个分类单元(39%)对靶标菌均有不同程度的抑制作用, 其中8个分类单元对根腐病菌的抑制率超过50%, 9个分类单元对炭疽病菌的抑制率超过50%,5个分类单元对黑斑病菌的抑制率超过50%,茄镰孢菌(Fusarium solani)、可可球二孢菌(Lasiodiplodia theobromae)、Rhexocercosporidium sp.、Phoma sp.、草茎点霉(P. herbarum)5个分类单元对3种病原真菌的抑制率均超过50%,显示了强的拮抗活性;在野生越南槐茎内生真菌组中,有9个分类单元(39%)对靶标菌均有不同程度的抑制作用,其中4个分类单元对根腐病菌的抑制率超过50%,7个分类单元对炭疽病菌的抑制率超过50%,1个分类单元对黑斑病菌的抑制率超过50%,分类单元尖孢镰刀菌(Fusarium oxysporum)对3种病原真菌的抑制率均超过50%,显示了强的拮抗活性;在野生越南槐种子内生真菌组中,有4个分类单元(36%)对靶标菌均有不同程度的抑制作用,其中2个分类单元对根腐病菌的抑制率超过50%,3个分类单元对炭疽病菌的抑制率超过50%,1个分类单元对黑斑病菌的抑制率超过50%,分类单元海水仙炭疽菌(Colletotrichum hymenocallidis)对3种病原真菌的抑制率均超过50%,显示了强的拮抗活性。
体外抗病原菌功能测定结果(表3,表4)显示,野生越南槐根内生真菌组具有丰富的抗病原菌分类单元(10个,43%),体外对6种病原细/真菌均显示了强广谱的拮抗活性,尤其是黑僵菌、茄镰孢菌、可可球二孢菌、Rhexocercosporidium sp.、Phoma sp.、草茎点霉6个分类单元对3种以上病原细/真菌均具强广谱的拮抗活性;野生越南槐茎内生真菌组也具有丰富的抗病原菌分类单元(10个,43%),体外对6种病原细/真菌也均显示了强广谱的拮抗活性,尤其是Bionectria sp.、尖孢镰刀菌2个分类单元对3种以上病原细/真菌均具强广谱的拮抗活性;野生越南槐种子内生真菌组同样具有丰富的抗病原菌分类单元(4个,36%),体外对靶标病原细菌没有拮抗活性,但对3种病原真菌均显示了强广谱的拮抗活性,尤其是分类单元海水仙炭疽菌对3种病原真菌均具强广谱的拮抗活性。研究结果表明,野生越南槐根茎内生真菌组体外均能有效拮抗病原细/真菌,具强广谱的体外抗病原细/真菌功能,而野生越南槐種子内生真菌组体外均能有效拮抗病原真菌,具强广谱的体外抗病原真菌功能。
3 讨论与结论
植物的每个组织都定殖有不同而多样的内生真菌组,内生真菌组与宿主植物协同进化、互惠共生 (Gogarten & Townsend, 2005)。在内生真菌组与宿主植物的互作过程中,基于“获得性免疫”理论,部分内生真菌能激活植物的天然免疫系统使宿主植物获得免疫活性以拮抗害虫和抗病微生物(Arnold et al., 2003);基于“马赛效应”,部分内生真菌通过内生真菌-宿主/内生真菌-内生真菌间的互作在宿主植物组织里合成多样性的化学成分以保护宿主(Carroll, 1991);基于“平衡协作”学说,部分内生真菌能帮助宿主直接拮抗病原菌(Kusari et al., 2012; 李玲玲, 2021)。已有研究结果表明,内生真菌组在植物宿主的抗病中发挥着重要的作用。课题组在越南槐的栽培推广中发现,栽培越南槐的根、茎和种子非常容易发病,而野生越南槐各组织则极少发病,且越南槐各组织内有内生真菌(姚裕群, 2017; Yao et al., 2017)。基于内生真菌组及越南槐的前期研究工作,推测生长于广西石灰岩山区独特生境的越南槐根、茎和种子内部可能存在独特的有益内生真菌组,这些独特内生真菌组在野生药材抗病性方面可能发挥着重要的作用。宿主生长年限、生长季节、生长环境及组织类型也显著影响内生真菌组的系统进化、多样性及功能(Mishra et al., 2012; Nascimento et al., 2015)。为了避免生长年限和生长季节对内生真菌组的影响,研究独特生境下越南槐根、茎和种子内生真菌组的系统发育、多样性及抗病潜力,进而有效利用独特生境野生越南槐各组织有益内生真菌组防治其宿主栽培越南槐病害,本研究分三个时期分别从相同生长年限/相同发育期的野生越南槐根茎/种子分离鉴定内生真菌,分析各组织内生真菌组的系统发育、多样性、相似性和体外抗病原菌功能,探明野生越南槐各组织内生真菌组作为有益微生物组防治栽培宿主病害的潜力。
α-多样性表明野生越南槐根、茎和种子内均存在分类单元较丰富多样的内生真菌组。根茎内生真菌组的α-多样性显著高于种子可能由于根茎的生长时期远大于种子,研究结果与前人研究基本一致(González & Tello, 2011;Nascimento et al., 2015; 李玲玲, 2021)。基于“获得性免疫”理论,越南槐根、茎和种子内生真菌组的分类单元越丰富越有助于激活宿主各组织的天然免疫系统,使宿主各组织获得拮抗多种病原的免疫活性;基于“马赛效应”,分类单元多样的越南槐根、茎和种子内生真菌组通过多样的分类单元-宿主/分类单元-分类单元互作而有益于在宿主各组织内合成多样性的化学成分以保护宿主各组织免受多种病原侵害。因此,基于“获得性免疫”理论和“马赛效应”,丰富多样的野生越南槐根、茎和种子内生真菌组有益于帮助宿主各组织防御病害。聚类分析和低的β-多样性进一步表明,越南槐根、茎和种子内生真菌组在属种的发育上差异大,表明越南槐各组织内存在不同的内生真菌组,内生真菌组具有组织特异性,组织特异性的内生真菌组在与特异组织的互作中,可能帮助宿主组织拮抗特异的病原。内生真菌组的体外抗病功能分析发现,在越南槐根、茎和种子的内生真菌组中均有三分之一以上的分类单元具有体外抗病原菌活性,这些抗病原菌活性分类单元,尤其是强广谱抗病原菌活性分类单元,如根内生真菌组分类单元黑僵菌、茄镰孢菌、可可球二孢菌、Rhexocercosporidium sp.、Phoma sp.、草茎点霉,茎内生真菌组分类单元Bionectria sp.、尖孢镰刀菌,种子内生真菌组分类单元海水仙炭疽菌,可能直接参与拮抗宿主各组织病原菌的入侵。根、茎和种子3个内生真菌组共有青霉属、枝孢菌属这2个属,共有属可能在帮助宿主越南槐根、茎和种子拮抗共同病害方面发挥作用。根-茎/茎-种子间均有共同的分类单元,推测各组织内生真菌组间可能存在菌株交流。
番茄抗病植株根系微生物组中的优势属,虽然在体外不能抑制病原菌,但是接种番茄后能激活宿主的天然免疫系统而强烈抑制病原菌引起的番茄枯萎病(Kwak et al., 2018)。可见微生物组中的优势属在帮助宿主获得抗病活性方面发挥着重要作用。本研究中,野生越南槐各组织的内生真菌组均存在特定的优势属,如根内生真菌组中的优势属镰刀菌属、茎点霉属、青霉属、Rhexocercosporidium,茎内生真菌组中的优势属节孢霉属、青霉属、镰刀菌属、枝孢菌属,种子内生真菌组中的优势属炭疽菌属、枝孢菌属、假尾孢菌属,特别是这些优势属的部分分类单元还具有病原菌拮抗活性,这些优势属定殖根、茎和种子后可能激活其天然免疫系统,使宿主组织能拮抗各病原菌引起的相关病害,由此推测越南槐根、茎和种子内生真菌组内的这些优势属在保护宿主各组织拮抗病害方面可能发挥着重要作用。此外,虽然野生越南槐种子内生真菌组检测不到病原细菌的体外拮抗活性,但其優势属定殖种子后仍可能激活宿主使其获得拮抗病原细菌的免疫活性。
野生越南槐根、茎和种子内均有较丰富的内生真菌组,这些内生真菌组具有生物多样性、组织特异性以及强广谱的体外抗病原菌功能,作为有益微生物组在宿主各组织的抗病性方面可能发挥重要作用。
参考文献:
ARNOLD AE, MEJA LC, KYLLO D, et al., 2003. Fungal endophytes limit pathogen damage in a tropical tree [J]. Proc Natl Acad Sci USA, 100(26): 15649-15654.
BERG G, RYBAKOVA D, GRUBE M, et al., 2016. The plant microbiome explored: implications for experimental botany [J]. J Exp Bot, 67(4): 995-1002.
CARROLL GC, 1991. Beyond pest deterrence—alternative strategies and hidden costs of endophytic mutualisms in vascular plants [M]//ANDREW JH, HIRANO SS. Microbial ecology of leaves. New York: Springer Verlag: 358-375.
Chinese Pharmacopoeia Committee, 2020. Pharmacopoeia of the Peoples Republic of China [M]. Beijing: China Medical Science Press: 28-29. [国家药典委员会, 2020. 中华人民共和国药典 [M]. 北京: 中国医药科技出版社: 28-29.]
COMPANT S, SAMAD A, FAIST H, et al., 2019. A review on the plant microbiome: ecology, functions, and emerging trends in microbial application [J]. J Adv Res, 19: 29-37.
DANGL, JL, HORVATH DM, STASKAWICZ BJ, 2013. Pivoting the plant immune system from dissection to deployment [J]. Science, 341(6147): 746-751.
GOGARTEN JP, TOWNSEND JP, 2005. Horizontal gene transfer, genome innovation and evolution [J]. Nat Rev Microbiol, 3(9): 679-687.
GONZLEZ V, TELLO ML, 2011. The endophytic mycota associated with Vitis vinifera in central Spain [J]. Fungal Divers, 47(1): 29-42.
GU XY, LONG HR, XIE JQ, et al., 2013. Determination of 14 heavy metal elements in Sophora tonkinensis from Guangxi by microwave digestion and ICP-MS [J]. Lishizhen Med Mat Med Res, 24(2): 332-333. [谷筱玉, 龍海荣, 谢景千, 等, 2013. 广西山豆根中14种重金属元素的微波消解ICP-MS法测定 [J]. 时珍国医国药, 24(2): 332-333.]
HACQUARD S, SPAEPEN S, GARRIDO-OTER R, et al., 2017. Interplay between innate immunity and the plant microbiota [J]. Ann Rev Phytopathol, 55: 565-589.
JONES JD, DANGL JL, 2006. The plant immune system [J]. Nature, 444(7117): 323-329.
KUSARI S, HERTWECK C, SPITELLER M, 2012. Chemical ecology of endophytic fungi: origins of secondary metabolites [J]. Chem Biol, 19(7): 792-798.
KWAK MJ, KONG HG, CHOI K, et al., 2018. Rhizosphere microbiome structure alters to enable wilt resistance in tomato [J]. Nat Biotechnol, 36(11): 1100-1109.
LI LL, 2021. Antimicrobial activities of different species of endophytes from Artemisia annua [J]. Guihaia, 41(7): 1112-1119. [李玲玲, 2021. 药用植物青蒿不同种类的内生菌抑菌活性分析 [J]. 广西植物, 41(7): 1112-1119.]
MISHRA A, GOND SK, KUMAR A, et al., 2012. Season and tissue type affect fungal endophyte communities of the Indian medicinal plant Tinospora cordifolia more strongly than geographic location [J]. Microbial Ecol, 64(2): 388-398.
NASCIMENTO T, OKI Y, LIMA D, et al., 2015. Biodiversity of endophytic fungi in different leaf ages of Calotropis procera and their antimicrobial activity [J]. Fungal Ecol, 14: 79-86.
O′BRIEN HE, PARRENT JL, JACKSON JA, et al., 2005. Fungal community analysis by large-scale sequencing of environmental samples [J]. Appl Environ Microbiol, 71(9): 5544-5550.
PENG C, 2011. Traditional Chinese medicine [M]. Beijing: China Traditional Chinese Medicine Press: 3305-3320. [彭成, 2011. 中華道地药材 [M]. 北京: 中国中医药出版社: 3305-3320.]
PIETERSE CM, ZAMIOUDIS C, BERENDSEN RL, et al., 2014. Induced systemic resistance by beneficial microbes [J]. Ann Rev Phytopathol, 52: 347-375.
YAO YQ, 2017. The diversity, antimicrobial activity and secondary metabolites of endophytic fungi in Sophora tonkinensis Gagnep [D]. Nanning: Guangxi University: 55-68. [姚裕群, 2017. 越南槐内生真菌多样性、抑菌活性及其次生代谢产物研究 [D]. 南宁: 广西大学: 55-68.]
YAO YQ, LAN F, QIAO YM, et al., 2017. Endophytic fungi harbored in the root of Sophora tonkinensis Gapnep: Diversity and biocontrol potential against phytopathogens [J]. Microbiol Open, 6(3): e00437.
ZHANG W, WEI X, ZHANG LY, et al., 2020. Chemical constituents of Sophora tonkinensis [J]. Chem Nat Compd, 56(6): 1140-1142.
(责任编辑 周翠鸣)
