一种快速有效鉴定烟草苗期青枯病抗性的水培接种法
2023-06-29张海玲许玉红马丽聪夏岩石李荣华黄依琳周子苑肖建旺袁清华赵伟才郭培国
张海玲 许玉红 马丽聪 夏岩石 李荣华 黄依琳 周子苑 肖建旺 袁清华 赵伟才 郭培国

摘要:为探寻一种快速有效的烟草青枯病苗期抗性鉴定方法,以红花大金元、青梗、长脖黄和 D101等4个烟草品种为材料,在水培条件下采用伤根和不伤根法进行青枯菌侵染接种,依据病情指数进行抗病性鉴定。结果显示,水培条件下采用伤根和不伤根接种法,接种后7~10 d 便可判断出各品种的抗性,结果为 D101中抗、长脖黄高感、红花大金元高感或感病、青梗感病,与传统盆栽伤根灌菌接种法的评价结果基本一致,而盆栽伤根灌菌接种法则需3~4周。本研究建立的水培接种法可快速、高效准确鉴定和评价烟草苗期青枯病抗性。
关键词:烟草青枯病;水培;抗病性;鉴定
中图分类号: S435.72 文献标识码: A 文章编号:1007-5119(2023)01-0071-06
A Hydroponic Inoculation Method for Rapid and Efficient Evaluation of Tobacco Resistance to Bacterial Wilt Disease at Seedling Stage
ZHANG Hailing1, XU Yuhong1, MA Licong1, XIA Yanshi1, LI Ronghua1, HUANG Yilin1,ZHOU Ziyuan1, XIAO Jianwang1, YUAN Qinghua2, ZHAO Weicai3, GUO Peiguo1*
(1. School of Life Sciences, Guangzhou University, Guangzhou 510006, China;2. Crop Research Institute, Guangdong Academy ofAgricultural Sciences, Guangzhou 510640, China;3. Guangdong Research Institute of Tobacco Sciences, Shaoguan, Guangdong512400, China)
Abstract: In order to develop a rapid and effective method for resistance evaluation of tobacco bacterial wilt disease (BWD) at seedling stages, four tobacco varieties including Honghuadajinyuan, Qinggeng, Changbohuang and D101 were selected as materials in this study, and their BWD resistance or susceptibility were evaluated based on the disease index after inoculation of Ralstonia solanacearum with root-undamaged and root-damaged methods in a hydroponic system. The results showed that the BWD resistance/susceptibility for cultivars could be identified at the 7 or 10 days after inoculation by both root-damaged and undamaged inoculation methods, respectively. D101 was middle resistant, Changbohuang was highly susceptible, Honghuadajinyuan was highly susceptible or susceptible, and Qinggeng was susceptible. These results were basically consistent with the resistance evaluation obtained by a traditional root-damaged inoculation method in pot culture experiment, which needed 3 to 4 weeks. These results indicated that the hydroponic inoculation method established in this study was a rapid, efficient and accurate method for evaluation of tobacco BWD resistance/susceptibility at seedling stages.
Keywords: tobacco bacterial wilt disease; hydroponics; disease resistance; evaluation
煙草青枯病是由青枯菌( Ralstonia solanacearum)引起的一种土传性细菌病害,该病害的隐秘性、爆发性和传播性极强,一旦爆发,将降低烟叶的产量和品质,给烟草生产带来不可估量的损失[1]。目前国内外主要采用农业、生物和化学等方法防控青枯病,但防控效果欠佳[2],而选育抗病品种是防治青枯病发生的最为经济有效的途径[3]。
准确有效地鉴定烟草材料的抗病性对选育抗病品种至关重要。目前,烟草青枯病的抗性鉴定主要分为田间鉴定和苗期鉴定[4]。田间鉴定能较好地评价烟草材料的青枯病抗性,但易受到生态、气候、区域分布和其他病害干扰等因素的影响,且存在工作量大、耗时长和操作繁琐等不足[5-6]。苗期鉴定常采用传统的盆栽试验进行青枯菌接种[7],但抗病性评价周期较长,一般需1个月左右[8]。目前我国普遍采用烟草漂浮育苗,刘勇等[9]建立了塑料大棚内漂浮育苗水培接种法,该方法虽能有效避免土培烟苗再移植盆栽等复杂繁琐的操作,但存在漂浮池面积较大青枯菌难以均匀分布等问题;范江等[10]采用塑料大棚内漂浮育苗水培接种法对47个烟草品种进行青枯病抗性鉴定,发现鉴定结果受季节影响,且易受其他病害干扰。
据此,本研究在前人[9-10]研究的基础上,参考番茄[11]、茄子[12]和马铃薯[13]等植物开展的青枯病抗性鉴定方法,应用水培技术,采用伤根和不伤根法在烟草苗期进行青枯菌接种,以期建立一种适用于温室和人工气候箱的小型、易移动且快速有效的烟苗青枯病抗性鉴定评价体系。
1材料与方法
1.1供试材料
供试烟草品种为 D101、青梗、红花大金元和长脖黄,由广东省烟草科学研究所提供。其中,D101为青枯病抗病性较强的品种,青梗、红花大金元和长脖黄为易感青枯病的烟草品种[14-15]。
1.2供试培养基
参照谭茜等[16]采用的适宜青枯菌生长的细菌琼脂葡萄糖(BG)培养基,配方如下:酵母提取物1.0 g/L、酪蛋白氨基酸1.0 g/L、细菌蛋白胨10 g/L、琼脂15 g/L、葡萄糖5 g/L 。加入1%的2, 3, 5-三苯基氯化四氮唑(TTC)溶液使其终浓度为0.005%,即为 TTC 选择性平板。
1.3病原菌的分离与鉴定
2021年7月,收集广东省南雄市古市镇溪口村呈典型青枯病症状的烟株,称取约1 g 病健交界处的维管束组织,置于30 mL 的灭菌水中浸泡20min,蘸取浸出液在 TTC 平板上划线分离,于30 C的恒温培养箱中培养48 h。
参考已报道的鉴定青枯病病原菌的3个特异性 PCR 引物:759F/760R 、fliC-F/R 和 pehA#3/6[17-19](表1),进行青枯菌的 PCR 鉴定。25?L 的 PCR 反应体系包含 ddH2O 9.5?L ,2×Taq PCR Master Mix (诺唯赞生物科技股份有限公司)12.5?L,青枯菌菌液模板1?L,每对引物(10?mol/L)分别为1?L。PCR 扩增程序为:95 C预变性5 min ,扩增30个循环[95 C变性30 s ,59 C (fliC-F/R 和pehA#3/6)或60 C (759F/760R)退火1 min,72 C 延伸2 min],最后72 C延伸10 min。
1.4水培体系的构建
1.4.1水培设备所使用的水培设施主要包括:水培箱(长×宽×高41 cm×24 cm×14 cm )、定植篮(长×宽×高1.7 cm×3.4 cm×3.5 cm )、气泵(SY-Q01)和曝气石等。
1.4.2水培烟苗烟草种子消毒后,在26 C人工气候箱催苗培养,待烟苗长至十字叶期移入定植篮,并置于含有 Hoagland 营养液的水培箱中;每一个水培箱內放置一个爆气石进行增氧型水培,每7天更换1次营养液。
1.4.3水培接种将保藏的菌种在 TTC 平板上复苏,挑取青枯菌的单菌落在 LB 溶液中扩繁48 h,在4800 r/min 下离心20 min 收集菌体;用灭菌水调配好的 Hoagland 营养液悬浮菌体,浓度约为1×108 cfu/mL[20],每一个水培箱中注入7 L 的菌悬液。
不伤根试验处理,将4~6叶期烟苗根部置于盛有1×108 cfu/mL 的青枯病菌悬液的水培箱中,水培接种两周左右;伤根试验处理,用无菌剪刀在4~6叶期烟苗主根的根尖处剪掉1 cm,再置于上述水培箱中水培接种两周左右。
伤根和不伤根接种试验,每个品种均选用12株烟苗,重复3次。水培箱置在温度30 C、湿度80%、光周期16 h/d 的人工气候箱中。
1.5盆栽接种
采用伤根灌菌法[21]对烟苗伤根,每株接种菌液10 mL,以无菌水为空白对照,每个品种均选用10株烟苗,重复3次。设置人工气候箱温度为30 C、80%湿度、光周期16 h/d。
1.6病情调查与抗性评价标准
参照标准 GB/T 23222—2008《烟草病虫害分级及调查方法》进行病情调查,采用 Excel 2010和 SPSS 26.0整理数据和统计分析。参照 GB/T 23224—2008《烟草品种抗病性鉴定》进行抗病性评价,在感病对照品种长脖黄的病情指数达到80以上时[10],依据各品种病情指数调查结果,按评定标准值判断其抗病性强弱(表2)。
2结果
2.1供试烟草青枯病菌的分离筛选
蘸取1?L 的病株浸出液,在 TTC 平板上划线分离,待长出形态不一的单菌落(图1A),挑取疑似青枯菌形态的单菌落继续分离。经纯化后,供试菌株的单菌落为不规则圆形,中央为粉色,边缘为乳白色,且具有较强的流动性(图1B )。
2.2烟草青枯病病菌的 PCR 鉴定
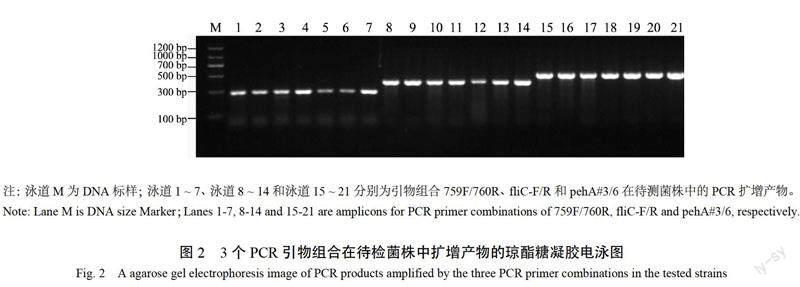
采用已报道鉴定青枯菌的3对引物组合(759F/760R 、flic-F/R 、pehA#3/6)对初步筛选出的菌株进行 PCR 鉴定(图2),结果发现这3对引物均能在待测的菌株中扩增出特异性条带,大小分别约为281、400和504 bp,与前人[17-19]报道的青枯菌特征扩增片段的大小一致,故判定从烟草感病材料中分离筛选出的菌株为青枯病病菌。
2.3烟草青枯病病原菌的致病性
对水培烟苗(4~6叶期)接种分离出的青枯菌,接种后的第3天,烟株有1片叶开始出现半边萎蔫(图3A);随着病情的加重,烟株一侧的叶片萎蔫,呈典型的“半边疯”症状[22](图3B);发病后期,整株叶片全部凋萎且茎部出现明显的黑色条斑(图3C );而未接种青枯菌的对照则正常生长(图3D );选取病株茎部流溢的乳白色悬浮液(即菌脓)为模板,以青枯菌种的特异性引物组合759F/760R 进行 PCR 扩增,可检测到281 bp 的特征条带(图3E ),而对照则无此条带。这些结果表明,分离出的病原菌可侵染烟苗,且具较强的致病力,导致烟苗出现典型的青枯病症状。
2.4水培伤根法接种青枯菌鉴定烟草品种的青枯病抗性
供试的4个烟草品种水培烟苗剪除根尖1 cm 后,接种青枯病病原菌。在接种后的第3天,长脖黄、红花大金元和青梗3个品种,已有部分烟株出现半边叶片萎蔫的发病症状但仍为绿色;而 D101叶片只有零星病症,且症状较轻(表3)。接种后第5天,4个烟草品种的感病表型较为明显,其中长脖黄、红花大金元和青梗的叶片均萎蔫下垂,病指明显上升,但 D101的发病相对较缓。在接种后的第7天,4个品种的发病率均大幅度增加,伴随有叶片黄化,部分烟株茎秆上出现黑色条斑,甚至蔓延至烟株顶部继而枯死;长脖黄、红花大金元和青梗3个品种与D101的病情指数差异显著,其抗性等级评价分别属于高感、高感、感病和中抗。说明水培伤根法仅需7 d 便可鉴定供试烟草品种的青枯病抗性。
2.5水培不伤根法接种青枯菌鉴定烟草品种的青枯病抗性
由表4可知,4个烟草品种的病情指数在接种后的前3天无显著差异。接种后第5天,长脖黄、红花大金元和青梗的病症逐渐加重,病情指数增加较快,D101的下部叶片亦开始出现轻度萎蔫症状。接种后第7天,感病对照长脖黄的病情指数大幅度上升,红花大金元和青梗次之, D101的病情指数最低。接种后第10天,红花大金元和长脖黄的叶片明显黄化与枯萎,青梗病症加重亦有枯萎现象,而 D101的叶片只出现轻微发病症状;依病情指数,长脖黄、红花大金元、青梗和 D101的抗性等级分别属于高感、感病、感病和中抗。说明水培不伤根法只需10 d 就可鉴定供试烟草品种的青枯病抗性。
2.6盆栽伤根法接种青枯菌鉴定烟草品种的青枯病抗性
为检测水培法接种青枯菌鉴定烟苗青枯病抗病性的可应用性,采用传统的土壤盆栽伤根灌菌法进行比较试验。由表5可知,在接种后的前10天,4个烟草品種的病情指数呈缓慢上升的趋势。在接种后的第15天,青梗和红花大金元的病情指数急剧上升,有明显萎蔫与黄化的叶片,长脖黄的病情指数次之,而 D101病指上升较缓慢。当接种时间延长至第21天,长脖黄、红花大金元和青梗的病指明显上升,有较多叶片枯萎,茎秆上的黑色条斑蔓延至叶柄和烟株顶部,尤其青梗病情表现最重,多数叶片干枯坏死,有的烟株自下而上枯萎至死亡。以青梗为感病对照,依据病情指数,4个烟草品种的抗性等级分别是青梗为高感、红花大金元和长脖黄为感病, D101为抗病。此外,当接种时间至第30天,以长脖黄为感病对照,依据病情指数,红花大金元、青梗与长脖黄的抗性级别均为高感,而 D101仍属于抗病等级。说明盆栽伤根灌菌法需3~4周才可鉴定供试烟草品种的青枯病抗性。
3讨论
植物青枯病抗病性是植物与青枯菌在一定环境条件下相互作用的结果,而在不同环境条件下进行青枯病抗病性鉴定试验,抗病性评价效果不尽相同[23]。目前常见青枯菌的接种方法有叶片注射法[24]、伤根灌菌法[25]、灌根法[26]等。在自然环境条件下,青枯菌一般可从新生的侧根和根尖处或植株伤口处入侵[27],因而,多数研究常采用伤根灌菌法和灌根法。其中,伤根灌菌法常用于烟草[28]等植物的青枯病抗病性鉴定,且效果相对稳定。
本研究采用烟草水培伤根法和不伤根法接种青枯菌,均可导致叶片枯萎、黄化且茎部一侧出现黑色条斑,甚至蔓延到叶柄等部位。以上症状作为本研究烟苗感染青枯病的典型特征,与番茄[29]在水培条件下接种青枯菌所表现的青枯病症状相同,亦与本研究的烟草盆栽伤根灌菌法所观察到烟株发病表型一致。针对4个烟草品种采用的水培伤根法、水培不伤根法及盆栽伤根灌菌法,接种青枯菌鉴定青枯病抗性的结果基本一致,D101均具有较强的青枯病抗性,其余3个品种的青枯病抗性基本上均表现为易感青枯病。这些结果表明该烟草水培接种体系是一种鉴定烟草青枯病抗性行之有效的方法。
在选用4个烟草品种烟苗水培接种青枯菌的试验中,发现伤根接种法导致青枯菌侵染烟苗的速度稍快于不伤根法;在接种后第7天,感病对照品种长脖黄病情指数超过80,达到高感水平;而不伤根接种法烟草青枯病的发病速度则相对较缓,接种后第10天长脖黄的病情指数值才达到80以上,说明伤根接种法有利于加快青枯病病原菌的入侵与定殖,这与 WANG 等[30]研究的马铃薯水培接种青枯菌鉴定品种抗性所得的结果一致;而采用盆栽伤根灌菌法接种烟苗,易感对照品种长脖黄在接种后4周,病指才达到80以上,表明该接种方法烟苗青枯病的发病速度远远低于水培伤根和不伤根的接种方法。
水培法接种青枯菌所需水培设施简便,鉴定试验可在温室或人工气候箱里完成,不受季节影响,一年可开展多次,方法易于操作[31-33];与土壤盆栽或田间的青枯病抗性鉴定方法相比,青枯菌在水培条件下能均匀地接触到根系,减少了试验误差及避免田间土传病害的干扰,提高了抗病性鉴定的准确性和重复性[32-33];同时,水培法接种青枯菌,青枯病发病迅速,抗性鉴定需时短而快速[33]。因此,本研究建立的烟苗水培伤根或不伤根法接种青枯菌鉴定烟草材料抗病性的体系,是一种简捷、准确有效和快速的体系。
4结论
本研究建立了一种鉴定烟草苗期青枯病抗性的水培接种法,利用该方法鉴定评价了4个烟草品种的青枯病抗性,在接种后7~10d 就可判断出各品种的抗性,与传统盆栽伤根灌菌接种法需要3~4周才能获得的鉴定结果基本一致,表明所建立的水培接种法是一种快速和准确有效鉴定烟草材料青枯病抗性的方法。
参考文献
[1] 樊俊,谭军,王瑞,等.烟草青枯病发病土壤理化性状及细菌群落结构分析[J].中国烟草科学,2021,42(6):15-21.
FAN J, TAN J, WANG R, et al. Analysis of soil physical and chemical properties and bacterial community structure with tobacco bacterial wilt infection[J]. Chinese Tobacco Science, 2021, 42(6):15-21.
[2] 冯永新,关辉,靳彦峰,等.短小芽孢杆菌与化学杀细菌剂协同
防治烟草青枯病研究[J].中国烟草科学,2021,42(4):44-49. FENG Y X, GUAN H, JIN Y F, et al. Synergistic control effect of Bacillus pumilus AR03 and fungicides against tobacco bacterial wilt[J]. Chinese Tobacco Science, 2021, 42(4):44-49.
[3] 牛文利,巫升鑫,余文,等.烟草抗青枯病突变体153-K 的抗性遗传及与农艺性状的关系[J].中国烟草科学,2021,42(2):1-7.
NIU W L, WU S X, YU W, et al. Analysis of resistance inheritance of 153-K to bacterial wilt and its correlation with agronomic charactersin tobacco[J]. Chinese Tobacco Science, 2021, 42(2):1-7.
[4] 陆宁,任学良,汪汉成,等.不同烤烟品种(系)对青枯病的抗性鉴定[J].湖北农业科学,2015,54(4):864-867.
LU N, REN X L, WANG H C, et al. Identifying resistance of tobacco varieties against bacterial wilt[J]. Hubei Agricultural Sciences, 2015, 54(4):864-867.
[5] 紀成灿,方树民,顾钢,等.烟草品种抗青枯病鉴定中的相关因素分析[J].中国烟草科学,2000(2):3-6.
JI C C, FANG S M, GU G, et al. Analysis of correlated factors in the identification of tobacco bacterial wilt resistance[J]. Chinese Tobacco Science, 2000(2):3-6.
[6] 徐进,许景升,张昊,等.烟草品种青枯病抗性的组培苗接种鉴定方法研究[J].中国烟草科学,2016,37(5):51-56.
XU J, XU J S, ZHANG H, et al. Study on granville wilt resistance screening in tobacco using an in vitro plantlet inoculation method[J]. Chinese Tobacco Science, 2016, 37(5):51-56.
[7] 黎妍妍,李亚培,孙玉晓,等.外源橙皮素对烟草青枯病及根围土壤细菌群落的影响[J].中国烟草科学,2022,43(5):38-43.
LI Y Y, LI Y P, SUN Y X, et al. The effects of exogenous hesperetin on tobacco bacterial wilt infection and bacterial community of rhizosphere soil[J]. Chinese Tobacco Science, 2022, 43(5):38-43.
[8] LI Y Y, WANG L, SUN G W, et al. Digital gene expression analysisof the response to Ralstonia solanacearum between resistant and susceptible tobacco varieties[J]. Scientific reports, 2021, 11(1):1-16.
[9] 刘勇,秦西云,李文正,等.抗青枯病烟草种质资源在云南省的评价[J].植物遗传资源学报,2010,11(1):10-16.
LIU Y, QIN X Y, LI W Z, et al. The resistance evaluation to bacterial wilt of tobacco germplasm in Yunnan Province[J]. Journal of Plant Genetic Resources, 2010, 11(1):10-16.
[10]范江,劉勇,李永平,等.烟草苗期青枯病抗性鉴定及其抗性评价方法的比较[J].云南农业大学学报(自然科学),2014,29(4):487-493.
FAN J, LIU Y, LI Y P, et al. Evaluation of tobacco seedlings resistance to bacterial wilt and comparison of resistance evaluation system[J]. Journal of Yunnan Agricultural University (NaturalScience), 2014, 29(4):487-493.
[11] ZOHOUNGBOGBO H, QUENUM A, HONFOGA J, et al.Evaluation of resistance sources of tomato (Solanum lycopersicum L.) to phylotype I strains of Ralstonia solanacearum species complex inBenin[J]. Agronomy, 2021, 11(8):1513.
[12] RAKHA M, NAMISY A, CHEN J R, et al. Development ofinterspecific hybrids between a cultivated eggplant resistant to bacterial wilt (Ralstonia solanacearum) and eggplant wild relatives for the development of rootstocks[J]. Plants, 2020, 9(10):1405.
[13]陈卓,肖熙鸥,陈曙,等.利用 GFP 标记的 Ralstonia solanacearum鉴定马铃薯青枯病抗性[J].中国瓜菜,2021,34(1):35-41.
CHEN Z, XIAO X O, CHEN S, et al. Identification of potato bacterial wilt resistance using GFP-labeled Ralstonia solanacearum[J]. China Cucurbits and Vegetables, 2021, 34(1):35-41.
[14] GAO W, CHEN R, PAN M, et al. Early transcriptional response ofseedling roots to Ralstonia solanacearum in tobacco (Nicotiana tabacum L.)[J]. European Journal of Plant Pathology, 2019, 155(2):527-536.
[15]张振臣,邓海滨,刘琼光,等.广东抗青枯病烟草资源筛选[J].广东农业科学,2014,41(7):27-29.
ZHANG Z C, DENG H B, LIU Q G, et al. Screening of tobacco germplasm resistant to bacterial wilt in Guangdong[J]. Guangdong Agricultural Sciences, 2014, 41(7):27-29.
[16]谭茜,李杰,汪代斌,等.我国主要烟草青枯病病圃青枯菌系统发育分析[J].中国烟草科学,2022,43(2):52-57.
TAN Q, LI J, WANG D B, et al. Phylogenetic analysis of Ralstonia solanacearum strains from the main disease identification nurseries inChina[J]. Chinese Tobacco Science, 2022, 43(2):52-57.
[17] SHARMA D, SINGH Y. Characterization of Ralstonia solanacearumisolates using biochemical, cultural, molecular methods and pathogenicity tests[J]. Journal of Pharmacognosy and Phytochemistry, 2019, 8(4):2884-2889.
[18] SCHONFELD J, HEUER H, VAN ELSAS J D, et al. Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of fliC fragments[J]. Applied and Environmental Microbiology, 2003, 69(12): 7248-7256.
[19] GILLINGS M, FAHY P, DAVIES C. Restriction analysis of an amplified polygalacturonase gene fragment differentiates strains of the phytopathogenic bacterium Pseudomonas solanacearum[J]. Letters in Applied Microbiology, 1993, 17(1): 44-48.
[20] LI S L, YANG L, RAN Y, et al. A epsB mutant of Ralstonia solanacearum as novel biocontrol agent of tobacco bacterial wilt via activating salicylic acid signalling[J]. Physiological and Molecular Plant Pathology, 2022, 119: 101834.
[21] 李小杰,刘畅,李成军,等. 基于 RAPD 分子标记的烟草青枯病菌特异引物筛选及效果评价[J]. 中国烟草学报,2021,27(2):72-78.
LI X J, LIU C, LI C J, et al. Screening and evaluation of specific primers for Ralstonia solanacearum based on RAPD Technology[J]. Acta Tabacaria Sinica, 2021, 27(2): 72-78.
[22] 余峰,李洁,黎妍妍,等. 橙皮素对烟草青枯病的诱导抗性研究[J]. 中国烟草科学,2022,43(4):55-61.
YU F, LI J, LI Y Y, et al. Study on the effect of hesperetin on the induction of tobacco resistance to bacterial wilt[J]. Chinese Tobacco Science, 2022, 43(4): 55-61.
[23] 潘晓英,张振臣,袁清华,等. 植物抗青枯病的分子机制研究进展[J]. 植物生理学报,2022,58(4):607-621.
PAN X Y, ZHANG Z C, YUAN Q H, et al. Research advances on molecular mechanisms of resistance to bacterial wilt in plants[J]. Plant Physiology Journal, 2022, 58(4): 607-621.
[24] XU Y, SHANG K, WANG C, et al. WIPK-NtLTP4 pathway confers resistance to Ralstonia solanacearum in tobacco[J]. Plant Cell Reports, 2022, 41(1): 249-261.
[25] LEI N, CHEN L, KIBA A, et al. Super-multiple deletion analysis of type III effectors in Ralstonia solanacearum OE1-1 for full virulence toward host plants[J]. Frontiers in microbiology, 2020, 11: 1683.
[26] 何永宏,曾乙心,刘林,等. 温度和品种抗性对烟草青枯病潜育期的影响[J]. 烟草科技,2017,50(6):16-20,32.
HE Y H, ZENG Y X, LIU L, et al. Effects of temperature and varietal resistance on latent period of tobacco bacterial wilt[J]. Tobacco Science & Technology, 2017, 50(6): 16-20, 32.
[27] 肖熙鸥,林文秋,陈卓,等. 马铃薯抗青枯病育种研究进展[J]. 江苏农业学报,2021,37(5):1344-1351.
XIAO X O, LIN W Q, CHEN Z, et al. Research advances in potato breeding for bacterial wilt resistance[J]. Jiangsu Journal of Agricultural Sciences, 2021, 37(5): 1344-1351.
[28] 方树民,顾钢,纪成灿,等. 烟草青枯菌致病型及分布的研究[J]. 中国烟草学报,2002(3):41-44.
FANG S M, GU G, JI C C, et al. Studies on pathogenic types and distribution of Ralstonia solanacearum in tobacco[J]. Acta Tabacaria Sinica, 2002(3): 41-44.
[29] MANDAL S, KAR I, MUKHERJEE A K, et al. Elicitor-induced defense responses in Solanum lycopersicum against Ralstonia solanacearum[J]. The Scientific World Journal, 2013: 561056.
[30] WANG H, HU J, LU Y, et al. A quick and efficient hydroponic potato infection method for evaluating potato resistance and Ralstonia solanacearum virulence[J]. Plant Methods. 2019, 15(1): 1-11.
[31] THAKUR K, SAGAR V, SIDDAPPA S, et al. An efficient and quick in-vitro method of evaluation of potato genotypes against Ralstonia solanacearum[J]. Plant Cell Biotechnology and Molecular Biology, 2020, 21(11&12): 46-52.
[32] 李乃堅,黄爱兴,袁四清,等. 茄科作物抗青枯病水培法鉴定研究 II.液体培养青枯菌的致病力[J]. 广东农业科学,2000(3):38-40.
LI N J, HUANG A X, YUAN S Q, et al. Studies on hydroponic identification of resistance to bacterial wilt in Solanaceae crops II. Pathogenicity of liquid culture of Ralstonia solanacearum[J]. Guangdong Agricultural Sciences, 2000 (3): 38-40.
[33] NONOMURA T, MATSUDA Y, TSUDA M, et al. Susceptibility of commercial tomato cultivars to bacterial wilt in hydroponic system[J]. Journal of General Plant Pathology, 2001, 67(3): 224-227.
