根治性膀胱切除术后肠梗阻并发症的危险因素分析
2023-06-28王继鑫宋鸿文王玉杰木拉提热夏提王文光
王继鑫 宋鸿文 王玉杰 木拉提?热夏提 王文光
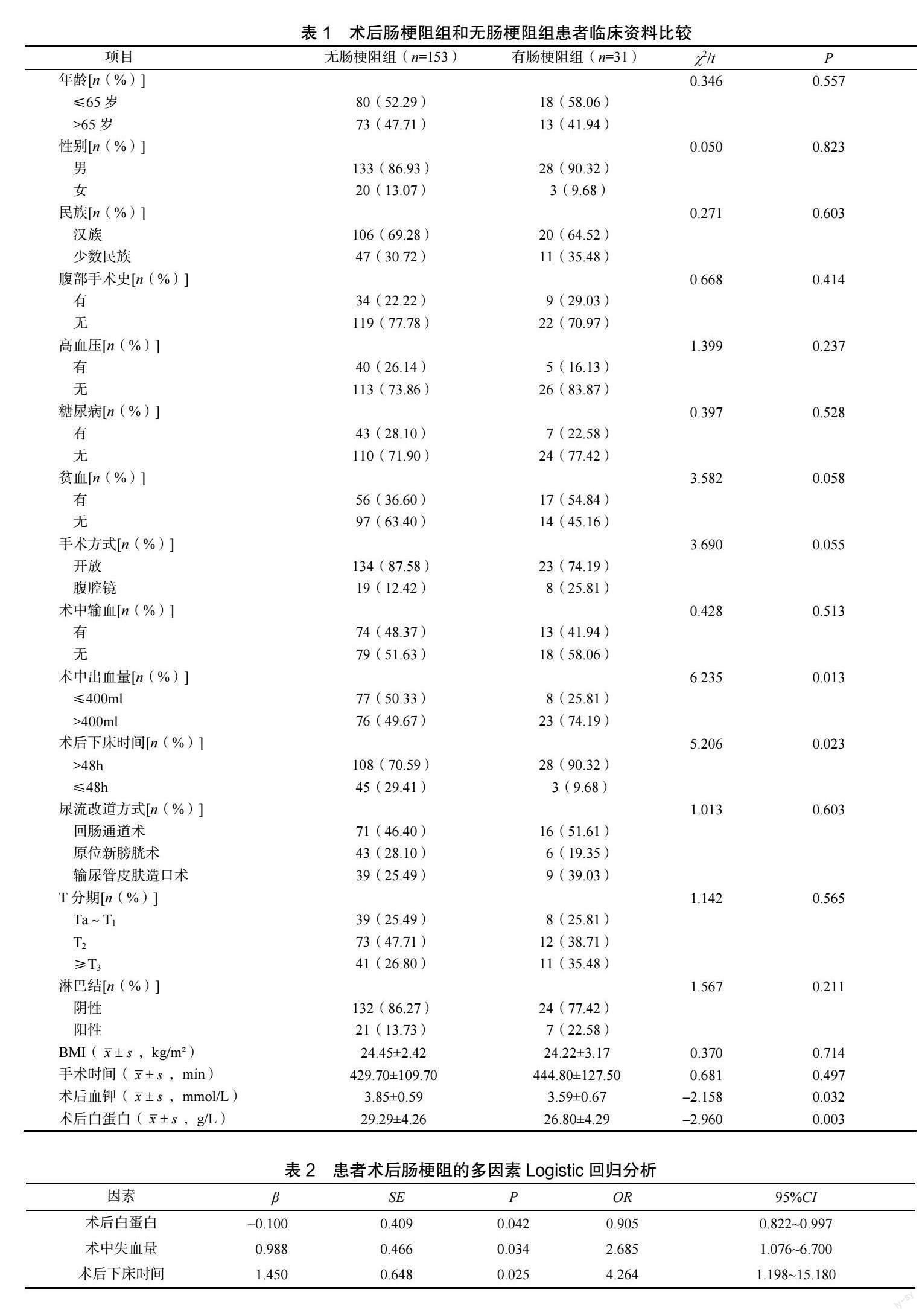
[摘要] 目的 探讨根治性膀胱切除术后发生肠梗阻的相关危险因素。方法 分析2010 年1 月至2021 年8 月因膀胱肿瘤接受根治性膀胱切除术患者184 例,根据是否发生术后肠梗阻分为肠梗阻组(n=153)和无肠梗阻组(n=31),应用单因素和多因素分析两组患者的各项因素。结果 术后肠梗阻组患者的术中出血量更多(≤400mlvs.>400ml,P=0.013),术后血钾(3.85±0.59mmol/Lvs. 3.59±0.67mmol/L,P=0.032)和白蛋白(29.29±4.26g/Lvs. 26.80±4.29g/L,P=0.003)更低及术后下床时间较晚(≤48hvs. >48h,P=0.023)。兩组患者的年龄、体质量指数(body mass index,BMI)、性别、民族、腹部手术史、是否患有高血压、糖尿病,是否贫血,手术方式及尿流改道方法,术中是否输血,手术时间及肿瘤病理分期和盆腔淋巴结是否转移比较,差异无统计学意义(P>0.05)。多因素Logistic 回归分析结果显示:患者术中出血量多(OR=2.685,95%CI:1.076~6.700,P=0.034)、术后白蛋白低(OR=0.905,95%CI:0.822~0.997,P=0.042)、术后下床时间晚(OR=4.264,95%CI:1.198~15.180,P=0.025)是术后肠梗阻发生的危险因素。结论 术中出血量、术后白蛋白及术后下床时间与根治性膀胱切除术后肠梗阻的发生具有相关性,尤其术中出血量>400ml、术后白蛋白低于30g/L 和术后卧床时间>48h 时应高度重视肠梗阻的发生。
[关键词] 膀胱肿瘤;膀胱切除术;肠梗阻
[中图分类号] R737 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.12.013
膀胱癌是常见的恶性肿瘤[1],发病率、死亡率较高。为了提高患者的生存率,避免或减少局部复发及远处转移,根治性膀胱切除术+盆腔淋巴结清扫术是肌层浸润性膀胱癌和高危或极高危非肌层浸润性膀胱癌的标准治疗方法[2]。近年来随着医疗卫生水平的提高,泌尿外科医生及患者越来越注重根治性膀胱切除术后并发症的处理,但据相关文献报道,仍有29.5%~58.0%的患者术后出现不同类型及不同程度的并发症[3]。其中术后肠梗阻是根治性膀胱切除术后常见的早期并发症之一,文献报道其发生率约为2%~39%[4]。术后肠梗阻的发生延长了患者的康复时间及住院时间,给患者带来较大的负担。本研究旨在分析根治性膀胱切除术后发生肠梗阻的相关危险因素,为减少术后肠梗阻并发症的发生提供参考依据。
1 资料与方法
1.1 临床资料
回顾性分析2010 年1 月至2021 年8 月因膀胱肿瘤接受根治性膀胱全切术患者184 例患者,其中男161 例,女23 例,年龄40~83 岁,其中汉族126例,少数民族58 例;体质量指数(body mass index,BMI)19~36kg/m2。43 例既往有腹部手术史。45 例既往患有原发性高血压,21 例有2 型糖尿病,该部分患者术前血压及血糖控制良好,无手术禁忌。27例接受腹腔镜手术,157 例接受开放手术。87 例行回肠通道术,49 例行原位新膀胱术,48 例行输尿管皮肤造口术。手术时间195~720min。术中出血量50~2000ml。87 例患者术中接受输血。患者总住院时间12~91d。73 例患者术后出现并发症,其中31 例出现肠梗阻。术后病理类型:移行细胞癌175 例、鳞癌4 例、腺癌3 例、梭形细胞结节1 例、小细胞恶性肿瘤合并腺癌1 例。所有患者术前病理检查诊断为膀胱肿瘤,胸片、电子计算机断层扫描等影像学检查未显示远处转移,心肺功能及全身情况无绝对手术禁忌。所有患者均签署知情同意书,手术由同一中心经验丰富的泌尿外科医师进行,已通过新疆医科大学第一附属医院伦理学委员会批准(伦理审批号:K202210-02)。
1.2 手术方式
开放性膀胱癌根治术经中下腹壁正中绕脐切口,经腹游离双侧输尿管中下段,常规行盆腔淋巴结清扫和膀胱切除。男性患者同时切除前列腺、部分输精管和精囊;女性患者切除双侧附件、子宫及部分阴道前壁,并缝合封闭阴道断端。腹腔镜膀胱切除采用经腹5 通道法。尿流改道方式:①回肠通道术为将双侧输尿管远端以半乳头法种植于长约15cm 回肠通道近端,回肠通道远端于麦氏点造口;②回肠原位新膀胱术为取长约55cm 回肠袢,保留肠系膜,沿肠系膜对侧缘将肠管剖开,将肠段折叠成“W”形并缝合切缘,重建新膀胱储尿囊。将两侧输尿管远端以半乳头法种植于新膀胱,将新膀胱储尿囊放置于盆腔,缝合新膀胱与尿道断端恢复尿道连续性;③输尿管皮肤造口术为根据输尿管长度于右侧腹壁行单一造口或于双侧腹壁造口。于腹膜外将输尿管牵出腹壁,纵行劈开1~2cm,外翻做乳头,与腹壁固定。
1.3 统计学方法
采用SPSS 26.0 统计学软件对数据进行处理分析,计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验;计量资料用均数±标准差(x s )表示,组间比较采用t 检验,多组间比较采用单因素方差分析,多因素进行Logistic 回归分析,P<0.05为差异有统计学意义。
2 结果
本组患者中31 例出现术后肠梗阻,2 例保守治疗无效,行剖腹探查+肠粘连松解术,术后恢复可,余予以保守治疗,行留置鼻导管胃肠减压,大承气汤灌肠,静脉营养支持,维持电解质平衡等治疗,直至胃肠功能恢复。据患者是否发生术后肠梗阻,将184 例患者分为肠梗阻组和无肠梗阻组,两组患者的年龄、BMI、性别、民族、腹部手术史、是否患有高血压、糖尿病、是否贫血、手术方式及尿流改道方法、术中是否输血、手术时间及肿瘤病理分期和盆腔淋巴结是否转移比较,差异无统计学意义(P>0.05)。应用单因素分析:发现术后肠梗阻患者的术中出血量更多(≤400mlvs. >400ml,P=0.013),术后血钾(3.85±0.59mmol/Lvs. 3.59±0.67mmol/L,P=0.032)和白蛋白(29.29±4.26g/Lvs. 26.80±4.29g/L,P=0.003)更低以及术后下床时间较晚(≤48hvs.>48h,P=0.023)。多因素分析:将差异具有统计学意义的因素进行Logistic 回归分析,结果显示患者术中出血量多(OR=2.685,95CI:1.076~6.700,P=0.034)、术后白蛋白低(OR=0.905,95%CI:0.822~0.997,P=0.042)、术后下床时间晚(OR=4.264,95%CI:1.198~15.180,P=0.025)与术后肠梗阻的发生具有相关性,见表2。
3 讨论
膀胱癌根治性切除术后出现肠梗阻会导致患者恢复时间延长,生理和心理状态受到更大的打击,早期预测肠梗阻的出现并予以积极的干预具有重要意义。本研究184 例患者中31 例出现肠梗阻,发生肠梗阻的患者住院时间明显延长,且需要更多的肠外营养支持及其他促进肠道功能恢复的治疗。根据文献报道可以将术后4d 肠道功能仍未恢复及术后1个月内出现恶心、呕吐,腹痛、腹胀,肛门排气排便停止等症状定义为术后发生肠梗阻[5-6]。目前对术后肠梗阻的发生机制可以总结为以下几点[7-10]:①手术刺激肠道巨噬细胞,促进诱导型一氧化氮合酶的表达,产生大量一氧化氮,抑制肠道平滑肌收缩。②创伤应激导致肠道神经调节和激素分泌平衡失调,致使肠胃动力障碍。③反复翻动肠管导致肠管充血水肿,引起肠道麻痹及蠕动障碍。④阿片类麻醉药物的使用减少肠道蠕动。以上阐述主要为术后麻痹性肠梗阻的发生机制,其他如术中破坏腹盆腔原有的解剖结构使肠管与盆壁粘连的机会增加,以及术后腹腔会出现大量的粘连,进而限制肠道蠕动,造成机械性肠梗阻的发生[4]。通过分析多种膀胱癌根治术后肠梗阻并发症的危险因素,为减少术后肠梗阻的发生提供临床参考,制定个性化治疗方案,规范化预后监测评估水平。
Svatek 等[5]及孟一森等[7]研究认为,年龄和BMI是根治性膀胱切除术后肠梗阻发生的危险因素。但本研究结果显示,年龄和BMI 与术后肠梗阻发生无相关性,说明年龄不是影响肠梗阻发生的因素的原因,可能与地域水土因素及年龄会影响术者对尿流改道方法的选择有关。
本研究患者术后白蛋白水平普遍降低,低蛋白血症发生率达94.8%,肠梗阻组患者术后白蛋白水平较无肠梗阻组更低,说明术后白蛋白越低患者发生术后肠梗阻的风险更大(OR=0.905 , 95%CI:0.822~0.997,P=0.042)。重大手术及创伤应激情况下,使人体对氮类物质摄入吸收减少,分解大量白蛋白供能,全身毛细血管通透性增加,白蛋白大量外渗出血管,从而引起术后白蛋白降低,出现低蛋白血症[11],再者大手术出血加速白蛋白丢失,进一步加重低蛋白血症的程度。低蛋白血症导致患者体内血浆胶体渗透压降低,引起肠管水肿麻痹,蠕动功能减弱,患者发生术后肠梗阻的风险提升;严重的低蛋白血症会使大量液体潴留于组织间隙,引起循环血量减少,加重肠管的缺血缺氧。低蛋白血症可以作为评价疾病严重程度的一个非特异性指标,常预示患者的康复率较低[12]。Williams 等[13]认为,改善术前患者白蛋白水平与术后并发症的减少具有一致性,因此临床工作中应对患者术前进行营养评估并补充营养物质来降低术后低蛋白血症的发生,但是也有研究发现外源性补充白蛋白会加重肝脏代谢负担,增加感染的风险,并认为合并严重低蛋白血症的重症感染患者才有补充的必要[14],所以应谨慎应用人血白蛋白,当血浆白蛋白低于30g/L 时,应高度重视肠梗阻的发生,并积极采取措施控制患者的血浆白蛋白水平。以往文献报道[15-16],手术失血量与术后肠梗阻的发生具有相关性,本研究结果也显示,手术失血量与术后肠梗阻的发生具有相关性(OR=2.685,95%CI:1.076~6.700,P=0.034);当人体失血过多时,全身血流优先供应心脑肾等重要器官,肠道血流量减少,肠道组织出现缺血缺氧、电解质及酸碱平衡紊乱,肠系膜屏障功能下降,肠腔细菌发生移位引起免疫功能受损等一系列的生理变化,由此可能引起术后肠道功能恢复延迟,增加肠梗阻发生的风险。再者缺血、感染等会使纤维蛋白不能快速降解,而形成纤维粘连,可能会增加小肠成角形成粘连性肠梗阻的风险[17]。因此,术中应尽可能地减少出血量,以及当术中出血量超过400ml 时,及时补充红细胞等成分对患者术后肠道功能恢复具有重要意义。以往文献报道[18-19],腹腔镜根治性膀胱切除术及机器人辅助腹腔镜下根治性膀胱切除术与开放性膀胱切除术比较,患者术后并发症发生率更低,可能因为腔镜微创手术出血量更少,术中創伤更小,以及与降低患者的应激反应等因素有关,所以选择微创手术减少术中出血是有必要的。但本中心研究结果手术方式并不是术后肠梗阻发生的危险因素(P=0.055),考虑可能与行腹腔镜手术的病例数量较少有关。
本研究也发现术后下床时间是根治性膀胱切除术后肠梗阻并发症发生的危险因素之一,术后48h后下床活动的患者比术后48h 内下床活动的患者发生术后肠梗阻的风险增大(OR=4.264,95%CI:1.198~15.180,P=0.025)。腹部手术后,通常需要38~96h 左右逐渐恢复肠道功能[20]。患者术后早期下床活动,可因为体位变化促使肠道蠕动,并防止肠粘连,有助于患者的心理恢复。另外,下床活动会促进人体全身血液循环,加快恢复肠道血运,促进肠道功能的恢复。加速康复外科(enhanced recoveryafter surgery,ERAS)作为促进术后康复的多模式方法被普外科领域广泛欢迎,ERAS 的核心理念之是鼓励术后1~2d 下床活动,术后2d 试饮食以促进排便[21]。综上,外科医生应注意一些公认的危险因素,如年龄、BMI、腹部手术史以及整体身体状况不佳等,帮助筛选出高风险患者,纠正围手术期患者白蛋白水平及电解质紊乱,减少术中出血量,运用快速康复理念督促患者早期下床以及可适量采用术后嚼口香糖、喝咖啡等方法促进患者肠道功能恢复,减少肠梗阻的发生。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancerstatistics 2020: GLOBOCAN estimates of incidence andmortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2021, 71(3): 209–249.
[2] STEIN J P, QUEK M L, SKINNER D G. Lymphadenectomyfor invasive bladder cancer: Historical perspective andcontemporary rationale[J]. BJU Int, 2006, 97(2): 227–231.
[3] 杨小明, 易成智, 李帅, 等. 299 例膀胱全切术后早期并发症及危险因素分析[J]. 临床泌尿外科杂志, 2016,31(6): 513–518.
[4] 吕强, 曹强, 杨潇, 等. 完全盆底腹膜化技术在腹腔镜下根治性全膀胱切除术中的应用(附光盘)[J]. 现代泌尿外科杂志, 2019, 24(6): 421–424.
[5] SVATEK R S, FISHER M B, WILLIAMS M B, et al.Age and body mass index are independent risk factorsfor the development of postoperative paralytic ileusafter radical cystectomy[J]. Urology, 2010, 76(6):1419–1424.
[6] 刘陈黎, 周艳, 廖锦先, 等. 膀胱癌根治术后肠梗阻危险因素分析[J]. 国际泌尿系统杂志, 2019, (3): 468–471.
[7] 孟一森, 苏杨, 范宇, 等. 根治性膀胱全切术后肠梗阻的危险因素分析(附740 例报道)[J]. 北京大学学报(医学版), 2015, 47(4): 628–633.
[8] 王李, 高羽, 童卫东, 等. 诱导型一氧化氮合酶与Cajal 间质细胞在术后肠梗阻大鼠小肠中的表达及意义[J]. 中华消化外科杂志, 2012, (4): 382–385.
[9] VENARA A, NEUNLIST M, SLIM K, et al. Postoperativeileus: Pathophysiology, incidence, and prevention[J]. JVisc Surg, 2016, 153(6): 439–446.
[10] 阚会丽, 张宗旺. 术后肠梗阻的机制与防治新进展[J].现代医学与健康研究电子杂志, 2020, 4(11): 112–115.
[11] 罗辉遇, 谢长江, 刘卫江, 等. 大手术重症患者血清白蛋白水平的变化及临床意义[J]. 实用医学杂志,2006, (12): 1400–1401.
[12] GATTA A, VERARDO A, BOLOGNESI M.Hypoalbuminemia[J]. Intern Emerg Med, 2012, 3:S193–S199.
[13] WILLIAMS J D, WISCHMEYER P E. Assessment ofperioperative nutrition practices and attitudes-a nationalsurvey of colorectal and GI surgical oncology programs[J].Am J Surg, 2017, 213(6): 1010–1018.
[14] 周國超, 杨大刚. 低蛋白血症的研究进展[J]. 贵州医药, 2015, 39(3): 279–281.
[15] 夏照明, 土应果, 郭民, 等. 根治性膀胱切除术后30d内并发症的发生情况及危险因素分析[J]. 临床泌尿外科杂志, 2021, 36(9): 709–712.
[16] CHANG S S, COOKSON M S, BAUMGARTNER R G,et al. Analysis of early complications after radical cystectomy:Results of a collaborative care pathway[J]. J Urol, 2002,167(5): 2012–2016.
[17] 高金龙, 王晓雄, 洪宝发. 尿流改道早期术后小肠梗阻的多因素分析[J]. 中国医学工程, 2006, 14(4): 371–373.
[18] 魏军, 刘飞, 刘珏, 等. 腹腔镜与开放性根治性膀胱切除术治疗老年膀胱癌患者的疗效比较[J]. 西南军医,2018, 20(2): 174–177.
[19] ZENNAMI K, SUMITOMO M, TAKAHARA K, et al.Intra-corporeal robot-assisted versus open radicalcystectomy: A propensity score-matched analysiscomparing perioperative and long-term survivaloutcomes and recurrence patterns[J]. Int J Clin Oncol,2021, 26(8): 1514–1523.
[20] 方荣臻, 林少露. 腹部手术后应用大承气汤保留灌肠联合针刺对患者胃肠功能恢复的影响[J]. 当代医学,2021, 27(11): 74–76.
[21] XUE X, WANG D, JI Z, et al. Risk factors of postoperativeileus following laparoscopic radical cystectomy anddeveloping a points-based risk assessment scale[J].Transl Androl Urol, 2021, 10(6): 2397–2409.
(收稿日期:2022–09–15)
(修回日期:2023–01–15)
