核桃过敏原成分PCR 方法的建立
2023-06-21吴玉双黄淑迪
吴玉双,杨 倩,黄淑迪,陈 艳,姬 华
(1. 石河子大学食品学院,新疆石河子 832000;2. 国家食品安全风险评估中心中国医学科学院创新单位(2019RU014 号),北京 100021)
在过去的20 年里,过敏反应和过敏反应的发生率在不同的国家都有所增加。在全世界范围内,有高达6%的儿童和2%的成年人是过敏患者,并且这个数据呈现出明显的上升趋势[1-3]。近年来,食品过敏成为影响食品安全的重要影响因素之一[4-6]。过敏患者通常是无法治愈的,对过敏患者的唯一“治疗”是从饮食中完全去除引发过敏的成分,因此过敏患者十分依赖加工食品的成分标签。所以,为了尽可能地避免过敏患者因误食而导致的过敏反应,我国与其他各国均采用将食品成分进行标示的方法[7]。核桃和其他坚果是最常引起严重过敏反应的食物,人们通常认为食用核桃是一种健康的饮食习惯,但是对核桃的过敏会导致严重危害甚至死亡。全球约有4.9%的人对核桃过敏[8],15%的儿童是核桃过敏体质[9]。核桃过敏会引发机体产生一系列的过敏症状并对皮肤、呼吸道、消化道等造成伤害[10],过敏反应不仅影响患者的身体健康,而且降低了他们的生活质量。然而,核桃在食品加工过程中被广泛使用,患者想要完全避免误食核桃过敏原是极其困难的,超过80%的受访者认为应强调成分列表中的可能过敏原,并描述过敏原含量[11]。由此可见,与之相关的核桃过敏原的检测方法是具有重大意义的,核桃过敏原的检测主要有酶联免疫吸附法(ELISA) 及聚合酶链反应(PCR) 2 种方法。Yano T 等人[12]利用传统PCR 的方法检测核桃过敏原,发现mat K 基因是是其基因组中特异性最强的基因。Linacero R 等人[13]在过敏原编码序列上设计新型引物,利用荧光定量PCR 方法检测食品中的核桃过敏原,检测限为2.5 pg 核桃DNA,与ELISA 分析比较,该方法在核桃的痕量检测中显示出更高的灵敏度和可靠性。PCR 法在复杂食品中过敏原的定量分析及物种鉴定方面,具有其他方法无法比拟的优点,这使PCR 方法在动植物源性食物过敏原检测方面,存在极大的优势,适合国际法规所要求的食品中痕量过敏原的检测原则[14]。
在所有核桃过敏原中研究最多的是英国核桃中的Juglans Jug r 1,一种2 S 白蛋白种子储存蛋白,是引起过敏反应最主要的一种过敏原,可溶于水和低浓度盐溶液[14]。Jug r 1 还是一种前体蛋白,可在生化反应中分裂为一个大亚基和一个小亚基S。通过对核桃DNA 的扩增,根据Jug r 1 设计出的3 对新型引物,旨在建立灵敏度高、特异性强的核桃PCR 检测方法。
1 材料与方法
1.1 材料
1.1.1 食品材料
黄豆、青豆、蚕豆、绿豆、红豆、巴旦木、榛子、夏威夷果、扁杏仁、开心果、葵花籽、碧根果、腰果、核桃、松子、鹰嘴豆、黑豆、花生,均购自石河子农贸市场。
1.1.2 设备
均质机;DNA 提取盒;分析天平,上海民桥精密科学仪器有限公司产品;数显恒温水浴锅;漩涡振荡器;凝胶成像系统,美国Bio-Rad 公司产品;小型台式高速离心机;PCR 仪,Techne 公司产品;电泳仪,北京市六一仪器厂产品;微量核酸定量仪。
1.1.3 试剂
巯基乙醇、氯仿、500 bp ladder DNA marker,光明试剂厂提供;天根植物基因组DNA 提取试剂盒,天根公司提供;高盐甘露醇琼脂,青岛高科技工业园海博生物技术有限公司提供;2×premix Taq,北京博大恒泰生物技术有限公司提供;琼脂糖,北京索莱宝科技有限公司提供;50 mmol/L 乙二胺四乙酸二钠盐EDTA;100 mmol/L Tris-HCl。
1.2 方法
1.2.1 DNA 提取
提取样品DNA 需使用天根公司生产的天根植物DNA 提取盒,依据以下步骤依次操作:试验最开始先将27 μL 无水乙醇与13 μL 缓冲液GD 混合,60 μL无水乙醇与15 μL 漂洗液PW 混合,将二者混合均匀。将混合好的缓冲液GP1 65 ℃水浴加热,加热完毕,再加入0.1%的巯基乙醇,后取700 μL 的混合溶液于离心管中,继续水浴加热。取核桃仁100 mg,在液氮的降温下充分地碾磨,将研磨好的核桃粉末样品马上转移到装有缓冲液GP1 的离心管中,并迅速上下颠倒振荡混匀后,再于65 ℃下水浴,时间为20 min,加热过程中需要多次颠倒振荡离心管,使之充分混匀。混匀后再加入700 μL 氯仿,充分混匀,离心(转速12 000 r/min,时间10 min),将离心所得上清液收集到离心管中,再加入700 μL 缓冲液GP2,振荡混匀。混匀后移到收集管的吸附柱CB3 中,离心(转速12 000 r/min,时间30 s),离心结束后倒掉废液。向吸附柱CB3 中加入500 μL 缓冲液GD,离心(转速12 000 r/min,时间30 s),倒掉吸附管的液体,再将吸附柱CB3 放入无菌收集管中。向吸附柱CB3 中加入600 μL 漂洗液PW,离心(转速12 000 r/min,时间30 s),倒掉吸附管的液体,将吸附柱CB3 重新放入无菌收集管中,重复以上步骤2 次。将吸附柱CB3 置于室温下放置数分钟,丢掉收集管,以彻底晾干吸附材料中残余的漂洗液。将吸附柱CB3 放入无菌离心管中,向吸附膜的中间部位滴加100 μL 洗脱缓冲液TE,尽量使洗脱液全部滴在吸附膜上,室温下放置5 min,离心(转速12 000 r/min,时间2 min),离心后将上清液收集到离心管中。为提高DNA 的收集率,将收集到的液体重新移入到上述吸附柱CB3 中,吸附柱套入新的离心管中,离心(转速12 000 r/min,时间2 min),离心后将上清液收集到离心管中[15]。用同样的方法提取红豆、黄豆、蚕豆、青豆、榛子、花生、绿豆、巴旦木、夏威夷果、扁杏仁、开心果、葵花籽、鹰嘴豆、碧根果、腰果、松子、黑豆的DNA。由于红豆、黄豆、绿豆、黑豆质地较硬,提取前用无菌水浸泡1 h,便于研磨。
1.2.2 引物的设计
阳性参考:根据不同物种具有各自特异的基因,从Genbank 数据库下载核桃的Jug r 1 的基因,利用Primer Premier 6 软件设计出3 组引物,设计并利用NCBI 网站初步监测引物的特异性。查找文献,利用2 对引物WAL-F/R(GATCTATATTGTTGGAAAATGTAGC/GGTTAGAATCATTAGTGGAAATCAG)[16],Jur Primer-F/R(TTCAACGTGACCATCTCCCC/ACACGAGGATGTGCTTGCTA)[17]做阳性参考。
引物的设计:设计出3 对引物,Jur 1 Primer-F/R(CTGGAAGATAACTGGTGACTA/ATTAGCAAGACGAGGCATT) 158 bp;Jur 2 Primer-F/R(GACAACCAGCGGCAGCATT/GCACCATCTCCTCCATTTCCTC)145 bp;Jur 3 Primer-F/R(GGGTGAGGAAATGGAGGAGAT/GGATGTGC TTGCTAGTTGCTA) 199 bp。
1.2.3 各引物PCR 扩增条件优化
以核桃DNA 为模板,以1.5%的琼脂糖凝胶进行电泳,以确定3 对引物的各自最佳退火温度。
1.2.4 各引物PCR 反应体系优化
WAL:Taq DNA 聚合酶12.5 μL、上下游引物各0.5 μL、DNA 模板1 μL,添加灭菌蒸馏水10.5 μL;Jur Primer:Taq DNA 聚合酶22 μL、上下游引物各1 μL、DNA 模板2 μL,添加灭菌蒸馏水74 μL;Jur 1 Primer:Taq DNA 聚合酶25 μL、上下游引物各1 μL、DNA 模板2 μL,添加灭菌蒸馏水20 μL;Jur 2 Primer:Taq DNA 聚合酶23 μL、上下游引物各1 μL、DNA 模板2 μL,添加灭菌蒸馏水20 μL;Jur 3 Primer:Taq DNA 聚合酶23 μL、上下游引物各1 μL、DNA 模板2 μL,添加灭菌蒸馏水20 μL。
PCR 扩增的反应条件见表1[18]。
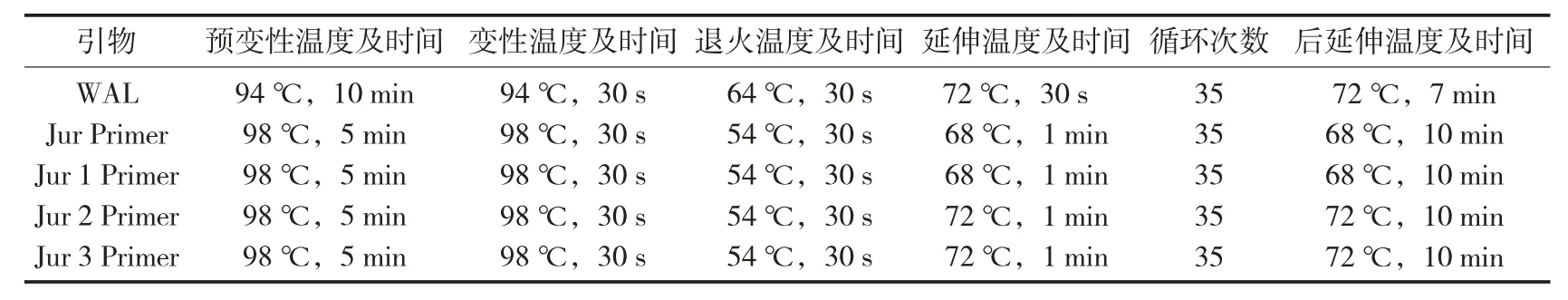
表1 PCR 扩增的反应条件
1.2.5 特异性试验
用市面上常见的干果豆类:黄豆、青豆、蚕豆、绿豆、红豆、巴旦木、榛子、夏威夷果、扁杏仁、开心果、葵花籽、碧根果、腰果、核桃、松子、鹰嘴豆、黑豆、花生检测引物的特异性。
1.2.6 灵敏度试验
分别取10 g 的核桃、花生加入不同研钵,快速研磨成粉末状。制出含有0.01%,0.10%核桃成分的花生粉样品[15]。将稀释后的样品的DNA 进行PCR 扩增,并进行电泳。
2 结果与分析
2.1 样品DNA 提取效率
为避免利用天根植物DNA 提取盒提取的DNA出现假阴性,需经过检测以确定是否适合后续的PCR 检测。
样品DNA 的提取效率见表2。
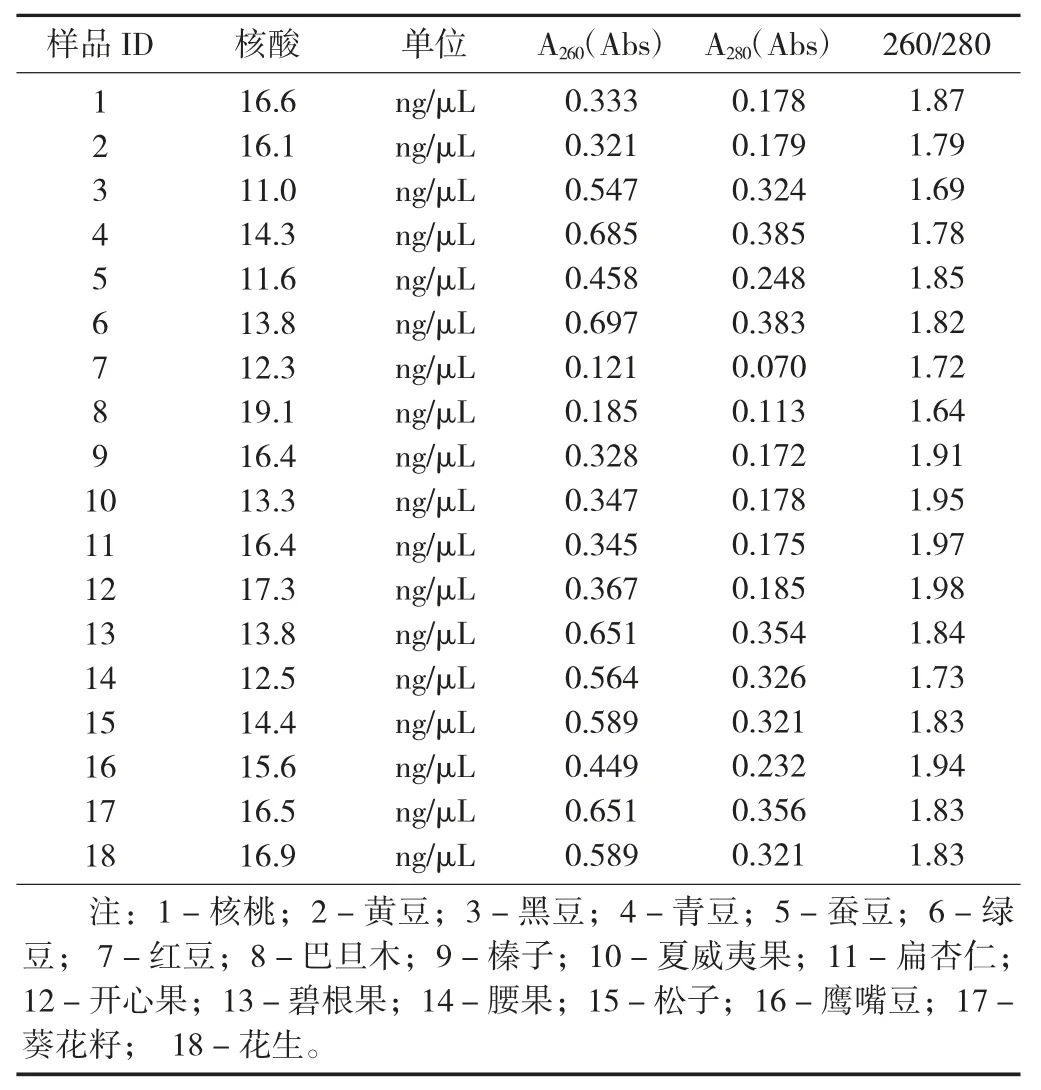
表2 样品DNA 的提取效率
2.2 各引物PCR 扩增条件的确定
WAL 引物的最佳退火温度为64 ℃,Jur 引物的最佳退火温度为54 ℃,引物Jur 1 Primer,Jur 2 Primer,Jur 3 Primer 的最佳退火温度需要设置温度梯度确定[19]。
Jur 1 Primer 引物PCR 退火温度的确认见图1,Jur 2 Primer 引物PCR 退火温度的确认见图2,Jur 3 Primer 引物PCR 退火温度的确认见图3。
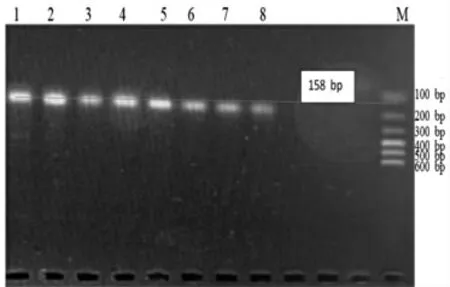
图1 Jur 1 Primer 引物PCR 退火温度的确认
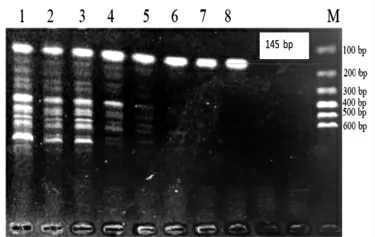
图2 Jur 2 Primer 引物PCR 退火温度的确认
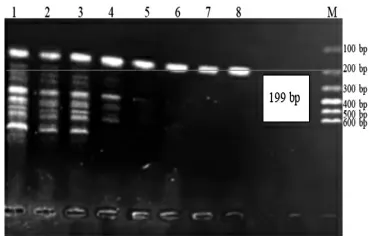
图3 Jur 3 Primer 引物PCR 退火温度的确认
由图1 ~图3 可知,最佳退火温度为:Jur 1 引物50.7 ℃,Jur 2 引物(64.0 ℃;Jur 3 引物64.0 ℃。
Jur 1 引物的Tm值为50 ℃,设置退火温度50~60 ℃,8 个梯度分别为A:60.0 ℃,B:59.2 ℃,C:58.0 ℃,D:56.1 ℃,E:53.8 ℃,F:51.9 ℃,G:50.7 ℃,H:50.0 ℃,如图1 所示。在图1 中,Jur 1 引物在50.7 ℃时,扩增出158 bp 大小的片段,且条带清晰没有拖带,故Jur 1 引物的最佳退火温度为50.7 ℃。
Jur 2 和Jur 3 引物的Tm值均为55 ℃,故均设置退火温度50~64 ℃,形成8 个梯度,分别为A:64.0 ℃,B:62.9 ℃,C:61.2 ℃,D:58.5 ℃,E:55.3 ℃,F:52.7 ℃,G:51.0 ℃,H:50.0 ℃,如图2 和图3 所示。在图2 中,Jur 2 引物在64.0 ℃时,扩增出145 bp大小的片段,且条带清晰没有拖带,故Jur 2 引物的最佳退火温度为64.0 ℃。在图3 中,Jur 3 引物在64.0 ℃时,扩增出199 bp 大小的条带,且条带清晰没有拖带,故Jur 3 引物的最佳退火温度为64.0 ℃。
2.3 引物的特异性检测
Jur 1 Primer 引物对常见富含蛋白质植物DNA 扩增的结果见图4,Jur 2 Primer 引物对常见富含蛋白质植物DNA 扩增的结果见图5,Jur 3 Primer 引物对常见富含蛋白质植物DNA 扩增的结果见图6。
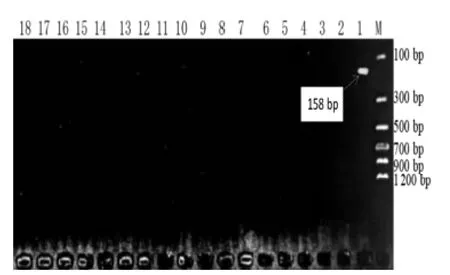
图4 Jur 1 Primer 引物对常见富含蛋白质植物DNA 扩增的结果

图5 Jur 2 Primer 引物对常见富含蛋白质植物DNA 扩增的结果

图6 Jur 3 Primer 引物对常见富含蛋白质植物DNA 扩增的结果
由图4 ~图6 可知,3 对引物的特异性良好。在图4 中,Jur 1 引物只扩增出158 bp 大小的核桃DNA片段;同样的,在图5 和图6 中,Jur 2 引物和Jur 3引物也分别只扩增出145 bp 和199 bp 大小的核桃DNA 片段。结果表明,对引物是核桃基因组DNA 的特异性引物,且特异性良好。
2.4 PCR 灵敏度的检测
Jur 1 Primer 引物灵敏度检测结果见图7,Jur 2 Primer 引物灵敏度检测结果见图8,Jur 3 Primer 引物灵敏度检测结果见图9。
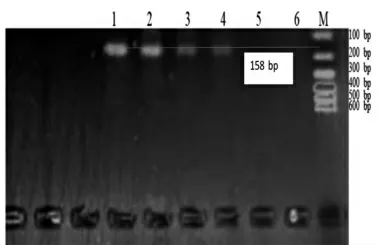
图7 Jur 1 Primer 引物灵敏度检测结果
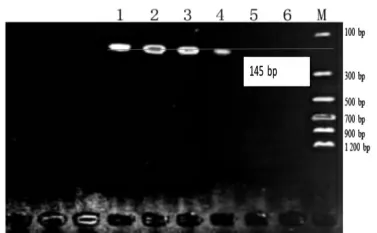
图8 Jur 2 Primer 引物灵敏度检测结果
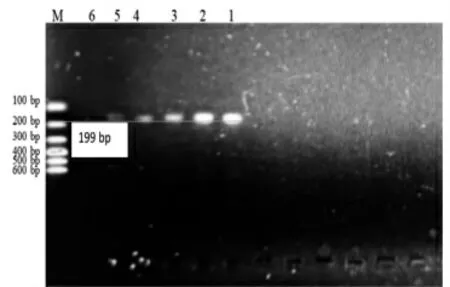
图9 Jur 3 Primer 引物灵敏度检测结果
在图7 中,Jur 1 引物只在100%核桃基因组、10%核桃+ 90%花生基因组以及0.1%核桃+ 99.9%花生基因组中扩增出158 bp 大小的DNA 片段,故Jur 1引物的核桃检测最低限为0.1%;同样的,在图8 中,Jur 2 引物只在100%核桃基因组、10%核桃+ 90%花生基因组以及0.1%核桃+ 99.9%花生基因组中扩增出145 bp 大小的DNA 片段,故Jur 2 引物的核桃检测最低限为0.1%;而在图9 中,Jur 3 引物在0.01%核桃+ 99.99%花生基因组中扩增出199 bp 大小的DNA 片段,故Jur 3 引物的核桃检测最低限为0.03%。3 对引物相比而言,Jur 3 的灵敏度更高,适合于精密检测。
3 结论
核桃过敏原的检测主要有ELISA、普通PCR 和荧光PCR 等3 种方法,但是与其他2 种方法相比,普通PCR 方法所用的仪器简单、操作方便、成本低,能够满足一般实验室的要求,除此之外还有结果准确、灵敏度高等优点。试验采用普通PCR 法,将核桃DNA 浓度进行梯度稀释,利用设计的3 对引物进行灵敏度试验,结果表明该方法灵敏度高,3 对引物的最低检测限可达0.01%(质量分数);试验选择18 种常见的干果豆类,利用设计的3 对引物进行特异性试验,结果表明设计的3 对引物特异性强;最后,试验所设计的引物来源于核桃的特有过敏原基因Jur 1,可提高试验的准确度,有效避免试验的假阳性。以上数据均表明该试验建立的PCR 方法适用于食品中核桃成分的分析。
PCR 检测过程中,影响PCR 检测效果的因素有很多,其中DNA 的提取效率也是影响PCR 扩增效果的重要因素之一。此外,核桃中含有蛋白质、单宁、多糖、酚类及色素等次生代谢物质会影响Taq DNA聚合酶的活性,进而影响PCR 扩增的效果。以前曾用的多种核酸提取方法提取核桃的DNA,如SDS法、高盐低PH 法、CTAB 法和简易CTAB 法等,然而还是不能有效除去干扰物质,导致影响试验结果的准确性。为了保证试验的准确性和可靠性,采用试剂盒法提取核桃额DNA,避免的上述缺陷。但是试验所使用的PCR,又需要花费大量的时间,因此还需去探索更快速、灵敏、准确的方法,如荧光定量PCR、质谱法和表面等离子共振生物生物传感器等[19-20]。
