嗜水气单胞菌外膜蛋白AHA2991的原核表达、纯化与免疫原性研究
2023-06-10简思杰陈春琳
简思杰,晁 嘉,孙 薇,陈春琳,陆 娟,刘 勇,刘 祥
(1. 阜阳师范大学生物与食品工程学院, 安徽 阜阳 236037;2. 陕西理工大学生物科学与工程学院/中德天然产物研究所,陕西 汉中 723001)
【研究意义】嗜水气单胞菌(Aeromonashydrophila)属于气单胞菌属(Aeromonas),是革兰氏阴性菌,广泛分布于水生环境,是鱼类细菌性败血症的主要病原菌。其可危害鲢鱼(Hypophthalmichthysmolitrix)、鲫鱼(Cruciancrap)、鲤鱼(Cyprinuscarpio)、草鱼(Ctenopharyngodonidellus)等经济型淡水鱼类[1]。嗜水气单胞菌毒力强、病程短、致死率高,感染后主要表现为腹腔水肿、溃疡和局部感染等[2]。这不仅造成水产养殖户巨额损失,且阻碍了我国水产行业的发展。目前该病原菌防治主要以抗生素治疗为主,但抗生素滥用易导致细菌耐药性、环境污染等问题[3];饲料中维生素与中草药的添加虽会提高鱼类抗菌力,但防治效果不明显;益生素的使用能够提高一部分鱼类的自身免疫力,但适用范围并不广泛[4]。而主动疫苗作为一种有效且环保的防治方法,目前已获得人们的广泛关注。【前人研究进展】外膜是革兰氏阴性菌的独有膜系统[5],而外膜蛋白(Outer membrane protein, OMP)在革兰氏阴性菌外膜系统中发挥着重要的生物学功能,其暴露的抗原决定簇也可使外膜蛋白极易被免疫系统识别,从而激发机体的特异性免疫[6]。目前,已有大量外膜蛋白使机体产生免疫保护作用的研究,例如Zhang等[7]对嗜水气单胞菌外膜蛋白OmpF与OmpK进行了免疫学分析,通过对欧洲鳗鲡(Anguillaanguilla)进行免疫及攻毒,结果表明OmpF与OmpK对欧洲鳗鲡的保护率分别为35.5%、70.0%;荣娜等[8]构建嗜水气单胞菌外膜蛋白P5大肠杆菌表达菌株,发现攻毒后外膜蛋白P5对红鲫的保护率为69%。【本研究切入点】嗜水气单胞菌外膜蛋白AHA2991为外排蛋白,可从细胞内排出抗生素等毒性因子,是导致细菌耐药性的重要外膜蛋白[9]。但目前关于嗜水气单胞菌外膜蛋白AHA2991的免疫原性研究未见报道。【拟解决的关键问题】本研究选取嗜水气单胞菌外膜蛋白AHA2991进行原核表达并确定最佳诱导条件,Western blotting检测AHA2991红鲫血清的特异性与效价,ELISA模拟红鲫血浆与嗜水气单胞菌的体外相互识别作用,酸性、碱性磷酸酶测定与细胞吞噬作用评价非特异性免疫,组织病理学切片探究免疫AHA2991对红鲫内脏的影响,为嗜水气单胞菌疫苗的研发奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株及供试动物 嗜水气单胞菌 ATCC ATCC 7966、EscherichiacoliDH5a、BL21菌株及pET-32a质粒由陕西理工大学中德天然产物研究所保存;红鲫购买自汉中市水族馆。
1.1.2 主要试剂rTaq聚合酶、EXTaq聚合酶、T4-DNA连接酶、内切酶BamH Ι及XhoⅠ购自日本TaKaRa 公司;细菌基因组提试剂盒取购自北京天根试剂公司,质粒提取试剂盒、胶回收试剂盒购自杭州博日公司;四甲基联苯胺(Tetramethylbenzidine, TMB)显色液为上海生工公司产品;辣根过氧化物酶(Horseradish peroxidase, HRP)标记山羊抗大鼠免疫球蛋白G(Immunoglobulin G, IgG)购于Sigma公司;碱性磷酸酶(Alkaline phosphatase, AKP)、酸性磷酸酶(Acid phosphatase, ACP)试剂盒购自南京建成生物工程研究所;弗氏完全佐剂、不完全佐剂购自MP生物医疗公司;引物合成、基因测序由西安奥科生物公司提供;大鼠抗鱼血清为实验室自制。
1.2 试验方法
1.2.1 生物信息学分析 从NCBI数据库中下载不同菌株与AHA2991相同家族的氨基酸序列,GeneDoc软件生成序列对比图,MEGA软件绘制系统发育树。
1.2.2 重组质粒pET-32a-AHA2991的构建 NCBI数据库中查找嗜水气单胞菌 ATCC7966 全基因组,根据全基因组设计AHA2991的扩增引物:SensePrimer: AGAGGATCCATGACGATGTACCACTTA,Anti-sense Primer: ACACTCGAGTCAGCTGCGATCGCT CC(划线部分为酶切位点);扩增模板为嗜水气单胞菌全基因组;利用Taq聚合酶扩增,体系为50 μL。预变性温度、退火温度与退火时间分别为94 ℃、55 ℃、90 s;对PCR产物进行电泳鉴定并切胶回收;使用BamH Ι 与XhoⅠ对PCR产物与pET-32a质粒进行双酶切;通过T4-DNA 连接酶将目的片段与载体在16 ℃下连接16~18 h。将连接后的产物转化入E.coliDH5α中,转化成功后可提取构建好的重组质粒。利用双酶切与基因测序鉴定,最后将重组质粒转化入E.coliBL21中,进行相应蛋白的原核表达。
1.2.3 重组蛋白的表达与纯化 挑取单菌落培养8~12 h,1∶100转接至含氨苄青霉素的培养基中培养3~4 h,0.1 mol/L 异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside, IPTG)诱导8 h。取1 mL菌液并离心收菌,加入300 μL 2×SDS上样缓冲液后沸水浴2 min,SDS-PAGE电泳检测目的蛋白的表达。重组蛋白的纯化具体步骤如下:以1∶100的比例将过夜培养的表达菌液转接至600 mL LB培养液(Amp+)中;培养至OD600=0.5时,加入600 μL 0.1 mol/L IPTG,诱导8 h;4000 r/min离心10 min,收集诱导菌体,进行超声破碎,超声结束后 8000 r/min离心10 min,收集包涵体;将包涵体反复洗涤后进行SDS-PAGE电泳;将目标条带切下研磨至无凝胶碎片,用蛋白浸提液重悬,室温轻摇2 h;4 ℃、8000 r/min离心20 min,收集上清,加入4倍体积预冷丙酮,-20 ℃过夜沉淀;将沉淀后的蛋白离心,收集沉淀用无菌水溶解,测量浓度并冻干。
1.2.4 重组蛋白表达条件的优化 以L9(34)正交实验模型(表1)确定目的蛋白的最佳表达条件。步骤简要如下:将过夜培养的蛋白表达菌液以1∶200的比例接入600 mL培养液中,培养至设定的OD600值;按照表中要求加入不同浓度的IPTG,每组进行3次重复。取1 mL诱导菌液,离心收菌后菌体加入300 μL 2×SDS蛋白上样缓冲液,沸水浴2 min,SDS-PAGE电泳获得不同诱导条件下的AHA2991蛋白表达图谱。通过软件Phoretix 1D和SPSS对表达图谱进行分析。
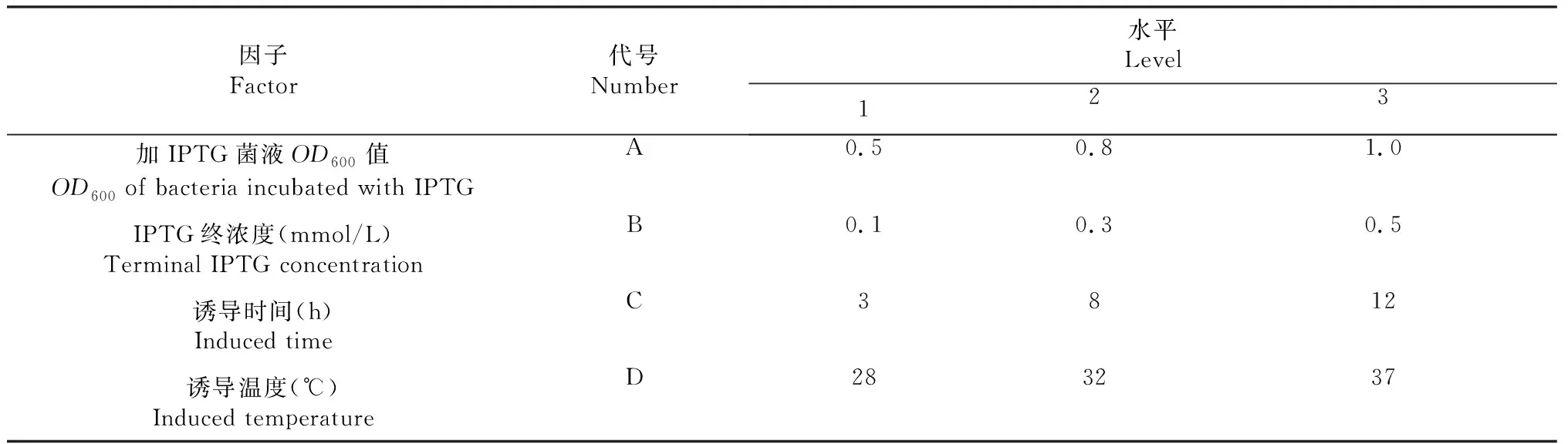
表1 蛋白表达条件正交试验的因子与水平Table 1 Factors and levels of orthogonal test for protein expression condition
1.2.5 AHA2991红鲫多克隆抗体制备 红鲫饲养时,每天换水1/3,2 d喂食1次。经过7 d适应性饲养,体表健康无损伤。实验组和对照组各15尾,采用腹腔注射法进行免疫,实验组注射外膜蛋白AHA2991,对照组注射生理盐水。免疫程序如下:纯化的重组外膜蛋白以鱼体重2 μg/g的剂量与等体积弗氏不完全佐剂充分乳化进行首次免疫,每尾50 μL。14 d后,采用相同的蛋白量进行免疫,加强免疫红鲫。7 d后,红鲫经尾静脉取血,血液于4 ℃静置待血清自然析出,4 ℃、3000 r/min离心10 min,收集抗血清于-80 ℃保存备用。
1.2.6 蛋白免疫后红鲫血清抗体的特异性检测 采用Western blotting夹心法验证红鲫抗血清特异性,步骤简述如下:嗜水气单胞菌全蛋白进行SDS-PAGE电泳;将所获得的蛋白条带转于硝酸纤维素(Nitrocellulose, NC)膜上,转膜条件为:80 V,1 h;转膜结束后,将NC膜置于脱脂牛奶中4 ℃过夜封闭;将封闭结束的NC膜与不同稀释倍数(1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200)的红鲫抗血清于37 ℃孵育40 min,TBST溶液洗涤3次,每次10 min;再与大鼠抗红鲫血清(1∶400)孵育,具体步骤同上;最后与山羊抗大鼠抗体(1∶3000)孵育,洗涤后DAB显色确定红鲫抗血清的特异性。
1.2.7 酸性、碱性磷酸酶免疫指标的测定 本试验采用南京建成生物工程研究所试剂盒进行测定,严格按说明书步骤进行。
1.2.8 体外细胞吞噬实验 取免疫AHA2991后红鲫血浆200 μL与1%甲醛生理盐水灭活的金黄色葡萄球菌(6×108CFU)均等混合,25 ℃水浴60 min(每10 min振荡混匀1次);反应结束后制作血涂片,用快速姬姆萨染色试剂盒(上海生工)进行染色,在显微镜(油镜)下对吞噬细胞进行计数。
1.2.9 体外模拟鱼血浆与嗜水气单胞菌的相互识别作用 ELISA[10]检测鱼血浆与嗜水气单胞菌的相互作用。具体步骤简述如下:嗜水气单胞菌培养至OD600约1.0后将菌体离心并洗涤;菌体OD600调整至1.0(菌浓度109cfu/mL),分装菌体每管150 μL,与不同稀释倍数的血浆(1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200)37 ℃条件下孵育90 min,对照为阴性血浆。再与1∶400的大鼠抗鱼血清孵育90 min;最后与1∶300山羊抗大鼠抗体孵育1 h。将洗涤好的菌体与20 μL PBS混合后加入酶标板,加入200 μL的TMB显色液;50 μL 2 mol/L H2SO4终止反应,450 nm读数。
1.2.10 病理切片观察AHA2991蛋白免疫对红鲫内脏的影响 取肾、脾、肠为病理学组织切片材料。病理切片主要有3个步骤,即组织包埋、组织切片和H&E染色。①组织包埋:将组织立即浸泡在改良的Davidson’s[11]固定液中,固定18~24 h后转入10%甲醛溶液中继续固定24 h;将固定好的组织于梯度浓度(80%、90%、95%、100%)的乙醇中脱水,再放入二甲苯中透明;将透明好的组织于60 ℃的石蜡中充分浸蜡,再包埋于折叠好的模具中。②切片:将包埋好的组织修正成约1 cm2的立方体,石蜡切片机切成厚度为4 μm的切片,附着于载玻片上,烘干。③H&E染色:使用苏木素与伊红进行染色。烘干的切片放入二甲苯中脱蜡、乙醇中复水;苏木素染色30 s,使细胞核上色,伊红染色20 min,使细胞质着色。于梯度浓度的乙醇中脱水,在二甲苯中透明,最后用中性树脂封片即可。
1.3 数据处理
实验结果以平均值 ± 标准差表示,以Microsoft Office Excel 2019进行数据计算,采用SPSS Statistics 26软件进行单因素方差分析,用GraphPad Prism 8.0.1软件绘图。
2 结果与分析
2.1 AHA2991同源性与系统发育分析
研究结果表明,AHA2991蛋白家族在不同菌株间具有同源性(图1),以MEGA软件构建的进化树显示,嗜水气单胞菌与达氏气单胞菌(Aeromonasdhakensis)亲缘关系接近,且不同种菌株间也有一定的亲缘关系(图2)。因而,AHA2991免疫动物产生的抗体可能对不同种属的细菌感染有交叉免疫保护作用。

图1 氨基酸序列比对Fig.1 Sequence alignment of amino acid

图2 系统发育树Fig.2 Phylogenetic tree
2.2 重组质粒的构建及蛋白表达纯化
PCR扩增AHA2991基因如图3-A所示,在1500 bp左右处呈现单一且清晰的条带,与理论值相同;重组质粒pET-32a-AHA2991经过BamH Ι与XhoΙ双酶切鉴定,在1374 bp处得到一条带,与理论值相同,表明重组质粒构建成功(图3-B)。重组质粒经E.coliBL21转化、诱导并纯化后,可得一条约50 kDa的条带(图3-C)。

A. PCR扩增AHA2991基因; B. 重组质粒pET-32a-AHA2991的双酶切; C. AHA2991蛋白的表达纯化; M1. DNA Marker; M2. 蛋白Marker; 1. AHA2991基因; 2. 重组质粒pET-32a-AHA2991; 3. BamH Ι和Xoh Ι 双酶切; 4. 未诱导菌株; 5. 诱导菌株; 6. 纯化的AHA2991蛋白。A. Amplification of AHA2991 gene by PCR; B. Double digestion of recombinant plasmid pET-32a-AHA2991; C. Expression and purification of AHA2991; M1. DNA Marker; M2. Protein marker; 1. AHA2991 gene; 2. Recombinant plasmid pET-32a-AHA2991; 3. Double digestion by BamH Ι and Xho Ι; 4. Uninduced strain; 5. Induced strain; 6. Purified AHA2991 protein.图3 AHA2991重组质粒的构建及蛋白纯化Fig.3 Construction of recombinant plasmid and protein purification of AHA2991
2.3 AHA2991蛋白表达条件的优化
通过正交实验确定AHA2991的最佳表达条件,每组3个重复。将诱导后的菌液进行处理,经过蛋白电泳可得不同条件下的蛋白表达(图4);通过Phoretix 1D对正交表达图进行光密度分析,将所得数据通过SPSS计算可得蛋白的最佳表达条件为:菌液浓度OD600=1.0,IPTG终浓度0.5 mmol/L,在28 ℃下诱导8 h;通过显著性分析(表2)可知,IPTG浓度对蛋白的高效表达有重要作用。

A, B, C为3次重复; M. 蛋白marker; 1. 未诱导菌株; 2~4. OD600值为1.0, 诱导温度分别为28、37、32 ℃; 5~7. OD600值为0.8, 诱导温度分别为28、32、37 ℃; 8~10. OD600值为0.5, 诱导温度分别为37、32、28 ℃。A, B, C are three repetitions; M. Protein marker; 1. Uninduced strain; 2-4. OD600 is 1.0, inducing temperature is 28, 37, 32 ℃, respectively; 5-7. OD600 is 0.8, inducing temperature is 28, 32, 37 ℃, respectively; 8-10. OD600 is 0.5, inducing temperature is 37, 32, 28 ℃, respectively.图4 不同诱导条件下AHA2991蛋白表达图谱Fig.4 Expression map of AHA2991 under different induction conditions
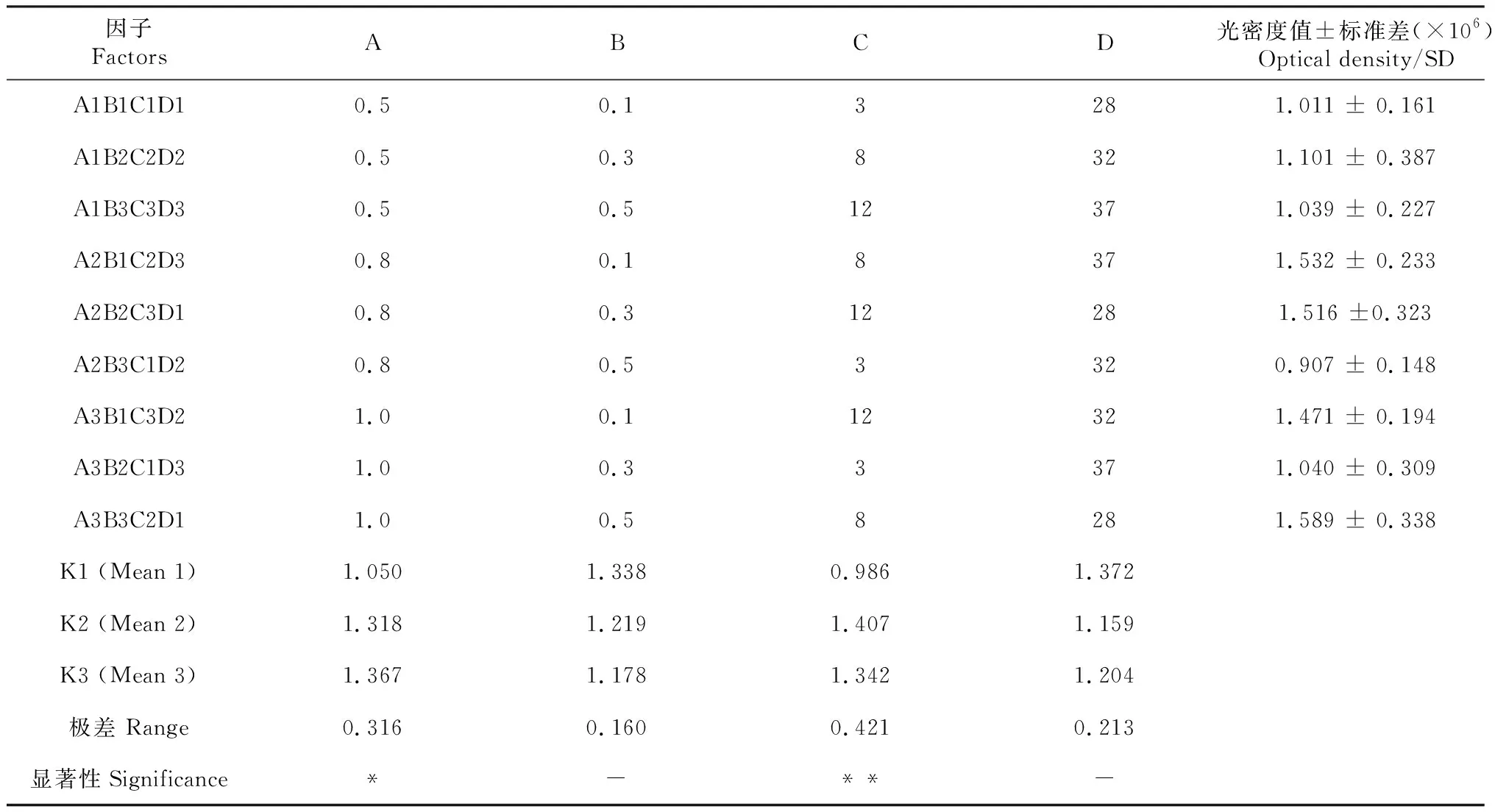
表2 蛋白表达条件正交试验Table 2 Factors and levels of orthogonal test for protein expression condition
2.4 AHA2991免疫后鱼血清的特异性与效价检测
Western blotting试验结果表明,出现大小约为45 kDa的特异性条带,而对照组未见条带,效价为1∶800(图5)。

M. 蛋白质marker; 1. 阴性对照血清; 2. 血清稀释倍数为1∶100; 3. 血清稀释倍数为1∶200; 4. 血清稀释倍数为1∶400; 5. 血清稀释倍数为1∶800。M. Protein marker; 1. Negative control serum; 2. Serum dilution ratio is 1∶100; 3. Serum dilution ratio is 1∶200;4. Serum dilution ratio is 1∶400; 5. Serum dilution ratio is 1∶800.图5 Western blotting检测鱼血清特异性与效价Fig.5 Detection of specificity and titer of fish serum by Western blotting
2.5 免疫蛋白AHA2991后鱼血浆的酸性、碱性磷酸酶测定
红鲫在免疫蛋白AHA2991后,血浆的ACP、AKP指标较对照组相比均极显著升高(图6),表明AHA2991激活了红鲫的非特异性免疫。
2.6 体外细胞吞噬作用
如表3所示,AHA2991血浆细胞吞噬作用较对照组相比具有明显升高,吞噬百分数升高;且吞噬指数极显著高于对照组(P<0.01)。

表3 免疫AHA2991后红鲫血浆的细胞吞噬作用Table 3 Leukocyte phagocytosis of C. auratus plasma after immunization with AHA2991
2.7 免疫AHA2991后红鲫血浆与嗜水气单胞菌的相互识别作用
ELISA实验结果表明,免疫AHA2991后红鲫血浆与嗜水气单胞菌在体外具有相互识别作用;且抗体的滴度可达1∶3200(图7)。

图7 免疫AHA2991后红鲫血浆与嗜水气单胞菌体外相互作用Fig.7 Interaction between C. arassius plasma after immunization with AHA2991 and A. hydrophila in vitro
2.8 病理切片观察AHA2991蛋白免疫对红鲫内脏的影响
红鲫免疫AHA2991蛋白2次后,取其肾脏、脾脏、肠组织进行组织病理学切片;发现AHA2991与对照组相比其内脏组织无明显区别(图8),表明红鲫免疫外膜蛋白AHA2991对其内脏无影响。

A为对照组(免疫无菌水),B为AHA2991蛋白免疫;a、b、c依次为肾、脾、肠。A is the slice from the control group (immunization sterile water), and B is the slice after immunization with AHA2991 protein; a, b and c are kidney, spleen, intestine.图8 红鲫肾、脾、肠组织病理学切片Fig.8 Pathological sections of kidney, spleen and intestine of C. auratus
3 讨 论
嗜水气单胞菌作为一种水产养殖主要病原菌,其危害性已引起公众的关注,但其目前的防治方法单一,主要使用抗生素防治[12],而抗生素的滥用已经引发一系列环境健康、食品安全等问题。故本研究选取嗜水气单胞菌外膜蛋白AHA2991进行主动免疫评价,为嗜水气单胞菌渔用疫苗的研发奠定基础。
分子克隆技术是分子生物学的基础,目前已应用在基因扩增、限制性内切酶的应用、载体构建、细胞转化、重组体筛选鉴定、基因表达以及物质生产等方面。王记圆等[13]对橡胶树炭疽菌疏水蛋白Hydr进行基因扩增并将其插入载体pET-32a中,构建了Hydr蛋白的原核表达载体,经由IPTG诱导,可正确表达蛋白。董素芳等[14]克隆了类鼻疽伯克霍尔德菌TssE-6蛋白,利用pET-30a载体成功进行了原核表达,通过Ni2+纯化获得了单一的目标蛋白。本研究利用分子克隆技术成功构建了pET-32a-AHA2991载体,并转化至大肠杆菌,SDS-PAGE电泳显示外膜蛋白AHA2991相对分子量大小正确,为后续实验奠定基础。
生物信息学可准确预测不同蛋白质间的同源性、亲缘性及高级结构。在蛋白质的抗原表位分析和设计方面,可有效降低实验的盲目性,提高工作效率[15]。研究发现荧光假单胞菌外膜蛋白ExbB进化保守,且具有交叉免疫保护作用[16];Liu等[17]对荧光假单胞菌外膜蛋白PF1380进行生物信息学分析,发现PF1380与多种菌株具有同源性,在交叉免疫评价中具良好的保护效果。本研究通过生物信息学对外膜蛋白AHA2991进行分析,发现AHA2991进化保守,免疫动物产生的抗体可能对不同种属的细菌感染有交叉免疫保护作用。
蛋白质的分离纯化在生物化学研究应用中使用广泛,是一项重要的操作技术。蛋白纯化的方法主要有凝胶过滤层析、离子交换层析、亲和层析、包涵体洗涤和SDS-PAGE电泳切胶等方法。李秋璇等[18]利用原核表达系统制备了诺如病毒VP1蛋白,通过His标签镍离子蛋白柱纯化,得到高纯度的VP1蛋白;刘祥[19]利用包涵体洗涤和梯度复性的方法获得较高纯度的蛋白。本研究结合包涵体洗涤法和SDS-PAGE电泳切胶法,成功纯化嗜水气单胞菌外膜蛋白AHA2991,浓度测定与SDS-PAGE电泳结果表明纯化结果较为理想,为后续蛋白免疫原性研究及功能性分析奠定基础。此外,为确定AHA2991表达菌株的最佳诱导条件,通过L9(34)正交模型确定的AHA2991最佳表达条件为:菌液浓度OD600=1.0,IPTG诱导终浓度0.1 mmol/L,在28 ℃下诱导8 h。通过SPSS分析可知菌液浓度及诱导时间对AHA2991的表达有显著影响,其中诱导时间为极显著。研究报道IPTG对细菌具有毒性,过量的IPTG会影响蛋白表达[20],本研究结果与此结论相同;Wyre等[21]发现大肠杆菌在低温情况下可减少表达蛋白的不溶性包涵体,这与本研究结果一致。适度的诱导时间对蛋白的表达同样有重要的作用,伍娜娜等[22]报道过长的诱导时间会导致蛋白被蛋白酶降解,本研究也表明诱导时间对蛋白的表达有极显著影响。综上,最佳诱导条件的确定,为工业上大规模制备蛋白AHA2991提供了理论依据。
为探索外膜蛋白AHA2991的免疫原性,采用Western blotting检测红鲫血清的特异性与效价;体外模拟红鲫血浆与嗜水气单胞菌的识别作用。Western blotting发现红鲫抗血清具有特异性,效价为1∶800。有研究利用布鲁氏菌的重组蛋白OMP16免疫 BALB/c小鼠制备多克隆抗血清,并检测其效价为1∶100 000 000[23];刘玮等[24]以嗜水气单胞菌外膜蛋白OmpTS与溶血素Hly的融合蛋白免疫新西兰兔后,抗血清在Western blotting分析中呈阳性,滴度可达1∶4000。孙薇等[25]表达纯化了荧光假单胞菌外膜蛋白SlyB并制备了小鼠抗血清,ELISA表明其滴度可达1∶12 800。本研究以间接ELISA法检测红鲫血浆与嗜水气单胞菌的体外识别作用,其滴度为1∶3200,表明体外AHA2991红鲫血浆对嗜水气单胞菌具有识别作用。本研究以纯化的嗜水气单胞菌外膜蛋白AHA2991免疫红鲫,发现AHA2991具有一定的免疫原性,为渔用疫苗的开发提供了生物学基础。
非特异性免疫也称为先天免疫,与机体的免疫功能密切相关。吞噬作用是血液中特定细胞识别并吞噬异物的作用,是机体基本的防卫方式[26];有研究证明酸性磷酸酶(ACP)、碱性磷酸酶(AKP)为鱼类主要解毒酶[27],且广泛存在鱼体组织、血液或细胞中,因而可作为主要免疫指标[28]。故本研究选择吞噬作用、ACP、AKP作为非特异性免疫的评价指标。本研究通过免疫AHA2991后,发现红鲫血浆中ACP、AKP、吞噬作用均高于对照组。王卓等[29]发现青海湖裸鲤幼鱼在碳酸盐碱度胁迫下,ACP、AKP酶活性升高;赵娜等[30]将牙鲆免疫海豚链球菌,发现牙鲆血细胞中ACP、吞噬指标均上升。以上结果均证明红鲫非特异性免疫被激活。组织病理形态学观察可直观地了解组织损伤或病变程度,常被采用进行药物功能的评价。杨成年等[31]以维氏气单胞菌感染杂交鲟后,对其肝、脾、肠观察使用组织切片技术进行病理变化描述;兰蕾等[32]将大鼠进行艾烟染毒,对其心、肝、脾、肺等组织进行病理学切片,发现染毒后均有损伤。本研究利用组织病理学切片技术,发现AHA2991蛋白的免疫对红鲫内脏无明显影响。
4 结 论
AHA2991表达菌株的最佳诱导表达条件为菌液浓度OD600=1.0,IPTG终浓度0.1 mmol/L,在28 ℃下诱导8 h;红鲫主动免疫嗜水气单胞菌外膜蛋白AHA2991后,血浆中ACP、AKP活力升高,细胞吞噬作用增强;ELISA体外模拟结果显示,AHA2991血浆对嗜水气单胞菌特具有识别作用,滴度可达1∶3200;Western blotting结果显示红鲫血浆中含有特异性抗体;组织病理学切片表明红鲫免疫外膜蛋白AHA2991对其内脏无影响。上述结果说明嗜水气单胞菌外膜蛋白AHA2991是一种保护性抗原,可为嗜水气单胞菌疫苗的开发提供理论基础。
