甘青青兰根际及内生细菌群落结构组成分析
2023-06-10索朗桑姆刘盼盼徐雨婷陈诚欣禄亚洲兰小中张二豪
索朗桑姆,何 萍,简 阅,刘盼盼,徐雨婷,陈诚欣,禄亚洲,兰小中,张二豪
(西藏农牧学院食品科学学院,西藏 林芝 860000)
【研究意义】甘青青兰(DracocephalumtanguticumMaxim) 又称唐古特青兰,为唇形科多年生草本植物,主要分布于藏东南、青海东部、甘肃南部和四川西部等海拔1900~4600 m的高原[1]。甘青青兰味甘、性寒,具有止咳化痰、清热解毒和胃舒肝的功效[2],是藏医药中常用临床药材。研究表明,甘青青兰含有丰富的酚酸类、黄酮苷和黄酮类等活性物质,其中以胡麻甙6″-乙酯、迷迭香酸和绿原酸为主要活性成分,这些成分已被证明具有抗氧化、抗病毒、抗心脑缺氧、抗炎和保肝等多种药理作用[3-7]。植物内生菌是一类栖息于健康植物体内且又不会引起植物病害的微生物类群[8]。研究表明,植物根际土壤及内生细菌在植物生长发育、抗逆性、生物合成及病虫害防治中扮演着重要角色[9-10]。同时,植物内生菌还具有转运和产生与宿主植物相同或相似次生代谢产物的能力,如生物碱类、萜类、酮类和醌类等活性物质[11-13]。因此,揭示甘青青兰不同组织和根际土壤细菌群落结构组成,对甘青青兰中益生微生物资源的开发和利用、野生药用植物资源的保护具有重要意义。【前人研究进展】植物组织类型、植物品系、气候类型、土壤理化因子等因素会影响植物内生菌和根际土壤微生物群落结构组成[14-16],而药用植物品质与植物内生菌和根际土壤微生物息息相关[17-18]。刘莹等[19]从三七植物组织中分离出一株具有产皂苷能力的肠杆菌属细菌,张玉洁等[20]从三七植物组织中分离出众多具有抗根腐病病原菌能力的内生真菌,Zhao等[21]从石斛兰属植物中分离的内生真菌链霉菌具有产新骨架聚酮类化合物(Chartspiroton)的能力,宋发军等[22]从重楼中分离出4株具有促生功能的内生细菌,印度梨状芽孢杆菌和圆褐固氮菌能促进药用植物黄花蒿中青蒿素的合成[23]。可见,内生菌在植物生长发育、抗病虫害和提升药材品质等方面具有积极作用。【本研究切入点】目前,有关甘青青兰的研究主要集中在生理生长特性和活性成分等方面,而甘青青兰根际及内生细菌群落结构组成的研究尚未见报道,因此,系统全面地分析药用植物根际及内生微生物群落结构组成和多样性对后期基础研究和应用研究具有重要意义。【拟解决的关键问题】本研究基于高通量测序技术对西藏甘青青兰根际土壤和不同组织内生细菌的群落结构组成特征进行研究,旨在更加全面、准确地反应甘青青兰根际和内生细菌物种组成和多样性,为后期应用研究提供理论参考。
1 材料与方法
1.1 样本采集
植物样品及根际土壤采自西藏昌都市洛隆县(30°45′18.8″ N, 95°53′36.7″ E),该地海拔3922 m,年均降水量423.7 mm,年平均温度5.5 ℃,属高原温带半干旱气候。根据随机取样原则,随机选取9株新鲜健康、无病虫害、长势一致的甘青青兰植株,装入无菌袋中,每组3个重复,低温保存并带回实验室,24 h内处理。采用“抖根法”收集根际土壤,并过直径2 mm的过滤筛除去残枝落叶,自然风干后4 ℃保存备用。甘青青兰叶部样品(DtL)标记为DtL1、DtL2、DtL3;茎部样品(DtS)标记为DtS1、DtS2、DtS3;根部样品(DtR)标记为DtR1、DtR2、DtR3;根际土壤样品(DtRS)标记为DtRS1、DtRS2、DtRS3。
1.2 样品前处理
将采集的甘青青兰植物先用流动的自来水冲洗,然后用75%乙醇浸泡2 min,无菌ddH2O冲洗3次,再用3%次氯酸钠浸泡3 min,最后用无菌ddH2O冲洗3次[24],将消毒后的植物组织置于无菌PE管中,-80 ℃保存备用。
1.3 总DNA提取
根据DNeasy Plant Mini Kit (Qiagen, Germantown, MD, USA)试剂盒操作说明抽提甘青青兰组织和根际土壤细菌总DNA,用1%琼脂糖凝胶电泳检测DNA质量,DNA浓度和纯度利用紫外分光光度计NanoDrop ND-2000进行检测。
1.4 16S rRNA基因序列扩增及测序
以样品总DNA为模板,利用799F (5′-AACMG GATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC-3′)对细菌16S rRNA基因V5~V7区进行PCR扩增。扩增体系:10×PCR缓冲液 2 μL,5 mmol/L dNTPs 1 μL,引物799F和1193R各1 μL,DNA模板1 μL,rTaq酶0.2 μL,补ddH2O至20 μL。反应程序: 94 ℃预变性5 min; 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环35次; 72 ℃延伸10 min,4 ℃保存。PCR扩增产物经2%琼脂糖凝胶电泳检测后,纯化回收PCR扩增产物并送至上海派森诺科技股份有限公司进行测序。
1.5 数据分析
Illumina MiSeq测序所得的原始数据经拼接、质控和过滤后,在97%相似水平下,利用软件Uparse(7.0.1090)进行OTU(Operational taxonomic units)聚类分析;采用RDP classifier(2.11)贝叶斯算法将97%相似水平的OTU代表序列与细菌SILVA (138)数据库比对,进行分类学分析;利用MOTHUR(1.30.2)和QIIME(Version 1.9.1)软件进行α(alpha)多样性和β(beta)多样性分析;用R语言(3.3.1)工具进行统计和作图;用 PICRUSt 软件包对测序结果进行功能预测。
2 结果与分析
2.1 甘青青兰不同组织和根际土壤细菌序列及alpha多样性
从表1可知,DtL、DtS、DtR和DtRS分别获得45 784、45 407、47 492和42 381条序列,经质控、过滤后分别获得34 694、33 787、23 317和16 733条有效序列,平均长度376 bp。在97%相似水平下,OTU聚类分析结果表明,DtL、DtS、DtR和DtRS所产生的OTUs数分别为1703、1872、1341和1384。
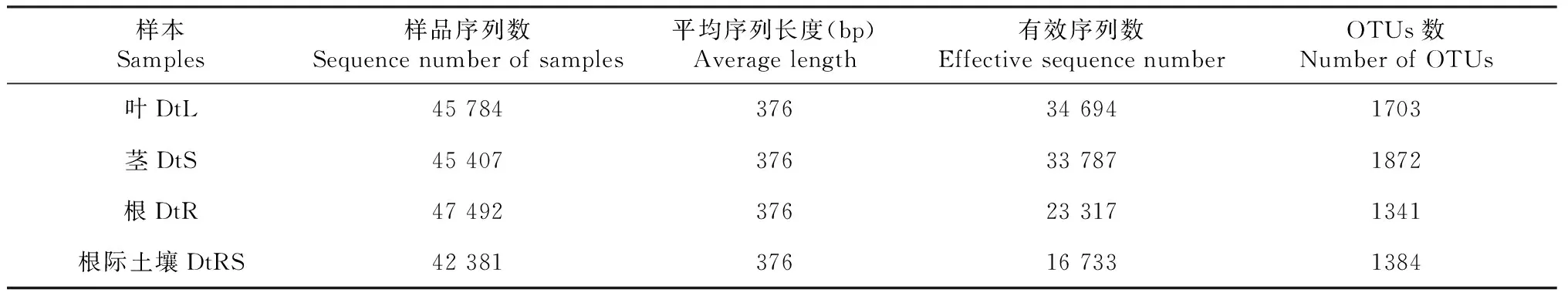
表1 甘青青兰不同组织及根际土壤的OTUs及相关序列指数Table 1 OTUs and related sequence indexes in different tissues and rhizosphere soil of D. tanguticum
从图1可知,DtS中丰富度指数显著高于DtR和DtRS(P<0.05),但与DtL相比无显著差异,DtR中丰富度指数最低。均匀度指数分析结果表明,DtS和DtRS均匀度指数最高,且均显著高于DtR(P<0.05),但与DtL相比无显著差异。多样性分析结果表明DtS多样性指数最高,其次是DtRS和DtL,DtR多样性指数最低。

A, B, C和D分别代表Chao指数、Shannon指数、Shannoneven指数和Simpson指数,*表示P<0.05, **表示P<0.01, ***表示 P<0.001。A, B, C and D represent Chao, Shannon, Shannoneven and Simpson indexe analysis, respectively. * represents P<0.05, ** represent P<0.01, and *** represent P<0.001.图1 甘青青兰不同组织及根际土壤alpha多样性指数Fig.1 Alpha diversity indexes in different tissues and rhizosphere soil of D. tanguticum
从图2可知,随着测序深度增加,各样本OTU数量增幅变缓,稀释曲线逐步趋于平坦,各样本的测序覆盖度在98.1%~99.4%,说明此次测序结果可真实反映甘青青兰不同组织和根际土壤细菌群落结构的组成。4个样品共获得2351个OTUs,DtL、DtS、DtR和DtRS共同拥有892个OTUs,特有的OTUs分别为138、101、253和76个,说明不同样品间细菌群落结构组成差异较大。

图2 甘青青兰不同组织和根际土壤细菌OTUs分布Fig.2 OTUs distribution of bacterial community detected in different tissues and rhizosphere soil of D. tanguticum
2.2 甘青青兰不同组织和根际土壤细菌种群归类
从表2可知,不同样品所得的2351个OTUs分属29门、76纲、191目、319科和570属,其中DtL中内生细菌归属27门、70纲、168目、279科和460属,DtS中内生细菌归属29门、73纲、167目、277科和489属,DtR中内生细菌归属23门、57纲、128目、210科和361属,DtRS中细菌归属24门、56纲、127目、197科和351属。甘青青兰不同组织和根际土壤所测得的细菌在各分类等级上的数量明显不同。在属分类水平上,DtS中内生细菌种类最多,其次是DtL和DtR,DtRS中细菌种类数最少,这与甘青青兰不同组织和根际土壤细菌的OTUs结果(表1)基本一致。
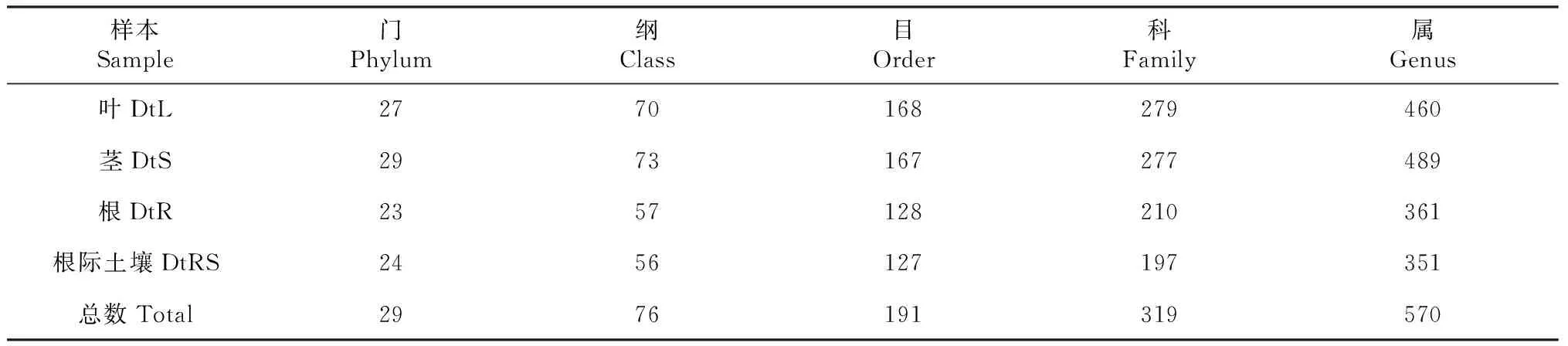
表2 甘青青兰不同组织和根际土壤细菌学分类阶层总数Table 2 Total numbers of bacterial taxa detected in different tissues and rhizosphere soil of D. tanguticum
2.3 甘青青兰不同组织和根际土壤细菌群落结构组成
从图3可知,甘青青兰DtL、DtS和DtRS中,占比大于1%的优势细菌门为4个,分别为放线菌门(Actinobacteriota)、变形菌门 (Proteobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi),而DtR占比大于1%的优势细菌门为3个,分别为放线菌门(69.48%)、变形菌门 (21.36%)和绿弯菌门(4.58%)。DtL中优势细菌门依次是放线菌门(68.25%)、变形菌门 (13.25%)、厚壁菌门(8.87%)和绿弯菌门(4.35%);DtS中优势细菌门依次是放线菌门(63.99%)、变形菌门 (17.17%)、厚壁菌门(7.86%)和绿弯菌门(5.16%);DtRS中优势细菌门依次是放线菌门(67.36%)、变形菌门 (16.82%)、绿弯菌门(5.89%)和厚壁菌门(3.61%) 。以上结果表明,除DtR样品外,其他样品中的优势细菌门类型相同,但其相对丰度存在差异。

图3 甘青青兰不同组织和根际土壤细菌优势细菌门组成Fig.3 Dominant bacterial phyla in different tissues and rhizosphere soil of D. tanguticum
从图4可知,DtL中内生细菌相对丰度大于1%的属有6个,其中能够准确分类的属有4个,分别为芽孢杆菌属(Bacillus,6.96%)、土壤红杆菌属(Solirubrobacter,6.46%)、Gaiella属(5.61%)和假诺卡氏菌属(Pseudonocardia,4.10%);DtS中相对丰度大于1%的属有6个,其中能够准确分类的属有4个,分别为芽孢杆菌属(5.87%)、土壤红杆菌属(5.85%)、假诺卡氏菌属(5.03%)和Gaiella属(4.33%);DtR中相对丰度大于1%的属有6个,其中能够准确分类的属有4个,分别为土壤红杆菌属(11.78%)、游动放线菌属(Actinoplanes,5.56%)、Gaiella属(3.20%)和假诺卡氏菌属(1.74%);DtRS中相对丰度大于1%的属有7个,其中能够准确分类的属有5个,分别为土壤红杆菌属(8.24%)、Gaiella属(4.33%)、假诺卡氏菌属(3.16%)、芽孢杆菌属(2.54%)和游动放线菌属(1.28%)。说明,DtL和DtS样品的优势内生细菌属类型相同,但相对丰度差异较大,而DtR、DtRS与DtL和DtS样品间的优势细菌属类型不同,因此,不同样品间既存在共性又存在差异。
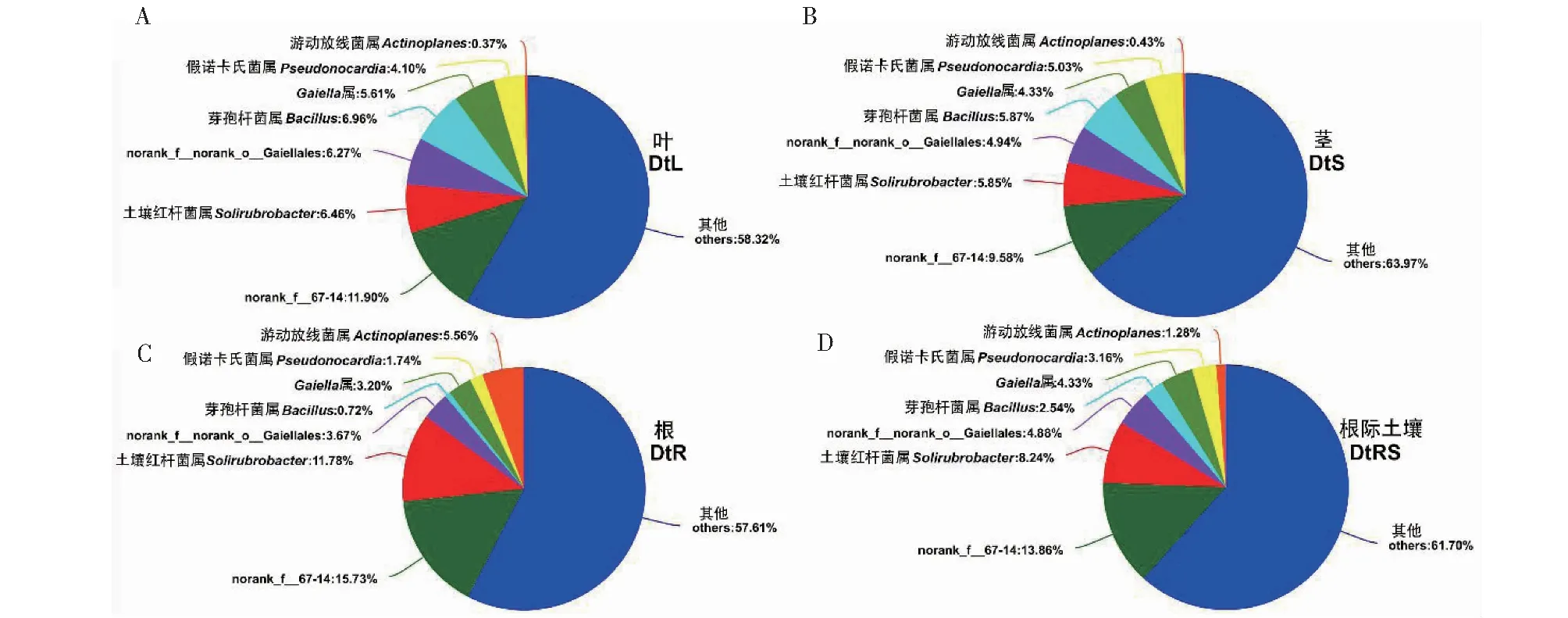
图4 甘青青兰不同组织和根际土壤细菌优势细菌属组成Fig.4 Dominant bacterial genera in different tissues and rhizosphere soil of D. tanguticum
2.4 甘青青兰不同组织和根际土壤细菌层级聚类
从图5-A可知,主成分分析1(PC1)和主成分分析2(PC2)对样品的差异贡献率分别为51.02%和26.01%,合计77.03%,能够较好地区分甘青青兰不同组织和根际土壤样品,是差异的主要来源,说明甘青青兰不同组织和根际土壤样品间细菌群落结构组成存在差异。基于非加权组平均法(Unweighted pair group method with arithmetic mean,UPGMA)构建的样本层聚类分析结果如图5-B所示,甘青青兰不同组织和根际土壤样品主要分为2个类群,DtL和DtS聚为一类,而DtR和DtRS聚为一类。说明DtL和DtS样品的细菌群落结构组成相似,而DtR和DtRS样品的细菌群落结构组成相似。
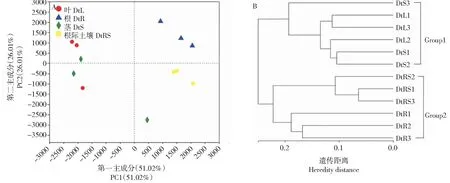
图5 甘青青兰不同组织及根际土壤细菌主成分分析(A)和UPGMA聚类分析(B)Fig.5 Principal component analysis (A) and UPGMA cluster analysis (B) in different tissues and rhizosphere soil of D. tanguticum
2.5 甘青青兰不同组织和根际土壤细菌功能基因预测
由图6可知,在第一等级功能层上,所有样品细菌功能基因均注释到6类生物代谢通路上,其中代谢(Metabolism)为主要组成成分,且DtL和DtS样品中参与各种生物代谢通路的细菌相对丰度均明显高于DtR和DtRS样品。第二等级KEGG (Kyoto encyclopedia of genes and genomes)代谢通路丰度分析结果如表3所示,样品中细菌群落的代谢功能主要集中在膜转运(Membrane transport)、氨基酸代谢(Amino acid metabolism)、碳水化合物代谢(Carbohydrate metabolism)、外源性化合物生物降解和代谢(Xenobiotics biodegradation and metabolism)、能量代谢(Energy metabolism)和脂类代谢(Lipid metabolism)等通路,且DtL和DtS样品中参与各种功能活动的内生细菌物种相对丰度最高,其次是DtR,而DtRS样品中参与调控各种代谢的细菌物种相对丰度最低。

图6 甘青青兰不同组织和根际土壤细菌PICRUSt功能基因预测Fig.6 PICRUSt functional gene prediction of bacterial community in different tissues and rhizosphere soil of D. tanguticum
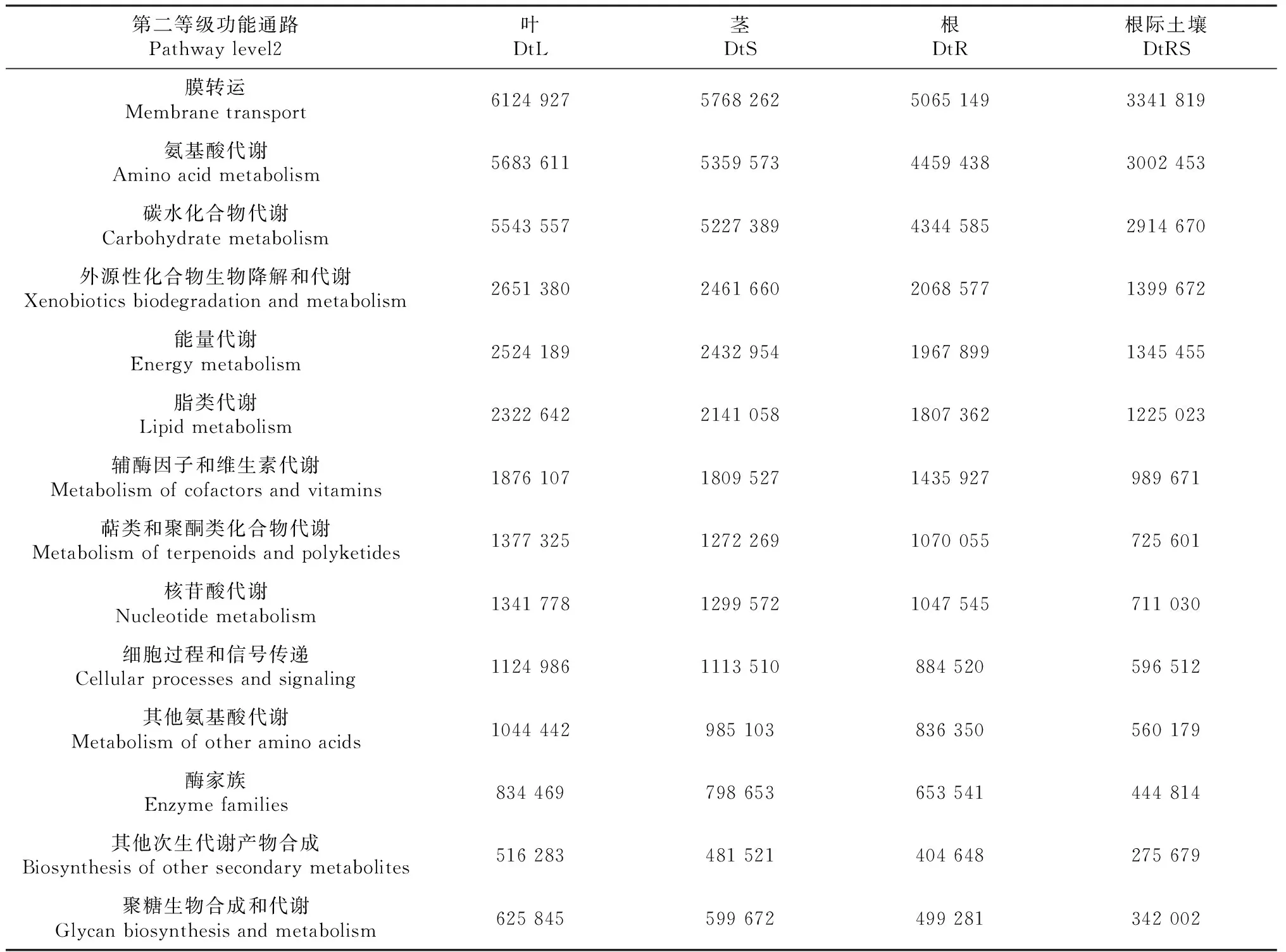
表3 甘青青兰不同组织和根际土壤细菌群落KEGG 代谢通路丰度 Table 3 KEGG metabolic pathway abundance of bacterial community among different tissues and rhizosphere soil of D. tanguticum
3 讨 论
甘青青兰作为一种藏医药常用藏药材,具有治疗关节炎、胃炎、肝炎和抗癌等功效,被广泛用于藏药制剂[2]。植物内生菌和根际土壤细菌在植物生长发育、抗逆境和生理代谢等方面扮演着重要角色[9-10],研究表明,内生菌具有独自或帮助宿主产生与宿主相同或相似的药用活性成分的功能[25],而植物组织类型、植物品系、气候类型等因素影响植物内生菌群落结构组成[14-16],不同组织中的内生菌具有一定的差异性和专一性。对铁皮石斛不同部位内生细菌群落组成分析表明,铁皮石斛叶部内生细菌多样性最高,其次是茎和根[26];顾美英等[27]研究表明,黑果枸杞根部内生细菌多样性最高,其次是花、果实、茎和叶部;安超等[28]研究发现,竹根七根、茎和根际土壤细菌群落结构组成存在较大差异;李秋桦等[29]分析三七不同部位内生细菌多样性时发现,根部的内生细菌丰富度最高,其次是茎和叶,与本研究结果相似,甘青青兰不同组织和根际土壤测得的细菌在各分类等级上的数量明显不同,DtS中内生细菌种类最多,其次是DtL和DtR。此外,DtS中的细菌多样性指数最高,其次是DtL,DtR多样性指数最低,呈现明显的组织差异性。研究表明,根际土壤微生物数量受土壤类型影响[30],此次采集的甘青青兰根际土壤均为沙土,这可能是导致DtRS中细菌种类数最少的原因。
放线菌门和变形菌门是植物内生菌和根际土壤最普遍的菌门[31],与本研究结果一致,放线菌门和变形菌门是甘青青兰不同组织和根际土壤相对丰度最高的优势类群,说明甘青青兰的生境适合放线菌门和变形菌门的生存与繁殖。变形菌门具有固氮、害虫防治、土壤修复和污染物降解等功能[32],且有助于提高用植物的产量和质量[33];放线菌作为一类重要的生防微生物,能够产生大量的、种类繁多的抗生素[34],因此,放线菌门和变形菌门的大量富集可能与甘青青兰药用活性成分的合成有关。
植物内生菌群落结构组成与植物种类、组织类型、环境和气候等因素密切相关。研究表明,黑果枸杞叶部的优势细菌属是红球菌属 (Rhodococcus) 和慢生根瘤菌属 (Bradyrhizobium),茎部是沙雷氏菌属(Serratia)和假单胞菌属(Pseudomonas),根部是盐单胞菌属(Halomonas)和Fodinicurvata[27];竹根七叶部优势细菌属是拟杆菌属(Bacteroides)和不动杆菌属 (Acinetobacter),根部是艾克曼菌属(Akkermansia)和伯克霍尔德菌属(Burkholderia)[28];在黄芪中,Anderseniella和芽孢杆菌属是优势细菌属[35],说明不同植物、不同组织中内生菌群落结构组成差异较大。本研究发现,DtL和DtS内生细菌群落结构组成相似,其优势细菌属均为芽孢杆菌,土壤红杆菌属是次优势属,与其它药用植物相比差异较大。根际土壤作为植物根系及根系分泌物的接触区域,其微生物与根部内生菌存在一定的相似性[36-38]。本研究发现,DtR和DtRS中的细菌群落结构组成相似,其优势菌属均为土壤红杆菌属,这与主成分分析和样本层级聚类结果一致。在黑果枸杞中,内生细菌芽孢杆菌有较高的促生作用[39],在人参中,内生细菌芽孢杆菌能够增加人参生物量并诱导人参皂苷的合成[40]。甘青青兰作为一种传统藏药材,主要以地上部分入药,而茎和叶中富含大量的芽孢杆菌,说明芽孢杆菌可能参与甘青青兰药用活性成分的合成。土壤红杆菌属能够适应并定植到不同的生态系统,甚至是严重污染的土壤[41-42],土壤红杆菌属是DtR和DtRS中的优势细菌属,这可能与甘青青兰生长环境和生态适应性有关。假诺卡氏菌属中的许多成员都能够产生重要的生物活性物质,如抗生素、维生素和酶制剂等[43],而甘青青兰不同组织和根际土壤中含有大量的假诺卡氏菌属,说明甘青青兰组织及根际土壤中含有产抗生素的微生物资源。
PICRUSt基因功能预测表明,甘青青兰不同组织和根际土壤细菌中与代谢相关的功能基因相对丰度最高。由于黄酮类、黄酮苷类、萜类、挥发油类和植物甾醇类等是甘青青兰的主要药用活性物质[3-6],甘青青兰组织和根际土壤细菌中与膜转运、氨基酸代谢、碳水化合物代谢、外源性化合物生物降解和代谢、能量代谢和脂类代谢等通路相关的功能基因相对丰度最高,这些细菌的功能基因可能参与了甘青青兰药用活性成分的合成;DtL和DtS样品中参与各种生物代谢通路的细菌相对丰度均明显高于DtR和DtRS样品,这可能与甘青青兰主要药用部分是DtL和DtS有关。综上所述,研究甘青青兰不同组织和根际土壤细菌群落结构组成及多样性,为系统、全面了解甘青青兰不同组织和根际土壤细菌群落结构组成,为阐明菌群功能和挖掘西藏甘青青兰中特定微生物资源提供理论参考。
4 结 论
首次采用高通量测序技术对甘青青兰不同组织和根际土壤细菌群落结构组成及多样性进行研究,并对不同组织和根际土壤细菌功能进行了预测分析。DtL和DtS中内生细菌群落结构组成相似,且其优势细菌属均为芽孢杆菌和土壤红杆菌属;DtR和DtRS中细菌群落结构组成相似,其优势菌属均为土壤红杆菌属;DtS中内生细菌多样性指数最高,其次是DtRS和DtL,DtR多样性指数最低;此外,甘青青兰不同组织和根际土壤细菌中富含与黄酮类、黄酮苷类和萜类等物质合成相关的功能基因,这些可能参与了甘青青兰药用活性成分的合成,为后续筛选益生内生菌奠定了基础。
