脱-γ-羧基凝血酶原蛋白的原核表达与鉴定
2023-06-08龚吕鸿刘雅楠吴胜昔韦广苗
龚吕鸿,徐 丽,刘雅楠,吴胜昔,许 东,秦 萍,韦广苗,曾 鹏
(1.重庆理工大学 药学与生物工程学院, 重庆 400054;2.重庆市第七人民医院, 重庆 400054)
0 引言
肝细胞癌(HCC)是肝细胞疾病,是世界上最具威胁性的癌症之一,许多国家的新病例仍在迅速增加[1]。乙型肝炎病毒感染、过度饮酒和酒精性肝病等是HCC的主要危险因素[2]。肝细胞癌侵袭性强,发展迅速,预后效果差,严重危害人类健康[3-4]。由于患者在疾病早期缺乏特定的症状和体征,一旦确诊,大多已处于中期和后期阶段。据报道,HCC患者的5年净生存率为5%~30% ,且变化率很小[5]。如果能在早期发现并治疗肝癌,则患者5年生存率可提高至70%[6]。因此研究HCC的早期检测方法十分必要。
脱-γ-羧基凝血酶原(DCP)是无基本的凝血功能的异常凝血酶原。Liebman等[7]首次报道DCP水平与HCC患者高度相关。DCP在诊断HCC方面的敏感性和准确性要优于传统的甲胎蛋白(alpha-fetoprotein,AFP)诊断[8-9]。DCP与肿瘤的血管侵袭密切相关[10],在HCC预后中也有明显作用[11]。因此,DCP在肝细胞癌的诊断、评估和预后等方面具有广阔的应用前景[12]。
在保证原始DCP蛋白氨基酸序列正确的基础上,优化该基因密码子,合成优化后的CDS基因,并将其融合到pET28a(+)质粒中,构建pET28a(+)/DCP重组质粒,再转化至感受态的BL21(DE3)中,利用Ni柱层析的原理对DCP蛋白进行纯化,并进行生物特性检测。研究目的是制备高纯度、特异性好、成本低的DCP蛋白,为肝癌的早期检测方法研究提供试剂参考。
1 材料
1) 菌株和质粒:江苏金唯智生物公司构建pET28a(+)/DCP、质粒pET28a(+),保藏于重庆理工大学实验室。
2) 主要试剂及仪器:Glycine购自碧云天公司;Imidazole购自Genview公司;限制性内切酶 NdeⅠ 和 XhoⅠ、10×QuickCut Green buffer购自TaKaRa公司;NGCTM亲和层析系统、Ni柱购于美国Bio-Rad公司。
2 方法
2.1 DCP基因合成
查询NCBI数据库DCP基因的CDS序列(LX095963),将该序列委托金唯智生物公司进行优化密码子宿主偏好性,在N和C端引入酶切位点NdeI和XhoI,并融合质粒自带的His标签进行合成。
2.2 pET28a -DCP重组质粒的双酶切鉴定与测序
将合成的穿刺菌划线平板培养,选取单菌落于试管中活化12 h。用质粒试剂盒提取质粒。用NdeI、质粒、XhoI、酶缓冲反应液、超纯水配制酶切体系,将上述混合系于37 ℃水浴中酶促反应30 min,经电泳检测正确后送金唯智公司进行测序鉴定。
2.3 DCP重组蛋白诱导表达
将活化的菌落扩大培养,当菌液OD600值在0.6时,加入IPTG诱导剂,30 ℃下诱导6 h。8 000 r/min ,12 min离心,弃上清,加入25倍菌重的裂解液,混合液超声破碎15 min,10 000 r/min, 10 min,进行电泳检测。
2.4 DCP重组蛋白诱导表达条件优化
将活化的菌落扩大培养,并按1%的接种量接种于大瓶中30 ℃、180 r/min, OD600值达到0.6时取出。对温度(16、25、30、37 ℃)、时间(2、4、6、8、10、12 h)、IPTG最终浓度(0.2 、0.4、0.6 、0.8、1.0 mmol/L)进行筛选。收菌8 000 r/min,12 min,加入细菌裂解液和PMSF(1%菌重)用超声机进行破碎,离心条件为 11 000 r/min,10 min。收集固体和上清,与上样缓冲液适量混匀,分别进行电泳检测。
2.5 DCP重组蛋白的纯化
根据2.4筛选到的最佳条件,将菌液扩大培养,菌液配平后 8 000 r/min,10 min离心,弃上清,加入 25 倍菌重体积的PBS重悬后,再重复1次之前的步骤,加入相同体积的裂解液超声破碎40 min,弃上清,加入裂解液和PMSF(1%菌重)后,4 ℃过夜搅拌。10 500 r/min,20 min离心,收集上清液,用0.22 μm进口滤头过滤备用。用NGCTM层析纯化系统纯化DCP 重组蛋白,具体操作步骤见文献[13],收集紫外吸收峰280 nm下的液体。
2.6 DCP重组蛋白的SDS-PAGE检测
将上样液、流穿液、各洗脱峰组分加入适当体积的上样缓冲液后,变性处理10 min,进行SDS-PAGE检测,完成后,进行考马斯亮蓝染色处理30 min,然后进行过夜脱色处理,拍照。
2.7 DCP重组蛋白的Western Blot 检测
将纯化后得到的DCP蛋白样品进行电泳,待电泳毕,进行切胶转膜(100 V,70 min);待转膜完成后,用现配的5%脱脂奶粉将膜封闭2 h。以DCP蛋白市售抗体(YRX201648M,无锡云翠生物科技有限公司)作为一抗(1∶10 000稀释)4 ℃过夜,弃掉一抗,用TBST摇洗3次。按(1∶4 000)孵育酶标IgG二抗1 h。加入等量混合的ECL化学发光显色液,静置反应3 min,显影。
3 结果与分析
3.1 pET28a(+)/DCP重组质粒酶切鉴定及测序
将pET28a(+)/DCP重组质粒进行双酶切凝胶电泳,目的基因大小为1 875 bp与质粒基因大小5 369 bp处有明显印迹,基本切合预期目的片段及空载体(如图1)。将pET28a(+)/DCP质粒进行测序,显示连接位点均正确。
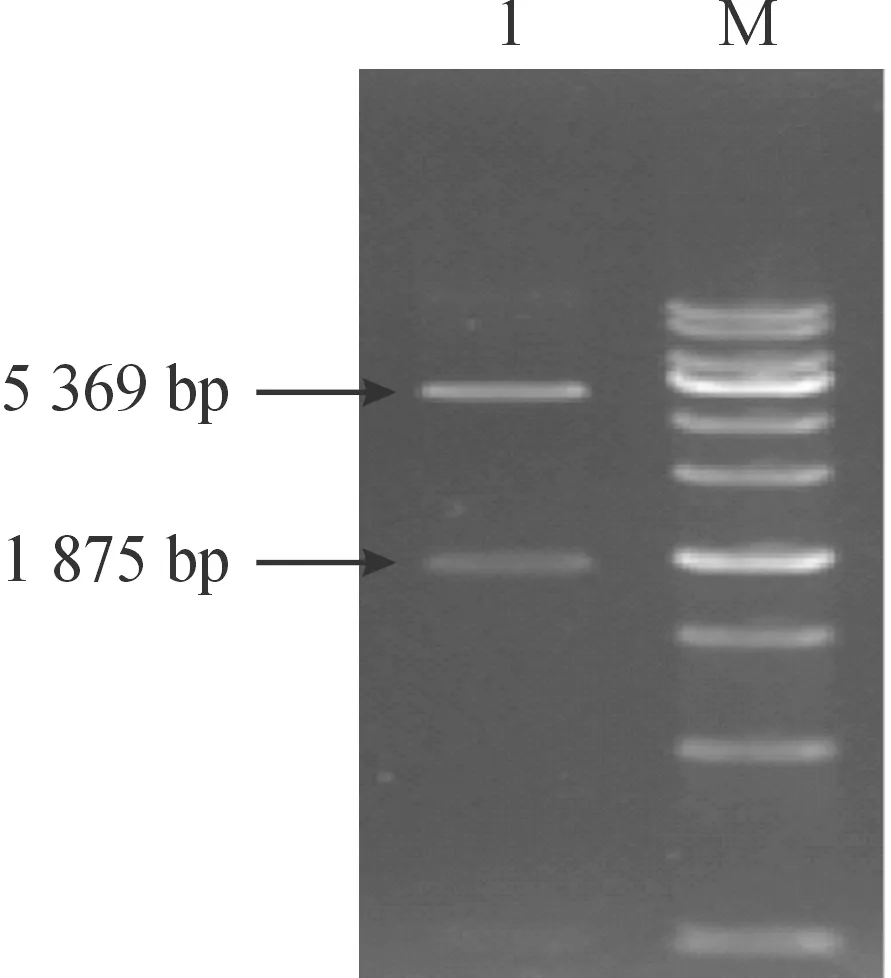
M: 标准酶切MARKER; 1:DCP质粒酶切检测。
3.2 DCP重组蛋白表达鉴定
将合成的重组菌株和对照组(空载体)在进行诱导表达后(同一条件)进行电泳检测。结果显示,BL21空载体在目的蛋白印迹有少量表达,重组菌株的沉淀组分在72 kD处有较多目的蛋白,而上清中较少(见图2)。这切合预期的分子量,表明重组菌株pET28a(+)/DCP成功构建,且主要以包涵体形式出现在沉淀组分中。

M:Marker; 2:空载体上清;3:空载体沉淀; 4:工程菌上清; 5:工程菌沉淀。
3.3 DCP重组蛋白诱导表达条件优化
为摸索DCP重组蛋白表达的影响因素,选取设定温度(16、25、30、37 ℃)、时间(2、4、6、8、10、12 h)、IPTG浓度(0.2、0.4、0.6、0.8、1.0 mmol/L)3个对蛋白表达有影响的因素进行优化。经过电泳检测,结果图3—5目的蛋白表达量最大的前提下,综合3个主要因素得出,诱导条件为:温度为30 ℃,IPTG终浓度为0.6 mmol /L,时间为6 h。

M:Marker 1、3、5、7、9:16 ℃、25 ℃、30 ℃、37 ℃(1 mmol/L IPTG,6 h)诱导条件下DCP重组蛋白超声破碎后上清;2、4、6、8:16 ℃、25 ℃、30 ℃、37 ℃(1 mmol/L IPTG,6 h)诱导条件下DCP重组蛋白超声破碎后沉淀。

M:Marker 1、3、5、7、9、11:0.2、0.4、0.6、0.8、1.0 mmol/L IPTG(25 ℃,6 h)诱导条件下DCP重组蛋白超声破碎后沉淀;2、4、6、8、10、12:0.2、0.4、0.6、0.8、1.0 mmol/L IPTG(25 ℃,6 h)诱导条件下DCP重组蛋白超声破碎后上清。

M:Marker 1、3、5、7、9:2、4、6、8、10、12h(25 ℃,0.8 mmol/L IPTG)诱导条件下DCP重组蛋白超声破碎后沉淀;2、4、6、8、10、12 h(25 ℃,0.8 mmol/L IPTG)诱导条件下DCP重组蛋白超声破碎后上清。
3.4 DCP重组蛋白的纯化
将重组菌株pET28a(+)/DCP进行LB平板培养,然后进行大量培养(最佳条件下);细菌溶液进行前处理过夜,通过Ni柱进行纯化,按梯度浓度的洗脱液对 DCP蛋白进行脱洗。结果表明:DCP蛋白的紫外吸收峰280 nm能被100 mM和200 mM洗脱液洗脱下来。如图6所示。
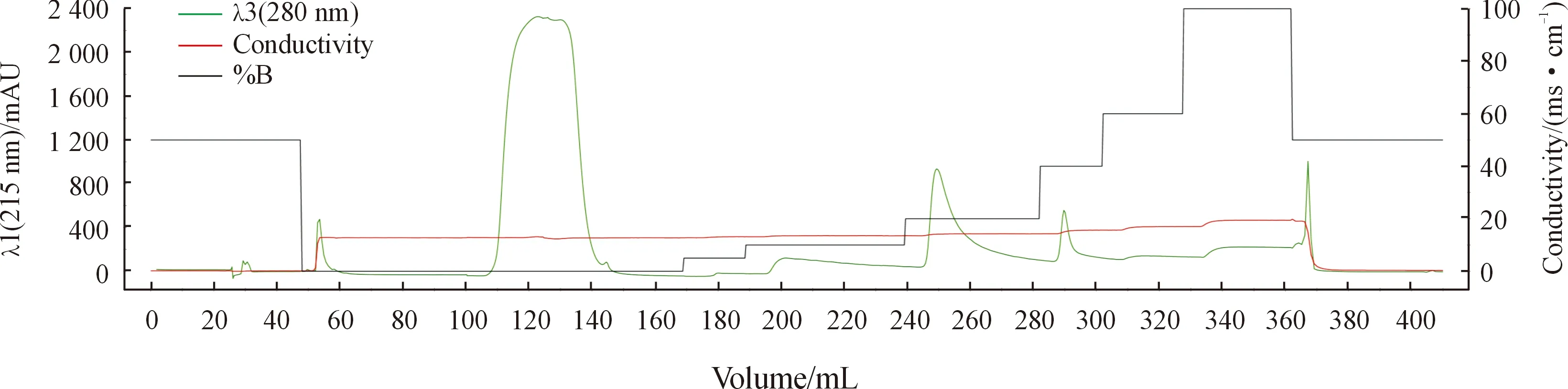
图6 NGCTM层析系统纯化DCP重组蛋白图谱
3.5 DCP重组蛋白的SDS-PAGE检测
取上样液、流穿液、各280 nm吸收峰样品进行电泳检测,结果见图7,表明纯化后的浓度较高部分的DCP蛋白能在100 mM被洗脱下来。
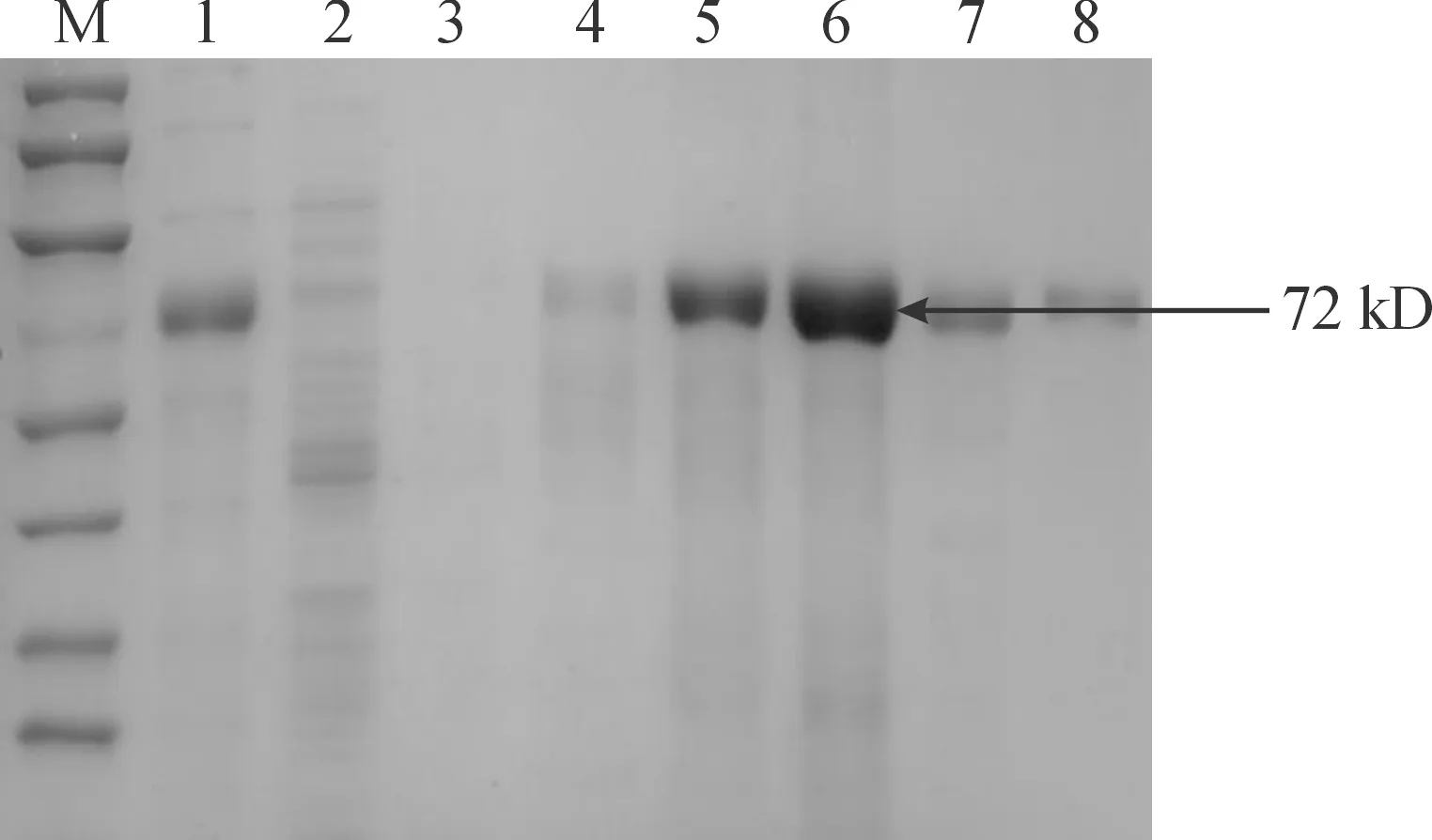
M:Markerv 1:上样液;2:流穿液;3-4:50mM洗下杂蛋白;5-6:100mM洗下DCP蛋白 7-8: 200mM洗下DCP蛋白。
3.6 DCP重组蛋白的Western Blot 检测
经过Western Blot检测表明,特异性蛋白条带出现在72 kD处,而对照组没有条带,切合预期结果。说明DCP蛋白已表达成功。

M:Marker;1: DCP 重组蛋白 2:pET28a(+)空载体沉淀组分。
4 结束语
肝癌在早期没有特殊的症状表现,中晚期才会出现明显症状,而此时的五年存活率极低,严重威胁人们的健康。因此,HCC的早期诊断非常重要。目前,在HCC的临床初步检测中,主要采用影像学检查方法和血清学检测方法[14]。血清学检测最为方便,但临床常用的血清标志物AFP检测[15]存在不足。DCP作为新的血清标物,在特异性和准确性方面均优于AFP[9],且已纳入中国肝癌诊疗规范[16],作为HCC早期的检测指标。同时,DCP水平不仅与HCC的血管侵袭相关,也是HCC治疗结果预后的一个重要指标[17]。
在DCP蛋白基因CDS序列选择pET28a(+)作为表达载体,并在上游端和下游端分别融合组氨酸标签后进行 DCP重组蛋白的表达,发现影响DCP蛋白表达的温度、时间、IPTG浓度这3个因素中,25 ℃、IPTG浓度 0.8 mmol/L、诱导6 h时,DCP重组蛋白表达量最高。在100 mM咪唑浓度下洗脱的蛋白含大量DCP目的蛋白,后续为提高目的蛋白的收率,可在更窄的咪唑梯度下洗脱,以达到提高目的蛋白纯度的目的。也可纯化之前进行杂蛋白的初步分离,例如使用含有曲拉通的低浓度尿素溶液进行洗涤。DCP重组蛋白在菌体内形成包涵体,重组蛋白表达过快,使得蛋白不能正确地折叠,导致蛋白质进行非特异性结合[18],产生大量不溶性蛋白。本研究成功制备出纯度较高的DCP蛋白,其生物活性良好,为后续DCP的检测方法研究提供了参考。
