灰霉菌MyosinⅠ的体外表达纯化及抑制剂筛选
2023-05-29宋国红刘松涛李林蔚刘飞张峰
宋国红,刘松涛,李林蔚,刘飞,张峰*
(1.南京农业大学植物保护学院,江苏 南京 210095;2.江苏省中国科学院植物研究所,江苏 南京 210014)
灰霉病是世界第二大真菌性病害,对作物产量造成了巨大损失[1],其病原菌灰葡萄孢菌(Botrytiscinerea,简称灰霉菌)是一种死体营养型、广寄主性的丝状子囊真菌,可侵染蔬菜、果树和花卉等200多种作物,如番茄和草莓,引起番茄灰霉病和草莓灰霉病[2-4]。生产上对灰霉菌的防治以化学防治为主,目前常用的化学药剂主要有苯并咪唑类、氨基甲酸酯类、二甲酰亚胺类和苯胺类等,然而长期单一地使用某一类化学药剂不仅会导致病原菌产生抗药性,而且会造成农药残留和环境污染[5-6]。因此,急需开发新型作用机制的化合物来解决以上问题。
肌球蛋白(Myosin)属细胞骨架蛋白,在肌动蛋白丝上利用ATP水解产生的能量来转运肌动蛋白丝并产生力量[7]。肌球蛋白在真核生物的多种生命过程中如胞质分裂、内吞作用、细胞形状维持、转录因子调控、胞内运输和信号转导等方面发挥着重要作用[8-10]。肌球蛋白主要由三部分结构域组成:氨基端的马达结构域(头部结构域)、颈部结构域、可变的羧基端尾部结构域,其中氨基端的马达结构域是最保守的,具有ATPase活性[11]。
氰烯菌酯(2-氰基-3-氨基-3-苯基丙烯酸乙酯)是一种新型2-氰基丙烯酸酯类杀菌剂,其作用靶标是Ⅰ型肌球蛋白(MyosinⅠ),主要用以防治禾谷镰刀菌和串珠镰刀菌等引起的小麦赤霉病和水稻恶苗病,对其他病原菌如稻瘟病菌、灰霉菌和小麦白粉病菌等抑制作用较弱或几乎没有抑制作用[12-15]。本实验室前期在氰烯菌酯化合物结构骨架基础上设计合成一批化合物,但这些化合物是否会对灰霉菌肌球蛋白具有抑制活性尚不清楚。
在本试验中,我们利用SF9昆虫细胞蛋白表达系统成功表达纯化出具有活性的BcMyosinⅠ单体蛋白;从实验室化合物库中成功筛选出B1和B17两个对灰霉菌肌球蛋白具有抑制活性的化合物。本文通过真核表达系统对BcMyosinⅠ蛋白进行体外表达和纯化,并发现2个灰霉菌肌球蛋白抑制剂,未来可在B1和B17化合物结构骨架基础上优化设计更高活性的肌球蛋白抑制剂,期望为灰霉病的绿色防控提供全新的解决方案,并延缓灰霉菌抗药性的产生和发展速度。
1 材料与方法
1.1 试验材料
1.1.1 菌株、载体及细胞灰霉菌B05.10菌株由南京农业大学植物保护学院周明国教授惠赠。DH5α菌株、DH10Bac菌株、草地贪夜蛾(Spodopterafrugiperda)SF9细胞和杆状病毒表达载体pFastBac由农药靶标生物学实验室保存。
1.1.2 主要试剂与仪器2×TaqMaster Mix酶、2×Vazyme Lamp Master Mix和反转录酶均购自南京诺唯赞生物技术公司;氨苄青霉素钠和RNA提取试剂盒购自上海生工生物工程有限公司;高保真酶2×FastPfu Premix、ToloPrep 柱式DNA胶回收试剂盒、ToloPrep 柱式质粒提取试剂盒、核酸染料ToLo Safered Nucleic Acid Stain、T4DNA连接酶、同源重组酶2×Ezmax-single CloneMix Plus和GoldBand 5000 DNA Marker均购自吐露港生物技术公司;限制性内切酶购于大连宝生物工程(TaKaRa)有限公司;SF9昆虫细胞培养基和转染试剂Sinofection购自北京义翘神州科技股份有限公司;His抗体购自赛默飞有限公司;PMSF蛋白酶抑制剂购自源叶生物;ADP-GloTMKinase Assay试剂盒购自北京普洛麦格生物产品(Promega)有限公司;104μg·mL-1氰烯菌酯由南京农业大学植物保护学院周明国教授惠赠。Heal Force Trident 960 PCR仪;Cytiva AKTA pure 25 蛋白纯化仪;Vilber FUSION FX7 RGB SPECTRA生物大分子分析仪;Molecular Devices多功能酶标仪SpectraMax M5。
1.2 方法
1.2.1 蛋白序列分析用Uniprot在线网站(https://www.uniprot.org/)搜索BcMyosinⅠ信息(Gene ID:BC1G_10821),利用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)和ESPript(https://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)在线网站与已解析的禾谷镰刀菌MyosinⅠ(FgMyosinⅠ)氨基酸序列进行同源性比对,选取合适的蛋白表达长度。
1.2.2 载体构建以灰霉菌cDNA为模板,设计引物对A1/A2扩增BcMyosinⅠ(1-737)片段,用EcoRⅠ和NheⅠ双酶切pFastBac质粒,胶回收试剂盒分别回收片段和酶切质粒,同源重组酶连接目的片段和酶切质粒,连接产物进行DH5α转化,挑取单克隆菌落进行PCR验证并送通用生物有限公司测序;以灰霉菌cDNA为模板,设计引物对A3/A4扩增BcCaM(1-149)片段,用EcoRⅠ和Hind Ⅲ分别双酶切pFastBac质粒和片段,用T4DNA连接酶连接产物和片段,进行DH5α转化并挑单克隆送公司测序。测序结果用BioEdit软件查看。引物序列见表1。
1.2.3 病毒液制备与蛋白表达挑选测序正确的质粒导入DH10Bac感受态细胞,挑选PCR验证正确的转化子,提取杆粒DNA,转染SF9昆虫细胞,27 ℃ 细胞培养箱静置培养6 d,4 ℃、2 000 r·min-1离心20 min,上清液即为P1代病毒液。将P1代病毒液按1∶100的体积比加入对数生长期的SF9细胞,27 ℃、125 r·min-1振荡培养2 d,离心收集的上清液即为P2代病毒液。按同样的方法收集P3代病毒液。将P3代病毒液pFast-BcMyosinⅠ(1-737)-H8和pFast-BcCaM(1-149)-H6按照2∶1的体积比加入对数生长期的SF9细胞,27 ℃、125 r·min-1振荡培养2 d,离心后弃上清液,收集下部细胞碎片。
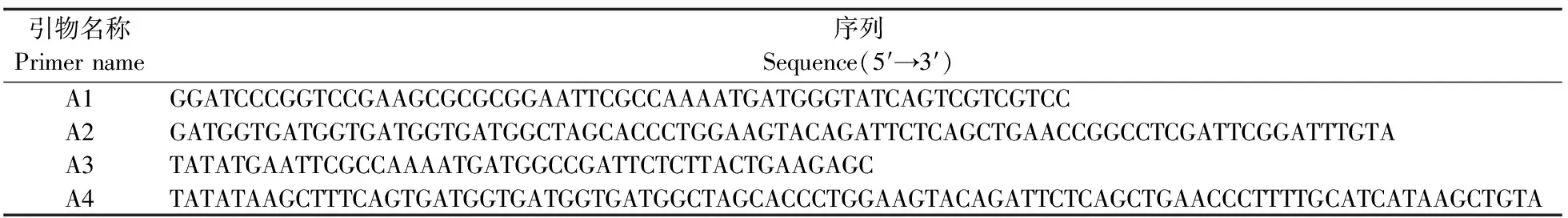
表1 引物序列Table 1 Sequence of primers
1.2.4 亲和层析与凝胶过滤层析纯化将菌体用裂解缓冲液(50 mmol·L-1Tris-HCl,300 mmol·L-1NaCl,25 mmol·L-1咪唑,5 mmol·L-1ATP,0.5% Triton X-100,10% 甘油,pH8.5)重悬后超声波破碎仪破碎至澄清透明状,超高速离心后收集上清液。上清液与提前用裂解缓冲液处理后的Ni-NTA Beads孵育2 h,用蛋白缓冲液W1(50 mmol·L-1Tris-HCl,300 mmol·L-1NaCl,25 mmol·L-1咪唑,10% 甘油,pH8.5)洗去杂蛋白,用蛋白缓冲液W2(50 mmol·L-1Tris-HCl,300 mmol·L-1NaCl,75 mmol·L-1咪唑,10% 甘油,pH8.5)洗去杂蛋白,用洗脱缓冲液E(50 mmol·L-1Tris-HCl,300 mmol·L-1NaCl,250 mmol·L-1咪唑,10% 甘油,pH8.5)洗脱目的蛋白,将目的蛋白上样于提前用凝胶过滤层析缓冲液(20 mmol·L-1Tris-HCl,200 mmol·L-1NaCl,10% 甘油,pH8.5)平衡后的Superdex 200 Increase 10/300GL柱子进一步纯化,判断蛋白状态。
1.2.5 蛋白质免疫印迹分析取纯化后的目的蛋白洗脱液20 μL上样于150 g·L-1蛋白凝胶,设置120 V、2 h进行SDS-PAGE。切取凝胶,设置200 mA、2 h转移凝胶上的蛋白至PVDF膜,膜用5%脱脂奶粉封闭过夜,抗体孵育后进行显色,生物大分子分析仪拍照记录结果。
1.2.6 ATPase活性的测定ATPase活性测定使用ADP-GloTM激酶检测试剂盒。在100 μL PCR管中先加入由40 mmol·L-1Tris(pH7.5)、20 mmol·L-1MgCl2和0.1 mg·mL-1BSA 配制成的1×激酶反应缓冲液A,再依次加入20 μmol·L-1化合物(B1和B17)、0.5 μmol·L-1BcMyosinⅠ(1-737)、0.1 μmol·L-1BcCaM和0.5 mmol·L-1ATP,吸打混匀后室温孵育30 min,此时体系为16 μL;加入16 μL ADP-GloTMreagent,吸打混匀后室温继续孵育40 min;加入32 μL激酶检测缓冲液吸打混匀,室温孵育40 min后完成反应。吸取20 μL反应液转移至384孔白板内,放于酶标仪下读数并记录试验结果。每个处理重复3次,试验独立重复3次。
1.2.7 化合物对菌丝生长的抑制速率测定将化合物配制成终浓度为104μg·mL-1的母液,再用溶剂稀释为20 mmol·L-1的次母液,按照次母液与PDA培养基1∶1 000体积比制成最终浓度为20 μmol·L-1的含药培养基。活化好的B05.10菌株用无菌打孔器打取直径5 mm的菌碟反向接种于含药培养皿中央,25 ℃培养箱内黑暗倒置培养2 d后用十字交叉法测量菌落生长直径,计算菌丝生长抑制率。每个处理重复3次,试验独立重复3次。菌落生长直径=菌落直径-菌饼直径。抑制率=(对照菌落生长直径-处理菌落生长直径)/对照菌落生长直径×100%。
1.2.8 同源模建预测BcMyosinⅠ三维结构基于灰霉菌与禾谷镰刀菌的MyosinⅠ马达结构域82.2% 的序列同源性,以解析的FgMyosinⅠ三维结构为模板(PDB:6UI4),使用Discovery Studio 3.5软件同源模建预测BcMyosinⅠ三维结构,并用Pymol视图软件查看,用PROCHECK评价BcMyosinⅠ结构的立体化学质量。
1.2.9 分子对接用AutoDock-Vina软件[16]和拉马克遗传算法(Lamarckian genetic algorithm,LGA),以半经验势函数作为能量打分函数对小分子的构象和位置进行全局搜索。计算过程中受体格点盒子为22 Å×22 Å×22 Å,格点间距为1 Å,格点盒子包围住配体活性腔;能量评估和生成最大值分别设为250 000 和25 000;选择均方根偏差(RMSD)作为评价标准(最大容忍范围为1 Å)。
2 结果与分析
2.1 蛋白表达序列的选取
根据同源比对结果和蛋白结构域信息,选择保留氨基端全长的马达结构域和IQ1结构域,即第1至第737位氨基酸(1-737)作为BcMyosinⅠ蛋白表达长度;选择灰霉菌钙调蛋白(BcCaM)的全长序列作为共同表达蛋白(图1)。

图1 BcMyosinⅠ蛋白和BcCaM蛋白结构域示意图Fig.1 Schematic diagram of BcMyosinⅠprotein and BcCaM protein domains
2.2 pFast-BcMyosinⅠ(1-737)-H8和pFast-BcCaM(1-149)-H6载体的构建
用引物对A1/A2和A3/A4分别扩增出2 211 bp的BcMyosinⅠ(1-737)-H8 DNA片段和450 bp的BcCaM(1-149)-H6 DNA片段(图2-A、B),分别用EcoRⅠ/NheⅠ和EcoRⅠ/Hind Ⅲ双酶切pFast载体(图2-C),用EcoRⅠ/Hind Ⅲ双酶切BcCaM(1-149)-H6 DNA产物(图2-D),用2×Ezmax-single CloneMix Plus酶和T4DNA连接酶分别连接2个片段的酶切质粒和片段,进行DH5α转化,挑取单克隆送公司测序后用BioEdit软件比对测序结果。
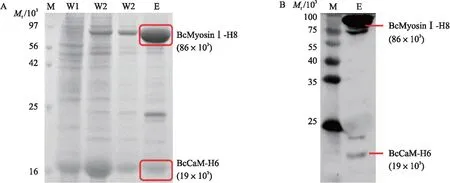
图3 BcMyosinⅠ(1-737)-H8和BcCaM(1-149)-H6 的表达纯化结果Fig.3 Expression and purification of BcMyosinⅠ(1-737)-H8 and BcCaM(1-149)-H6A. Ni-NTA柱纯化BcMyosinⅠ(1-737)-H8和BcCaM(1-149)-H6 的SDS-PAGE;B. BcMyosinⅠ(1-737)-H8 和 BcCaM(1-149)-H6的Western blot结果。M. 蛋白标准品;W1. 缓冲液1;W2. 缓冲液2;E. 洗脱缓冲液。A. SDS-PAGE of BcMyosinⅠ(1-737)-H8 and BcCaM(1-149)-H6 purified by Ni-NTA column;B. Western blot results of BcMyosinⅠ(1-737)-H8 and BcCaM(1-149)-H6. M. Protein marker;W1. Buffer 1;W2. Buffer 2;E. Elution buffer.
2.3 BcMyosinⅠ(1-737)的表达纯化
将pFast-BcMyosinⅠ(1-737)-H8和pFast-BcCaM(1-149)-H6 载体的P3代病毒液按照2∶1的体积比共表达于SF9细胞,利用 His8 和His6 标签对 Ni-NTA 琼脂糖树脂的亲和作用,使用Ni-NTA Beads对蛋白进行纯化,用Anti-His单抗检测发现BcMyosinⅠ和BcCaM蛋白均可正常表达纯化(图3)。
2.4 凝胶过滤层析检测蛋白状态
为进一步判断目的蛋白存在状态,将上述洗脱的目的蛋白上样于Superdex 200 Increase 10/300GL纯化柱,收集管中样品进行SDS-PAGE,参照标准蛋白出峰图推测BcMyosinⅠ(1-737)-H8和BcCaM(1-149)-H6复合体蛋白以单体形式稳定存在(图4),可用于后续测定ATPase活性。
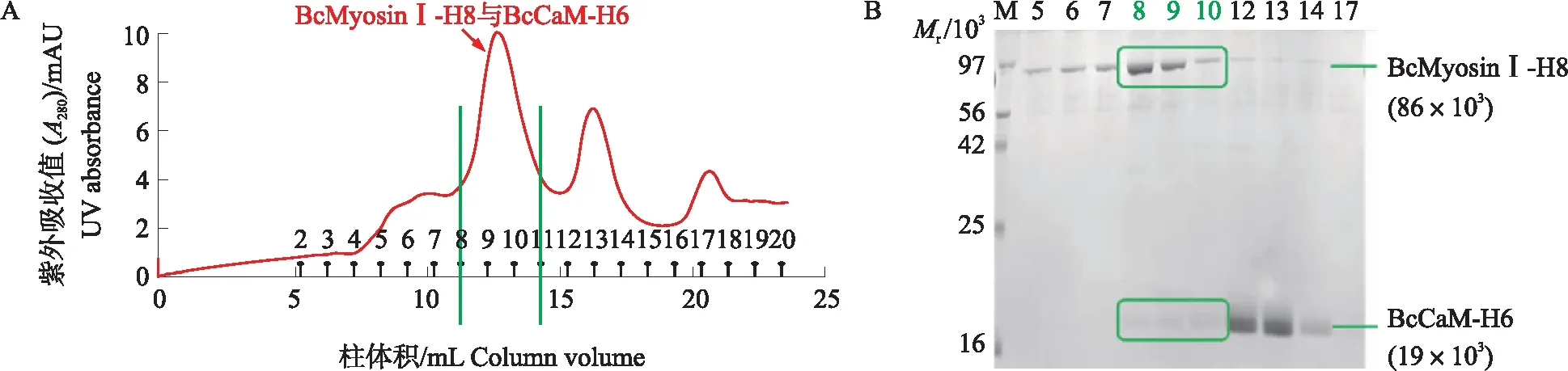
图4 BcMyosinⅠ(1-737)-H8 和BcCaM(1-149)-H6复合体蛋白凝胶过滤层析纯化(A)和收集管SDS-PAGE电泳图(B)Fig.4 Gel filtration(A)of BcMyosinⅠ(1-737)-H8 and BcCaM(1-149)-H6 complex proteinsand SDS-PAGE(B)for collectionsM. 蛋白标准品Protein marker. 2~20. 收集管2~20 Collection 2-20.
2.5 化合物对BcMyosinⅠ的ATPase活性影响的测定
20 μmol·L-1条件下,化合物B1和B17对BcMyosinⅠ的ATPase活性抑制率分别为56.24% 和65.39%,较氰烯菌酯的抑制率(27.29%)均有明显提高(图5)。
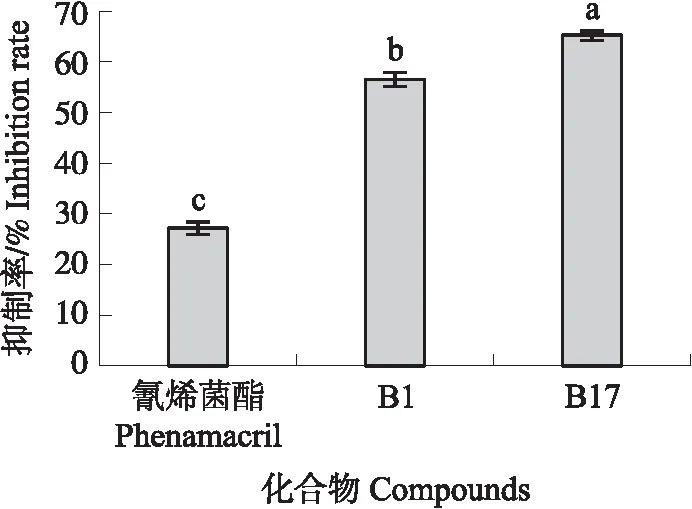
图5 20 μmol·L-1化合物对BcMyosinⅠ的ATPase活性抑制率Fig.5 Inhibition rates of ATPase activity of BcMyosinⅠby 20 μmol·L-1 compounds不同字母表示差异显著(P<0.05)。Different letters represent significant differences(P<0.05).
2.6 抑制剂B1和B17对灰霉菌的活性测定
采用菌丝生长速率法测定肌球蛋白抑制剂B1和B17在20 μmol·L-1条件下对灰霉菌的抑制活性,结果表明抑制剂B1和B17对灰霉菌的菌丝生长抑制率分别为32.90% 和83.44%,较氰烯菌酯的抑制率(1.06%)均有明显提高(图6)。
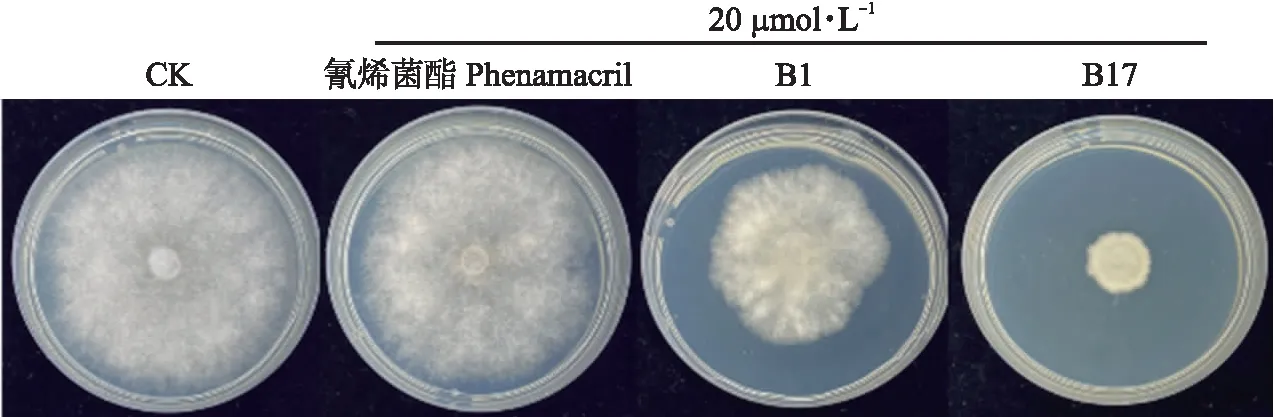
图6 20 μmol·L-1化合物对灰霉菌菌丝生长的影响Fig.6 Effect of 20 μmol·L-1 compounds on mycelial growth of Botrytis cinerea
2.7 预测的BcMyosinⅠ三维结构
同源模建预测的BcMyosinⅠ三维结构标记为蓝色,模板FgMyosinⅠ三维结构标记为绿色(图7-A);PROCHECK统计数据(图7-B)显示 BcMyosinⅠ整体结构98.7%的氨基酸残基都存在于完全允许区域(红色)和额外允许区域(黄色),表明预测的BcMyosinⅠ基本骨架构象是合理的。
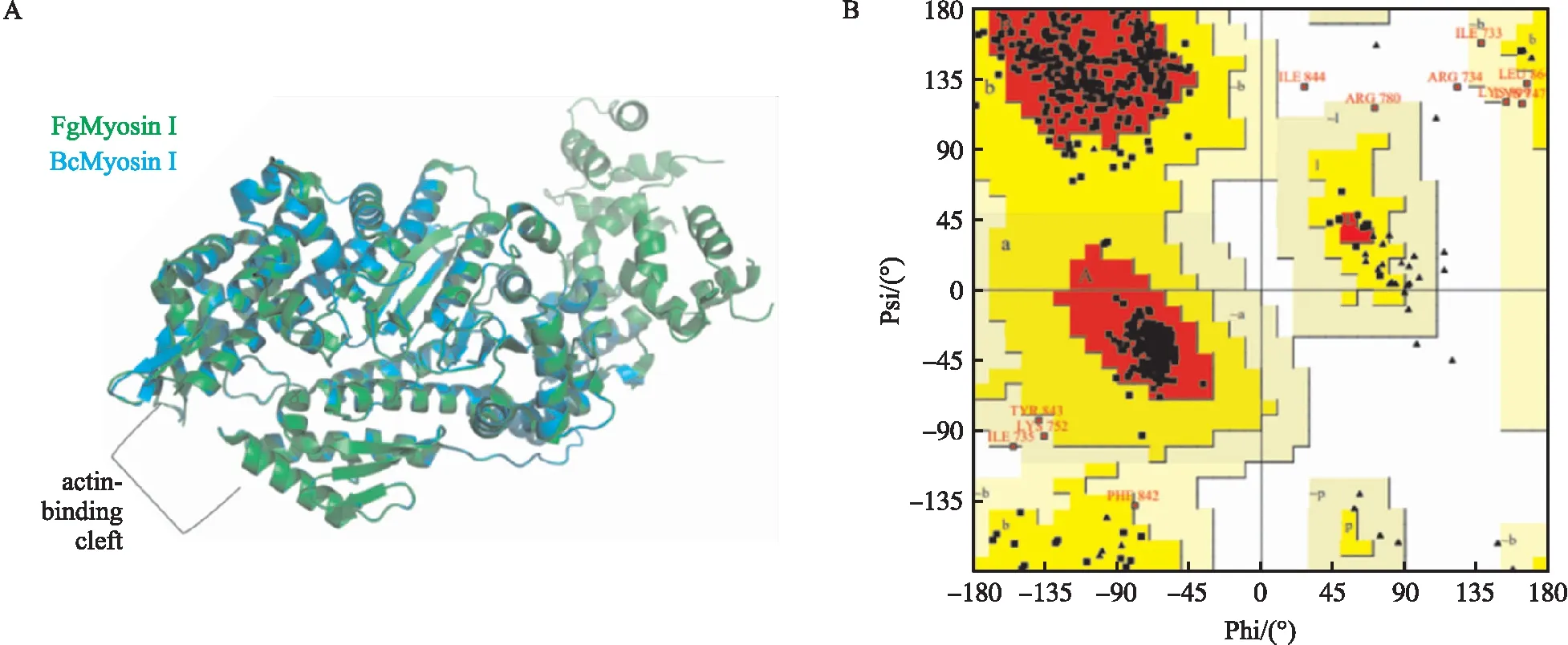
图7 BcMyosinⅠ的三维结构图Fig.7 The 3D structure of BcMyosinⅠA. BcMyosinⅠ三维结构图的卡通模型The 3D structure of BcMyosinⅠin cartoon representation;B. BcMyosinⅠ模型的拉氏图Ramachadran plot calculated for the BcMyosinⅠmodel.
2.8 抑制剂B1和B17与BcMyosinⅠ蛋白的分子对接
为研究抑制剂B1和B17与BcMyosinⅠ蛋白间的可能结合模式,我们进行了分子对接。图8中灰白色条带为同源模建预测的BcMyosinⅠ三维结构局部图,用不同颜色标记的分别为化合物B1和B17。对接结果表明化合物B1与BcMyosinⅠ的氨基酸残基Lys217和Cys424形成氢键,结合能为-35.53 kJ·mol-1;化合物B17与BcMyosinⅠ的氨基酸残基Thr218、Lys376和Asp541形成氢键,结合能为-36.78 kJ·mol-1;对照药剂氰烯菌酯与BcMyosinⅠ的氨基酸残基Thr218和Asp541形成氢键,结合能为-29.26 kJ·mol-1。结合能的高低与化合物和靶蛋白结合的稳定性有关,可用于评估化合物对靶点的抑制活性强弱,结合能越低,化合物活性越强,由分子对接结果也表明化合物B1和B17对BcMyosinⅠ的抑制活性均高于氰烯菌酯。
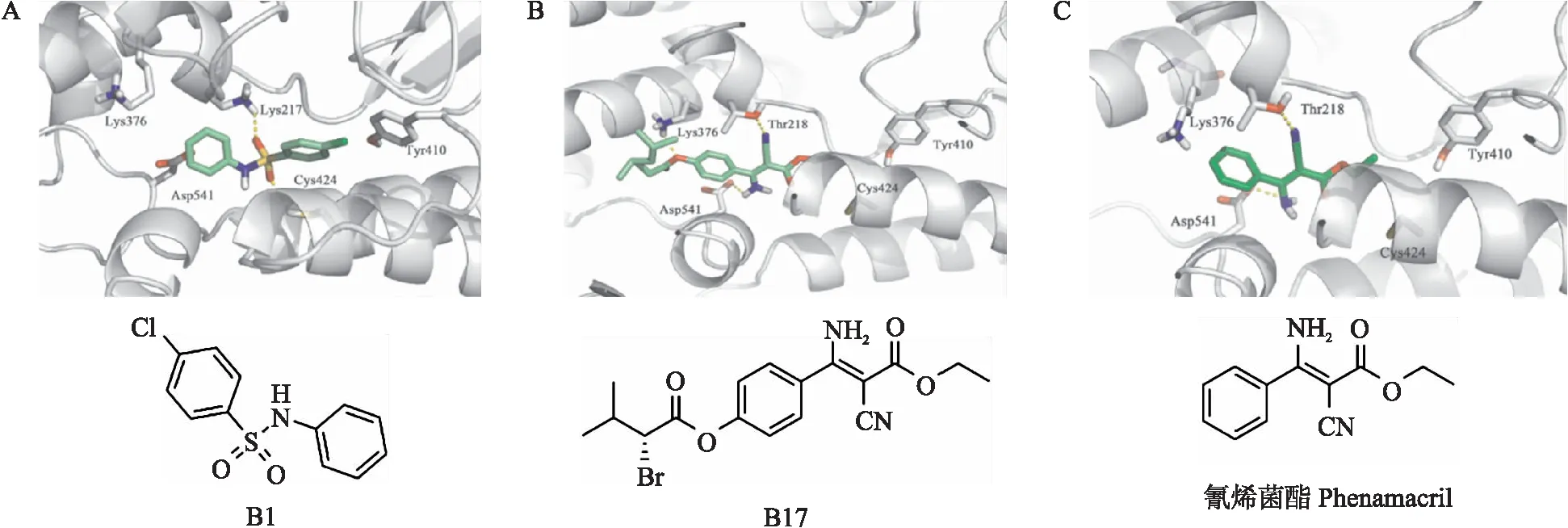
图8 B1、B17和氰烯菌酯与BcMyosinⅠ的结合模式Fig.8 The binding patterns of B1,B17 and phenamacril with BcMyosinⅠA. B1与BcMyosinⅠ的结合模式图Diagram of binding pattern of B1 and BcMyosinⅠ;B. B17与BcMyosinⅠ的结合模式图Diagram of binding pattern of B17 and BcMyosinⅠ;C. 氰烯菌酯与BcMyosinⅠ的结合模式图Diagram of binding pattern of phenamacril and BcMyosinⅠ.条带表示BcMyosinⅠBands indicate BcMyosinⅠ;化合物(绿色)和关键残基(白色)用棍状图表示Compounds(green)and key residues(white)are shown in stick plots;氢键用黄色虚线表示Hydrogen bonds are shown in dotted yellow lines.
3 讨论
肌球蛋白属于细胞骨架蛋白,在生命活动中发挥重要作用。在医学领域,肌球蛋白功能障碍与心肌病、耳聋、失明、肾病和神经系统缺陷等疾病有关[17]。目前已开发出一些肌球蛋白抑制剂,如五氯修地林(pentachloropseudilin,PCIP)、N-苄基-对甲苯磺酸胺(N-benzyl-p-toluenesulfonamide,BTS)和2,3-丁烷二酮一肟(2,3-butanedione monoxime,BDM)等[18]。在农业领域,目前仅有氰烯菌酯一个肌球蛋白抑制剂,然而氰烯菌酯的选择性极强,仅对禾谷镰刀菌和串珠镰刀菌引起的小麦赤霉病和水稻恶苗病有效,对农业上为害很重的稻瘟病菌和灰霉菌等没有抑制活性或活性很低。氰烯菌酯这一药剂特征,严重限制其在植物病害化学防控中的大范围应用。
从本实验室设计合成的氰烯菌酯衍生物库中筛选得到对灰霉菌Ⅰ型肌球蛋白具有显著抑制活性的B1和B17两个化合物。从ATPase活性和菌丝生长试验可以看出,B1和B17的可能作用位点为灰霉菌Ⅰ型肌球蛋白(BcMyosinⅠ)。另外,分子对接的结果也表明化合物B1和B17与BcMyosinⅠ分子对接的结合自由能均低于对照药剂氰烯菌酯,证实B1和B17对BcMyosinⅠ的结合活性优于氰烯菌酯。
本文首次报道了灰霉菌MyosinⅠ的体外表达纯化方法,并以此作为靶标成功筛选得到对灰霉菌肌球蛋白具有显著抑制活性的化合物B1和B17,其中化合物B17的生物活性高于B1。将B1与氰烯菌酯的分子结构式进行对比,发现B1中取代芳环替代酯基可提高化合物对灰霉菌肌球蛋白的抑制活性,且磺酰胺基可作为电子等排体替换氰烯菌酯中的取代双键;将B17与氰烯菌酯的分子结构式进行对比,发现在芳环对位引入取代基可使小分子与BcMyosinⅠ蛋白Lys376残基间形成氢键,增强蛋白与小分子化合物间的相互作用,有利于化合物活性的提高;通过比较B1和B17与BcMyosinⅠ的分子对接结果,发现B1与BcMyosinⅠ的氨基酸残基Lys217和Cys424形成氢键,B17与BcMyosinⅠ的氨基酸残基Thr218、Lys376和Asp541形成氢键,B17与较多氨基酸形成氢键从而降低结合自由能,推测B17对灰霉菌具有更高的抑制活性,与菌丝生长和ATPase活性测定结果一致。今后可在氰烯菌酯的芳环对位引入其他取代基以增强与BcMyosinⅠ蛋白间的相互作用,以期得到更高活性的灰霉菌肌球蛋白抑制剂,进而为灰霉病的绿色防控提供新的解决方案,为新农药创制提供新的发展方向。
