菊花CmHB15-1基因克隆及调控木质素合成功能分析
2023-05-29甘好李菲蒋甲福宋爱萍丁莲陈发棣陈素梅
甘好,李菲,蒋甲福,宋爱萍,丁莲,陈发棣,陈素梅
(南京农业大学作物遗传与种质创新利用全国重点实验室/农业农村部花卉生物学与种质创制重点实验室(南方)/国家林业与草原局华东地区花卉生物学重点实验室/钟山生物育种实验室/园艺学院,江苏 南京 210095)
木质素是植物细胞中苯丙氨酸/酪氨酸代谢途径的产物[1],在植物的生长发育中起着重要作用。作为细胞壁的主要成分,木质素增强了植物细胞壁的刚性、疏水性,并促进了植物维管束中矿物质的运输[2]。木质素对维持茎秆强度起关键作用[3],木质素含量的增加可增强茎秆强度,从而提高植株的抗倒伏能力[4]。此外,木质素在抵御害虫和病原体等生物和非生物胁迫方面发挥重要作用。因此,木质素生物合成相关基因的挖掘备受关注。
已知Ⅲ类同源域-亮氨酸拉链(Class Ⅲ Homeodomain-leucine Zipper,HD-ZIP Ⅲ)基因参与拟南芥分生组织等的发育[5-6],在木质部组织形成、器官极性和分生组织形成中发挥重要作用[5,7]。其中,HD-ZIP Ⅲ家族成员ArabidopsisthalianaHomeobox15(AtHB15)表达水平下调,抑制芽的生长[8]。AtHB15与维管组织和束间纤维发育有关[9-10],其对维管细胞分化、木质部组织的形成具有负调节作用[11]。AtHB15抑制髓内次生壁发育,次生壁相关转录网络受AtHB15的影响[12]。此外,AtHB15过表达植株还出现卷曲叶和花梗向下的表型[13]。表明HB15是调控木质素的重要候选基因。
菊花(Chrysanthemummorifolium)是菊科、菊属多年生宿根草本植物,具有极高的观赏价值,也是世界四大切花之一。茎秆强度是影响菊花栽培模式的重要性状,直接影响菊花种植密度和生产中是否需要拉网或绑扎加以固定,间接影响菊花产量、品质与效益,而木质素含量是影响植株茎秆强度的主要因素之一。因此,开展控制菊花木质素合成基因的挖掘,对于目标性状的改良具有重要的意义。为此,本研究开展了拟南芥HB15同源基因CmHB15-1的克隆,对其进行序列分析、亚细胞定位及转录激活活性分析、组织特异性表达分析,并遗传转化拟南芥进行功能鉴定,旨在为菊花茎秆强度改良、抗倒伏品种选育及木质素合成分子调控机制研究奠定基础。
1 材料与方法
1.1 植物材料
供试菊花品种‘神马’由南京农业大学中国菊花种质资源保存中心提供。待植株长至5片展开叶时,取植株上部第1片完全展开叶片,经液氮速冻后于-80 ℃保存。
1.2 总RNA的提取与cDNA的检测
利用通用植物RNA提取试剂盒(北京华越洋生物科技有限公司)提取RNA,采用20 g·L-1琼脂糖凝胶电泳检测RNA质量。利用反转录试剂盒(TaKaRa)反转录RNA获得cDNA,以菊花内参基因EF1α设计内参引物EF1α-F/R(表1)进行PCR扩增,检测cDNA质量,合格后用于后续试验。

表1 本文所用引物序列Table 1 Primer sequences used in this study

续表1 Table 1 continued
1.3 CmHB15-1基因的克隆
以上述cDNA为模板,根据菊花转录组中的数据,设计特异性引物CmHB15-1-F/R(表1),采用Phusion DNA Polymerase(Thermo Scientific)进行高保真PCR扩增。目的条带使用胶回收试剂盒(Thermo Scientific)进行回收。将回收产物连接到pMD19-T载体上。采用热激法转化大肠杆菌感受态DH5α,挑取阳性克隆送公司测序。
1.4 CmHB15-1氨基酸的序列及系统进化树分析
利用DNAMAN 8.0软件对菊花CmHB15-1序列与其他物种HB15的氨基酸序列进行同源性分析。使用邻接法(Neighbor-joining)构建系统发育树。利用BioXM 2.6软件预测CmHB15-1蛋白质相对分子质量及等电点。
1.5 CmHB15-1基因过表达载体构建及亚细胞定位分析
对pMD19-T-CmHB15-1质粒与pORE-R4空载分别进行BamHⅠ、EcoRⅠ(TaKaRa)双酶切,构建过表达载体pORE-R4-CmHB15-1,转化农杆菌感受态EHA105。将P19菌液分别与pORE-R4-CmHB15-1-GFP、pORE-R4-GFP空载菌液混合,于28 ℃黑暗条件下静置3~5 h后注射至生长3周并带有mCherry的烟草叶片背面,注射后整株先暗培养24 h,再光培养48 h,最后于激光共聚焦显微镜下观察荧光信号。
1.6 CmHB15-1转录激活活性分析
在目的基因的上、下游分别引入EcoRⅠ及BamHⅠ酶切位点,引物为pGBKT7-CmHB15-1-F-EcoRⅠ/R-BamHⅠ(表1),构建酵母表达载体pGBKT7-CmHB15-1。
参考MatchmarkerTMYeast Transformation System 2酵母杂交试剂盒(Clontech)说明书,将上述质粒与pCL1(阳性对照)、pGBKT7(阴性对照)转化到酵母菌株Y2H中,pCL1涂布于SD/-Leu培养基,pGBKT7与pGBKT7-CmHB15-1涂布于SD/-Trp培养基,30 ℃倒置培养3~5 d。挑取单克隆用1×TE悬浮,并点板至添加与不添加X-α-gal的SD/-His/-Ade培养基上,30 ℃倒置培养过夜,观察菌落并拍照记录。
1.7 CmHB15-1基因的组织特异性表达分析
取营养生长期(20片展开叶)的菊花‘神马’植株的根、茎(顶部第4节间,I4)、叶、顶芽。每个样品 3个单株重复,取样后立即放于液氮速冻,-80 ℃保存用于后续RNA提取。3次生物学重复。
取营养生长时期的菊花‘神马’植株的根、顶芽以及第3、6、9、12、15节间组织,取样操作与上述一致。
将RNA反转录成cDNA用于不同部位组织定量试验,定量引物为DL-CmHB15-1-F-2010/R-2118,菊花内参基因引物EF1α-F/R(表1)。反应体系(20 μL):上、下游引物各1 μL,ddH2O 3 μL,TB GreenPremixExTaqⅡ(TaKaRa)10 μL,稀释10~30倍的cDNA 5 μL。采用2-ΔΔCT法[14]进行基因相对定量分析。
1.8 CmHB15-1基因遗传转化拟南芥
1.8.1 蘸花法遗传转化拟南芥拟南芥转基因采取蘸花法[15],在含有卡那霉素的1/2 MS固体琼脂培养基上筛选拟南芥种子,T2代种子筛选到以抗性3∶1分离的株系后,选取T3代用于后续研究。
1.8.2CmHB15-1转基因拟南芥植株DNA水平鉴定与RT-PCR检测播种CmHB15-1转基因拟南芥T3代与野生型种子,抽薹前取莲座叶叶片提取DNA,利用35S-F和CmHB15-1-R-824引物(表1),通过PCR反应进行 DNA水平的鉴定。同时取莲座叶叶片,提取RNA,反转录后利用基因特异性半定量引物 RT-CmHB15-1-F-429/R-824及拟南芥内参引物AtActin-F/R分别进行PCR扩增。PCR程序:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,AtActin为25个循环,CmHB15-1基因为32个循环;72 ℃ 10 min,4 ℃保存。琼脂糖凝胶电泳检测目的基因条带。
1.9 木质素含量测定
取长势一致的野生型及CmHB15-1过表达转基因拟南芥植株抽薹后的茎(距基部1 cm处),进行盐酸-间苯三酚染色[16],每个株系取样15株以上,观察切片80张以上。取相同部位的茎,60 ℃烘干后研磨成粉,过0.63 mm孔径筛,采用木质素含量检测试剂盒(Solarbio)测定木质素含量。
图1 CmHB15-1基因的克隆Fig.1 Cloning of the CmHB15-1 geneM:DL5000 marker.
2 结果与分析
2.1 CmHB15-1基因的克隆与序列分析
以菊花‘神马’cDNA为模板,克隆获得CmHB15-1基因(图1),其开放阅读框为2 520 bp,编码839个氨基酸,预测其蛋白质相对分子质量为 92.44×103,等电点为6.46。NCBI BLAST比对发现,CmHB15-1蛋白具有Homeobox、bZIP、START、MEKHLA结构域。CmHB15-1与除虫菊TcATHB-15、向日葵HaATHB-15、小蓬草EcATHB-15-like、洋蓟CcATHB-15-like-1都具有相同的结构域(图2)。序列比对结果显示,CmHB15-1与除虫菊TcATHB-15氨基酸序列同源性最高,为96.19%,与向日葵 HaATHB-15、小蓬草EcATHB-15-like、洋蓟CcATHB-15-like-1氨基酸序列同源性分别为90.24%、89.64%、89.29%,与拟南芥AtHB15的氨基酸序列同源性为79.22%。系统进化树分析结果显示,CmHB15-1与除虫菊TcATHB-15亲缘关系最近,CmHB15-1与拟南芥AtHB15亲缘关系较远(图3)。

图2 CmHB15-1与其他物种氨基酸同源序列比对Fig.2 Alignment of the amino acid sequence of CmHB15-1 with homologous from other speciesCm:菊花 Chrysanthemum morifolium;Tc:除虫菊Tanacetum cinerariifolium;Ha:向日葵Helianthus annuus;Ec:小蓬草Erigeron canadensis;Cc:洋蓟Cynara cardunculus var. scolymus.

图3 CmHB15-1蛋白的进化树分析Fig.3 Phylogenetic analysis of CmHB15-1 protein
2.2 CmHB15-1亚细胞定位与转录激活活性分析
亚细胞定位结果(图4)显示,在转化pORE-R4的对照组烟草中,细胞核和细胞膜上都能观察到GFP信号,而转化pORE-R4-CmHB15-1的烟草中只有细胞核上能观察到GFP信号,且与核Marker共定位,表明CmHB15-1定位于细胞核中,可能与基因转录调控相关。
由图5可见:转化pGBKT7空载的酵母在SD/-His/-Ade双缺培养基上不能正常生长,而转化pCL1和pGBKT7-CmHB15-1的酵母能够正常生长,且在添加X-α-gal的SD/-His/-Ade双缺培养基上变蓝,表明CmHB15-1具有转录激活活性,可能作为转录激活因子调控基因的表达。
2.3 CmHB15-1基因的组织特异性表达分析
如图6所示:CmHB15-1基因在茎中的表达量最高,约为根的1.3倍,在根、叶、顶芽中的表达量依次降低(图6-A)。茎顶端第3节间至茎基部第15节间中的表达分析结果显示,CmHB15-1表达量从茎顶端向基部节间逐渐增加,在茎基部节间中表达量最高,约为根的2.5倍(图6-B),推测CmHB15-1在茎组织发育中发挥一定的作用。

图4 CmHB15-1的亚细胞定位分析Fig.4 Subcellular localization of CmHB15-1 in tobacco leaves cells
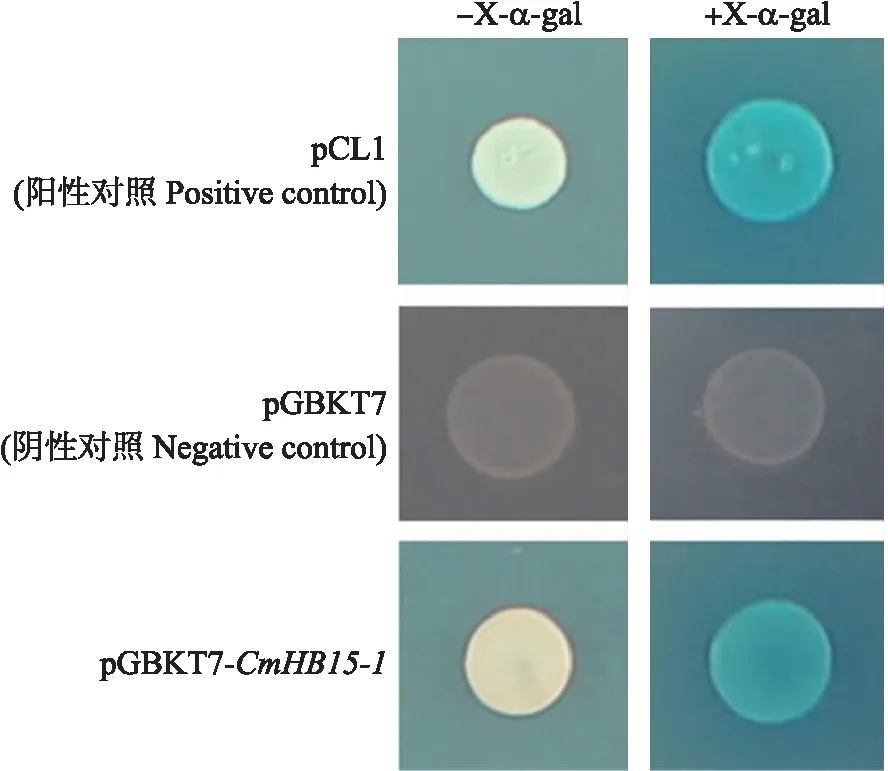
图5 CmHB15-1的转录激活活性分析Fig.5 Transcriptional activation activity analysis of CmHB15-1
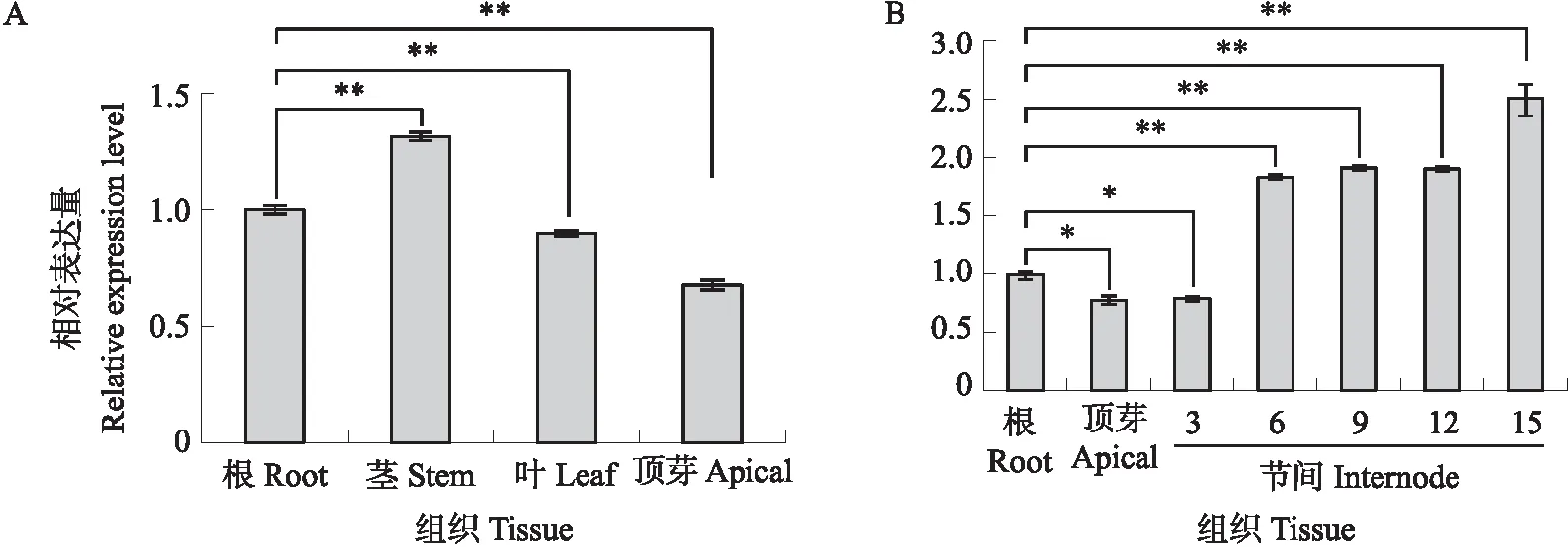
图6 CmHB15-1在菊花不同组织中的表达量Fig.6 Relative expression level of CmHB15-1 in different tissues of Chrysanthemum morifoliumA. CmHB15-1在不同组织中的表达量Relative expression level of CmHB15-1 in different tissues;B. CmHB15-1在不同组织与不同节间中的表达量Relative expression level of CmHB15-1 in different tissues and different stem internode.*P<0.05,**P<0.01. The same below.
2.4 CmHB15-1转基因拟南芥阳性苗鉴定
对转基因拟南芥植株进行DNA水平鉴定,结果(图7)显示共获得2株阳性株系OE-20、OE-23。拟南芥半定量(RT-PCR)鉴定结果显示,CmHB15-1在转基因株系OE-20、OE-23中都有表达,在阳性对照中也能检测到表达,而在野生型Col和阴性对照中未检测到表达(图8),表明转基因株系OE-20、OE-23为阳性株系,可用于后续研究。
2.5 CmHB15-1调控木质素生物合成
2.5.1CmHB15-1转基因拟南芥木质素含量由图9可见:CmHB15-1过表达转基因植株与野生型相比,其木质素染色部位增多,表现为染色加深。木质素含量测定结果显示,野生型植株木质素含量为215.25 mg·g-1,CmHB15-1过表达株系OE-20、OE-23木质素含量分别为249.65和262.46 mg·g-1,与野生型相比分别增加了15.98%和17.99%。表明过表达CmHB15-1促进木质素的生物合成。
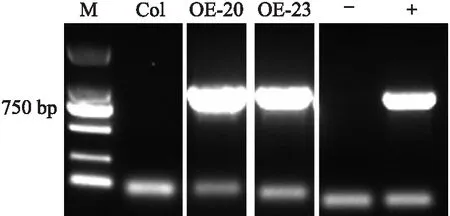
图7 CmHB15-1转基因拟南芥DNA水平鉴定Fig.7 DNA level identification of CmHB15-1transgenic Arabidopsis thaliana linesM:DL2000 marker;Col:野生型 Wild-type;OE-20,OE-23:转基因株系 Transgenic lines;-:阴性对照 Negative control;+:阳性对照 Positive control. 下同The same as follows.
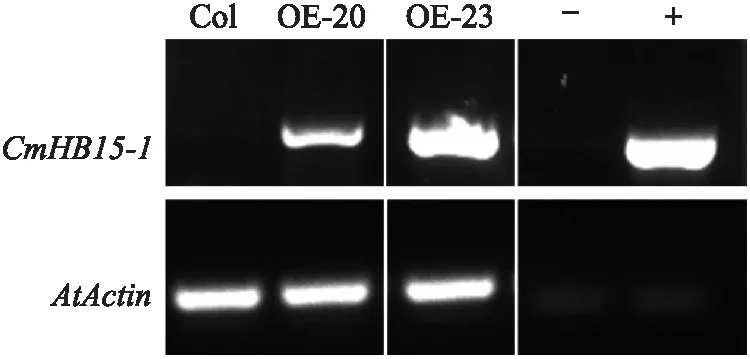
图8 CmHB15-1转基因拟南芥RT-PCR鉴定Fig.8 RT-PCR identification of CmHB15-1overexpression A.thaliana lines
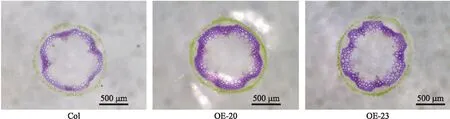
图9 野生型和 CmHB15-1转基因拟南芥植株盐酸-间苯三酚染色Fig.9 Wild-type and CmHB15-1 transgenic A.thaliana lines stained with HCl-phloroglucinol
2.5.2 拟南芥木质素合成相关基因表达量分析由图10可见:在转基因株系中木质素合成相关基因苯丙氨酸解氨酶基因(PAL1)、肉桂酸-4-羟基化酶基因(C4H)、4-香豆酰辅酶 A连接酶基因(4CL1)、咖啡酰辅酶 A甲基转移酶基因(CCoAOMT1)、阿魏酸-5-羟基化酶基因(F5H)表达量均明显上调,在转基因拟南芥植株中,PAL1、C4H、4CL1、CCoAOMT1、F5H的表达量比野生型平均上调1.68、1.41、1.46、1.31、1.35倍,推测CmHB15-1通过调控这些木质素合成相关基因的表达从而调控木质素生物合成。
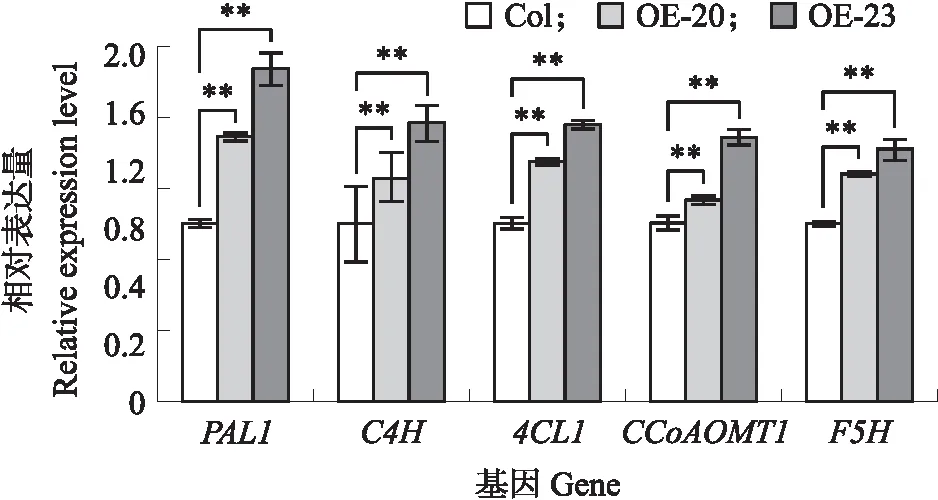
图10 CmHB15-1转基因拟南芥植株中木质素生物合成基因的表达量Fig.10 The expression level of lignin biosynthesis gene in CmHB15-1 transgenic A.thaliana plants
3 讨论
木质素是植物细胞壁的重要组成部分,对植物生长发育和环境适应性具有重要意义。木质素在植物抗倒伏和应对各种环境胁迫中发挥重要作用,与植物抗病、抗虫、耐旱、耐热、耐冷、耐重金属等耐性或抗性也有一定的相关性[1]。植物抗倒伏能力是影响植物产量与品质的重要因素,木质素含量是调控茎秆强度、增强抗倒伏能力的主要因素之一[17]。菊花作为一种观赏植物,木质素含量不仅影响其茎秆强度、抗倒伏性,还与菊花的抗虫性和抗病性密切相关。本研究从菊花‘神马’中克隆得到了CmHB15-1基因,发现其能够促进木质素生物合成,推测CmHB15-1基因可能参与茎秆强度调控。
木质素包含3种主要类型:紫丁香基木质素(S型木质素)、愈创木基木质素(G型木质素)、对羟基苯甲基木质素(H型木质素)[18]。木质素生物合成途径由一系列酶催化,PAL作为苯丙烷途径的第1个酶,具有不可或缺的作用[19]。拟南芥含有4个PAL基因(PAL1—PAL4),在发育后期,PAL1、PAL2、PAL4在茎中的表达水平相对较高[20]。C4H在苯丙烷途径的第2步发挥作用,例如拟南芥c4h突变体表现为木质素沉积减少、矮化、顶端优势丧失等[21];桉树C4H表达下调,其总木质素含量降低[22]。4CL是苯丙烷途径的关键限速酶。水稻中的5个4CL基因都是在茎中表达[23],其中4CL1基因参与木质素单体生物合成途径[24]。CCoAOMT是植物木质素生物合成的关键酶[25],CCoAOMT1的表达上调能促进木质素含量的增加[1],拟南芥ccoaomt1突变体的木质素含量低于野生型,且其G型木质素含量下调[26]。F5H的上调使G型木质素生物合成转移到S 型木质素生物合成,导致木质素的S/G摩尔比升高[27]。在水稻中,过表达F5H基因OsCAld5H1增加了S型木质素的含量,而下调F5H基因的表达则促进了G型木质素的产生[28]。对木质素合成的转录调控多集中在NAC和MYB调控因子以及它们的下游基因[18],拟南芥AtHB15通过调控木质素合成基因PAL4、CCoAOMT、CCR1、CCR2的表达,以及NAC调控因子SND1和NST2的表达调控次生细胞壁的发育[12]。本研究发现,菊花CmHB15-1超表达拟南芥植株中木质素含量增加,拟南芥中AtHB15抑制木质素的合成。序列分析结果显示,菊花CmHB15-1与拟南芥AtHB15的序列同源性仅为79.22%,推测基因序列的差异可能导致其功能差异。此外,氨基酸序列的差异可能导致蛋白空间结构的不同,从而改变其与其他蛋白的互作关系及对下游靶基因的转录调控作用。菊花HB15家族成员与拟南芥AtHB15可能对木质素合成调控的作用不同,暗示2个物种的HB15基因调控木质素合成的机制不同,HB15基因的功能存在物种差异性。在HB15所属的HD-ZIP Ⅲ转录因子家族成员中已有相关报道,如REVOLUTA(REV)与AtHB15同属于HD-ZIP Ⅲ转录因子家族,在拟南芥Col背景下,REV促进木质素合成,rev功能缺失突变体表现为束间纤维缺失;但在拟南芥Ler背景下,束间纤维含量基本不受REV基因的影响[5],即同一个基因在不同遗传背景材料中功能亦不相同。表明HD-ZIP Ⅲ 转录因子家族在木质素合成调控中的作用机制存在复杂性。本研究发现CmHB15-1能够上调PAL1、C4H、4CL1、CCoAOMT1、F5H的表达,推测其通过调控木质素生物合成基因的表达从而促进木质素含量的增加,而关于菊花CmHB15-1与NAC或MYB调控因子的作用及其对次生细胞壁的影响还有待进一步探究。
综上,本研究表明菊花CmHB15-1基因能够调控木质素合成,为调控茎秆强度、培育抗倒伏品种及抗虫和抗病性等方面研究奠定了基础,但其在菊花木质素合成调控中的作用和分子机制还有待进一步研究。
