中华绒螯蟹血细胞体外原代培养条件研究
2023-05-23苏慧肖喜悦郭利荣张广成王丽燕
苏慧 肖喜悦 郭利荣 张广成 王丽燕


摘要 为研究中华绒螯蟹血细胞的体外培养方法,分别从培养基、渗透压、胎牛血清和添加生长因子等培养条件进行探讨。结果表明,在23 ℃、2.5% CO2条件下,在L-15培养基中添加200 IU/mL双抗和1‰葡萄糖,400~600 mOsm/kg渗透压,4~5 d半换液,中华绒螯蟹血细胞可存活10 d以上。该研究建立了中华绒螯蟹血细胞体外原代培养体系,为深入研究中华绒螯蟹血细胞分子免疫机制研究奠定了理论和技术基础。
关键词甲壳动物;中华绒螯蟹;血细胞;细胞培养
中图分类号S96文献标识码A
文章编号0517-6611(2023)08-0086-05
doi:10.3969/j.issn.0517-6611.2023.08.020开放科学(资源服务)标识码(OSID):
Study on the Primary Cell Culture Conditions of Hemocytes from Eriochier sinensis in vitro
SU Hui XIAO Xi-yue GUO Li-rong et al(1.School of Life Sciences,Tianjin Normal University,Tianjin 300387;2.Tianjin Normal University/Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin 300387)
AbstractThe method of culturing Eriocheir sinensis hemocytes in vitro was studied from the aspects of culture medium,osmotic pressure,fetal bovine serum and adding growth factors.The results showed that E.sinensis hemocytes could survive for more than 10 days under the culture conditions of 23 ℃,2.5% CO2,using L-15 culture medium,adding 200 IU/mL double antibody and 1‰ glucose,change 50% of the liquid after 4-5 days at the osmotic pressure of 400-600 mOsm/kg.The primary culture system of E.sinensis hemocytes in vitro was established,which laid the theoretical and technical foundation for further research on the molecular immune mechanism of E.sinensis hemocytes.
Key wordsCrustacean;Eriocheir sinensis;Hemocytes;Cell culture
甲殼类动物是全球水产养殖系统的重要组成部分,每年销售额超过100亿美元[1]。中华绒螯蟹是一种具有重要经济价值的蟹种[2]。过去几十年,由于养殖密度过高和各种疾病暴发造成了甲壳类水产养殖业的巨大损失[3]。因此,防控疾病发生至关重要,其中细胞体外培养技术可为其提供基础理论和实验研究平台,然而目前尚无甲壳动物细胞系成功建立的报道。
甲壳动物细胞体外培养研究目前主要集中在细胞培养组织、培养基的选择与优化、培养条件的改善等方面。其中培养较好的是斑节对虾卵巢和心脏组织,Owens等[4]和Fraser等[5]分别采用Grace培养基和 L-15 培养基对其进行体外培养,发现斑节对虾卵巢的上皮样细胞在Grace培养基中的生存期可达2个月,成纤维样细胞在L-15培养基中可生存3~9个月。在淡水龙虾造血干细胞体外培养过程中,Sderhll 等[6]研究发现添加造血因子后其在体外的生存期可达1个月。目前,甲壳动物在体外培养过程中存在传代困难等问题。
由于缺乏获得性免疫力,甲壳类动物只有先天免疫力,其血细胞在免疫过程中起着重要作用。当外来病原体侵入机体时,血淋巴将通过吞噬、包囊等细胞免疫反应,产生一些体液免疫分子,如活性氧(ROS)、一氧化氮(NO)等,来响应免疫应答反应[7-8]。研究机体的分子免疫机制、提高物种的免疫力和抗病力已成为甲壳类动物研究领域关注的重心[9]。中华绒螯蟹(Eriochier sinensis)是弓蟹科绒螯蟹属甲壳类动物,又名河蟹、大闸蟹,是中国传统水产珍品。中华绒螯蟹在不同生活环境、不同生存压力下其血细胞的分类存在较大差异,所需的培养条件也不同。笔者通过探究中华绒螯蟹血细胞的体外培养条件,以期获得中华绒螯蟹血细胞体外培养体系,为深入研究中华绒螯蟹血细胞分化和分子免疫机制奠定理论和技术基础。
1材料与方法
1.1试验材料
1.1.1试验动物。中华绒螯蟹取自天津市王顶堤海鲜批发市场,体质量(9.9±0.8) g的小螃蟹和体质量(72.2±3.2) g的大螃蟹试验前置于深缸中淡水养殖;体质量(125.0±1.5) g的中华绒螯蟹试验前置于盐度21‰的海水中养殖,养殖温度为22 ℃,每天喂食1次,使其适应环境。试验时选择健康、有活力的中华绒螯蟹用于试验,所有细胞培养试验所用动物均为淡水饲养。
1.1.2试验试剂。L-15培养基、DMEM/F12培养基、M199培养基、MEM培养基,购自西格玛奥德里奇(上海)贸易有限公司;FBS,购自Thermo Fisher公司;Human EGF、Human FGF-basic,购自PeproTech公司;PBS,购自上海生工生物工程有限公司;抗凝剂为29.6 mmol/L柠檬酸钠、167.7 mmol/L NaCl、100 mmol/L葡萄糖、30 mmol/L柠檬酸、10 mmol/L EDTA-2Na,pH 7.2。所有试剂均为进口或国产分析纯。
1.1.3试验仪器与耗材。超低温冰箱(Thermo)、超净工作台(AIRTECH)、移液枪(Eppendorf)、离心机(Eppendorf)、恒温培养箱(常州诺基仪器有限公司)、高压灭菌锅(TsaoHisn)、注射器、解剖器、细胞培养板及细胞爬片等。
1.2试验方法
1.2.1中华绒螯蟹渗透压和pH的测定。选取状态良好的中华绒螯蟹,测定体长、体宽、体高、体质量,酒精棉球(含75%乙醇)消毒处理。用一次性注射器从中华绒螯蟹的最后一对附属肢处抽取0.5 mL血淋巴,立即置于冰上预冷好的1.5 mL无酶EP管中,使用 Fiske冰点渗透压仪测量血淋巴渗透压,重复3次,取平均值。同时,利用pH计测定血浆pH。
1.2.2不同渗透压培养。取合适的中华绒螯蟹,用酒精棉球(含75%乙醇)消毒处理。用一次性注射器从中华绒螯蟹最后一对附属肢处抽取0.5 mL血淋巴,与相同体积抗凝剂混合均匀。4 ℃ 2 000 r/min离心5 min,得到血细胞沉淀;再用PBS清洗沉淀的血细胞3次,2 000 r/min 离心5 min,收集血细胞。通过高浓度的生理盐水将 L-15培养基渗透压分别调整为400、600、800和1 000 mOsm/kg,将收集的血细胞分别重悬于这4种渗透压的培养基中,吹吸混匀,对细胞进行计数,按照5×10 cells/mL的细胞密度接种至96孔细胞培养板中,每孔100 μL培养基,置于23 ℃培养箱中,培养液pH为7.5。
1.2.3不同培养基培养。根据前面的试验结果,选择合适的渗透压。将收集的血细胞分别重悬于M199、DMEM/F12、L-15和MEM培养基中,吹吸混匀,按照5×105cells/mL的细胞密度接种至96孔细胞培养板中,每孔100 μL培养基,置于23 ℃培养箱中,培养液pH为7.5。
1.2.4不同浓度胎牛血清培养。选取合适的培养基和渗透压,在该培养基中分别添加0、5%、10%、15%和20% FBS,吹吸混匀,按照5×10cells/mL的细胞密度接种至96孔细胞培養板中,每孔100 μL培养基,置于23 ℃培养箱中,培养液pH为7.5。
1.2.5添加生长因子培养。在以上最适的培养条件下,在血细胞的培养过程中添加10 ng/mL b-FGF和EGF生长因子,通过存活率和细胞形态来观察添加生长因子对血细胞培养的影响。
2结果与分析
2.1中华绒螯蟹血细胞渗透压测定使用冰点渗透压仪测得体质量(9.9±0.8) g的小螃蟹血淋巴渗透压为600 mOsm/kg,体质量(72.2±3.2) g的大螃蟹血淋巴渗透压为440 mOsm/kg,而体质量(125.0±1.5) g的海水养殖中华绒螯蟹血淋巴渗透压为1 018 mOsm/kg。3种中华绒螯蟹血淋巴pH相差不大,均为7.4~7.6。
2.2不同渗透压对中华绒螯蟹血细胞培养的影响为确定体外培养中华绒螯蟹血细胞的最佳渗透压,根据中华绒螯蟹血淋巴渗透压的测定结果,设定渗透压为400~1 000 mOsm/kg,结果显示体外培养3 d的中华绒螯蟹血细胞在渗透压400~600 mOsm/kg 条件下细胞贴壁良好,形态完整,细胞脱颗粒和破裂现象较少;当渗透压在800 mOsm/kg 以上时,细胞开始皱缩成圆形,经台盼蓝染色发现当渗透压在800 mOsm/kg以上时培养的血细胞基本死亡(图1)。
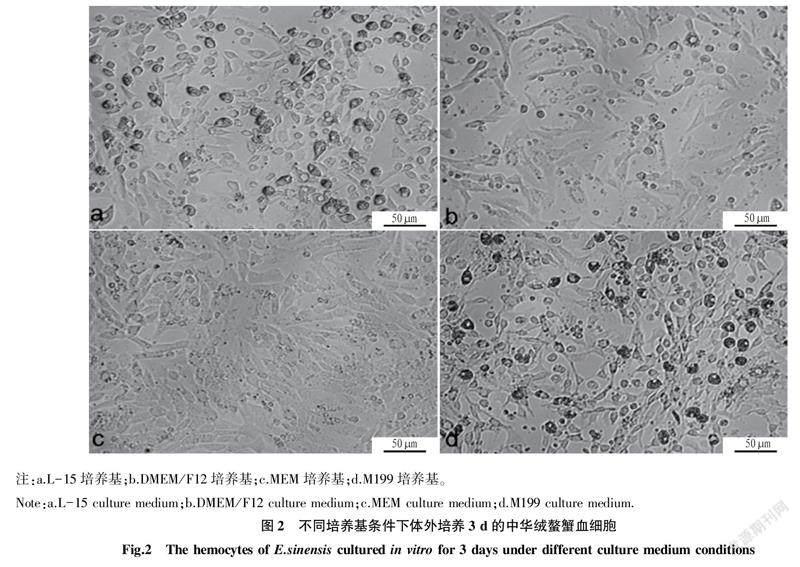
2.3不同培养基培养对中华绒螯蟹血细胞培养的影响选择M199、DMEM/F12、L-15、MEM培养基分别进行中华绒螯蟹血细胞的体外培养,结果发现在不同培养基中培养12 h时血细胞均贴壁;培养3 d时DMEM/F12和 M199培养基培养的血细胞出现明显的细胞碎片和细胞破碎现象(图2)。L-15和MEM 培养基中的血细胞则能保持较好的形态和细胞活力,但MEM培养基中的血细胞存活时间较短,培养4~6 d 细胞基本丧失活力,细胞破碎比较明显。
2.4不同胎牛血清浓度对中华绒螯蟹血细胞培养的影响胎牛血清(FBS)在细胞培养的过程中经常被作为一种重要的营养物质。在中华绒螯蟹血细胞的培养过程中,添加胎牛血清后培养的血细胞易聚集成团,更早出现细胞破裂、颗粒散逸的现象,细胞碎片增多,且这种现象随着胎牛血清浓度的增加而变得更加明显(图3)。因此,在体外培养中华绒螯蟹血细胞的过程中并不适合添加胎牛血清。
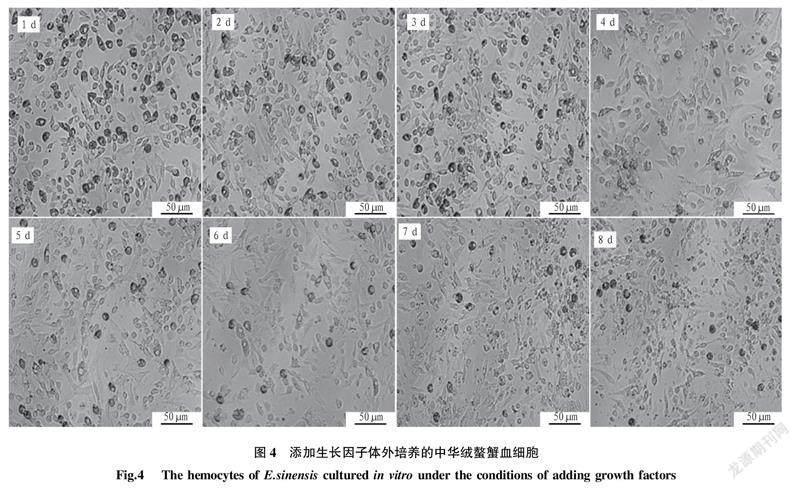
2.5添加生长因子对中华绒螯蟹血细胞培养的影响生长因子作为一种调节细胞分裂增殖的多肽类物质,可以促进DNA合成和细胞有丝分裂,从而使细胞增殖。在最适条件下培养的中华绒螯蟹血细胞中添加EGF和b-FGF 2种混合生长因子,结果发现血细胞的存活和增殖情况与生长因子的添加与否没有明显关联性(图4)。
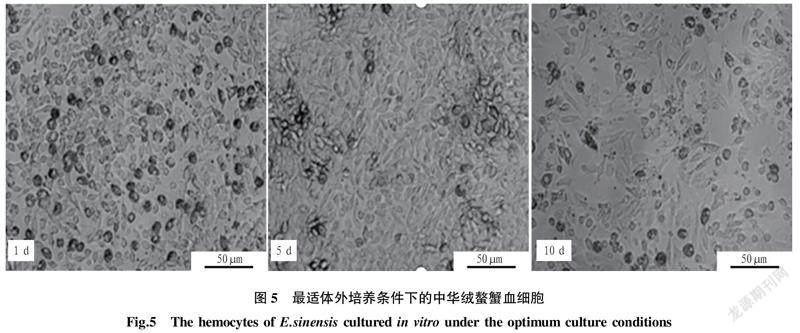
2.6最适条件下培养中华绒螯蟹血细胞体外培养中华绒螯蟹血细胞的最适培养条件如下:在L-15培养基中,调节渗透压为400~600 mOsm/kg,不添加胎牛血清,添加200 IU/mL双抗和1‰葡萄糖,4~5 d半换液,在23 ℃、2.5% CO2培养箱中培养的血细胞可存活10 d以上(图5)。
3讨论
无论是高等哺乳动物还是低等无脊椎动物,基因功能的深入研究离不开体外细胞培养[10],因此建立甲壳动物永生细胞系是当前迫切需要的。甲壳动物一般为变渗动物,在不同生活环境和不同生长阶段甲壳动物体内的渗透压都可能会发生变化。为探讨中华绒螯蟹血细胞体外培养的最佳渗透压,笔者对不同个体大小的中华绒螯蟹血淋巴渗透压进行测定,结果发现在淡水养殖中体质量(72.2±3.2) g的大螃蟹血淋巴渗透压为440 mOsm/kg,体质量(9.9±0.8) g的小螃蟹血淋巴渗透压为600 mOsm/kg,而体质量(125.0±1.5) g的海水养殖中华绒螯蟹血淋巴渗透压为1 018 mOsm/kg。鉴于不同规格中华绒螯蟹的渗透压情况,对培养的中华绒螯蟹血细胞渗透压进行比较,结果发现在渗透压400~600 mOsm/kg下血细胞生长状态良好,这与淡水养殖大螃蟹血淋巴渗透压大小基本一致。同样地,在斑节对虾淋巴器官体外培养的过程中,在渗透压470~500 mmol/kg下培养的细胞贴壁和生长最好[11]。杨鹤等[10]研究发现中华绒螯蟹血细胞在渗透压991 mOsm/kg条件下生长状态较好,养殖环境和螃蟹个体大小等可能对体外培养细胞的渗透压造成影响。因此,不同动物不同组织细胞的体外培养应选择合适的渗透压条件。
细胞培养基的选择对体外细胞培养至关重要。目前尚没有针对水产动物细胞的专用培养基。L-15、DMEM、M199等培养基在甲壳动物的细胞培养中成功培养了原代细胞[5,8,12]。该研究选取了甲壳动物细胞体外培养过程中常见的几种培养基,包括L-15培养基、M199培养基、MEM培养基和DMEM/F12培养基,研究发现L-15培养基中培养的中华绒螯蟹血细胞状态更好。L-15培养基一般被认为是最适宜甲壳动物细胞培养的培养基[13],在红螯螯虾(Cherax quadricarinatus)、凡纳滨对虾(Litopenaeus vannamei)、拟穴青蟹(Scylla paramamosain)和克氏原螯虾(Procambarus clarkii)血细胞原代培养中均表现出较好的培养效果[14-17]。M199培养基在日本对虾(Penaeus japonicus)血细胞培养中得到了应用[18]。
胎牛血清对于高等动物细胞培养是不可或缺的,是细胞培养中重要的添加物之一[19-21],但也有学者认为添加胎牛血清会对细胞培养产生不利影响[22-23]。笔者在中华绒螯蟹血细胞体外培养过程中添加不同浓度的胎牛血清(0、5%、10%、15%、20%),结果发现添加胎牛血清后的血细胞比未添加胎牛血清的血细胞更早出现细胞破裂、颗粒化等现象,这与洪宇航等[24]的研究结果相似。由此可见,中华绒螯蟹血细胞体外培养不适合添加胎牛血清。尽管胎牛血清在许多研究中已被用于甲壳类细胞培养,但它不会诱导长期细胞存活或刺激细胞分裂,甚至可能对细胞生长产生不利的影响[25],这种现象可能是由于不同物种间的巨大差异所致。细胞因子的添加对于细胞增殖也具有促进效果。例如,基础成纤维生长因子在斑节对虾细胞培养中具有明显效果[11]。但是,在中华绒螯蟹血细胞中添加b-FGF和EGF后血细胞的存活和增殖情况并没有明显的变化。
笔者研究了4种培养基(M199、DMEM/F12、L-15、MEM)、不同渗透压(400、600、800、1 000 mOsm/kg)、不同胎牛血清濃度(0、5%、10%、15%、20%)以及添加2种生长因子EGF和b-FGF条件下中华绒螯蟹血细胞的培养情况,结果发现在L-15培养基中,调节渗透压为400~600 mOsm/kg,不添加胎牛血清,添加200 IU/mL 双抗和1‰葡萄糖,4~5 d半换液,在23 ℃、2.5% CO2的培养箱中中华绒螯蟹血细胞可存活10 d以上。该研究结果为连续性体外细胞培养条件的建立奠定了基础。
参考文献
[1] JOHNSON K N,VAN HULTEN M C W,BARNES A C.“Vaccination” of shrimp against viral pathogens:Phenomenology and underlying mechanisms[J].Vaccine,2008,26(38):4885-4892.
[2] 贾志浩.中华绒螯蟹造血组织及造血作用机理的研究[D].北京:中国科学院大学,2018.
[3] STENTIFORD G D.Diseases in aquatic crustaceans:Problems and solutions for global food security[J].Journal of invertebrate pathology,2012,110(2):139.
[4] OWENS L,SMITH J.Early attempts at production of prawn cell lines[J].Methods in cell science,1999,21(4):207-212.
[5] FRASER C A,HALL M R.Studies on primary cell cultures derived from ovarian tissue of Penaeus monodon[J].Methods in cell science,1999,21(4):213-218.
[6] SDERHLL I,KIM Y A,JIRAVANICHPAISAL P,et al.An ancient role for a prokineticin domain in invertebrate hematopoiesis[J].The journal of immunology,2005,174(10):6153-6160.
[7] LEMAITRE B,HOFFMANN J.The host defense of Drosophila melanogaster[J].Annual review of immunology,2007,25:697-743.
[8] BOEHM T.Evolution of vertebrate immunity[J].Current biology,2012,22(17):R722-R732.
[9] LIU H,SDERHLL I.Histone H2A as a transfection agent in crayfish hematopoietic tissue cells[J].Developmental & comparative immunology,2007,31(4):340-346.
[10] 杨鹤,岳武成,侯鑫,等.中华绒螯蟹血细胞的原代培养及其管家基因检测[J].农业生物技术学报,2019,27(9):1703-1710.
[11] HSU Y L,YANG Y H,CHEN Y C,et al.Development of an in vitro subculture system for the Oka organ (Lymphoid tissue) of Penaeus monodon[J].Aquaculture,1995,136(1/2):43-55.
[12] 罗鹏,邱德全.凡纳滨对虾血淋巴、类淋巴细胞培养[J].海洋通报,2005,24(1):27-30.
[13] SHASHIKUMAR A,DESAI P V.Development of cell line from the testicular tissues of crab Scylla serrata[J].Cytotechnology,2011,63(5):473-480.
[14] 段虎.红螯螯虾(Cherax quadricarinatus)血细胞培养及细胞免疫学研究[D].青岛:中国科学院研究生院(海洋研究所),2014.
[15] 郑玉忠,刘亚群,刘昂,等.凡纳滨对虾血淋巴细胞的原代培养与研究[J].中国农业信息,2015(19):73-74.
[16] 乔琨,张亚群,王书平,等.拟穴青蟹血细胞原代培养及条件优化[J].中国畜牧兽医,2014,41(9):145-149.
[17] 魏静,陆承平,黄捷,等.克氏原螯虾的血淋巴细胞原代培养[J].畜牧与兽医,1999,31(5):11-12.
[18] 王军霞,王维娜,王安利,等.日本对虾血淋巴和肌肉的原代培养[J].海洋科学,2003,27(3):61-63.
[19] CHEN S N,WANG C S.Establishment of cell culture systems from Penaeid shrimp and their susceptibility to white spot disease and yellow head viruses[J].Methods in cell science,1999,21(4):199-206.
[20] MULFORD A L,LYNG F,MOTHERSILL C,et al.Development and characterization of primary cell cultures from the hematopoietic tissues of the Dublin Bay prawn,Nephrops norvegicus[J].Methods in cell science:An official journal of the society for in vitro biology,2000,22(4):265-275.
[21] TONG S L,MIAO H Z.Attempts to initiate cell cultures from Penaeus chinensis tissues[J].Aquaculture,1996,147(3/4):151-157.
[22] LUEDEMAN R A,LIGHTNER D V.Development of an in vitro primary cell culture system from the penaeid shrimp,Penaeus stylirostris and Penaeus vannamei[J].Aquaculture,1992,101(3/4):205-211.
[23] FRERICHS G N.In vitro culture of embryonic cells from the freshwater prawn Macrobrachium rosenbergii[J].Aquaculture,1996,143(3/4):227-232.
[24] 洪宇航,杨筱珍,張金彪,等.中华绒螯蟹血细胞原代培养条件的优化[J].动物学杂志,2012,47(2):52-58.
[25] ZHU Y T,JIN X K,FANG Z Y,et al.A novel Eriocheir sinensis primary hemocyte culture technique and its immunoreactivity after pathogen stimulation[J].Aquaculture,2015,446:140-147.
