低氮胁迫下外源色氨酸对高粱幼苗根系伸长的调控作用
2023-03-23刘春娟郭俊杰武宇昕邓志成周宇飞
李 邦 刘春娟 郭俊杰 武宇昕 邓志成 张 敏 崔 彤 刘 畅 周宇飞
低氮胁迫下外源色氨酸对高粱幼苗根系伸长的调控作用
李 邦**刘春娟**郭俊杰 武宇昕 邓志成 张 敏 崔 彤 刘 畅 周宇飞*
沈阳农业大学农学院, 辽宁沈阳 110866
低氮胁迫促进高粱根系伸长, 但其具体的生理机制仍不清晰。为解析高粱根系在低氮胁迫下伸长的生理机制, 本试验选用高粱耐低氮自交系(398B)和氮敏感自交系(CS-3541)为材料, 研究低氮胁迫下高粱根系伸长的物质和能量代谢基础。结果表明, 与正常氮相比, 低氮胁迫显著促进了398B和CS-3541根长及根尖细胞长度, 398B表现出更长的根长; 低氮胁迫后1、5和10 d, 398B和CS-3541根系中内源色氨酸含量显著增加; 应用RNA-seq技术对2个高粱自交系低氮胁迫后根系样品进行差异表达基因鉴定, 结果发现色氨酸代谢途径的有关基因参与了低氮下高粱根系的伸长。进一步利用外源色氨酸处理发现, 外源色氨酸通过增加生长素含量, 激活了质膜H+-ATPase的活性, 促进质膜酸化, 提高了能量代谢相关酶活性及ATP含量, 从而诱导了根系的能量代谢, 促进了低氮胁迫下高粱根系的伸长。而且, 外源色氨酸对低氮胁迫下398B的作用效果更好。综上所述, 低氮胁迫处理激活了内源色氨酸在高粱根系伸长中的关键作用, 依赖色氨酸途径合成的生长素及协同提高的能量代谢是促进低氮下高粱根系伸长的生理机制。
高粱; 低氮; 外源色氨酸; 生长素; 能量代谢; 根伸长
高粱((L.) Moench)是我国北方地区重要的粮食作物, 属于短日照C4植物, 生长能力较强, 往往被作为先锋作物种植在瘠薄的土壤中[1]。随着我国农业供给侧改革的深化, 高粱以其优异的耐贫瘠性成为种植业结构调整中重要的替代作物[2]。而贫瘠土地常常会导致土壤氮素供应不足, 影响高粱对氮素的吸收利用[3]。因此, 筛选耐低氮胁迫能力较强的高粱种质并研究其耐低氮生理机制, 对于有效利用贫瘠土地, 实现高粱高产稳产具有重要的现实意义[4-5]。根系具有可塑性, 在不同的生长环境下根系形态会发生变化, 低氮胁迫会显著促进根系伸长[6-7]。当氮素供应受限制时, 作物会将资源优先分配给根系, 保障根系的构建和功能, 而发达的根系是实现作物高产、稳产的必要保障[8-9]。研究表明玉米长而深的根系是其氮素有效吸收的必要条件[10]。同时, 玉米根长的增加显著提高了其耐低氮胁迫能力[11]。低氮环境下, 植株根系伸长生长, 利于植株寻找更多氮源[12-13]。因此, 在低氮条件下, 培养植物深根系统的能力对增强植物的耐低氮能力至关重要。
色氨酸作为重要的氨基酸之一, 在增强植物抗逆能力方面表现突出[14]。色氨酸可以通过提高根系对营养和水分的吸收, 从而增强植物的抗胁迫能力[15-16]。色氨酸作为生长素的合成前体, 依赖色氨酸途径是生长素合成的主要途径[17-18]。色氨酸氨基转移酶1 (TAA1)及其同源物TAR1和TAR2通过色氨酸依赖途径将L-色氨酸转化为吲哚-3-丙酮酸(indole-3-pyruvic acid, IPyA)[19], 黄素单加氧酶YUCCA (YUC)酶催化IPyA合成IAA[20-21]。在生长素介导的根系发育过程中发挥重要作用, 拟南芥突变体中在低氮条件下调节根系结构, 抑制了生长素在根系中的积累[22]。水稻中的过表达引起根尖生长素含量升高, 增加了根系的数量, 但抑制了根的伸长[23]。Zhang等[24]研究发现,是一个关键的硝酸盐信号调节因子, 它直接与启动子结合并激活其表达, 维持根原基的生长素信号, 色氨酸通过合成生长素促进了硝酸盐介导的根系发育。外源色氨酸可以刺激藜麦根部生长素的合成, 从而改善植株的生长, 提高藜麦的抗逆性[25]。另外, 生长素能够激活根系中质膜 H+-ATPase活性, 质膜H+-ATPase负责外质体酸化(以生长素诱导的方式)并激活细胞壁扩张相关酶的活性, 诱导的H+流出并且参与到细胞壁松动中, 进而通过酸化作用促进根系伸长[26]。综合分析表明, 色氨酸作为生长素前体诱导根系伸长的路径较为明确, 然而, 色氨酸对于植物生长的影响并不仅限于生长素的作用[27]。并且, 色氨酸在高粱抗逆研究中也鲜见此类报道, 因此进一步揭示低氮胁迫下色氨酸对高粱根系形态调控的生理机制具有重要意义。
植物生长伴随着能量代谢, 通过糖酵解、磷酸戊糖途径和三羧酸循环, 释放的能量保存在ATP中, 为生命活动提供能量来源[28]。然而上述能量转化过程易受环境的影响, 例如为提高干旱适应性, 杜仲叶片通过增强糖酵解途径和磷酸戊糖途径增加ATP、NADPH等能量物质, 维持在干旱环境中的生长[29]。研究表明, 施氮可以上调大部分糖酵解相关蛋白的含量, 增加糖酵解过程[30]。另外, 增施氮提高了低温条件下番茄叶片碳水化合物和能量代谢相关蛋白含量, 增加了能量代谢过程中的丙酮酸激酶活性[31]。江立庚等[32]研究表明, 在低氮胁迫下, 氮吸收效率高的水稻品种根系中具有较高的ATP含量。而低氮环境下, 植物是否也可能通过调节植株能量和物质代谢来响应低氮胁迫仍需深入研究[33]。色氨酸不仅是生长素的合成前体, 也是蛋白质合成的前体, 因此, 是影响植物生长发育中的重要物质[27]。黎旺姐[34]研究发现, 包括色氨酸在内的多种氨基酸参与蛋白质合成, 为植物体内的物质代谢和能量代谢提供底物。然而, 在特定条件下(如低氮胁迫)色氨酸参与植物生长和能量代谢中的作用仍不十分清楚。
本研究以高粱耐低氮自交系和氮敏感自交系为材料, 通过分析低氮胁迫下不同耐低氮自交系根系生长的响应差异和外源色氨酸对根系伸长调控的生理机制, 系统研究色氨酸诱导的根系生长素及协同的能量代谢变化, 探明高粱在低氮胁迫下的适应性, 为充分发挥高粱作为先锋作物的作用, 培育耐低氮高粱种质资源提供理论依据。
1 材料与方法
1.1 试验材料与设计
试验在沈阳农业大学高粱生理实验室进行, 选用高粱耐低氮自交系398B和高粱氮敏感自交系CS-3541为试验材料。选取大小相近的高粱自交系种子进行萌发。用10%次氯酸钠溶液消毒种子5~10 min, 用蒸馏水冲洗。随后, 放置在培养皿中潮湿的滤纸上, 然后放在培养箱中进行培养。培养箱设置温度为28℃/25℃日/夜, 光周期12 h, 光强为280 μmol m–2s–1。3 d后选取发育良好的幼苗20株, 插入黑色培养盒中, 蒸馏水培养3 d后, 将营养液改为1/2 Hoagland溶液培养3 d后, 以0.05 mol L–1氮源的1/2 Hoagland营养液进行低氮处理(low nitrogen, LN), 以1/2 Hoagland营养液为对照(normal nitrogen, NN)。
外源色氨酸(Trp)处理: 本试验选择叶面喷施色氨酸, 色氨酸浓度为50 mg L–1, 在低氮胁迫处理同时进行外源色氨酸的喷施(LN-T), 对照培养也喷施同样浓度色氨酸(NN-T)。外源色氨酸连续喷施3 d, 每天上午09:00喷施一次, 喷施状态均以叶片表面形成水滴而不掉落为准, 并加入0.1%的吐温(Tween)作为粘合剂, 在外源喷施色氨酸后1、5和10 d, 取每个处理长势一致的高粱幼苗进行根系扫描及相关生理指标的测定。
1.2 测定内容与方法
1.2.1 根长、根系形态及根尖细胞长度测定 每个处理中选取长势一致的10株高粱幼苗, 使用直尺测定每株高粱幼苗的根长(植株基部到根系形态学最下端的绝对距离)。在树脂玻璃槽内注水5~10 mm深, 将根系样品放置在树脂玻璃槽内, 使根系完全被水淹没过并充分展开, 用根系扫描仪(The LA2400 Scanner 2014)进行根系扫描, 之后使用WinRHIZO Pro 2013e软件(Regent Instruments Inc., 加拿大)进行分析, 获得总根长、根尖数和根系平均直径。在低氮处理后10 d, 切取高粱幼苗根尖15~20 mm, 用固定液固定。将固定好的根尖脱水、透明、包埋、切片、番红染色2 h、用不同梯度酒精脱色、固绿染色、二甲苯透明、中性树胶封片。使用扫描仪(Pannoramic DESK, P-MIDI, P250, 匈牙利)对切片进行扫描, 利用扫描软件(Pannoramic Scanner)对切片进行观察的处理。
1.2.2 全氮含量测定 将烘干后的样品用粉碎机粉碎, 取0.3 g样品放入到消煮管内, 加入10 mL浓硫酸进行消煮, 直至消煮液澄清, 用蒸馏水定容至100 mL待用。使用SmarChem 200 全自动化学分析仪测定全氮含量。
1.2.3 色氨酸含量测定 称取根系样品0.2 g置于水解管内, 加入1 g Ba(OH)2·8H2O及2 mL 5 g L–1淀粉溶液, 摇匀后放入沸水浴中加热溶解5 min, 取出抽真空封管, 置110℃烘箱内水解24 h。取出水解管待冷却至室温后打开管口, 在冰水浴中将试管内容物全部转入预先加有2 mL 4 mol L–1HCl的5 mL容量瓶中, 调整溶液pH 6.0, 待至室温后用超纯水定容至10 mL, 经0.45 μm滤膜过滤后即为样品测定液, 取标准工作液及样品测定液各20 μL, 利用高效液相色谱仪(安捷伦HPLC1100)进行测定。
1.2.4 根系ATP含量测定 取0.5 g幼苗根系, 加入5%三氯乙酸, 在冰浴条件下研磨, 用NaOH中和pH至7.5, 倒入刻度试管定容至5 mL, 在4℃ 13,000´条件下离心15 min, 上清液即为ATP提取液, 将上清液倒入试管, 置于冰水浴中备用。取0.2 mL ATP提取液和0.8 mL荧光素酶溶液于比色皿中, 放入FQ-300发光光度计, 记录发光峰值。
1.2.5 质外体pH值测定 将新鲜根系用去离子水洗净, 并用滤纸吸干水分。称取1.5 g根系放入50 mL注射器, 再加入280 mol L–1山梨醇溶液30 mL。堵住注射器出口, 用力抽气1 min, 使山梨醇溶液渗入根系质外体中, 紧接着用力压气1 min, 本过程重复10次, 直至根系表面积有大量小气泡为止, 取出根系, 吸干表面水分, 在4℃ 2000´离心10 min, 得到质外体提取液。质外体pH值用微电极(Mettler Toleab, Inlab 423, Electroly, 9811)直接在微型离心管内测定。
1.2.6 生长素含量及能量代谢相关酶活性测定 称取1 g根系样本, 加入9 mL PBS (pH 7.2~7.4, 浓度为0.01 mol L–1), 冰浴研磨至匀浆, 在4℃ 4000´离心10 min, 取上清液待测。生长素含量, 质膜H+-ATPase活性, 丙酮酸激酶活性, 柠檬酸合酶活性, α-酮戊二酸脱氢酶活性和6-磷酸葡萄糖脱氢酶活性采用索宝来试剂盒进行测定。以空白孔调零, 450 nm 波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min以内进行。
1.2.7 差异基因表达量测定 取高粱幼苗根尖, 进行差异基因表达量的测定。使用TRIzol法进行总RNA的提取, 每组样本进行3次生物学重复。用Prime-ScriptTMRT试剂盒去除基因组并反转录生成模板cDNA, 进行3次生物学重复。RT-qPCR在Light-Cycler 96仪器(Roche Applied Science, 德国)中进行, 反应体系(10 μL)为: cDNA (10×) 1 μL, SYBR Green 4 μL, qRT-Primer F 1 μL, qRT-Primer R 1 μL, ddH2O 3 μL。RT-qPCR反应条件为: 95℃预变性10 min; 95℃ 10 s, 55℃ 10 s, 72℃ 30 s, 40个循环。在PCR反应结束时, 生成溶解曲线, 以评估PCR引物特异性。根据扩增的循环数(CT值), 采用2–ΔΔCT方法对数据进行相对定量分析。用于qRT-PCR的基因ID和引物信息如表1所示。
1.2.8 转录组测定 采用TRIzol试剂(Invitrogen)提取根系总RNA, 挑选合格RNA样品进行高通量测序, 由武汉迈特维尔生物科技有限公司完成转录组测序。利用带有Oligo(dT)对样品总RNA进行mRNA分离, 然后将mRNA随机断裂。以片段化的mRNA为模板, 在逆转录酶的作用下合成双链cDNA, 经末端修复、加碱基A形成接头。通过PCR扩增进行文库富集, 进行文库制备工作, 将构建好的文库上机进行测序。利用Kyoto Encyclopedia of Genes and Genomes (KEGG)数据库对DEGs进行差异表达基因的KEGG Pathway富集分析。
1.3 数据分析
利用Microsoft Excel 2010软件对数据进行整理,采用SPSS18.0对试验数据进行统计分析, 并用Graph Pad Prism 8.0作图。

表1 试验所用基因引物序列
2 结果与分析
2.1 低氮胁迫对高粱幼苗表型及根长的影响
由图1可知, 在低氮处理后10 d, 高粱自交系的根系长度会显著增加, 398B根长增加了26.67%, CS-3541根长增加了15.47%, 398B根长显著大于CS-3541。
2.2 低氮胁迫对高粱幼苗根尖细胞长度的影响
由图2可知, 与正常氮条件相比, 低氮处理后10 d, 2份高粱自交系在低氮条件下根尖的细胞显著伸长, 398B根尖细胞长度显著增加了64.68%, CS-3541根尖细胞长度显著增加了41.18%, 在低氮条件下, 398B根尖细胞长度显著大于CS-3541。
2.3 低氮胁迫对高粱幼苗根系色氨酸含量的影响
由图3可知, 低氮胁迫下2份自交系根系中色氨酸含量呈现上升的趋势。低氮处理1、5和10 d, 398B根系中色氨酸含量分别显著增加13.52%、45.37%和20.91%, CS-3541根系中色氨酸含量分别显著增加33.52%、28.09%和67.22%。低氮条件下, 398B根系中色氨酸含量均大于CS-3541, 不同时间点两自交系间差异均达到显著水平。
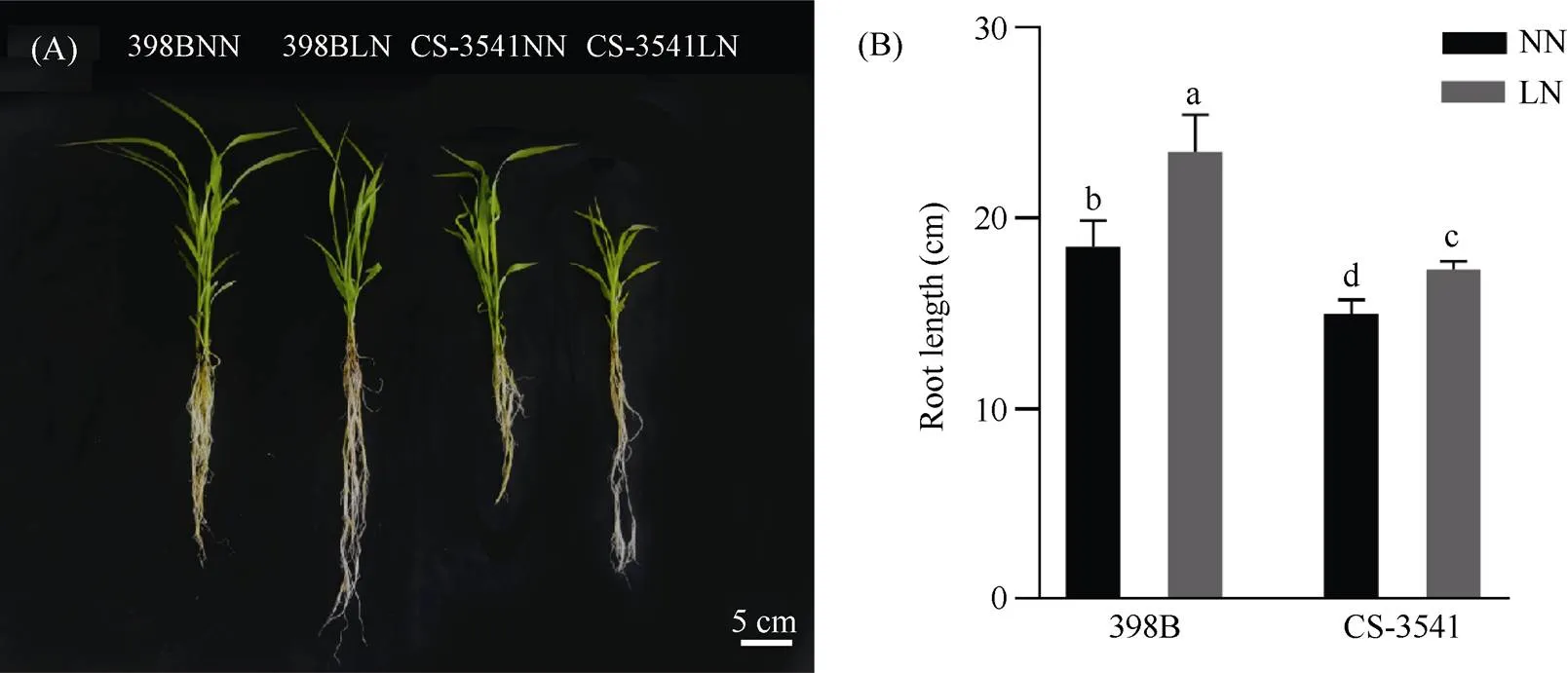
图1 低氮胁迫下高粱幼苗根系的表型(A)及根长(B)
不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理。
Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment.
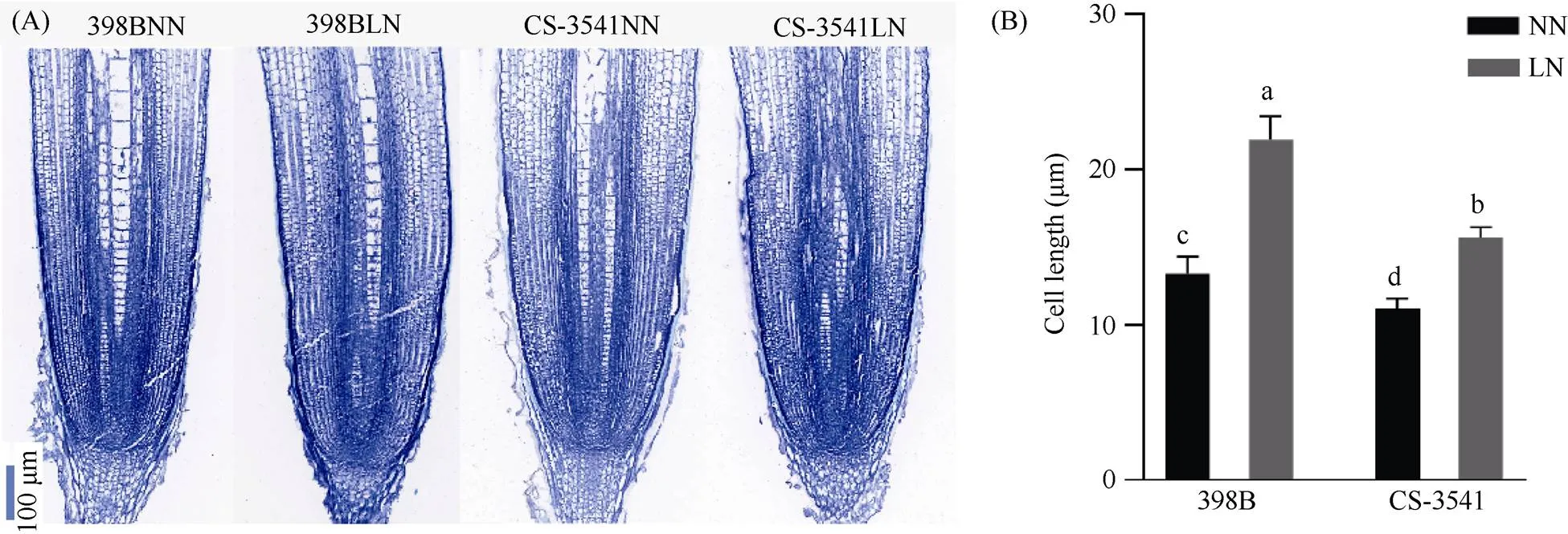
图2 低氮胁迫下高粱幼苗的根尖细胞形态(A)和长度(B)
不同小写字母表示在0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理。
Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment.
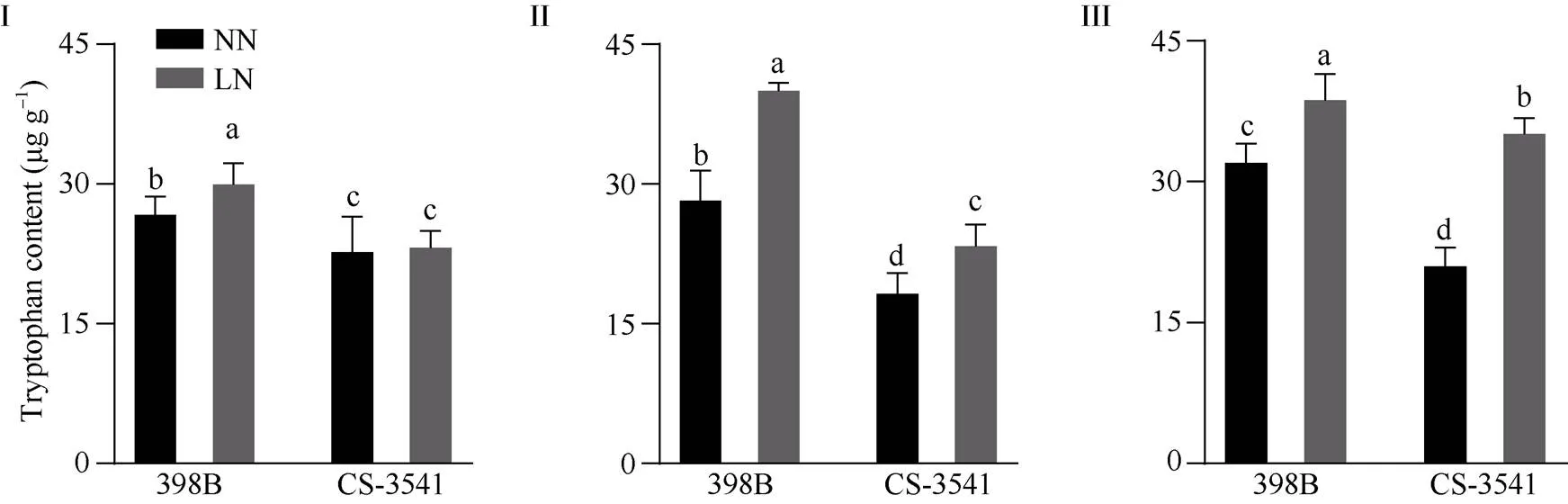
图3 低氮胁迫对幼苗根系色氨酸含量的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。不同小写字母表示在0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment.
2.4 低氮胁迫下高粱幼苗根系依赖色氨酸合成生长素的代谢途径
转录组数据分析可以看出(图4), 低氮胁迫下高粱幼苗根系的差异基因主要集中在IPA途径及生长素信号转导途径, IPA是色氨酸合成生长素的重要途径,其中主要的差异基因是调控生长素合成的和基因。
2.5 低氮胁迫对高粱幼苗根系生长素合成途径相关基因表达量的影响
通过qRT-PCR测定分析得出, 在低氮胁迫下、和表达存在显著差异。由图5可知, 低氮胁迫1、5和10 d后, 398B根系中表达量显著上升29.33%、124.74%和119.77%, CS-3541根系中表达量显著上升53.23%、141.80%和440.52%。低氮胁迫1 d后, 398B根系中表达量显著下降9.33%; 低氮胁迫5 d和10 d后, 398B根系中表达量显著上升331.06%和95.10%; 低氮胁迫1、5和10 d后, CS-3541根系中表达量显著上升33.61%、178.69%和85.57%。低氮胁迫1 d后, 398B根系中表达量显著下降14.00%; 低氮胁迫5 d和10 d后, 398B根系中表达量显著上升223.17%和240.56%; 低氮胁迫1、5和10 d后, CS-3541根系中表达量显著上升11.32%、273.33%和297.67%。
2.6 低氮胁迫下外源色氨酸对高粱幼苗根系表型的影响
由图6可知, 外源色氨酸影响了高粱幼苗根系的伸长。根系扫描图片可以看出, 随着处理时间的增加, 根系伸长的越明显。外源色氨酸处理后10 d, 根系形态差异最明显, 主要表现在根量增多, 根长增长; 外源色氨酸处理后10 d, 与低氮条件下未喷施色氨酸相比较, 398B和CS-3541根系长度显著增加8.63%和21.35%。
2.7 低氮胁迫下外源色氨酸对高粱幼苗根系质膜酸化的影响
2.7.1 幼苗根系生长素含量 由图7可知, 低氮胁迫1、5和10 d后, 398B根系生长素含量显著增加9.52%、21.49%和12.27%; CS-3541根系生长素含量显著增加2.45%、22.42%和13.70%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系生长素含量显著增加3.26%和36.18%; 外源色氨酸处理后5 d, CS-3541根系生长素含量差异未达显著水平; 外源色氨酸处理后10 d, CS-3541根系生长素含量显著增加了35.32%, 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
2.7.2 幼苗根系质膜H+-ATPase活性 由图8可知, 低氮胁迫1、5和10 d后, 398B根系质膜H+-ATPase活性显著增加10.86%、5.03%和4.07%; CS-3541根系质膜H+-ATPase活性显著增加5.78%、3.65%和3.65%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系质膜H+-ATPase活性显著增加12.31%和24.40%; CS-3541根系质膜H+-ATPase活性显著增加16.53%和22.58%;自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
2.7.3 幼苗根系pH 由图9可知, 低氮胁迫1、5和10 d后, 398B根系质外体pH值显著下降8.62%、15.05%和17.25%, CS-3541根系质外体pH值显著下降8.04%、9.17%和12.02%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系质外体pH值显著下降21.68%和21.58%, CS- 3541根系质外体pH值显著下降20.05%和16.85%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
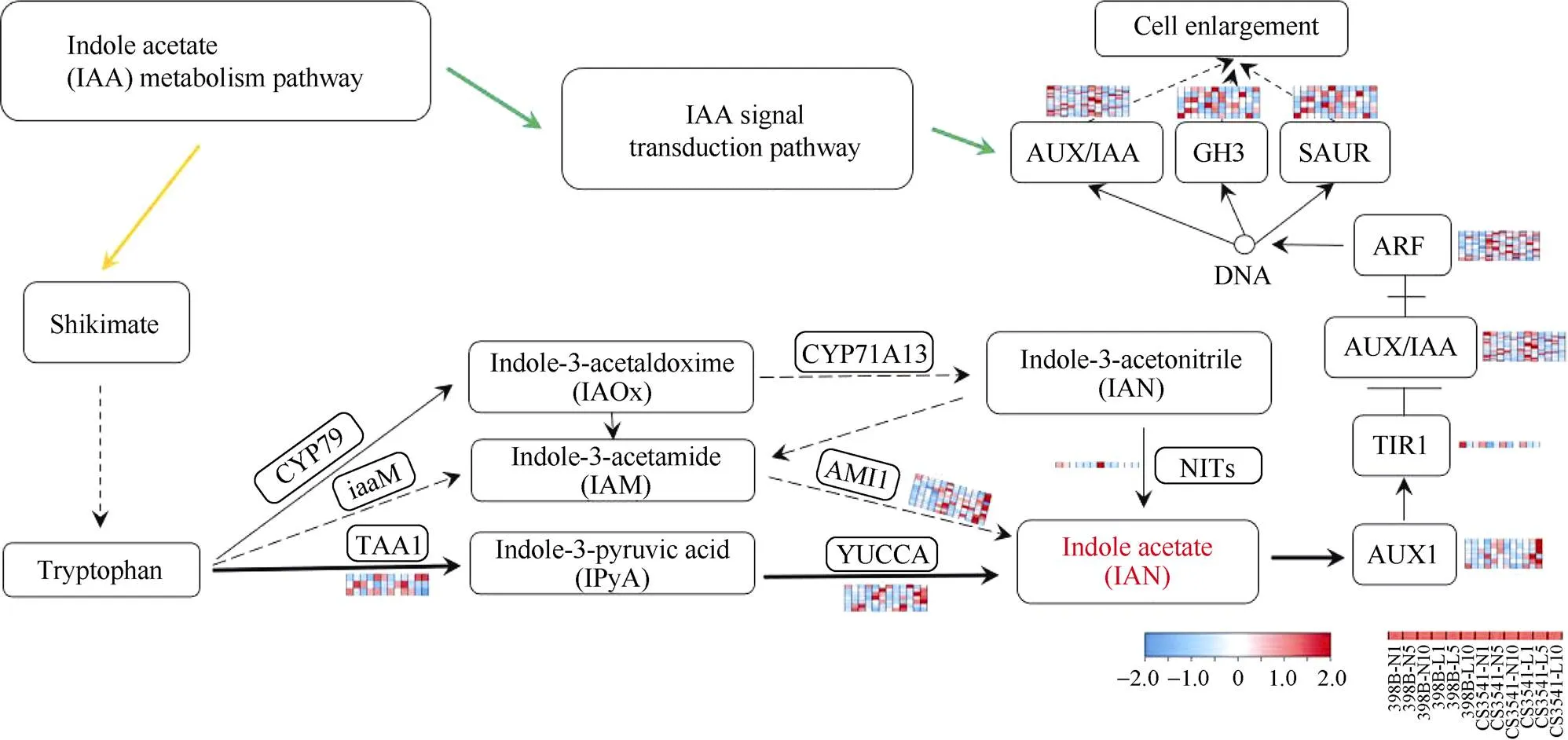
图4 色氨酸代谢通路图
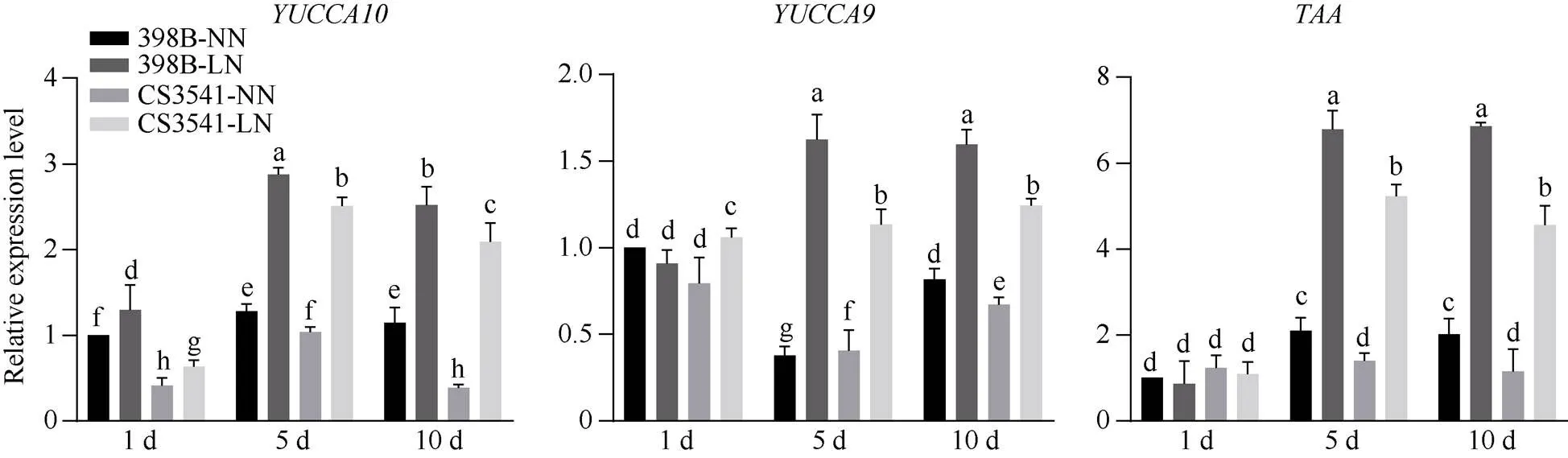
图5 低氮胁迫对高粱幼苗根系生长素合成相关基因表达量的影响
不同小写字母表示在0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理。
Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment.

图6 低氮胁迫下外源色氨酸对高粱幼苗根系生长的影响
NN: 正常氮处理; LN: 低氮处理。NN: normal nitrogen treatment; LN: low nitrogen treatment.
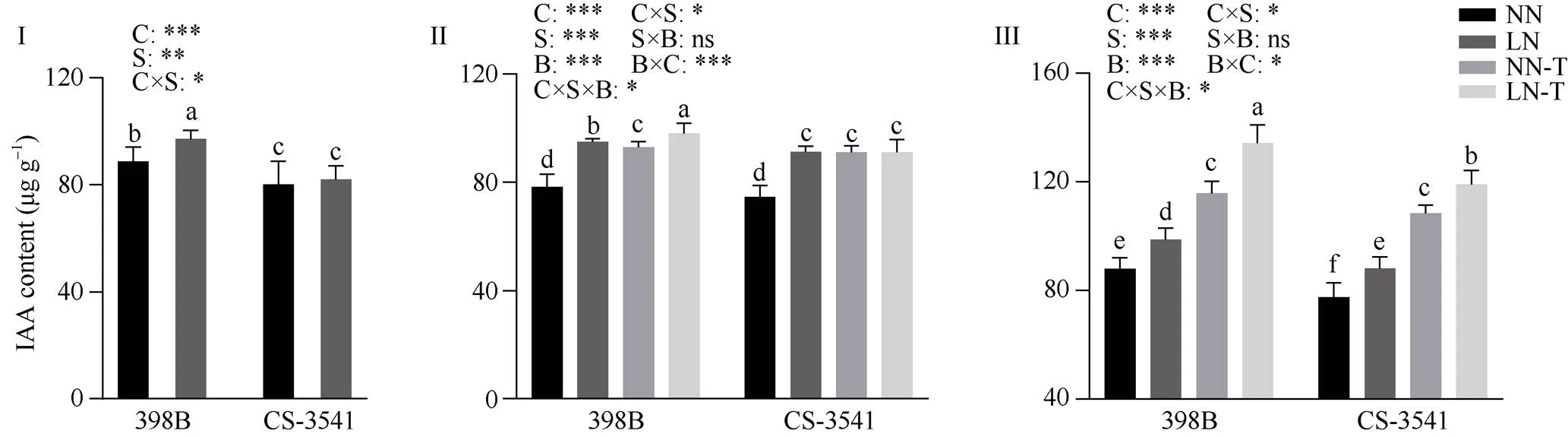
图7 低氮胁迫下外源色氨酸对幼苗根系生长素含量的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
2.8 低氮胁迫下外源色氨酸对高粱幼苗根系能量代谢的影响
2.8.1 幼苗根系ATP含量 由图10可知, 低氮胁迫1、5和10 d后, 398B根系ATP含量显著增加9.52%、20.87%和17.73%, CS3541根系ATP含量显著增加13.62%、12.17%和18.05%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系ATP含量显著增加21.18%和11.81%, CS- 3541根系ATP含量显著增加17.06%和19.39%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
2.8.2 幼苗根系6-磷酸葡萄糖脱氢酶活性 由图11可知, 低氮胁迫1 d后, 398B和CS-3541根系6-磷酸葡萄糖脱氢酶的活性差异不显著; 低氮胁迫5 d和10 d后, 398B根系6-磷酸葡萄糖脱氢酶的活性显著增加5.36%和3.18%, CS-3541根系6-磷酸葡萄糖脱氢酶的活性显著增加7.61%和6.73%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系6-磷酸葡萄糖脱氢酶的活性显著增加17.53%和29.45%, CS-3541根系6-磷酸葡萄糖脱氢酶的活性显著增加14.33%和21.72%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
2.8.3 幼苗根系丙酮酸激酶活性 由图12可知, 低氮胁迫1、5和10 d后, 398B根系丙酮酸激酶的活性显著增加3.34%、3.89%和3.12%; 低氮胁迫1 d和5 d后, CS-3541根系丙酮酸激酶的活性显著增加2.77%和3.11%, 低氮胁迫10 d后, CS-3541根系丙酮酸激酶的活性未达到显著水平。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系丙酮酸激酶的活性显著增加23.21%和17.00%, CS-3541根系丙酮酸激酶的活性显著增加21.26%和14.43%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
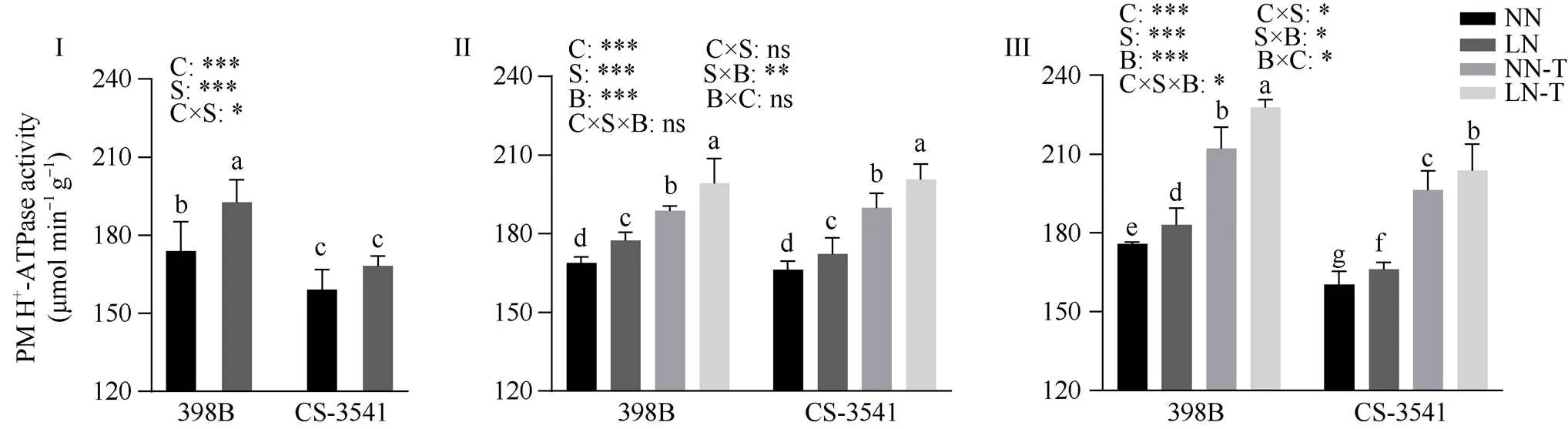
图8 低氮胁迫下外源色氨酸对幼苗根系中质膜H+-ATPase活性的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
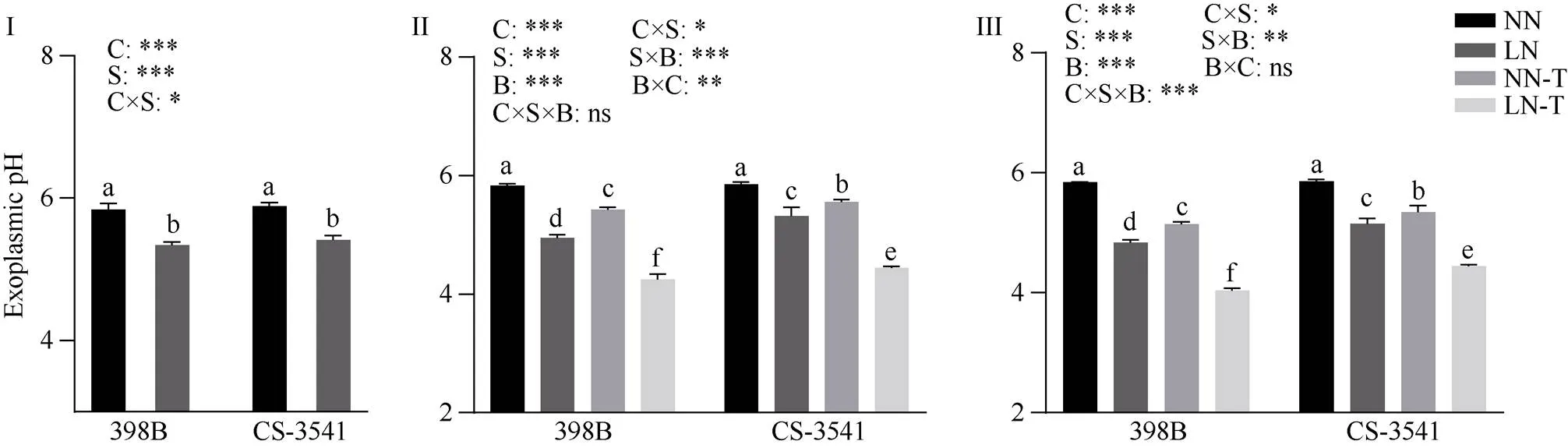
图9 低氮胁迫下外源色氨酸对幼苗根系质外体pH的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
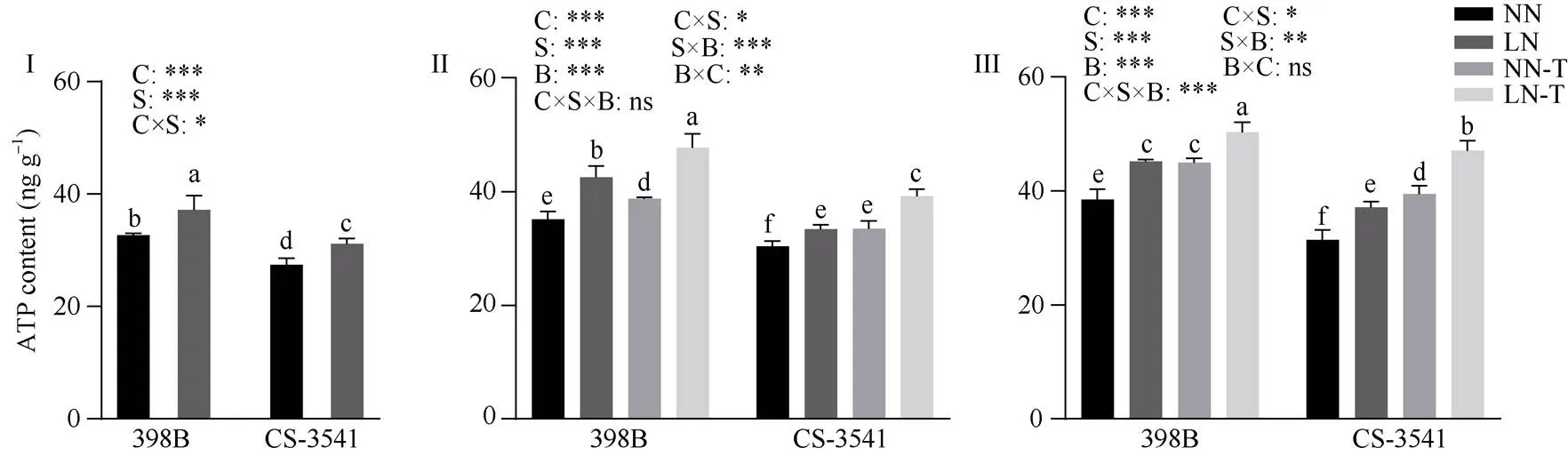
图10 低氮胁迫下外源色氨酸对幼苗根系ATP含量的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
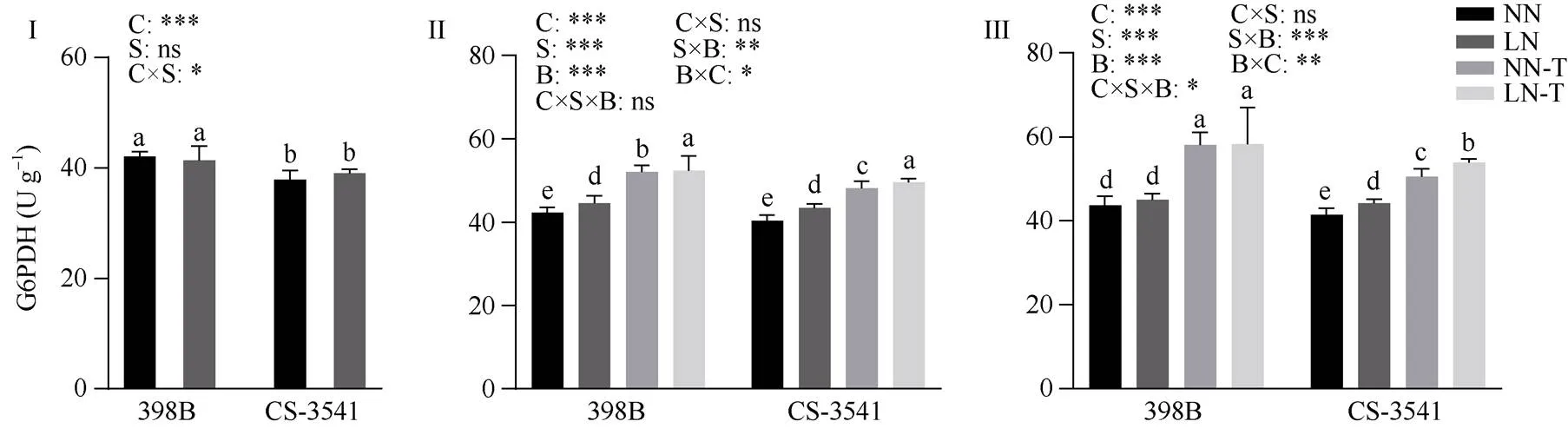
图11 低氮胁迫下外源色氨酸对幼苗根系6-磷酸葡萄糖脱氢酶活性的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
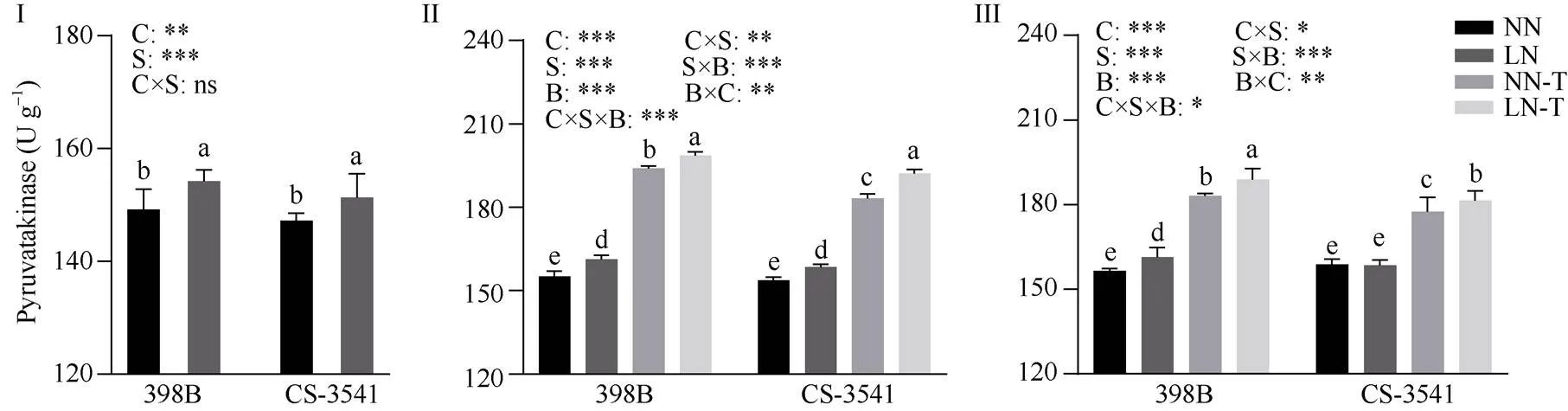
图12 低氮胁迫下外源色氨酸对幼苗根系丙酮酸激酶活性的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
2.8.4 幼苗根系柠檬酸合酶活性 由图13可知, 低氮胁迫1 d后, 398B和CS-3541根系柠檬酸合酶活性差异不显著; 低氮胁迫5 d和10 d后, 398B根系柠檬酸合酶的活性显著增加3.55%和6.82%, CS-3541根系柠檬酸合酶的活性显著增加6.93%和7.50%。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系柠檬酸合酶的活性显著增加19.06%和21.21%, CS-3541根系柠檬酸合酶的活性显著增加14.00%和12.52%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
2.8.5 幼苗根系α-酮戊二酸脱氢酶活性 由图14可知, 低氮胁迫1、5和10 d后, 398B根系α-酮戊二酸脱氢酶活性显著增加2.62%、3.62%和5.38%; 低氮胁迫1 d和5 d后, CS-3541根系α-酮戊二酸脱氢酶活性显著增加1.91%和3.54%, 低氮胁迫10 d后, CS-3541根系α-酮戊二酸脱氢酶活性未达到显著水平。外源色氨酸处理后5 d和10 d, 与低氮条件下未喷施色氨酸相比较, 398B根系α-酮戊二酸脱氢酶活性显著增加13.35%和19.76%, CS-3541根系α-酮戊二酸脱氢酶活性显著增加14.05%和17.71%; 自交系、低氮胁迫和外源色氨酸处理之间的交互作用存在显著性差异(<0.05)。
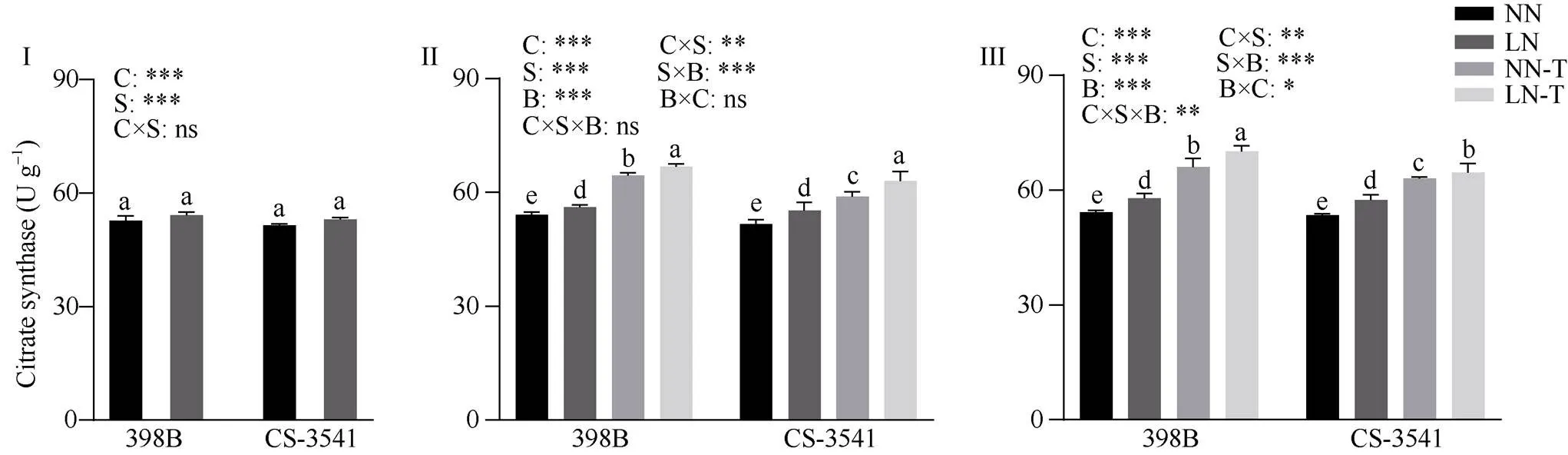
图13 低氮胁迫下外源色氨酸对幼苗根系柠檬酸合酶活性的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
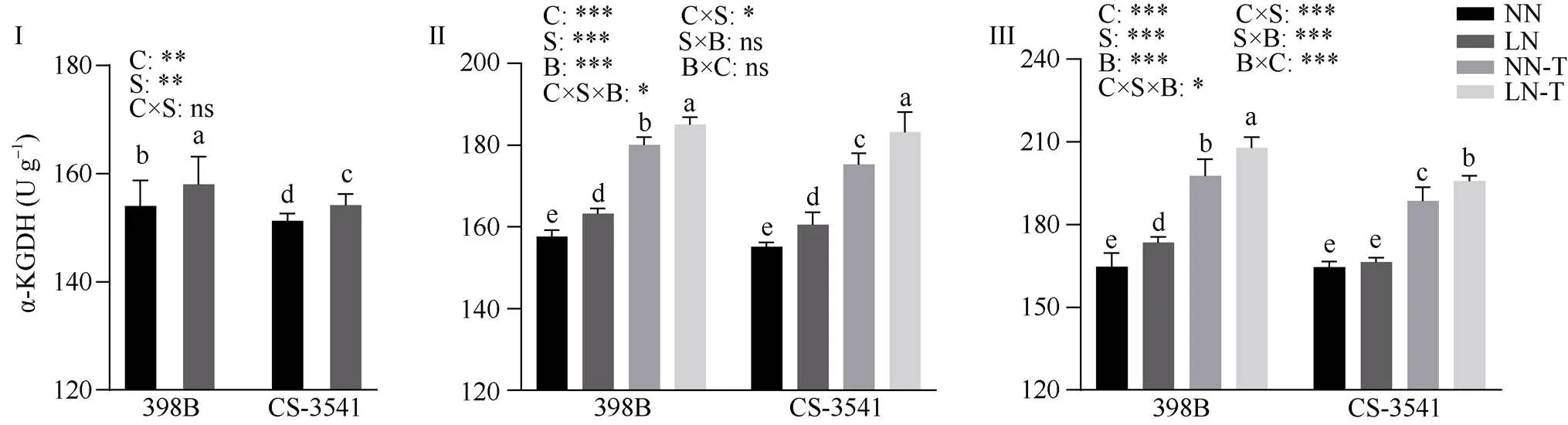
图14 低氮胁迫下外源色氨酸对幼苗根系α-酮戊二酸脱氢酶活性的影响
I为低氮处理后1 d; II为低氮处理后5 d; III为低氮处理后10 d。C、S和B分别表示不同自交系、不同氮水平处理和外源色氨酸处理。*、**和***分别表示在0.05、0.01和0.001概率水平差异显著, ns表示差异不显著。不同小写字母表示0.05概率水平差异显著。NN: 正常氮处理; LN: 低氮处理; NN-T: 正常氮喷施色氨酸处理; LN-T: 低氮喷施色氨酸处理。
I: 1 day after low nitrogen treatment; II: 5 days after low nitrogen treatment; III: 10 days after low nitrogen treatment. C, S, and B represent hybrid lines, different nitrogen treatments, and exogenous tryptophan treatments, respectively. *, **, and *** are significantly different at the 0.05, 0.01, and 0.001 probability levels, respectively, and ns is not significantly different. Columns with different lowercase letters are significantly different at the 0.05 probability level. NN: normal nitrogen treatment; LN: low nitrogen treatment; NN-T: normal nitrogen was sprayed with tryptophan; LN-T: low nitrogen was sprayed with tryptophan.
3 讨论
3.1 低氮胁迫对高粱幼苗根系伸长的影响
植物为了适应低氮环境, 一个重要的响应策略是促进根系伸长。Subudhi等[35]研究表明, 低氮条件下作物通过调节根系构型而影响对氮素的吸收, 从而增强对低氮的耐受性。研究表明, 不同耐低氮性苦荞和油菜品种间分别对低氮胁迫的响应存在显著差异, 耐低氮品种在低氮胁迫环境下具有极强的生长优势[36-37]。本试验结果表明在低氮胁迫条件下, 耐低氮能力不同的2份高粱自交系398B和CS-3541根系均显著伸长, 同时, 低氮胁迫下398B和CS- 3541根尖细胞长度也显著增加; 其中, 398B根系伸长的长度大于CS-3541, 说明398B相比较于CS- 3541具有更强的耐低氮能力。另外, 在本研究中, 低氮胁迫显著增加了根系中色氨酸含量以及依赖色氨酸途径合成生长素相关基因的表达, 进一步通过对根尖转录组分析发现, 低氮胁迫下根系差异基因集中在色氨酸代谢通路以及依赖色氨酸途径合成生长素通路上, 说明低氮胁迫下色氨酸可能通过合成生长素参与了高粱幼苗根系的伸长。Tian等[38]和Gao等[39]研究表明, 生长素在根系伸长中起着关键的调控作用, 不同氮浓度下玉米根系长度与根系IAA含量密切相关, 并且, 外源施加NAA和IAA能够促进根系伸长, 这与本研究的结果相一致。
3.2 低氮胁迫下外源色氨酸对高粱幼苗根系伸长的影响
色氨酸作为氨基酸之一, 能够增强植物对不利环境的适应性, 提高植物的抗逆性[40]。钟晓红等[41]研究表明, 外源色氨酸处理后的油菜幼苗根系更加发达, 提高了根系吸收养分的能力。本研究中, 低氮胁迫下, 外源色氨酸处理显著增加了根系中生长素的水平, 并进一步促进了高粱幼苗根系伸长。生长素对根系形态的构建起着关键作用, 色氨酸作为生长素合成前体, 其中YUC途径是最重要生长素合成途径[42]。在本研究中, 低氮胁迫显著增加了YUC途径上的、和基因表达量, 说明低氮胁迫下高粱幼苗通过色氨酸代谢途径增加根系生长素含量。并且, 398B根系生长素的含量高于CS-3541, 398B相对于CS-3541具有更强的耐低氮特性。根据酸生长理论, 在低氮胁迫下, 生长素在质外体积累并激活生长素受体蛋白, 刺激与膜结合的H+泵, 促进质子释放到细胞壁基质中, 改变细胞基质中的pH值, 细胞壁中的酸性环境激活相关酶和扩张素, 使细胞壁松动, 由于细胞自身存在膨压, 从而促进细胞扩大和伸长[43]。在本研究中, 低氮条件下398B和CS-3541根尖生长素含量的上升, 质膜H+-ATPase的活性上升, 说明低氮条件下高粱根系中生长素含量的提高激活了质膜H+-ATPase的活性, 从而促进了根尖细胞的长度, 进一步证明了色氨酸在低氮胁迫下通过合成生长素促进了高粱幼苗根系伸长的生理机制。
3.3 低氮胁迫下外源色氨酸对高粱幼苗根系能量代谢的影响
植物的生长发育过程中伴随着能量代谢, 以满足植物对能量的需求[44]。Liu等[45]研究表明, 低钾胁迫诱导了大豆根系能量代谢, 促进糖酵解和TCA循环, 从而增强能量代谢以此来抵抗低钾胁迫。洪丽芳等[46]研究表明, 外源生长素能够增加烟草根系碳水化合物含量, 提高了根系ATP含量, 为根系的伸长和物质跨膜运输提供能量, 进而利于根系的发育。研究发现, 外源色氨酸通过增强植物体内的物质代谢及相关酶活性, 不仅增加了植物的根长和株高, 同时提高了植物对逆境胁迫的响应[47]。在本研究中, 外源色氨酸处理后, 398B和CS-3541根系中能量代谢关键酶的活性均显著增加。其中, 低氮胁迫下, 398B根系丙酮酸激酶和α-酮戊二酸脱氢酶活性显著上升, 而CS-3541在低氮处理后10 d, 根系丙酮酸激酶和α-酮戊二酸脱氢酶活性差异不显著, 说明398B根系能够在低氮胁迫下保持更高的丙酮酸激酶和α-酮戊二酸脱氢活性。丙酮酸激酶是糖酵解途径上的调节酶, 而α-酮戊二酸脱氢酶作为调控三羧酸循环的关键酶, 其氧化脱羧过程与丙酮酸激酶相似[48], 低氮条件下二者含量的升高为高粱根系的伸长奠定了能量基础。在磷酸戊糖途径和三羧酸循环中, 6-磷酸葡萄糖脱氢酶和柠檬酸合酶作为关键酶之一[49]。低氮胁迫下, 398B和CS-3541根系中二者酶活性显著增加, 并且外源色氨酸处理的398B根系中酶活性上升的幅度更大, 398B更高的能量供应加快了其根系的伸长。因此, 低氮胁迫下, 外源色氨酸能够增加根系中能量代谢关键酶的活性, 以此产生更多的ATP, 为生长素酸化高粱根系细胞壁奠定了能量基础, 其对398B根系产生的能量更多, 从而398B对低氮环境的适应性更强。
4 结论
低氮胁迫下, 高粱幼苗根系伸长, 根尖细胞平均长度增加, 并且在低氮胁迫下398B根长和根尖细胞长度均大于CS-3541; 通过转录组分析发现, 低氮胁迫下差异基因集中在依赖色氨酸途径合成生长素上, 根系中内源色氨酸含量显著增加。低氮胁迫下外源色氨酸显著促进398B和CS-3541的根系伸长, 增加398B和CS-3541根系生长素含量及H+-ATP酶活性, 减少了根系pH, 从而酸化根系细胞壁; 外源色氨酸显著增强α-酮戊二酸脱氢酶、6-磷酸葡萄糖脱氢酶、丙酮酸激酶和异柠檬酸合酶的活性以及根系中ATP含量, 为生长素引起的根系酸化提供了能量, 最终促进高粱根系伸长, 其中, 对398B根系伸长的作用更大(图15)。
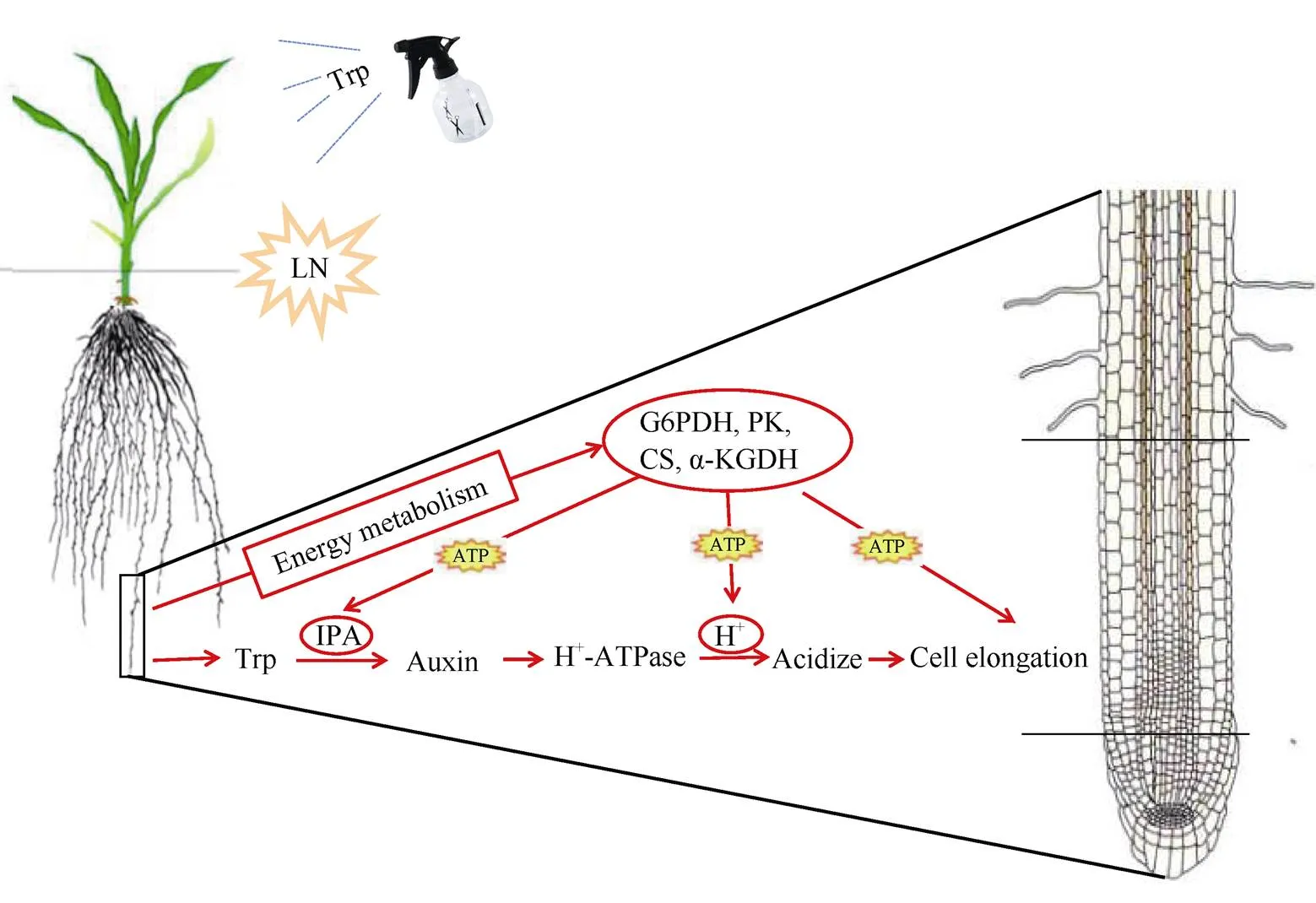
图15 低氮胁迫下外源色氨酸对高粱幼苗根系伸长的作用模式
[1] 刘晨阳, 张蕙杰, 辛翔飞. 中国高粱产业发展特征及趋势分析. 中国农业科技导报, 2020, 22(10): 1–9.
Liu C Y, Zhang H J, Xin X F. Analysis of the development characteristics and trends of sorghum industry in China., 2020, 22(10): 1–9 (in Chinese with English abstract).
[2] 邹剑秋. 高粱育种与栽培技术研究新进展. 中国农业科学, 2020, 53: 2769–2773.
Zou J Q. New research progress on sorghum breeding and cultivation techniques., 2020, 53: 2769–2773 (in Chinese with English abstract).
[3] 张彦, 王劲松, 董二伟, 武爱莲, 王媛, 焦晓燕. 中晚熟区主要高粱品种耐瘠性综合评价. 中国农业科学, 2021, 54: 4954–4968.
Zhang Y, Wang J S, Dong E W, Wu A L, Wang Y, Jiao X Y. Comprehensive evaluation of low-fertility tolerance of different sorghum cultivars in middle-late-maturing area., 2021, 54: 4954–4968 (in Chinese with English abstract).
[4] 刘鹏, 武爱莲, 王劲松, 南江宽, 董二伟, 焦晓燕, 平俊爱, 白文斌. 不同基因型高粱的氮效率及对低氮胁迫的生理响应. 中国农业科学, 2018, 51: 3074–3083.
Liu P, Wu A L, Wang J S, Nan J K, Dong E W, Jiao X Y, Ping J A, Bai W B. Nitrogen use efficiency and physiological responses of different sorghum genotypes influenced by nitrogen deficiency., 2018, 51: 3074–3083 (in Chinese with English abstract).
[5] 李邦, 姜冰, 邢艺凡, 陈小飞, 周宇飞. 高粱幼苗根系对低氮胁迫的响应. 见: 中国作物学会主编. 第十九届中国作物学会学术年会论文摘要集. 武汉: 中国作物学会, 2020. p 315.
Li B, Jiang B, Xing Y F, Chen X F, Zhou Y F. Response of sorghum seedling root to low nitrogen stress. In: Crop Science Society of China, eds. Abstracts of the 19th Annual Conference of Crop Science Society of China. Wuhan: Crop Science Society of China, 2020. p 315 (in Chinese with English abstract).
[6] Rasmussen A, Hosseini S A, Hajirezaei M R, Druege U, Geelen D. Adventitious rooting declines with the vegetative to reproductive switch and involves a changed auxin homeostasis., 2015, 66: 1437–1452.
[7] Gaudin A C M, McClymont S A, Holmes B M, Lyons E, Raizada M N. Novel temporal, fine-scale and growth variation phenotypes in roots of adult-stage maize (L.) in response to low nitrogen stress., 2011, 34: 2122–2137.
[8] Lynch J P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems., 2013, 112: 356–366.
[9] 谢呈辉, 马海曌, 许宏伟, 徐郗阳, 阮国兵, 郭峥岩, 宁永培, 冯永忠, 杨改河, 任广鑫. 施氮量对宁夏引黄灌区麦后复种糜子生长、产量及氮素利用的影响. 作物学报, 2022, 48: 463–477.
Xie C H, Ma H Z, Xu H W, Xu X Y, Ruan G B, Guo Z Y, Ning Y P, Feng Y Z, Yang G H, Ren G X. Effects of nitrogen rate on growth, grain yield, and nitrogen utilization of multiple cropping proso millet after spring-wheat in Irrigation Area of Ningxia., 2022, 48: 463-477 (in Chinese with English abstract).
[10] Mi G, Chen Y L. Ideotype root system architecture for maize to achieve high yield and resource use efficiency in intensive cropping systems., 2016, 139: 73–97.
[11] Postma J A, Dathe A, Lynch J P. The optimal lateral root branching density for maize depends on nitrogen and phosphorus availability., 2014, 166: 590–602.
[12] Linkohr B I, Williamson L C, Fitter A H, Leyser H M. Nitrate and phosphate availability and distribution have different effects on root system architecture of., 2002, 29: 5684–5701.
[13] Gruber B D, Giehl R F, Friedel S, Wirén N. Plasticity of theroot system under nutrient deficiencies., 2013, 163: 452–463.
[14] El-Bassiouny H M S. Physiological responses of wheat to salinity alleviation by nicotinamide and tryptophan., 2005, 7: 653–659.
[15] Abbas S H, Sohail M, Saleem M. Effect of L-tryptophan on plant weight and pod weight in chickpea under rainfed conditions., 2013, 163: 161–179.
[16] Hassan T U, Bano A. The stimulatory effects of L-tryptophan and plant growth promoting rhizobacteria (PGPR) on soil health and physiology of wheat., 2015, 15: 190–201.
[17] Pollmann S, Düchting P, Weiler E W. Tryptophan-dependent indole-3-acetic acid biosynthesis by ‘IAA-synthase’ proceeds via indole-3-acetamide., 2009, 70: 523–531.
[18] Mano Y H, Nemoto K C. The pathway of auxin biosynthesis in plants., 2012, 63: 2853–2872.
[19] Zhou Z Y, Zhang C G, Wu L, Zhang C G, Chai J, Wang M, Jha A, Jia P F, Cui S J, Yang M, Chen R J, Guo G Q. Functional characterization of thegene and dissection of hormonal actions in theroot., 2011, 66: 516–527.
[20] Won C, Shen X, Mashiguchi K, Zheng Z, Dai X, Cheng Y, Kasahara H, Kamiya Y, Chory J, Zhao Y. Conversion of tryptophan to indole-3-acetic acid by tryptophsn sminotrnsferases ofand YUCCAs in., 2011, 108: 18518–18523.
[21] Mashiguchi K S, Tanaka K, Sakai T Y, Sugawara S K, Kawaide H, Natsume M, Hanada A, Yaeno T, Shirasu K, Yao H, McSteen P, Zhao Y, Hayashi K, Kamiya Y J, Kasahara H K. The main auxin biosynthesis pathway in., 2011, 108: 234–241.
[22] Ma W Y, Li J J, Qu B Y, He X, Zhao X Q, Li B, Fu X D, Tong Y P. Auxin biosynthetic geneis involved in low nitrogen-mediated reprogramming of root architecture in., 2014, 78: 70–79.
[23] Yamamoto Y, Kamiya N, Morinaka Y, Matsuoka M, Sazuka T. Auxin biosynthesis by thegenes in rice.,2007, 143: 1362–1371.
[24] Zhang T T, Kang H, Fu L L, Sun W J, Gao W S, You C X, Wang X F, Hao Y J. NIN-like protein 7 promotes nitrate-mediated lateral root development by activating transcription of., 2021, 303: 110771.
[25] Bakry B A, Ibrahim F M, Maha M S. Effect of banana peel extract or tryptophan on growth, yield and some biochemical aspects of quinoa plants under water deficit., 2016, 9: 276–287.
[26] Janus F, Jesper T P, Anja T F, Michael P. Plasma membrane H+-ATPase regulation in the center of plant physiology., 2016, 9: 323–337.
[27] Jing Y, Cui D, Bao F, Hu Z, Qin Z, Hu Y. Tryptophan deficiency affects organ growth by retarding cell expansion in., 2008, 57: 511–521.
[28] Yu P H, Jiang N, Fu W M, Zheng G G, Li G Y, Feng B H, Chen T T, Ma J Y, Li H B, Tao L X, Fu G F. ATP hydrolysis determines cold tolerance by regulating available energy for glutathione synthesis in rice seedling plants., 2020, 13: 23–39.
[29] 赵欣, 白伟. 杜仲叶片干旱胁迫响应相关差异蛋白的筛选与鉴定. 植物研究, 2018, 38: 1422–1432.
Zhao X, Bai W. Screening and identification of the proteins related to drought response in leaves of., 2018, 38: 1422–1432 (in Chinese with English abstract).
[30] Zhang Y, Han Q, Guo Q, Zhang S. Physiological and proteomic analysis reveals the different responses ofseedlings to nitrogen and phosphorus additions., 2016, 146: 109–121.
[31] 刘国英. 供氮水平调控番茄低温耐性的机理研究. 西北农林科技大学博士学位论文, 陕西杨凌, 2018.
Liu G Y. Study on the Mechanism of Nitrogen Levels Regulate Tomato Tolerance to Low Temperature. PhD Dissertation of Northwest A&F University, Yangling, Shaanxi, China, 2018 (in Chinese with English abstract).
[32] 江立庚, 曹卫星. 水稻高效利用氮素的生理机制及有效途径. 中国水稻科学, 2002, 16(3): 64–67.
Jiang L G, Cao W X. Physiological mechanism and approach for efficient nitrogen utilization in rice., 2002, 16(3): 64–67 (in Chinese with English abstract).
[33] Konishi N, Ishiyama K, Matsuoka K, Maru I, Hayakawa T, Yamaya T, Kojima S. NADH-dependent glutamate synthase plays a crucial role in assimilating ammonium in theroot., 2014, 152: 138–151.
[34] 黎旺姐. 不同生长温度和施氮量对烟草叶片中游离氨基酸含量及其代谢的效应. 云南师范大学博士学位论文, 云南昆明, 2016.
Li W J. Effects of Different Growth Temperature and Nitrogen Fertilization on Amino Acid Content and Its Metabolism in Tobacco Leaves. PhD Dissertation of Yunnan Normal University, Kunming, Yunnan, China, 2016 (in Chinese with English abstract).
[35] Subudhi P K, Garcia R S, Coronejo S, Tapia R. Comparative transcriptomics of rice genotypes with contrasting responses to nitrogen stress reveals genes influencing nitrogen uptake through the regulation of root architecture., 2020, 21: 5795–5818.
[36] 张楚, 张永清, 路之娟, 刘丽琴. 苗期耐低氮基因型苦荞的筛选及其评价指标. 作物学报, 2017, 43: 1205–1215.
Zhang C, Zhang Y Q, Lu Z J, Liu L Q. Screeninggenotypes tolerant to low nitrogen stress at seedling stage and its evaluating indices., 2017, 43: 1205–1215 (in Chinese with English abstract).
[37] 秦璐, 韩配配, 常海滨, 顾炽明, 黄威, 李银水, 廖祥生, 谢立华, 廖星. 甘蓝型油菜耐低氮种质筛选及绿肥应用潜力评价. 作物学报, 2022, 48: 1488–1501.
Qin L, Han P P, Chang H B, Gu C M, Huang W, Li Y S, Liao X S, Xie L H, Liao X. Screening of rapeseed germplasms with low nitrogen tolerance and the evaluation of its potential application as green manure., 2022, 48: 1488–1501 (in Chinese with English abstract).
[38] Tian Q, Chen F, Liu J, Zhang F, Mi G. Inhibition of maize root growth by high nitrate supply is correlated with reduced IAA levels in roots., 2008, 165: 942–951.
[39] Gao K, Chen F J, Yuan L X, Mi G H. Cell production and expansion in the primary root of maize in response to low-nitrogen stress., 2014, 13: 2508–2517.
[40] Zahir Z A, Yasin H M, Naveed M, Anjum M A, Khalid M. L-tryptophan application enhances the effectiveness of Rhizobium inoculation for improving growth and yield of mungbean ((L.) Wilczek)., 2010, 42: 1771–1780.
[41] 蒋佳, 朱星宇, 李晶. 外源色氨酸对油菜幼苗色氨酸下游代谢网络及生长发育的影响. 西北植物学报, 2020, 40: 1549–1557.
Jiang J, Zhu X Y, Li J. Effect of exogenous tryptophan on the downstream metabolic network of tryptophan and growth in rapa seedlings., 2020, 40: 1549–1557 (in Chinese with English abstract).
[42] Nathan D T, John J R, Jerry D C. The shifting paradigms of auxin biosynthesis., 2014, 19: 44–51.
[43] Cosgrove D J. Loosening of plant cell walls by expansions., 2000, 407: 321–326.
[44] Tivendale N D, Millar A H. How is auxin linked with cellular energy pathways to promote growth., 2022, 233: 2397–2404.
[45] Liu C K, Tu B J, Wang X, Li Y S, Zhang Q Y, Liu X B. Transcript profile in vegetable soybean roots reveals potential gene patterns regulating K uptake efficiency.(Basel), 2020, 10: 1796–1818.
[46] 洪丽芳, 苏帆, 付利波, 梁颖, 瞿兴, 田育天, 刘武定. 生长素在烤烟钾素库源关系改变时对根系呼吸作用生理指标的影响. 中国农业科学, 2003, 36: 1604–1608.
Hong L F, Su F, Fu L B, Liang Y, Qu X, Tian Y T, Liu W D. Effects of auxin on the indexes to root respiratory metabolism when the relationship of sink and source was changed., 2003, 36: 1604–1608 (in Chinese with English abstract).
[47] Mustafa A, Imran M, Ashraf M, Mahmood K. Perspectives of using L-tryptophan for improving productivity of agricultural crops: a review., 2018, 28: 16–34.
[48] Tretter L, Adam V V. Alpha-ketoglutarate dehydrogenase: a target and generator of oxidative stress., 2005, 360: 2335–2345.
[49] Woo J E, Seong H J, Lee S Y, Jang Y S. Metabolic engineering offor the production of hyaluronic acid from glucose and galactose., 2019, 7: 351.
Effects of exogenous tryptophan on root elongation of sorghum seedlings under low nitrogen stress
LI Bang**, LIU Chun-Juan**, GUO Jun-Jie, WU Yu-Xin, DENG Zhi-Cheng, ZHANG Min, CUI Tong, LIU Chang, and ZHOU Yu-Fei*
College of Agronomy, Shenyang Agricultural University, Shenyang 110866, Liaoning, China
The physiological mechanism of root elongation in sorghum under low nitrogen stress remains unclear. Here, two sorghum inbred lines, 398B (low nitrogen tolerance) and CS-3541 (low nitrogen sensitivity), were used as experimental materials, to clarify the physiological mechanism of root elongation of sorghum seedlings under low nitrogen stress. The results showed that, compared with normal nitrogen stress, low nitrogen stress significantly increased root length and root tip cell length of 398B and CS-3541, and 398B had longer root length. The endogenous tryptophan content in roots of 398B and CS-3541 increased significantly at 1, 5, and 10 days after low nitrogen stress. Tryptophan was involved in root elongation of sorghum under low nitrogen conditions through the auxin synthesis pathway by RNA-seq, and the relative expression level of genes in the auxin synthesis pathway of root in 398B was significantly higher than that in CS-3541. Furthermore, the root lengths of 398B and CS-3541 were significantly increased by 50 mg L–1exogenous tryptophan treatment under low nitrogen conditions. Exogenous tryptophan activated the activity of H+-ATPase in plasma membrane by increasing the content of auxin, promoted the acidification of plasma membrane, and improved the activity of enzymes related to energy metabolism and ATP content, and thus inducing energy metabolism of root system. Exogenous tryptophan had a better effect on 398B under low nitrogen stress. In conclusion, low nitrogen stress activated the key role of endogenous tryptophan in sorghum root elongation, and auxin depended on tryptophan pathway and synergistic enhancement of energy metabolism were the physiological mechanism promoting root elongation of sorghum seedlings under low nitrogen stress.
sorghum; low nitrogen; exogenous tryptophan; auxin; energy metabolism; root elongation
10.3724/SP.J.1006.2023.24133
本研究由财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-06-14.5-A17)和辽宁省教育厅一般项目(LSNFW202006)资助。
This study was supported by the China Agriculture Research System of MOF and MARA (CARS-06-14.5-A17) and the General Research Project of Education Department of Liaoning Province of China (LSNFW202006).
周宇飞, E-mail: zhouyufei@syau.edu.cn
**同等贡献(Contributed equally to this work)
李邦, E-mail: 3281908550@qq.com; 刘春娟, E-mail: liuchunjuan@syau.edu.cn
2022-06-01;
2022-09-05;
2022-09-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220921.1033.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
