LINC01980 在宫颈癌中的表达及调控LIN28B 表达促进宫颈癌生长的作用机制①
2023-03-17王春梅吴德慧魏顺英马登云青海红十字医院妇一科西宁810000
王春梅 吴德慧 康 燕 魏顺英 马登云 (青海红十字医院妇一科,西宁 810000)
宫颈癌是妇科常见恶性肿瘤之一,发病率和病死率较高,且逐渐年轻化,严重威胁女性健康[1]。随着医学技术发展,早期宫颈癌可通过手术、放化疗治疗,但晚期或复发转移患者预后较差[2]。随着分子生物学发展,靶向治疗为癌症临床治疗提供了新思路,分析宫颈癌发展的相关机制可能为其临床治疗提供新方法[3]。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200 nt 的不具备蛋白编码功能的RNA 分子,可与DNA、RNA 和蛋白相互作用,在表观遗传、转录和翻译水平调节基因表达和蛋白活性,参与染色质修饰、转录激活和抑制等生物学过程[4]。lncRNA 不仅参与机体正常生理活动,在疾病发生发展尤其是肿瘤发生过程中具有重要作用,寻找宫颈癌中特异表达的lncRNA,并分析其在宫颈癌中的分子机制,可能有助于寻找宫颈癌治疗靶点,为宫颈癌靶向治疗提供新思路[5]。课题组前期生物信息学分析发现,宫颈癌中LINC01980表达显著上调,与肝癌、食管癌发生发展及预后相关,但其在宫颈癌中的表达及其对宫颈癌的影响尚未阐明[6-8]。LIN28B 是一种保守RNA 结合蛋白,与宫颈癌、卵巢癌等女性生殖系统恶性肿瘤发生有关,可能是治疗女性生殖系统恶性肿瘤的潜在靶标[9-10]。本研究生物信息学预测结果表明,LIN28B 与LINC01980 具有相互作用位点,因此,本研究拟探讨LINC01980在宫颈癌中的表达及其对宫颈癌细胞生长影响的可能机制,为宫颈癌治疗提供新的靶标。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取2020 年1 月至2021 年5 月青海红十字医院收治的病理学诊断为宫颈癌的患者60 例作为宫颈癌组,年龄35~67 岁,平均年龄(48.78±8.83)岁。排除标准:①接受手术、放化疗等治疗;②合并其他妇科疾病者;③合并肝、肾等重大功能脏器不全者;④合并其他恶性肿瘤患者。选取同期青海红十字医院健康体检者(宫颈未发生病变)60 例作为健康组,年龄33~70 岁,平均年龄(47.95±10.89)岁。两组研究对象年龄差异无统计学意义(P>0.05)。研究经青海红十字医院伦理委员会审核批准。
1.1.2 试剂与仪器 人宫颈癌细胞系Hela(TCHu187)购自中国科学院典型培养物保藏委员会细胞库;MEM培养基(41500034)、胎牛血清(10099)、胰蛋白酶(25200056)购自美国Gibco 公司;Lipofectamine3000试剂盒(L3000015)购自美国Invitrogen公司;RNAiso plus(9108Q)购自日本TaKaRa 公司;反转录试剂盒(205311)、qRT-PCR 试剂盒(204443)购自德国QIAGEN 公司;CCK-8(C0037)、蛋白提取试剂盒(P0012)、BCA 蛋白定量试剂盒(C1062)购自上海碧云天生物技术公司;DNA 含量检测试剂盒(细胞周期,CA1510)、AnnexinV Alexa Fluor488/PI凋亡检测试剂盒(CA1040)购自北京索莱宝科技有限公司;protein A/G 磁珠(sc-2003)购自美国Santa Cruz Technology公司;Magna RIP Kit(17-701)购自美国Merck Millipore;PierceTM生物素 3'末端DNA 标记试剂盒(89818)购自赛默飞世尔科技(中国)有限公司;兔抗人细胞周期蛋白D1(CyclinD1,ab16663)、周期蛋白依赖性激酶4(Cyclin-dependent kinases 4,CDK4,ab108357)、半胱氨酸天冬氨酸蛋白酶3(caspase-3,ab32351)、β-actin(ab8227)、山羊抗兔IgG H&L(ab6721)购自英国Abcam公司;LINC01980、LIN28B、GAPDH 引物和siRNA 质粒、siNC 质粒、pcDNA3.1载体、pcDNA3.1-LINC28B 质粒由生工生物工程(上海)股份有限公司合成;NanoDrop one 超微量分光光度计、Multiskan FC 酶标仪购自美国Thermo Fisher公司;CFX96 Touch 实时荧光定量PCR 仪、Gel-Doc XR蛋白凝胶成像仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 生物信息学分析 生物信息学工具iBio Tools V5.0(http://www.chrisapp.xyz:3838/R/AnnoE2/,设置参数:P<0.05,logFC=1)预测宫颈癌差异表达基因,catRAPID(http://service.tartaglialab.com/page/catrapid_group)预测lncRNA 与蛋白的相互结合关系,生物信息学预测LINC01980与LIN28B相互作用关系,提示辨识度(Discriminative Power)>20%可能发生交互作用,>75%极有可能存在交互作用。
1.2.2 血液采集 宫颈癌患者于术前、对照组于体检当日抽取肘部静脉血3 ml,4 ℃、3 000 r/min 离心15 min,转移上清至新离心管,-80 ℃保存。
1.2.3 细胞培养与分组 常规复苏宫颈癌细胞系Hela,加至含10%胎牛血清的MEM 培养基,37 ℃、5%CO2培养,2~3 d 更换1 次培养液,细胞融合度达到80%左右时胰蛋白酶消化传代。收集细胞,调整细胞数为6×105个/孔,接种至6 孔板,细胞融合度达到80%时更换为无血清DMEM 培养基,按照Lipofectamine3000 试 剂 盒 说 明 书 将 Lnc-NC、si-LINC01980、si-LINC01980+LIN28B-NC、si-LINC01980+LIN28B 分别转染至Hela 细胞,分为Lnc-NC 组、si-LINC01980 组、si-LINC01980+LIN28B-NC 组 和si-LINC01980+LIN28B 组,对照组仅添加新鲜培养液,转染48 h后收集细胞进行后续实验。
1.2.4 qRT-PCR 检测血清及细胞中LINC01980、LIN28B mRNA 表达 RNAiso Plus 试剂盒提取血清及Hela细胞中总RNA并检测浓度,反转录试剂盒将RNA 反转录为cDNA,进行qRT-PCR 反应,反应条件:预变性95 ℃ 45 s,变性95 ℃ 30 s,退火60/58/62 ℃ 45 s,延伸72 ℃ 30 s,共40个循环。以GAPDH为内参,2-ΔΔCt计算血清及Hela 细胞中LINC01980、LIN28B mRNA相对表达。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.5 RNA 免疫共沉淀 收集Hela 细胞,离心,加入等体积RIP裂解缓冲液吹打悬浮,取5 g 蛋白抗体于免疫沉淀缓冲液内与protein A/G 磁珠结合2 h,加入100 µl 细胞裂解物,4 ℃轻柔搅动孵育1 h,离心,弃上清,加入400 µl洗脱缓冲液4 ℃孵育2 h,TRIzol提取RNA,qRT-PCR 检测 LINC01980表达。
1.2.6 RNA pull-down 根据RNA pull-down 试剂盒说明书实验,将生物素标记的LINC01980 转染至Hela 细胞,培养48 h,收集细胞,加入细胞裂解液和链霉亲和素琼脂糖珠4 ℃孵育 3 h,预冷裂解缓冲液洗涤3 次,十二烷基硫酸钠缓冲液中回收蛋白,Western blot检测LIN28B表达。
1.2.7 CCK-8 检测细胞活力 收集1.2.3 中转染后的各组Hela 细胞,每组设置3 个重复,每个重复 3 个复孔,弃原培养基,37 ℃、5%CO2培养48 h,每孔加入10 µl CCK-8 试剂和100 µl 新鲜培养基,37 ℃避光培养2 h,弃上清,酶标仪检测450 nm 处吸光度(OD)值,细胞活力(%)=实验孔OD 值/对照孔OD值×100%。
1.2.8 流式细胞术检测HTR-8/Svneo 细胞周期及凋亡 收集1.2.3 中转染48 h 的各组Hela 细胞,每组设置3 个重复,每个重复3 个复孔,PBS 洗涤, 1 500 r/min 离心5 min,收集细胞并调整浓度为 1×106个/ml,吸取1 ml 细胞悬液,离心,弃上清,70%预冷乙醇固定2 h,PBS 洗涤,离心,加100 µl RNase A 溶液,重悬细胞,37 ℃水浴30 min,加入400 µl PI染色液混匀,4 ℃遮光孵育30 min,流式细胞仪检测细胞周期。收集1.2.3 中转染48 h 的各组Hela 细胞,每组设置3 个重复,每个重复3 个复孔,调整细胞浓度为1×106个/ml,PBS 洗涤,Binding Buffer 重悬细胞,吸取100 µl细胞悬液加至流式管,再加入5 µl室温遮光孵育10 min,加入5 µl PI 染色液室温遮光孵育5 min,加入PBS 至500 µl,混匀,流式细胞仪检测细胞凋亡。
1.2.9 Western blot 检测细胞蛋白表达 收集1.2.3 中培养48 h 的各组细胞,调整细胞数为 5×104个/孔,加至24孔板,弃上清,PBS洗涤,每组设置3 个重复,每个重复3 个复孔,试剂盒提取细胞总蛋白并检测蛋白浓度,SDS-PAGE 凝胶电泳,封闭,分别加入兔抗人CyclinD1、CDK4、caspase-3、β-actin 稀释液4 ℃孵育过夜,TBST 洗膜,加入山羊抗兔IgG H&L 二抗稀释液(1∶2 000 稀释),室温孵育1 h,TBST 洗膜,蛋白凝胶成像仪成像,Image J 分析蛋白相对表达。
1.3 统计学方法 采用SPSS25.0软件进行数据分析,计量资料采用±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌组与健康组血清LINC01980、LIN28B mRNA 表达比较 生物信息学工具iBio Tools V5.0(http://www.chrisapp.xyz:3838/R/AnnoE2/)预测结果表明,LINC01980在宫颈癌组织中表达上调(图1A)。与健康组比较,宫颈癌组血清LINC01980、LIN28B mRNA表达显著升高(P<0.001,图1B)。
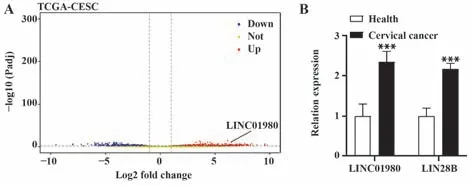
图1 两组血清LINC01980、LIN28B mRNA表达Fig.1 Expressions of serum LINC01980 and LIN28B mRNA in two groups
2.2 生物信息学网站预测LINC01980 结合蛋白 生物信息学网站(http://service.tartaglialab.com/page/catrapid_group)预测结果表明:LINC01980 RNA 与LIN28B 存在结合位点,且在1841-1990 处辨识度达88%,极有可能发生相互作用(表2)。
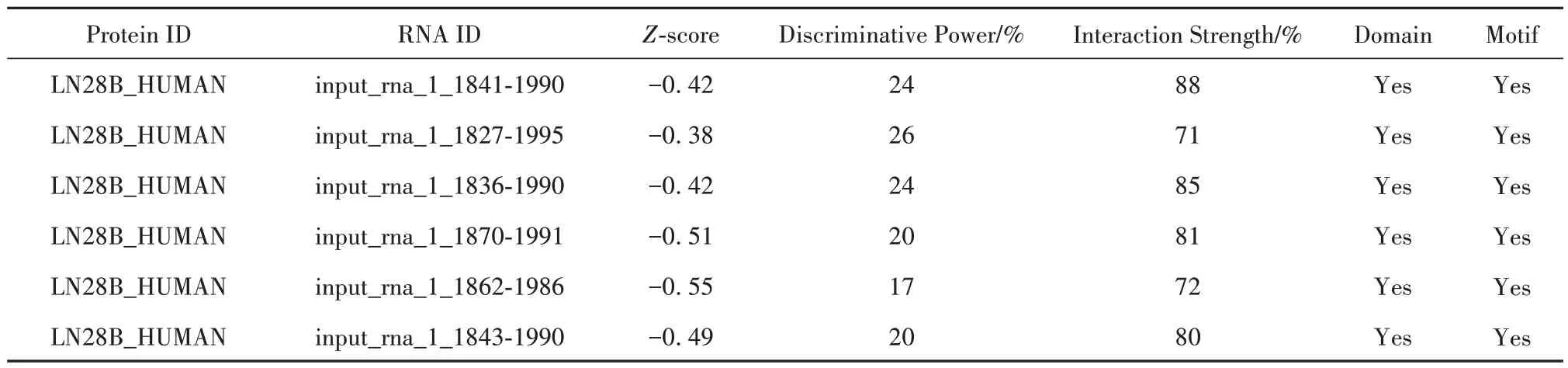
表2 生物信息学网站预测LINC01980结合蛋白Tab.2 Binding proteins of LINC01980 predicted by bioinformatics website
2.3 RNA 免 疫 共 沉 淀、RNA pull-down 检 测LINC01980 与LIN28B 结合 RNA 免疫共沉淀实验结果显示,与IgG 相比,免疫沉淀复合物中LINC01980 含量显著升高(P<0.001,图2A),RNA pull-down 实验结果显示,LINC01980 正义链下拉的沉淀物中检测出LIN28B 表达(图2B)。提示LINC01980与LIN28B发生相互作用。
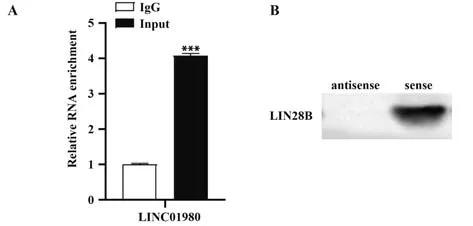
图2 LINC01980、LIN28B结合验证图Fig.2 LINC01980 and LIN28B combination verification diagram
2.4 沉 默LINC01980 对Hela 细 胞LINC01980、LIN28B mRNA 表达的影响 与对照组比较,Lnc-NC组LINC01980、LIN28B mRNA 表达差异无统计学意义(P>0.05),si-LINC01980 组 LINC01980、LIN28B mRNA表达显著降低(P<0.05,图3)。
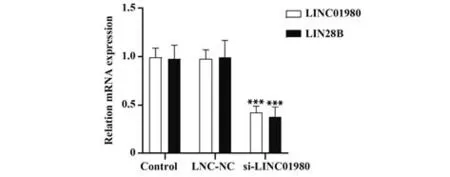
图3 Hela细胞LINC01980、LIN28B mRNA表达Fig.3 LINC01980 and LIN28B mRNA expressions in Hela cells
2.5 沉默LINC01980 对Hela 细胞生长的影响 与对照组比较,Lnc-NC 组细胞活力、细胞凋亡率、细胞周期G0/G1期、S 期、G2/M 期细胞百分比、CyclinD1、CDK4、caspase-3 蛋白表达差异无统计学意义(P>0.05),si-LINC01980 组细胞活力、S 期、G2/M 期细胞百分比、CyclinD1、CDK4、LIN28B 蛋白表达显著降低,细胞凋亡率、G0/G1期细胞百分比、caspase-3 蛋白表达显著升高(P<0.001,图4)。
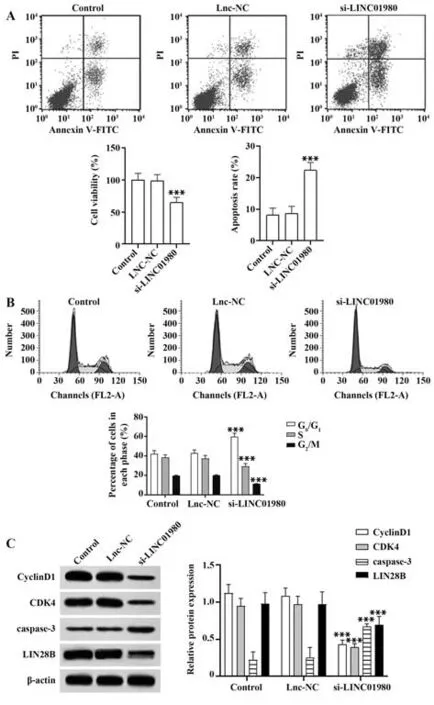
图4 沉默LINC01980表达对Hela细胞生长的影响Fig.4 Effect of silencing LINC01980 expression on Hela cell growth
2.6 过表达LIN28B逆转了沉默LINC01980对宫颈癌细胞生长的抑制作用 与si-LINC01980 组比较,si-LINC01980+LIN28B NC 组Hela 细胞活力、细胞凋亡率、G0/G1期、S 期、G2/M 期细胞百分比、CyclinD1、CDK4、caspase-3 蛋白表达差异无统计学意义(P>0.05),si-LINC01980+LIN28B 组细胞活力、S 期、G2/M 期细胞百分比、CyclinD1、CDK4、LIN28B蛋白表达显著升高,细胞凋亡率、G0/G1期细胞百分比、caspase-3蛋白表达显著降低(P<0.001,图5)。
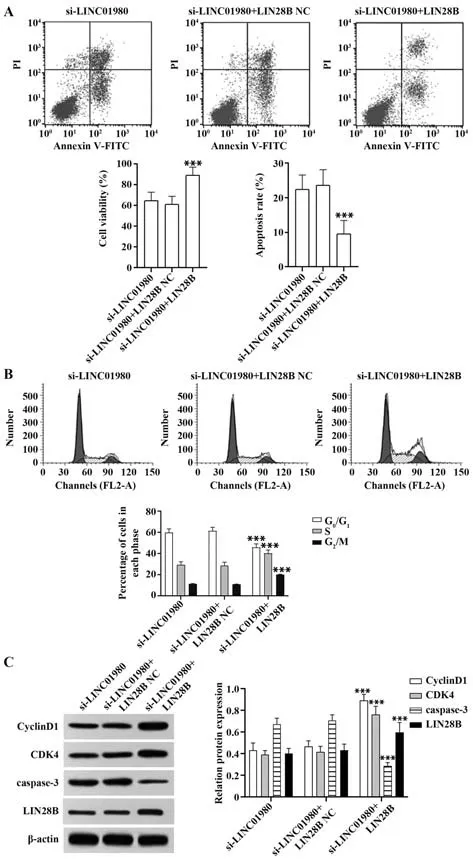
图5 过表达LIN28B逆转了沉默LINC01980对宫颈癌细胞生长的抑制作用Fig.5 Overexpression of LIN28B reversed inhibitory effect of silencing LINC01980 on growth of cervical cancer cells
3 讨论
宫颈癌是最常见的女性生殖道恶性肿瘤,同时也是女性第四大常见恶性肿瘤,其发生主要与高危型人乳头状瘤病毒(human papillomaviruses,HPV)持续感染有关[11]。手术和放化疗等虽然有效降低了宫颈癌病死率,但晚期宫颈癌患者预后较差,宫颈癌仍是导致癌症死亡的主要原因之一[12]。lncRNA是由200~300 个核苷酸组成的非编码RNA,其异常表达与肿瘤细胞增殖、迁移、侵袭、凋亡和上皮-间质转化有关,部分lncRNA 可作为恶性肿瘤诊断和预后的潜在靶标和生物标志物[13-14]。LINC01980 是 一种新发现的癌症相关lncRNA,研究表明肝癌组织中LINC01980 表达显著高于癌旁组织,LINC01980高表达的肝癌患者预后较差,且敲除LINC01980 能够抑制肝癌细胞Huh7 和Hep3B 增殖,促进细胞凋亡[6]。微列阵分析表明,LINC01980 在食管鳞状细胞癌组织中显著上调,且与癌症TNM 分期、组织浸润和患者预后有关,体内外实验均表明LINC01980能够促进食管鳞状细胞癌生长[8]。本研究生物信息学分析结果表明,LINC01980在宫颈癌中表达上调,临床试验显示宫颈癌患者血清中LINC01980表达显著高于健康对照组,提示在宫颈癌中LINC01980 表达异常。体外实验结果显示,沉默LINC01980 可抑制宫颈癌细胞Hela 活力,提高G0/G1期细胞百分比,促进细胞凋亡。CyclinD1是调节细胞周期的主要蛋白之一,与CDK4 形成复合物调控G1期细胞向S 期过 渡[15]。本 研 究Western blot 结 果 表 明,沉 默LINC01980 能够抑制蛋白CyclinD1 和CDK4 表达,提示LINC01980可能通过调控细胞周期和凋亡参与宫颈癌Hela 细胞生长和增殖,具体机制有待进一步分析。
lncRNA 通过碱基互补和二级结构形成颈环,能够与DNA、RNA 和蛋白相互作用,在表观遗传、转录和转录后水平影响基因表达,进而参与染色质修饰、转录激活和抑制、核内运输等过程[16-17]。lncRNA牛磺酸上调基因1(taurine-upregulated gene 1,TUG1)通过靶向极光激酶A(aurora kinase A,AURKA)促进上皮性卵巢癌细胞SK-OV-3增殖和侵袭[18]。生物信息学数据库分析表明,LINC01980 与LIN28B 存在相互作用。LIN28B 是一种高度保守的RNA 结合蛋白,在胚胎干细胞和发育组织中高表达,参与细胞发育、代谢重编程、肿瘤发生等多种生物学过程[19]。LIN28B 可通过直接结合mRNA 或阻断miRNA 生物合成调节基因表达[20]。Let-7是一种肿瘤抑制因子,研究表明LIN28B 能够通过与let-7 前体末端相结合阻断Let-7 生物合成[21]。本研究表明,在Hela 细胞中沉默LINC01980 表达,LIN28B 表达降低,过表达LIN28B 可逆转沉默LINC01980 对宫颈癌细胞生长的抑制作用,提示LINC01980 协同LIN28B 在Hela细胞增殖、凋亡中发挥作用。本研究证实LIN28B是LINC01980 的结合蛋白且存在相互作用,提示LINC01980 可结合LIN28B,抑制Hela 细胞增殖,促进细胞凋亡,但LINC01980与LIN28B蛋白的结合序列及具体作用机制尚不明确,是后续研究重点。
综上,LINC01980 在宫颈癌中过表达,沉默LINC01980 能够抑制宫颈癌Hela 细胞生长,可能与LINC01980 调控LIN28B 有关。但本研究仅通过生物学分析及体外细胞实验探讨了LINC01980可能通过调控LIN28B 影响宫颈癌Hela 细胞生长,需在体内进一步验证,且LINC01980 是否通过其他途径影响宫颈癌Hela细胞生长有待后续研究。