肺脏的区域免疫特性及其在感染性疾病中的调控机制研究进展①
2023-03-17雷泽慧张馨文刘翠华
雷泽慧 张馨文 汪 静 刘翠华
(中国科学院微生物研究所病原微生物与免疫学重点实验室,北京 100101)
肺脏是人体呼吸系统中最重要的器官,承载着气体交换的功能,而这一功能也决定了其与外界环境相通,且长期暴露于病原微生物等潜在有害的环境中。因此,为了抵御病原感染并避免炎症损伤,肺脏形成了一套完善的免疫防御体系,其中包括黏膜上皮细胞、组织驻留固有和适应性免疫细胞,及其产生的黏液、抗体和细胞因子等免疫效应分子。这些免疫组分之间协同作用,构成了抵御外来抗原的物理、化学及免疫屏障,从而共同维持肺脏免疫微环境稳态[1]。然而,部分病原微生物在与肺脏免疫防御体系搏斗的过程中,可以突破上述屏障,从而导致肺脏局部的免疫稳态失衡,并引发感染性疾病。目前,由呼吸道病原体导致的呼吸系统感染性疾病仍然是全球死亡的主要风险因素之一,幼儿、老年人及免疫功能低下者尤易发生此类感染[2]。因此,了解感染性疾病发生过程中的肺脏区域免疫应答机制并恢复其免疫稳态至关重要。近年来,新型单细胞测序技术等新技术的发展拓展了人们对生理及病理条件下肺脏区域免疫特性的了解,为肺部感染性疾病的防治提供了重要的科学依据和理论指导[3-5]。本文将总结归纳肺脏的区域免疫特性,包括固有和适应性免疫特性及其涉及的黏膜免疫特性,并重点阐释感染性疾病中的肺脏区域免疫特征以及探讨其对感染性疾病防治的指导意义,旨在为肺脏区域免疫特性的深入研究以及揭示区域免疫特性与感染性疾病的内在联系提供参考,并提供防治感染性疾病的免疫新靶点及新途径。
1 肺脏的区域免疫特性
肺脏长期接受外来抗原的刺激,是炎症性疾病的高发器官。为了维持肺脏局部微环境的稳态,其中的黏膜上皮、免疫细胞及基质细胞等共同构成了肺脏独特的固有及适应性免疫应答体系,以发挥免疫监视和免疫防御功能(图1)。
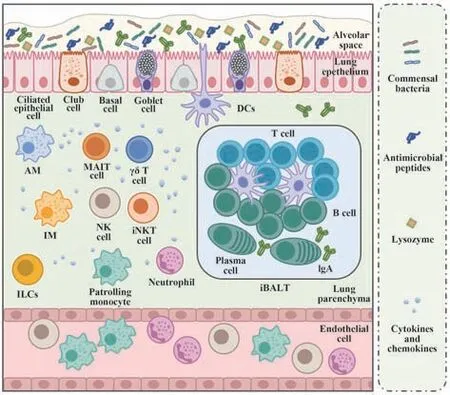
图1 肺脏的区域免疫特性Fig.1 Lung regional immunity
1.1 肺脏的固有免疫特性 肺脏的固有免疫应答是由黏膜上皮和固有免疫细胞共同执行的一种非特异性免疫防御机制,其可对多种抗原物质快速反应,并对激活随后的适应性免疫应答至关重要。
1.1.1 肺脏黏膜上皮 肺脏的黏膜上皮是抵御病原微生物入侵的首要物理及免疫化学屏障。一方面,纤毛上皮细胞、杯状细胞、克拉拉细胞及基底细胞等紧密连接形成完整的上皮屏障以抵御外来微生物入侵,纤毛上皮细胞还可通过纤毛的摆动促进病原微生物外排。另一方面,杯状细胞、克拉拉细胞及肺泡上皮细胞等通过分泌抗菌肽、溶菌酶、蛋白酶抑制剂及表面活性物质等黏液组分,覆盖于上皮表面进一步抵御病原微生物感染[6]。肺脏黏膜上皮细胞还可表达系列模式识别受体(pattern recognition receptors,PRRs),以识别病毒、细菌、真菌等的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),感知病原体感染并分泌多种细胞因子和趋化因子等,招募固有及适应性免疫细胞启动对应的免疫应答[7]。近年的一项研究系统分析了肺脏上皮细胞的PRRs 被激活后的转录组和分泌组数据,鉴定出多个与炎症免疫反应相关的调节基因和分泌蛋白,证明了此类细胞在协调炎症应答中的重要免疫调控作用,并提示上皮细胞可通过调节蛋白质组成及外泌体释放进而影响其与免疫细胞间的通讯[8]。此外,值得一提的是,肺脏的黏膜上皮表面被复杂而动态的微生物群定植,上皮细胞可与微生物组及其代谢物相互作用以维持肺部黏膜免疫微环境稳态,其失调将导致慢性阻塞性肺疾病等肺部疾病的发生;而且,由于黏膜免疫系统的共通性,肠道微生物群在肺脏免疫应答及相关疾病的发生发展过程中也发挥重要调控作用[9]。然而,目前此类研究仍处于初步阶段,急需利用微生物组学、代谢组学等多组学方法,对肺部上皮细胞和微生物群间的相互作用及其对肺部黏膜免疫微环境的调控作用予以阐释。综上,肺脏的黏膜上皮不再是传统观点中的静态屏障性结构,而是可感知和响应微环境变化,并与微生物群和免疫细胞等相互作用以塑造肺脏免疫应答的动态组织结构。
1.1.2 肺脏的组织驻留固有免疫细胞 肺脏的固有免疫应答除依赖于黏膜上皮外,还受到与上皮细胞相互作用的组织驻留固有免疫细胞的精细调控,主要包括:巨噬细胞、树突状细胞(dendritic cells,DCs)、固有淋巴样细胞(innate lymphoid cells,ILCs)和自然杀伤(natural killer,NK)细胞等。巨噬细胞是重要的肺脏组织驻留免疫细胞,包括肺泡巨噬 细胞(alveolar macrophages,AMs)和间质巨噬细胞(interstitial macrophages,IMs)。其中,AMs在感染早期通过上调细胞表面的吞噬性受体以及招募其他炎症细胞抵御病原体感染;而在感染晚期,AMs 促进转化生长因子-β(transforming growth factor-β,TGF-β)等抑炎因子产生以限制感染过程中的炎症反应,并促进感染后肺组织修复[10-11]。IMs具有很强的可塑性,其能根据不同的疾病表现出不同的表型及功能[12]。在过敏原等刺激状态下,IMs 持续表达IL-10 等免疫调控因子,以减轻过敏性炎症的发展[13-14]。在组织修复过程中,IMs通过表达损伤修复相关因子抑制组织的瘢痕化[15]。DCs是专职抗原提呈细胞,肺脏中的DCs 包括浆细胞样DCs(plasmacytoid DCs,pDCs)和 传 统DCs(conventional DCs,cDCs),cDCs 可进一步细分为cDC1s 和cDC2s,不同的DC 亚群具有不同的免疫功能。pDCs 通过增强Th2 型免疫应答调控肺部过敏性炎症,以及通过产生Ⅰ型IFN 参与抗病毒免疫应答[16-17]。cDC1s 通过产生IL-12 和IL-2 等调节过敏或感染条件下的Th2和Th17型免疫应答[18-19]。CDC2s可运输抗原到引流淋巴结,协调Th2 型免疫应答以应对感染[20]。ILCs是维持肺组织稳态的另一重要免疫亚群,包括ILC1s、ILC2s 和ILC3s。ILC1s 发挥免疫监视及控制感染的作用,其在流感病毒等感染的早期产生IFN-γ促进病毒早期清除[21-22]。ILC2s 分泌IL-13、IL-5 等Th2 型细胞因子,在肺脏的过敏性应答及清除寄生虫感染过程中发挥重要作用[23];其还是感染后肺组织修复的重要递质,但调控作用受细胞所处微环境的影响[24]。ILC3s是人肺脏中最丰富的ILC 亚群,可以快速分泌肺脏免疫关键分子IL-17 和IL-22,对于清除病原体感染至关重要[25-27]。NK 细胞近年来也被发现可在肺脏中驻留,主要通过上调脱颗粒/细胞毒性标志物CD107a 的表达,并产生颗粒酶B(granzyme B,GZMB)和IFN-γ 以 清 除 被 感 染 的 巨 噬细胞[28]。
除上述常规的组织驻留固有免疫细胞外,γδ T 细胞、黏膜相关恒定T(mucosal-associated invariant T,MAIT)细胞和恒定自然杀伤性T(invariant natural killer T,iNKT)细胞是三类发挥固有免疫效应的非典型T细胞,遍布肺部和气道的黏膜层,参与调控抗病原体免疫应答。肺脏中的γδ T 细胞主要通过分泌IL-17 促进病原体清除并减轻组织病理损伤[29]。MAIT细胞可被IL-12和IL-18等炎症细胞因子激活,进一步分泌IFN-γ 和TNF-α 等Th1 型细胞因子以及IL-17A 和IL-22 等Th17 型细胞因子,并释放GZMB和穿孔素以溶解感染的细胞[30]。肺脏中的iNKT 细胞主要包括NKT1 和NKT17,其可被趋化因子激活,并以CD1d 依赖性的方式识别糖脂抗原,进而产生IFN-γ 和IL-17 以抵抗呼吸道病原体感染[31]。此外,中性粒细胞、单核细胞及骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)等不在肺组织中驻留,但可在急性肺部炎症期间由外周血被招募至肺脏发挥免疫调控作用,在此不予详述。
1.1.3 肺脏的训练免疫 近年越来越多的研究表明,固有免疫细胞除在初次接受刺激时发挥效应外,也能通过表观遗传学改变和代谢重塑产生免疫记忆,并在接受同源或非同源抗原刺激时引起迅速而强烈的免疫应答,此现象称为训练免疫。研究发现肺脏固有免疫应答也具有训练免疫特性,其形成主要包括两种途径。一方面,在γ 疱疹病毒感染条件下,肺脏驻留的肺泡巨噬细胞可被循环的单核细胞替代,并被训练为具有免疫记忆的巨噬细胞,以抵御螨虫诱导的哮喘发生[32]。另一方面,腺病毒感染条件下,肺泡巨噬细胞可依赖于CD8+T 细胞释放的IFN-γ 促进其表观遗传学改变和代谢重塑,进而形成免疫记忆,此机制提供了一种适应性免疫逆向调控固有免疫记忆形成的新范式[33]。除肺泡巨噬细胞外,ILC2s 也被证明可以形成免疫记忆,记忆性ILC2s与记忆性CD8+T细胞具有相似的基因特征,且可在肺脏纵隔引流淋巴结中长期驻留,提示ILC2s的免疫记忆具有适应性免疫的特性[34]。除了上述两类细胞以外,肺脏中的其他固有免疫细胞以及上皮细胞、内皮细胞等是否也具有训练免疫特性及其形成机制仍有待阐明。
综上,肺脏固有免疫应答在肺部感染早期发挥重要调控作用,但其是一把双刃剑,过度的免疫应答可能造成组织炎症性损伤。因此,需深入阐明各种细胞的时空动态调控特征,以根据其特点选择合适的免疫治疗策略。此外,研究表明,流感病毒等感染条件下,肺脏DCs 产生的IL-12 和IL-18 可以促进ILC2s转化为ILC1s样细胞[35],因此肺脏驻留固有免疫细胞间存在动态相互作用,但更多的免疫细胞、上皮细胞及基质细胞间的相互动态调控网络仍有待揭示。
1.2 肺脏的适应性免疫特性 固有免疫应答发生后,肺脏中被激活的DCs 可迁移至鼻相关淋巴组织(nasopharynx-associated lymphoid tissue,NALT)和支气管相关淋巴组织(bronchus-associated lymphoid tissue,BALT),并在此向T 细胞提呈抗原,同时募集与促进B细胞分化,诱导适应性免疫应答。
1.2.1 T细胞免疫应答 T细胞免疫应答是肺脏区域免疫特性的重要组成部分,其由CD4+和CD8+T 细胞以及后形成的组织驻留记忆性T(tissue-resident memory T,TRM)细胞共同介导。CD4+T 细胞在抗原刺激下分化为功能不同的效应亚群并通过产生免疫调节细胞因子发挥作用,其亚群主要包括:Th1、Th2、Th17、滤泡辅助T(follicular helper T cell,Tfh) 细胞、调节性T(T regulatory,Treg)细胞以及新发现的驻留辅助性T(resident helper T,TRH)细胞[36]。Th1亚群主要识别胞内病原体感染的巨噬细胞表面所提呈的抗原,并通过释放IFN-γ 激活巨噬细胞,增强巨噬细胞清除病原体的能力。Th2 亚群通过产生IL-4、IL-5、IL-9、IL-10 和IL-13 等,促进嗜酸性粒细胞和肥大细胞介导的免疫应答以控制胞外寄生虫感染并调节炎症强度。Th17 亚群可产生IL-17 和IL-22 促进中性粒细胞对胞外细菌和真菌的清除。与Th1、Th2 和Th17 不同,Tfh 则主要在淋巴滤泡中辅助B细胞生发中心形成及高亲和力抗体产生。而不同于促进病原体清除的效应T 细胞,Treg 细胞主要在肺部炎症的晚期被招募,并通过产生IL-10 和TGF-β 抑制过度的免疫应答。此外,近年来在肺脏中发现了一类具有滤泡性辅助T 细胞和TRM 细胞特性的新型CD4+T细胞亚群TRH细胞,其可在黏膜组织中促进B 细胞和CD8+T 细 胞免疫应答[37-38]。与CD4+T 细胞通过增强其他细胞效应功能而发挥间接杀菌作用不同,CD8+T 细胞被活化为细胞毒性效应细胞后,可通过释放穿孔素、颗粒酶等直接作用于被感染的靶细胞诱导其死亡以清除病原体,但此过程的过度活化会导致肺组织病理损伤。
在炎症免疫应答后期,CD4+和CD8+T 细胞可以转变为CD69+和CD103+的TRM 细胞。肺脏中长期驻留针对细菌或病毒的特异性TRM 细胞,可在再次受到同源抗原刺激时于原位迅速产生免疫应答[39]。与CD8+TRM 细胞相比,CD4+TRM 细胞在肺脏中更为丰富,且发挥主要的免疫监视作用[40]。值得一提的是,肺脏中病毒特异性的CD8+TRM 细胞可被细菌性抗原刺激后产生的IL-12 和IL-18 激活,并进一步招募中性粒细胞以清除抗原并减轻肺部损伤,提示肺脏中的TRM 细胞不仅可发挥适应性免疫应答效应,还具备固有免疫特性,参与非同源抗原诱导的免疫应答[41]。除TRM 细胞外,此前研究还发现了 一类未经特异性抗原刺激,利用自身免疫性产生记忆细胞特征的虚拟记忆T(virtual memory T,TVM)细胞,可在呼吸道病原体感染早期进入肺组织并增殖分化,最终发育为TRM 细胞[42]。该研究表明TVM细胞可作为固有免疫与适应性免疫的桥梁,在感染早期发挥非特异性免疫清除功能,并可进一步发育为TRM细胞,以快速响应病原的再次入侵。
值得一提的是,适应性T 细胞免疫应答的特异性依赖于其表面表达的T细胞受体(T cell receptors,TCRs)与抗原主要组织相容性复合体(major histocompatibility complex,MHC)的相互作用。TCR 谱是所有T 细胞的TCR 总和,会随着机体的健康状态而发生变化,因此TCR 是个体免疫状态的重要指标。研究表明,具有高TCR 谱系多样性的多功能T 细胞应答与更有利的呼吸系统疾病结局密切相关[43-44]。因此,绘制感染或疫苗接种后TCR 谱多样性的变化图谱,对于确定适应性免疫应答效率和T 细胞应答能力至关重要,且也是评估疫苗有效性和感染后反应的重要指标。
1.2.2 B 细胞免疫应答 B 细胞通过发挥抗体依赖与非依赖的效应调控肺脏免疫微环境。一方面,当肺脏被感染或有慢性炎症发生时,B 细胞会被招募至肺脏的三级淋巴样结构(tertiary lymphoid structures,TLS)——诱导性支气管相关淋巴组织(induced BALT,iBALT)中,在此形成生发中心并分化为浆细胞产生高亲和力的IgG、IgA 和IgM,进一步通过调节吞噬活性或中和毒素等作用促进病原体清除[45]。另一方面,B 细胞可以不依赖于抗体,通过产生细胞因子以调控免疫稳态,如淋巴毒素可以促进次级淋巴器官生成、稳态维持和iBALT 发育;IL-6、IFN-γ 和TNF-α 可以影响效应和记忆CD4+T 细胞形成及免疫功能;IL-10 和IL-35 则在炎症免疫应答中发挥负向调控作用,抑制炎症因子的过度产生及其导致的组织损伤[46]。更重要的是,B 细胞表面表达MHC 分子,可作为抗原提呈细胞将加工处理过的抗原提呈至T细胞,促进T细胞活化[47]。
与T 细胞一样,在炎症免疫应答过程中,B 细胞也可以分化为高表达CXCR3和CD69的组织驻留记忆B(resident memory B,BRM)细胞。研究表明,小鼠感染流感病毒后,其肺组织中存在大量的BRM 细胞,且可在同源抗原再次刺激时快速分化为浆细胞[48]。此类细胞表达肺脏驻留标志物CXCR3、CCR6和CD69,位于肺脏的iBALT 中,具有不同于循环或脾脏中记忆B细胞的转录谱[49]。近年发现病毒感染的小鼠肺脏中存在两种不同的BRM 细胞亚群,其中一类为传统的BRM 细胞受到病毒再次刺激后,可立即分化为浆细胞并分泌可抵御病毒的抗体;而另一类为非特异的旁观BRM 细胞并不能直接识别病毒,而是通过一种特定的受体与传统BRM 细胞产生的抗体及其免疫复合物结合,进而发挥协同效应,增强肺脏中的抗病毒记忆反应[50]。除参与抗病毒感染免疫应答外,研究发现肺炎球菌等细菌性病原体感染也可诱导肺部BRM 细胞生成,此类细胞表达CD69、PD-L2、CD80 和CD73 等独特的表面标志物,可在受到病原菌刺激后迅速分泌抗体,以保护机体免受病原菌的再次感染[51]。综上,BRM 细胞是经历病原体感染的肺组织的共同特征,是肺脏适应性免疫应答的重要组成部分。但针对该细胞的研究仍处于初级阶段,其在肺脏免疫应答中的多效调控作用及分子机制仍有待深入研究。
综上,肺脏的固有及适应性免疫系统间相互交叉、相互作用,形成复杂而严密的调控网络共同维持肺脏的免疫稳态。而目前上述研究多局限于某一类细胞的免疫调控功能,而整个肺组织的细胞类型和位置信息及其相互作用图谱仍有待揭示。
2 感染性疾病中的肺脏区域免疫特性
病原体感染导致肺脏炎症免疫稳态失衡进而引发肺部感染性疾病,其可依据发病速度及病程长短分为急性和慢性感染性疾病,而此两类疾病在发病过程中也表现出不同的肺脏区域免疫特性(图2)。
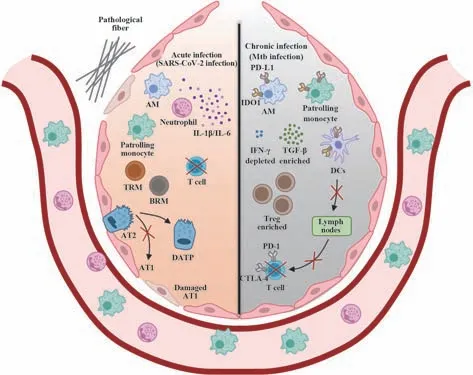
图2 急性与慢性感染性疾病中的肺脏区域免疫Fig.2 Lung regional immunity in acute and chronic infectious diseases
2.1 急性感染性疾病中的肺脏区域免疫特性 肺炎链球菌、流感病毒、新型冠状病毒等主要引起肺部的急性感染。对此,若肺脏可产生有效且适度的固有及适应性免疫应答,则机体能够自发控制感染,并建立长期的免疫记忆。然而,此类病原微生物感染往往诱发肺脏免疫稳态失衡,进而导致肺炎。新型冠状病毒感染导致的肺炎(以下简称新冠肺炎)的高死亡率及持续大流行,促使人们思考急性感染条件下的宿主肺脏保护性免疫机制。借助于单细胞测序等组学技术发展,这一机制逐步获得揭示。在此,本文将以新冠肺炎为例,对急性感染性疾病中的肺脏区域免疫特性予以讨论。
固有免疫系统的过度活化是肺脏急性感染性疾病的主要特征。研究表明,新冠肺炎患者的肺脏中密集浸润大量异常活化的单核细胞衍生的巨噬细胞及组织驻留的AMs,此类细胞能够快速持续产生IL-1β 和IL-6 等促炎细胞因子,从而导致感染局部的高炎症性微环境[4]。除产生促炎细胞因子外,巨噬细胞还可分泌CCL2、CCL4等趋化因子,以招募单核和中性粒细胞,进而导致炎症加重[52]。此外,新冠肺炎死亡患者肺脏中性粒细胞及其介导的免疫通路高度活化,与新冠病毒入侵相关的蛋白cathepsins B/L 以及炎症应答调控蛋白S100A8/A9 表达上调,也提示肺脏局部过度活化的免疫微环境。值得一提的是,研究发现新冠肺炎死亡患者的肺脏中病毒载量极低,提示是患者免疫系统过度活化导致的病理损伤,而非病毒大量扩增导致了患者死亡[53]。不同于固有免疫系统的过度活化,新冠肺炎患者的T 细胞免疫功能受损[4,54]。而在康复患者的呼吸道中可观察到功能性B 细胞以及CD4+和CD8+TRM细胞,但老年恢复期患者CD8+TRM细胞的应答异常可能导致肺功能受损等后遗症[55]。由于免疫系统过度活化导致了严重的肺脏病理损伤,肺组织修复障碍及纤维化是肺脏急性感染性疾病的另一重要特征。人类的Ⅱ型肺泡上皮细胞(alveolar type Ⅱ,AT2)通过自我更新和转分化为Ⅰ型肺泡上皮细胞(alveolar type Ⅰ,AT1)参与肺组织的修复与再生[56]。而在新冠肺炎患者肺脏中鉴定到一类AT2向AT1 分化过程中的过渡态细胞类型,具有损伤相关瞬时祖细胞(damage-associated transient progenitors,DATPs)特征,因而导致肺上皮细胞再生受损[4,57]。此外,研究发现新冠肺炎患者的肺脏中纤维化通路相关基因表达上调,病理性成纤维细胞比例升高,可在肺组织中迅速形成疤痕,且肺脏的纤维化程度随病程延长逐渐加重[4,53]。进一步机制学研究实验表明,低氧应答因子HIF-1α(hypoxia- inducible factor 1α)的持续激活及组织再生相关因子FOXO3(Forkhead box protein O3)的表达沉默可能是成纤维细胞向病理性成纤维细胞转变的关键驱动因素[57]。人源AT2 细胞可在肺脏发生纤维化时转分化为功能性的基底细胞,进而促进肺组织自我更新[58]。值得注意的是,上述揭示的新冠肺炎患者的肺脏区域免疫特性多是基于单个时间点的肺组织采集分析结果,因此仅能代表感染特定时期的免疫应答特点,而疾病发生发展过程中不同阶段的肺脏区域免疫应答动态特征值得进一步探究。
2.2 慢性感染性疾病中的肺脏区域免疫特性 病原微生物若在急性感染期间不能被及时有效地清除,将与宿主长期共存进而引发慢性感染性疾病,此类疾病的发生、发展与转归取决于病原微生物与宿主之间长期而复杂的相互作用。结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染导致的结核病(tuberculosis,TB)是重要的肺部慢性感染性疾病,长期严重威胁全球人类健康。本文将以TB为例,对慢性感染性疾病中的肺脏区域免疫特性予以讨论。
保护性免疫功能抑制是肺脏慢性感染性疾病的主要特征。Mtb 主要由呼吸道入侵机体并在肺部诱发肉芽肿,此病理性结构是由巨噬细胞、粒细胞、淋巴细胞和成纤维细胞等组成的动态空间屏障结构,是Mtb 的主要生态微环境。斯坦福大学的 MICHAEL ANGELO 团队通过收集TB患者的肺组织石蜡包埋样本,进一步对其进行多重成像(multiplexed ion beam imaging by time of flight,MIBI-TOF)绘制TB 患者的肉芽肿免疫调控网络,发现T 细胞、单核/巨噬细胞和DCs 为主要细胞类型,其中活化的T 细胞比例较低,发挥免疫负调控作用的Treg 细胞增殖增加,单核/巨噬细胞和DCs 高表达免疫抑制 分子PD-L1(programmed cell death-ligand-1)和IDO1(indoleamine 2,3-dioxygenase-1);且肉芽肿中的免疫抑制分子TGF-β 表达上调,而发挥抗Mtb 活性的IFN-γ 减少,综合上述结果表明TB 患者的肉芽肿为免疫抑制性微环境[5]。与此一致的是,基于病原与宿主互作界面的非原位研究也证实Mtb慢性感染过程中的肺脏免疫抑制特性。AMs是Mtb的主要宿主细胞,可通过吞噬、自噬、激活细胞的炎症信号通路及死亡信号通路等促进病原菌清除。而被Mtb感染的AMs 往往表现为免疫抑制状态,根源在于Mtb 可以利用其真核样蛋白磷酸酶或激酶等效应蛋白劫持或抑制AMs 的上述免疫应答功能,从而保障病原菌的胞内存活[59-60]。此外,Mtb感染可抑制DCs成熟并通过多种机制干扰有效的抗原提呈以延迟适应性免疫应答[61]。且T 细胞也表达PD-1(programmed cell death protein-1)和CTLA-4(cytotoxic T lymphocyte-associated protein 4)等抑制性受体,使其免疫应答活性减弱[62]。因此,慢性感染过程中固有免疫应答效能较弱,抗原提呈效率低,进而导致适应性免疫应答被延迟且活性差,最终导致病原菌难以被清除,长期存在于机体导致慢性感染。值得一提的是,除保护性免疫功能被抑制外,TB 患者的肺组织也会出现干酪样坏死、空洞化等免疫病理损伤。近年有研究提示坏死性凋亡在Mtb感染导致的组织损伤及病原菌播散过程中发挥重要调控作用,但其中的免疫动态调控网络仍远未清晰[63]。此外,慢性感染条件下,机体与病原菌的长期相互作用可能会重塑肺脏免疫微环境,进而影响慢性阻塞性肺疾病、肺癌等肺部疾病的发展以及肺部乃至机体的黏膜微生态。现有研究表明Mtb慢性感染与其他肺部疾病的转归具有相关性,且会引起肺部及肠道黏膜微生态变化[64]。其中的因果关系及精细的分子调控机制仍有待深入研究。
3 肺脏区域免疫特性对感染性疾病防治的启示
肺脏作为呼吸道病原体入侵的主要门户,在感染性疾病发生时具有不同于全身系统性免疫的区域免疫特性,与疾病的发生、发展及转归密切相关。而目前针对呼吸道感染性疾病的防治方法仍主要局限于系统性免疫应答,此类方法虽然能防止重症,但难以预防黏膜感染且存在持久性差的问题。因此,急需研发基于肺脏区域免疫特性的急性和慢性感染性疾病的防治新策略,以有效提升宿主的保护性免疫机能进而抑制疾病的发生或减缓发病过程中的免疫功能紊乱及病理损伤。本文从以下两方面提出基于肺脏区域免疫特性的感染性疾病防治思路。
3.1 新型疫苗研发中免疫原及免疫路径的合理选择 感染性疾病过程中肺脏区域免疫特性的形成依赖于病原体与肺脏独特的解剖结构间的相互作用,因此疫苗研发过程中免疫原及免疫路径的选择至关重要。研究表明,腹腔注射灭活的流感病毒可以产生特异性的中和抗体,而滴鼻感染弱毒力的流感病毒则可以产生肺脏区域的病毒特异性T细胞免疫应答,并产生CD4+和CD8+TRM 细胞以提供针对流感病毒的长期免疫保护[65]。值得一提的是,由于全身各系统及器官间的潜在联系,并非仅有滴鼻免疫途径才可以诱发肺脏区域免疫特性形成。研究发现,静脉注射卡介苗(bacillus calmette-Guerin,BCG)也可以促进肺脏CD4+TRM 细胞的产生并诱导组织驻留免疫记忆形成,而皮内注射BCG 产生此免疫效应的能力较弱[66]。因此,应基于病原体及其诱导的肺脏区域免疫应答特性,选择合适的免疫原及免疫路径进行新型疫苗研发,并发展基于肺脏区域免疫特性的疫苗免疫评价新手段。
3.2 感染过程中肺部区域免疫应答的稳态调控 肺脏急性和慢性感染性疾病均表现为免疫功能的紊乱。急性感染条件下,免疫系统过度活化可能是由于病原体的载量较大或毒力较强导致。因此,应在感染早期及时利用抗病原体药物对其予以清除,并结合可促进宿主自噬等过程的免疫调节类药物以减轻死亡的病原体可能造成的免疫损伤。而基于免疫系统过度活化的特性,在进行疫苗研发时,应以诱导适度且有效的免疫应答为原则进行免疫原设计。慢性感染条件下,免疫功能抑制多是由病原体的免疫负调控因子而导致的,因此可基于已阐明的病原因子对宿主免疫功能的调控机制,进行靶向免疫负调控因子的疫苗设计及基于病原-宿主互作界面的药物研发。免疫细胞表面抑制性受体的高表达及激活性受体的低表达可能是导致慢性感染条件下免疫抑制的另一重要因素,因此可分析肺脏关键固有及适应性免疫细胞表面激活及抑制性受体的表达情况,并开发基于此的疾病防治新策略。此外,慢性感染条件下适应性免疫应答出现延迟,可能由于固有免疫应答的强度不足以及抗原提呈过程受抑制,因此可通过揭示其中的具体调控机制,以开发可提升肺脏AMs、ILCs及DCs等固有免疫细胞活性的防治新策略。另外,需注意的是,研究发现肺脏的组织驻留记忆细胞,尤其是TRM 细胞可以提供更长效的免疫记忆且能够在病原体再次感染时快速启动免疫应答,因此诱导功能性的肺脏TRM 和BRM 细胞生成也是感染性疾病防治策略的重要方向[67]。除适应性免疫记忆外,固有免疫细胞的训练免疫也可促进病原体清除并具有广谱性,因此,可鉴定能够诱导肺脏固有免疫细胞训练免疫形成的特定成分(如β-glucan 等),并开发基于此的疾病防治新策略[68]。值得一提的是,近年发现肺脏除了其固有的免疫系统外,还拥有复杂的微生物组分且在感染性疾病中发挥重要调控作用,因此基于肺部微生物及其代谢物的相关制剂也将有机会用于感染性疾病防治[69]。综上,平衡且适度、长效且广谱、整体协同的肺部区域免疫应答是防治感染性疾病的重要宗旨。
4 展望
肺脏区域免疫是机体依赖于肺脏独特的解剖学结构、生理功能和组织微环境而进化出的一套多样而复杂的防御体系,与肺部众多疾病的发生发展紧密相关。近年来,基于多组学技术和体外研究模型的发展,人们对生理及病理条件下的肺脏区域免疫特性获得了一定认识。然而,疾病发生条件下异常的肺脏区域免疫特性表明对此认识远远不足,针对该领域的研究才初具成果,仍有一系列问题亟待探索。如呼吸系统感染性疾病发生发展过程中肺脏区域免疫的时空动态调控特征是什么,其又如何决定疾病的转归?肺脏的保护性免疫、病理损伤及组织修复机制如何,在疾病的发生发展过程中如何对其进行动态调控以实现平衡的免疫应答?肺部黏膜微生态与肺部区域免疫的关联和分子机制如何,其对呼吸系统感染性疾病的发生发展又发挥何种调控作用?昼夜节律、衰老等生理过程对肺脏区域免疫特性的调控作用如何,其又如何影响呼吸系统感染性疾病的发生?更重要的是,针对此系列问题的研究,不能仅限于基于表型的相关性,应该深入探寻其中的因果关系,并揭示这些调控作用受到哪些遗传因子的调控。此外,在用小鼠模型进行系列研究时,应对其与人体的一致性予以充分考量。近年来,高分辨空间转录组、单细胞测序技术、代谢组、遗传谱系追踪、类器官和人源化小鼠等新技术和新手段的发展为肺脏区域免疫特性的揭示带来了重大机遇。基于此,应充分利用已有的研究平台,并对多学科、多领域的研究方法和思路予以交叉整合,全面深入探索肺脏区域免疫在生理及感染性疾病过程中的动态变化及其精细的分子调控机制,从而为感染性疾病防治新策略的研发提供新思路和新靶点,并期望此系列研究体系和理论知识可用于其他肺部及肺外重大疾病的机制阐明和防治策略研发。