CP-25调控巨噬细胞来源的外泌体分泌对子宫内膜癌Ishikawa细胞系自噬性细胞死亡的影响①
2023-03-17郑小妹林叶飞张韶琼陈曼玲海南医学院第一附属医院妇科海口570100
郑小妹 林叶飞 张韶琼 杨 洁 陈曼玲 (海南医学院第一附属医院妇科,海口 570100)
子宫内膜癌(endometrial cancer,EC)是我国妇科恶性肿瘤的常见类型,其发病率已位居妇科恶性肿瘤第二位。EC主要发生于绝经后妇女人群,仅有约7%的患者为20~44 岁,然而,近年来其在年轻女性中发生率逐渐升高[1-2]。尽管多数患者可在疾病早期诊断出,但仍有部分恶性程度高、发生转移性或复发性疾病的患者预后较差,甚至引发死亡[3]。EC 的传统治疗方法包括外科治疗、免疫疗法、放射疗法及化学疗法,其中一些疗法不可避免地对人体造成损害并产生毒副作用。因此,在正常人体功能范围内寻找一种新型有效的治疗方法对于EC 患者至关重要。
巨噬细胞作为肿瘤微环境的重要组成部分,参与肿瘤的生长、转移及血管生成等过程。外泌体(exosome,Exo)是由包括巨噬细胞在内的多种细胞分泌的膜性囊泡,直径为50~100 nm,参与许多细胞行为,能够实现细胞与细胞间的信息交换过程,通过与靶细胞融合并释放信号分子来介导表观遗传或非表观遗传机制,以调节基因表达从而影响肿瘤细胞的表型转化[4-5]。芍药苷-6'-O-苯磺酸酯(paeoniflorin-6'-O-benzene sulfonate,CP-25)是一种酯化修饰合成的药物,属于芍药苷的新型衍生物,具有抗炎、抗肿瘤和免疫调节作用,但相关作用机制研究较少[6]。本研究从巨噬细胞来源的外泌体着手,研究其对EC Ishikawa 细胞活性与转移的影响,并检测CP-25 干预巨噬细胞来源的外泌体后对Ishikawa 细胞的作用及机制,为EC的诊治研究提供新思路。
1 材料与方法
1.1 材料 人单核细胞株THP-1 和人EC 细胞系Ishikawa(中国科学院典型培养物保藏委员会细胞库);CP-25(安徽临床药理研究所);胎牛血清(杭州四季青公司);胰蛋白酶、青霉素、链霉素、RPIM1640培养基及DMEM 培养基(Hyclone 公司);佛波酯(PMA,Sigma公司);BCA蛋白检测试剂盒、ECL试剂液和结晶紫染液(上海碧云天生物研究所);Transwell 小室(Corning 公司);CCK-8 试剂盒、Hoechst 33342 染色试剂盒、免疫荧光染色试剂盒(南京诺唯赞生物公司);Matrigel 胶和Annexin V-FITC/PI 细胞凋亡检测试剂盒(BD公司);CD9、CD63、Alix、LC3-Ⅱ、LC3-Ⅰ、Beclin-1 及P62 抗体(Abcam 公司);GAPDH和辣根过氧化物酶(HRP)标记的山羊抗兔抗体(北京中杉金桥公司);其他试剂均为国产分析纯。
1.2 方法
1.2.1 THP-1 巨噬细胞的培养与诱导 在THP-1细胞中加入含10%胎牛血清、1%青-链霉素的RPIM1640 培养基,培养于37 ℃、5%CO2恒温箱,消化传代。取生长状态良好的细胞,调整密度为 1×106个/ml,接种于无菌培养皿(直径10 cm),加入含终浓度为100 ng/ml PMA 的RPMI1640 培养液,继续诱导培养48 h。
1.2.2 外泌体的分离与鉴定 使用PBS 洗涤诱导后的巨噬细胞,加入无血清DMEM 培养基,置于37 ℃、5%CO2恒温箱培养48 h 后,在低温离心机中依次以300 g 离心15 min,留取上清液;2 000 g 离心15 min,留取上清液;10 000 g 离心30 min,留取上清液;再以100 000 g 离心1.5 h,弃上清液,加入PBS重悬沉淀,通过0.22 µmol/L 过滤器过滤,再次离心后获得外泌体悬液。透射电子显微镜观察外泌体形态,NTA 测量直径,Western blot 实验检测外泌体标志蛋白CD9、CD63、Alix表达。
1.2.3 Western blot 在外泌体或细胞中加入RIPA裂解液,冰上裂解30 min,抽提总蛋白,BCA 法检测蛋白浓度。制备10%SDS-PAGE 胶,取各样本等量蛋白上样后进行凝胶电泳分离蛋白,以90 min、恒流200 mA 电转至PVDF 膜;5%脱脂奶粉室温封闭 1 h,膜上滴加稀释的兔抗人Alix、CD9、CD63、LC3-Ⅱ、LC3-Ⅰ、Beclin-1、P62 抗体,4 ℃孵育过夜;第2 天,TBST 溶液洗膜,滴加稀释的HRP 标记的山羊抗兔抗体置于摇床,室温继续孵育1 h;结束后,TBST 溶液再次洗膜,ECL试剂液显色,凝胶成像系统采集图像,观察各蛋白表达情况,其中自噬相关蛋白检测以GAPDH 为内参,Image J 图像软件分析蛋白灰度值,以目的蛋白灰度值与内参蛋白灰度值的比值作为目的蛋白相对表达量。
1.2.4 CP-25干预外泌体 在Ishikawa细胞中添加含10%胎牛血清、1%青-链霉素的DMEM 培养液,置于37 ℃、5%CO2恒温箱内培养,消化传代,收集对数生长期的细胞,将其浓度调整为1×107个/ml,取 100 µl接种于96孔板,并随机分为5组,分别按照以下方法进行处理:①对照组:正常培养Ishikawa 细胞;②Exo 组:使用外泌体与Ishikawa 细胞共培养 24 h;③0.1 µmol/L CP-25+Exo 组:使用0.1 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养24 h; ④0.5 µmol/L CP-25+Exo组:使用0.5 µmol/L CP-25干预的外泌体与Ishikawa 细胞共培养24 h;⑤1 µmol/L CP-25+Exo组:使用1 µmol/L CP-25干预的外泌体与Ishikawa 细胞共培养24 h。置于37 ℃、5%CO2恒温箱内,处理结束后,收集Ishikawa 细胞,进行后续实验。
1.2.5 CCK-8 法检测细胞活性 调整各处理组Ishikawa 细胞密度,以1×103个/孔接种于96 孔板,使用含10%胎牛血清和1%青-链霉素的DMEM培养液,并置于37 ℃、5%CO2恒温箱内培养细胞,采用CCK-8法检测细胞活性,CCK-8 是一种基于WST-8 的细胞增殖检测试剂,原理是在电子载体1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(1-methoxy PMS)存在的情况下,能够被线粒体中的脱氢酶还原为具有高度水溶性的橙黄色甲瓒产物,颜色深浅与细胞增殖成正比。每组设5 个复孔,分别在培养24 h、48 h、72 h,每孔加入10 µl CCK-8 试剂,混合均匀,置于培养箱继续培养4 h,全自动酶标仪检测450 nm 处各孔细胞的吸光度(OD)值。
1.2.6 Transwell 实验 将50 µl 稀释的Matrigel 胶包被于24 孔Transwell 小室上室底部,置于37 ℃恒温箱使胶凝固。将各处理组Ishikawa 细胞密度调整为2×104个/ml,取200 µl 细胞悬液加入包被Matrigel胶的Transwell 小室上室,下室加入600 µl 含10%胎牛血清新鲜培养液,在37 ℃、5%CO2恒温箱培养 24 h,取出小室,弃培养液,擦去上室细胞,加入4%多聚甲醛固定30 min,0.1%结晶紫染色,PBS 清洗干净,光学显微镜下观察并拍摄图像,随机选择5个视野计数取其平均数,结果记为细胞侵袭数目。Transwell 检测细胞迁移中除不铺Matrigel 胶外,其他步骤均与侵袭步骤一致。
1.2.7 Hoechst 33342 染色 取对数生长期的Ishikawa细胞,将浓度调整为1×107个/ml,取100 µl接种于96 孔板,随机分为4 组,分别按照以下方法处理:①对照组:正常培养Ishikawa 细胞;②3-MA 组:使用5 mmol/L 3-MA 处理Ishikawa细胞24 h;③Exo-CP-25组:使用0.5 µmol/L CP-25干预的外泌体与Ishikawa细胞共培养24 h;④3-MA+Exo-CP-25组:使用5 mmol/L 3-MA处理Ishikawa细胞24 h,再用0.5 µmol/L CP-25干预的外泌体与Ishikawa细胞共培养24 h。
收集各处理组Ishikawa 细胞,4%多聚甲醛固定,滴加0.5%Triton X-100 透化15 min,PBS 洗涤细胞,滴加终浓度5 mg/L 的Hoechst 33342 染色,避光条件下室温孵育30 min,PBS 再次洗涤细胞,脱水,封片并干燥,荧光显微镜观察并拍摄图像。
1.2.8 流式细胞术 Ishikawa细胞按照1.2.7进行分组处理后,0.25%胰蛋白酶消化,PBS 洗涤细胞,以4 000 r/min 离心10 min,弃上清液,使用染色缓冲液1×binding buffer 重悬细胞,制备细胞密度为 1×106个/ml 的单细胞悬液,在无菌离心管内加入 100 µl 单细胞悬液,分别依次加入10 µl Annexin V-FITC与5 µl PI,混匀,避光条件下室温孵育15 min,在1 h 内通过流式细胞仪检测各处理组细胞凋亡比例。
1.2.9 透射电子显微镜检测 Ishikawa 细胞按照1.2.7 进行分组处理后,PBS 洗涤细胞,以预冷的戊二醛固定过夜,再固定在四氧化锇中,不同浓度梯度丙酮脱水,使用四乙酸铀和柠檬酸三水合物进行双重染色,包埋,于Zeiss 910 透射电子显微镜下观察各处理组细胞中自噬体形态。
1.2.10 免疫荧光染色 Ishikawa 细胞按照1.2.7进行分组处理后,收集各处理组细胞,PBS 洗涤,使用4%多聚甲醛固定30 min,自来水冲洗去除残留固定液,滴加0.5%TritonX-100 透膜处理15 min,再用10%山羊血清室温封闭2 h后,滴加稀释的兔抗人LC3B 抗体,4 ℃孵育过夜;第2 天,弃去一抗液,PBS洗涤干净,滴加对应荧光二抗,避光条件下室温 孵育1 h,洗去未结合的二抗,滴加DAPI 室温染色10 min,PBS 再次洗涤,封片并干燥,荧光显微镜下观察荧光表达,Image J图像软件分析荧光强度。
1.3 统计学分析 采用SPSS23.0统计软件对本研究数据进行分析处理,计量资料均采用±s表示,多样本比较采用单因素方差分析,组间样本比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的鉴定 利用透射电子显微镜观察巨噬细胞提取物,可见其外形呈杯状或球形,边缘膜状,测量其直径约为120 nm(图1A)。Western blot检测发现,外泌体标志蛋白Alix、CD9、CD63 均表达为阳性(图1B),表明分离的纳米颗粒为外泌体。
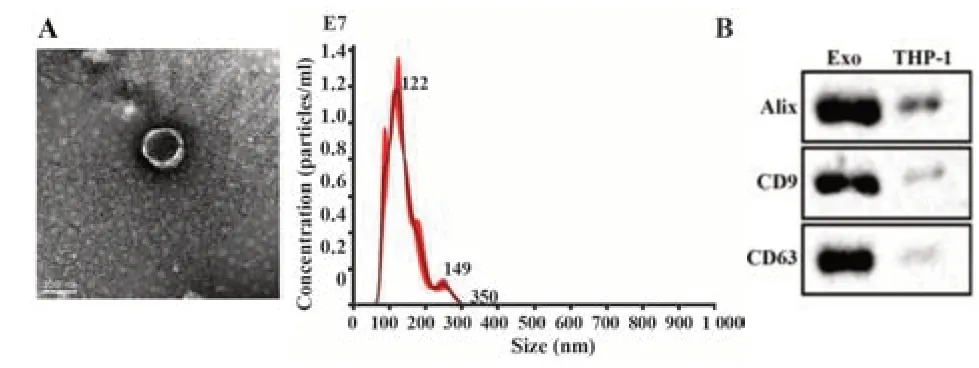
图1 分离的外泌体观察与鉴定Fig.1 Observation and identification of isolated exosomes
2.2 CP-25干预巨噬细胞外泌体对Ishikawa细胞活性的影响 CCK-8检测结果显示,与对照组相比,与巨噬细胞外泌体共培养24 h、48 h、72 h 后,Ishikawa细胞活性显著提高(P<0.05);而使用0.1、0.5、 1.0 µmol/L CP-25干预巨噬细胞外泌体再与Ishikawa细胞共培养24 h、48 h、72 h 后,Ishikawa 细胞活性均明显降低(P<0.05),见表1。
表1 各处理组Ishikawa细胞不同时间点吸光度值比较(±s)Tab.1 Comparison of absorbance values of Ishikawa cells at different time points in each treatment group (±s)
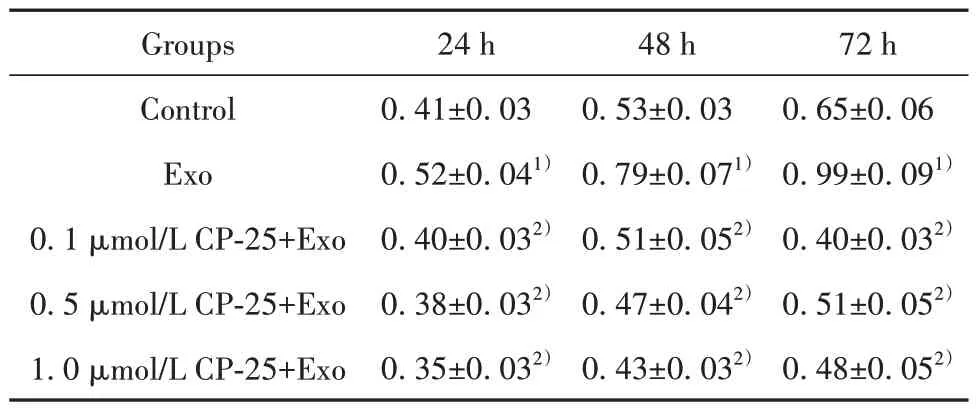
表1 各处理组Ishikawa细胞不同时间点吸光度值比较(±s)Tab.1 Comparison of absorbance values of Ishikawa cells at different time points in each treatment group (±s)
Note: Compared with control group, 1)P<0.05; compared with Exo group, 2)P<0.05.
2.3 CP-25干预巨噬细胞外泌体对Ishikawa细胞转移的影响 Transwell 实验结果显示,与巨噬细胞外泌体共培养的Ishikawa 细胞,其迁移细胞数与侵袭细胞数均显著高于对照组(P<0.01);而经0.1、0.5、1.0 µmol/L CP-25干预巨噬细胞外泌体再与Ishikawa细胞共培养后,与巨噬细胞外泌体共培养的Ishikawa细胞相比,各处理组Ishikawa 细胞的迁移细胞数与侵袭细胞数均显著减少(P<0.01),见图2。
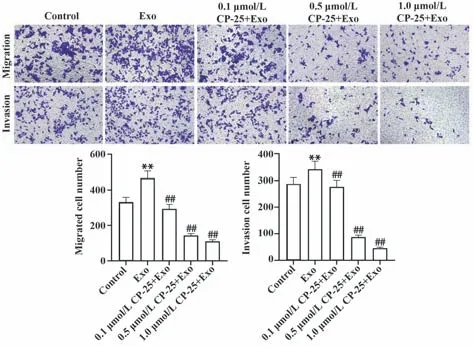
图2 Transwell 小室实验检测各处理组Ishikawa 细胞迁移与侵袭能力Fig.2 Transwell chamber experiment to detect migration and invasion ability of Ishikawa cells in each treatment group
2.4 CP-25干预巨噬细胞外泌体对Ishikawa细胞凋亡的影响 通过Hoechst 33342 染色从形态上观察各处理组Ishikawa 细胞的凋亡情况,可见对照组细胞偶见核浓缩;3-MA处理的细胞核外围轮廓较为清晰,未见明显核浓缩;0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养的细胞中有较多浓缩、碎裂的蓝色凋亡体;而经5 mmol/L 3-MA 处理Ishikawa细胞再用0.5 µmol/L CP-25干预的外泌体与Ishikawa细胞共培养后,细胞核浓缩与碎裂的现象明显减少,见图3。
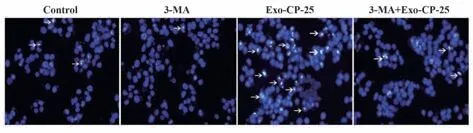
图3 Hoechst 33342 染色观察各处理组Ishikawa 细胞凋亡(×100)Fig.3 Hoechst 33342 staining to observe apoptosis of Ishikawa cells in each treatment group (×100)
流式细胞术结果显示,与对照组相比,经3-MA处理的Ishikawa 细胞凋亡率显著降低,0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后细胞凋亡率显著提高(P<0.01);而相较于0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养组, 5 mmol/L 3-MA 处理Ishikawa 细胞再用0.5 µmol/L CP-25干预的外泌体与Ishikawa细胞共培养后,细胞凋亡率显著降低(P<0.01),见图4。
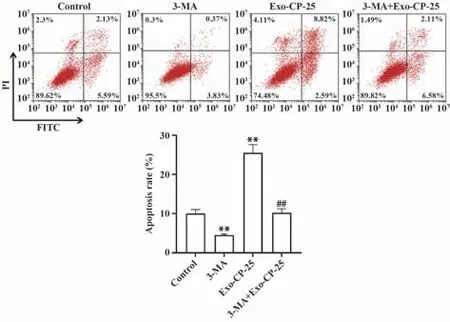
图4 流式细胞术检测各处理组Ishikawa细胞凋亡Fig.4 Flow cytometry detection of Ishikawa cell apoptosis in each treatment group
2.5 CP-25干预巨噬细胞外泌体对Ishikawa细胞自噬的影响 通过免疫荧光染色观察Ishikawa 细胞中绿色荧光表达,与对照组相比,3-MA 处理的细胞中绿色荧光表达明显减弱,LC-3 表达强度显著降低,而0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后的细胞中绿色荧光表达明显增强,LC-3 表达强度则显著提高(P<0.01);5 mmol/L 3-MA 处理Ishikawa 细胞后再用0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后,细胞中绿色荧光表达明显减弱,LC-3表达强度显著降低(P<0.01),见图5。
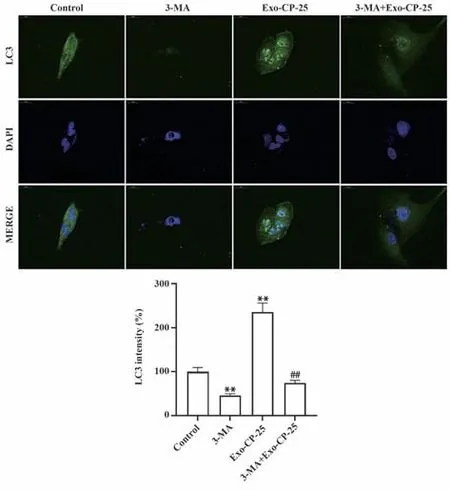
图5 免疫荧光染色检测各处理组Ishikawa细胞自噬标志物LC3表达(×200)Fig.5 Immunofluorescence staining to detect expression of autophagy marker LC3 in Ishikawa cells of each treatment group (×200)
透射电子显微镜观察到对照组细胞偶见自噬体,3-MA 处理的Ishikawa 细胞未观察到自噬体, 0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后的细胞质中可见多个由单层膜或双层膜组成的自噬体,5 mmol/L 3-MA 处理Ishikawa 细胞再用0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后的细胞中自噬体较少,见图6。
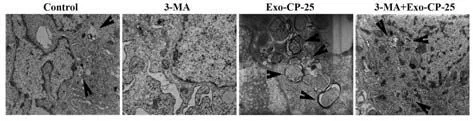
图6 透射电子显微镜观察自噬体(×10 000)Fig.6 Observation of autophagosomes by transmission electron microscope (×10 000)
Western blot检测结果显示,与对照组相比,3-MA处理的Ishikawa细胞中LC3-Ⅱ、Beclin-1蛋白表达减少,P62 蛋白表达增多,LC3-Ⅱ/LC3-Ⅰ显著下调,而0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养后的细胞中LC3-Ⅱ、Beclin-1 蛋白表达增加,P62 蛋白表达减少,LC3-Ⅱ/LC3-Ⅰ显著上调(P<0.01);与0.5 µmol/L CP-25干预的外泌体与Ishikawa细胞共培养细胞相比,5 mmol/L 3-MA 处理Ishikawa细胞后再用0.5 µmol/L CP-25 干预的外泌体与Ishikawa 细胞共培养的细胞中LC3-Ⅱ、Beclin-1 蛋白表达减少,P62 蛋白表达增多,LC3-Ⅱ/LC3-Ⅰ显著下调(P<0.01),见图7。
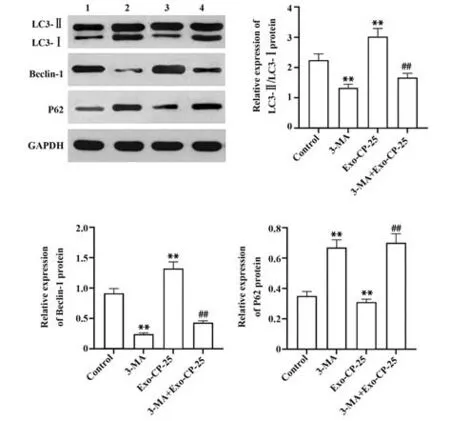
图7 Western blot 检测各处理组Ishikawa 细胞自噬相关 蛋白表达Fig.7 Western blot detection of autophagy-related proteins expressions of Ishikawa cells in each treatment group
3 讨论
目前,EC已成为多个国家和地区主要的妇科恶性肿瘤疾病之一,其发病率和病死率呈不断上升趋势,给患者和社会造成了越来越高的医疗负担。与EC发生相关的因素包括雌激素抵抗、饮食、肥胖、代谢紊乱和子宫内膜增生等,其发病机制非常复杂,目前尚不完全清楚[2]。尽管各项治疗手段技术取得了一定的进步,但在各种临床试验中观察到了低应答率或不良反应等现象,例如免疫疗法的应答率仅为13%[7]。迄今为止,尚无针对转移或复发性EC 患者的精准治疗方法。
在既往研究中,CP-25 显示出良好的抗炎和免疫调节活性,例如,CP-25 通过减少滑膜炎症和抑制炎症反应明显抑制了小鼠自身免疫性关节炎进展,该作用与其对免疫细胞(T细胞、B细胞、树突状细胞等)的功能调节及免疫细胞和G 蛋白偶联受体介导的细胞信号通路的相互作用密切相关[8-9];CP-25 通过抑制JAK1-STAT1/2-CXCL13 信号途径并干扰 B 细胞向唾液腺的迁移来缓解抗原诱导的小鼠实验性干燥综合征[10];CP-25 对甲氨蝶呤诱导的大鼠肾毒性具有良好的保护作用,这种作用通过抗肾细胞凋亡和排毒特性实现[11]。此外,关于CP-25 在肿瘤中的作用研究也在逐步开展。然而,关于CP-25 是否具有抗EC 的作用尚未见文献报道,值得进行相关实验探究。
外泌体是大多数细胞类型分泌的膜囊泡,已确定其在肿瘤生物学、免疫学、神经生物学等领域的细胞间通讯中发挥重要作用。其不同特征和功能主要取决于来源的细胞类型,其中一些细胞特定的生物活性脂质、蛋白质和遗传物质被包装在外泌体中。其中,肿瘤细胞来源的外泌体能够促进血管生成,重塑基质并调节远处转移[12]。此外,这还代表了一系列的免疫抑制机制。例如,肿瘤细胞来源的外泌体以诱导活化的细胞毒性T 细胞凋亡,促进骨髓单核细胞的分化或关闭自然杀伤细胞的反应[13]。由于不同环境中细胞的可塑性,巨噬细胞被认为是一组异质单核巨噬细胞谱系细胞,能够根据不同的刺激表现出不同表型,活化的巨噬细胞通过增强的迁移、吞噬作用及抗原加工和呈递对刺激做出反应,并分泌各种细胞因子,通过募集更多极化的巨噬细胞,以反馈的方式放大或减小炎症信号。已有研究表明,巨噬细胞释放的外泌体可被心肌组织中的心肌细胞、成纤维细胞、内皮细胞等吸收[14]。巨噬细胞外泌体还在多种生理及病理条件下发挥重要作用,能够促进肿瘤细胞的迁移、浸润和耐药。近期研究发现,巨噬细胞外泌体参与癌细胞代谢重编程,还可抑制特异性免疫细胞功能[15-16]。
本研究对分离的巨噬细胞来源外泌体进行鉴定,发现其外形呈球形至杯形,直径约为120 nm,外泌体标志蛋白Alix、CD9、CD63 均呈阳性表达,以上结果均表明成功分离并得到巨噬细胞来源外泌体。经检测发现,与巨噬细胞来源外泌体共培养的EC Ishikawa 细胞,其细胞活性与迁移侵袭能力均明显提高。为进一步探讨CP-25是否能够介导巨噬细胞来源的外泌体分泌影响EC Ishikawa 细胞,通过使用CP-25 干预巨噬细胞来源的外泌体并与EC Ishikawa细胞共培养后发现,细胞增殖活性下降,同时,细胞的迁移数与侵袭数均明显减少。由此推测,CP-25可能介导巨噬细胞来源外泌体的分泌从而调控EC Ishikawa细胞的生物学行为。
促进肿瘤细胞死亡一直是肿瘤研究中的重点内容,细胞死亡过程复杂,涉及一系列调控因子,且越来越多的证据表明,许多类型的癌症都可发展为具有抗凋亡特性的细胞,例如各种化疗药物的使用使得肿瘤细胞产生化疗抗性[17-18]。自噬是调节细胞稳态的关键机制,通过触发降解细胞质大分子物质或细胞器为自身提供能量,是细胞内蛋白质质量控制系统的主要组成部分之一。过度自噬会诱导细胞死亡,且激发自噬死亡机制可使耐药肿瘤细胞发生死亡,因此,以自噬作为细胞死亡发生机制是针对癌症治疗的一种反应[19-20]。本研究结果显示,经CP-25 干预巨噬细胞来源的外泌体并与EC Ishikawa细胞共培养后,细胞凋亡增加,自噬水平也增加,由此推测,CP-25 可能干预EC Ishikawa 细胞自噬性死亡。为了验证这一猜想,通过自噬抑制剂3-MA 处理Ishikawa 细胞,再用CP-25 干预巨噬细胞来源的外泌体与EC Ishikawa 细胞共培养,结果发现细胞凋亡率降低,同时细胞自噬水平也降低。
综上所述,本研究揭示了CP-25 干预巨噬细胞来源外泌体对EC Ishikawa 细胞的作用,可抑制Ishikawa 细胞的活性、迁移与侵袭,调控自噬性死亡过程,为EC 病理机制与治疗的研究提供了新视角。但CP-25干预巨噬细胞来源外泌体中的潜在靶点分子有待进一步深入探究,以期为EC 的诊治提供新途径。