五味子多糖对TGF-β1 诱导的人肾小球系膜细胞炎症因子和细胞外基质FN和COLⅠ表达的影响
2023-03-17刘丽萍褚福娟枣庄市中医医院药剂科枣庄277000
刘丽萍 褚福娟 (枣庄市中医医院药剂科,枣庄 277000)
系膜增生性肾炎(mesangial proliferative glomerulo nephritis,MesPGN)是一种肾脏疾病,其特征为肾小球系膜细胞弥漫性增殖、炎症反应和细胞外基质(extracellular matrix,ECM)积累,可能发展为肾小球硬化、肾间质纤维化和终末期肾脏疾病。MesPGN约占中国原发性肾小球肾炎病的60%,是慢性肾脏疾病、慢性肾功能衰竭和尿毒症的主要原因[1]。研究表明,TGF-β1 诱导的肾小球系膜细胞增殖和ECM 积累是MesPGN 最重要的病理变化,随着MesPGN 进程中炎症反应发生,可能进一步加重MesPGN[2]。目前MesPGN 疗法在临床实践中并不理想[3]。因此,需要开发一种新的MesPGN 治疗策略。近年研究表明,五味子在治疗糖尿病肾病和慢性肾炎等疾病中发挥重要作用[4]。五味子多糖(schisandra chinensis polysaccharide,SCP)作为五味子的主要活性成分,具有免疫调节、抗氧化、抗衰老、抗糖尿病和抗炎等功效。最新证据表明,SCP能够降低2型糖尿病大鼠血糖,并改善胰岛素抵抗,抑制炎症反应[5]。五味子乙素对糖尿病肾病大鼠肾脏具有保护作用[6]。但SCP 在MesPGN 中的作用尚不清楚。因此,本研究旨在探究SCP对TGF-β1诱导的肾小球系膜细胞炎症反应和ECM 积累的影响,并探究其潜在机制,以期为MesPGN治疗提供新的方向。
1 材料与方法
1.1 材料 人肾小球系膜细胞购自美国ATCC 细胞库;SCP 购自中国药品生物制品检定所;RPMI- 1640 培养液和胎牛血清购自天津博奥赛斯生物科技有限公司;IL-6、IL-1β、TNF-α 和MCP-1 ELISA 试剂盒购自上海酶联生物科技有限公司;MTT 试剂和二甲基亚砜购自美国Sigma 公司;FN、COL Ⅰ、TLR4、MyD88、NF-κB p65 和p-NF-κB p65 单克隆抗体及二抗购自北京中杉金桥生物技术有限公司;SDS-PAGE 凝胶试剂盒购自上海碧云天研究所;RNA 提取试剂盒、逆转录试剂盒、SYBR Green qRTPCR试剂盒、BCA蛋白定量检测试剂盒、ECL化学发光检测试剂购自赛默飞世尔科技有限公司;倒置显微镜购自日本Olympus 公司;全自动酶标仪购自美国MDC公司;二氧化碳培养箱购自德国Binder公司。
1.2 方法
1.2.1 细胞培养和分组 人肾小球系膜细胞在含10%胎牛血清的RPMI1640培养液中37 ℃常规培养,显微镜下观察细胞生长情况,每2 d更换1次新培养液,细胞贴壁后传代。将对数生长期肾小球系膜细胞随机分为对照(Con)组、模型(TGF-β1)组、SCP低、中、高浓度(SCP-L、SCP-M、SCP-H)组,TGF-β1组细胞采用4 ng/ml TGF-β1 干预48 h,SCP-L、SCP-M、SCP-H 组细胞分别采用200、400、800 µg/L SCP 干预48 h,Con组细胞不做任何处理。
1.2.2 MTT 检测细胞增殖活性 对数生长期肾小球系膜细胞以1.0×104个/孔接种至96 孔板,常规培养,细胞贴壁后按1.2.1 分组处理,各组细胞干预48 h 后分别向各孔中添加5 mg/ml MTT,继续培养 4 h,去培养液,100 µl/孔添加二甲基亚砜,振荡至沉淀完全溶解,全自动酶标仪测定490 nm 处各孔吸光度(OD)值。
1.2.3 ELISA 检测IL-6、IL-1β、TNF-α 和MCP-1 含量 对数生长期肾小球系膜细胞以1.0×104个/孔接种至96 孔板,常规培养,待细胞贴壁后按照1.2.1分组处理,各组细胞干预48 h 后收集上清,IL-6、 IL-1β、TNF-α 和MCP-1 ELISA 试剂盒检测上清中 IL-6、IL-1β、TNF-α 和MCP-1 含量,严格参照ELISA试剂盒说明书操作。
1.2.4 qRT-PCR 检测FN 和COLⅠmRNA 表达 对数生长期肾小球系膜细胞以1.0×104个/孔接种至 96孔板,常规培养,待细胞贴壁后按照1.2.1分组处理,干预48 h 后收集各组细胞,采用RNA 提取试剂盒分别抽提各组细胞总RNA,逆转录合成cDNA,采用SYBR Green 试剂盒进行qRT-PCR 检测。反应程序:94 ℃ 5 min,40 个循环:94 ℃ 30 s、60 ℃ 30 s、72 ℃ 20 s。以GAPDH 为内参,2-ΔΔCt分别计算各组细胞FN 和COLⅠ基因相对表达。引物序列为FN F:5'-GATGTCCGAACAGCTATTTACCA-3',R:5'-CC- TTGCGACTTCAGCCACT-3';COL ⅠF:5'-GCTCCT- CTTAGGGGCCACT-3';R:5'-CCACGTCTCACCATTGGGG-3';GAPDH F:5'-GAATGGGCAGCCGTTAGGAA-3',R:5'-AAAAGCATCACCCGGAGGAG-3'。
1.2.5 Western blot检测FN、COLⅠ、TLR4、MyD88、 p-NF-κB p65 和NF-κB p65 蛋白表达 对数生长期肾小球系膜细胞以1.0×104个/孔接种至96 孔板,常规培养,待细胞贴壁后按照1.2.1 分组处理,干预48 h 后收集各组细胞,裂解后离心,上清即为总蛋白,BCA 试剂盒测定蛋白含量。沸水浴加热使蛋白变性,等量蛋白上样,行SDS-PAG 凝胶电泳,蛋白分离后转至PVDF 膜,封阻1.5 h,洗膜,浸入1∶800 稀释的FN、COLⅠ、TLR4、MyD88、p-NF-κB p65和NF-κB p65一抗中4 ℃摇床过夜孵育,洗膜,浸入1∶2 000稀释的二抗中孵育2 h,ECL 显影,成像系统获取图像,以GAPDH 为内参,采用Image J 软件分析条带灰度值,分别计算各组细胞FN、COLⅠ、TLR4、MyD88、 p-NF-κB p65和NF-κB p65表达。
1.3 统计学分析 采用SPSS21.0软件进行统计学分析,计量资料采用±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 SCP 对TGF-β1诱导的肾小球系膜细胞增殖的影响 各组细胞培养48 h 后,MTT 检测细胞增殖活性,结果显示,与Con 组相比,TGF-β1 组细胞增殖活性显著升高(P<0.05);与TGF-β1 组相比,随着SCP浓度升高,细胞增殖活性依次降低(P<0.05,表1)。
表1 各组肾小球系膜细胞增殖活性比较(±s,n=3)Tab.1 Comparison of proliferation activity of glomerular mesangial cells in each group (±s,n=3)

表1 各组肾小球系膜细胞增殖活性比较(±s,n=3)Tab.1 Comparison of proliferation activity of glomerular mesangial cells in each group (±s,n=3)
Note:Compared with Con group, 1)P<0.05; compared with TGF-β1 group, 2)P<0.05.
2.2 SCP 对TGF-β1诱导的肾小球系膜细胞炎症因子表达的影响 各组细胞培养48 h 后,ELISA 检测炎症因子表达,结果显示,与Con 组相比,TGF-β1 组炎症因子IL-6、IL-1β、TNF-α 和MCP-1 含量明显升高(P<0.05);与TGF-β1 组相比,随着SCP 浓度升高,炎症因子IL-6、IL-1β、TNF-α 和MCP-1 含量逐渐降低(P<0.05,表2)。
表2 各组炎症因子IL-6、IL-1β、TNF-α和MCP-1含量比较(±s,n=3, pg/ml)Tab.2 Comparison of levels of inflammatory factors IL-6, IL-1β, TNF-α and MCP-1 in each group (±s, n=3, pg/ml)

表2 各组炎症因子IL-6、IL-1β、TNF-α和MCP-1含量比较(±s,n=3, pg/ml)Tab.2 Comparison of levels of inflammatory factors IL-6, IL-1β, TNF-α and MCP-1 in each group (±s, n=3, pg/ml)
Note:Compared with Con group, 1)P<0.05; compared with TGF-β1 group, 2)P<0.05.
2.3 SCP 对TGF-β1 诱导的肾小球系膜细胞FN 和COLⅠ mRNA 表达的影响 各组细胞培养48 h 后,qRT-PCR 检测细胞外基质成分FN 和COLⅠ mRNA表达,结果显示,与Con 组相比,TGF-β1 组细胞FN和COLⅠ mRNA表达均明显升高(P<0.05);与TGF-β1组相比,随着SCP 浓度升高,FN 和COLⅠ mRNA 表达逐渐降低(P<0.05,表3)。
表3 各组细胞FN和COLⅠ mRNA表达比较(±s,n=3)Tab.3 Comparison of expressions of FN and COL Ⅰ mRNA in each group of cells (±s,n=3)

表3 各组细胞FN和COLⅠ mRNA表达比较(±s,n=3)Tab.3 Comparison of expressions of FN and COL Ⅰ mRNA in each group of cells (±s,n=3)
Note:Compared with Con group, 1)P<0.05; compared with TGF-β1 group, 2)P<0.05.
2.4 SCP 对TGF-β1 诱导的肾小球系膜细胞FN 和COLⅠ蛋白表达的影响 各组细胞培养48 h 后,采用Western blot 检测细胞外基质成分FN 和COLⅠ蛋白表达,结果显示,与Con 组相比,TGF-β1 组细胞FN和COLⅠ蛋白表达明显升高(P<0.05);与TGF-β1组相比,随着SCP 浓度升高,细胞FN 和COLⅠ蛋白表达逐渐降低(P<0.05,图1、表4)。

图1 Western blot检测ECM成分中FN和COLⅠ蛋白表达Fig.1 Western blot detection of expressions of ECM components FN and COLⅠ protein
表4 各组细胞中FN和COLⅠ蛋白表达比较(±s,n=3)Tab.4 Comparison of FN and COL Ⅰ protein expressions in cells of each group (±s,n=3)

表4 各组细胞中FN和COLⅠ蛋白表达比较(±s,n=3)Tab.4 Comparison of FN and COL Ⅰ protein expressions in cells of each group (±s,n=3)
Note:Compared with Con group, 1)P<0.05; compared with TGF-β1 group, 2)P<0.05.
2.5 SCP 对TGF-β1 诱导的肾小球系膜细胞TLR4/NF-κB 信号通路的影响 各组细胞培养48 h 后,Western blot 检测细胞TLR4/NF-κB 信号通路关键蛋白表达,结果显示,与Con 组相比,TGF-β1 组细胞TLR4、MyD88 和p-NF-κB p65 蛋白表达明显升高 (P<0.05);与TGF-β1 组相比,随着SCP 浓度升高,细胞TLR4、MyD88 和p-NF-κB p65 蛋白表达逐渐降低(P<0.05,图2、表5)。
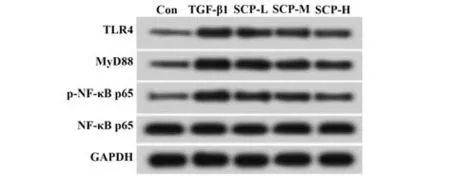
图2 Western blot 检 测TLR4、MyD88、p-NF-κB p65 和 NF-κB p65蛋白表达Fig.2 Western blot detection of TLR4,MyD88,p-NF-κB p65 and NF-κB p65 protein expressions
表5 各组细胞TLR4、MyD88、p-NF-κB p65 和NF-κB p65蛋白表达比较(±s,n=3)Tab.5 Comparison of TLR4, MyD88, p-NF-κB p65 and NF-κB p65 protein expressions in each group of cells (±s,n=3)

表5 各组细胞TLR4、MyD88、p-NF-κB p65 和NF-κB p65蛋白表达比较(±s,n=3)Tab.5 Comparison of TLR4, MyD88, p-NF-κB p65 and NF-κB p65 protein expressions in each group of cells (±s,n=3)
Note:Compared with Con group, 1)P<0.05; compared with TGF-β1 group, 2)P<0.05.
3 讨论
MesPGN 是一种常见肾脏疾病,我国20%~40%MesPGN 患者已发展为终末期肾脏疾病[7]。MesPGN主要病理变化为肾小球膜细胞增殖、炎症和ECM 积聚,进而损害肾小球功能。肾小球系膜细胞对维持正常肾小球结构和功能至关重要,主要通过提供正确的机械张力并产生各种细胞因子发挥作用,对调节ECM 转换至关重要[8]。肾小球系膜细胞和肾小管间质ECM 蛋白积累会增强纤维化,是慢性肾脏疾病的标志,也是肾功能不全的主要驱动力。肾功能不全的主要调节因子TGF-β1 是由代谢损伤产生的[9]。已有研究采用TGF-β1 诱导肾小球系膜细胞构建MesPGN 体外细胞模型,探究MesPGN 的发生机制[10]。研究证实,SCP具有多种生理功能,如抗氧化、免疫调节、抗肿瘤、保肝、降血脂、抗疲劳、抗糖尿病和降血糖、止咳、镇痛和抗衰老[11-12]。SCP 无明显毒性,几乎无副作用,可作为一种安全有效的补充疗法用于多种疾病治疗,包括肾脏疾病[13]。本研究证明SCP 能够减轻TGF-β1 诱导的肾小球系膜细胞炎症反应和ECM积累,表明SCP可能成为MesPGN 的潜在治疗药物。
越来越多的证据表明,肾小球系膜细胞是一种主要的肾脏驻留细胞,且与MesPGN 发生和发展高度相关[14]。肾小球系膜细胞过度增殖是与MesPGN相关病理生理机制的主要因素[15]。已有报道TGF-β1刺激增强肾小球系膜细胞增殖并最终促进肾间质纤维化[16]。与既往研究结论相符,本实验结果显示,TGF-β1诱导的肾小球系膜细胞增殖活性明显升高,但SCP能够降低TGF-β1诱导的肾小球系膜细胞增殖活性。越来越多的证据表明,肾小球系膜中ECM 过度积累与MesPGN 发展密切相关[8]。ECM 由多种细胞外分子组成,胶原蛋白是其中最丰富的成员。TGF-β1在系膜增生性肾炎肾组织中高表达,是肾纤维化的关键标志物。TGF-β1 可上调FN 表达,FN 是ECM 的关键分子,主要在肾纤维化期间合成。大量研究表明,TGF-β1 可能增强COLⅠ和FN 分泌[17-18]。本研究通过检测FN 和COLⅠ反映ECM 表达是基于既往多项研究结果,如YAN 等[18]发现球囊导管在血管内膜损伤后可引起明显内膜增生,增生性内膜COLⅠ和FN表达增加,说明增生性血管内膜ECM 合成增多,进一步促进了血管平滑肌细胞增殖和内膜增生。LI 等[19]研究显示,机械和电联合刺激更大程度上促进COLⅠ和FN 表达增强前成骨细胞ECM 合成。此外,有研究显示,内脂素能够通过上调COLⅠ和FN 表达促进肾小球系膜细胞ECM 表达[20]。这些研究均采用FN 和COLⅠ表达表示ECM表达,因此,本研究同样采用FN 和COLⅠ表达体现ECM 表达。本研究TGF-β1 刺激的肾小球系膜细胞中,发现COLⅠ和FN 表达有明显上升趋势,而SCP能够有效抑制COLⅠ和FN表达,表明SCP能够减少肾小球系膜细胞中TGF-β1 诱导的ECM 积累。过度的炎症反应和ECM 沉积是MesPGN 的关键致病因素。已有文献证明,TGF-β1处理可诱导肾小球系膜细胞中炎症细胞因子产生[21]。与既往研究结果一致,本实验观察到TGF-β1 刺激能够显著促进肾小球系膜细胞增殖,促进炎症因子IL-6、IL-1β、TNF-α和MCP-1 表达,且ECM 积累增加。而SCP 能够有效抑制TGF-β1 诱导的肾小球系膜细胞增殖,降低炎症因子IL-6、IL-1β、TNF-α 和MCP-1 表达,减少ECM积累。表明SCP 能够通过抑制肾小球系膜细胞增殖、炎症反应和ECM 积累抑制MesPGN 发生和进展。研究表明,通过激活的TLR4/NF-κB 诱导炎症细胞因子表达,诱发炎症反应,参与MesPGN 发病[22-23]。本实验结果显示,TGF-β1 诱导的肾小球系膜细胞中TLR4、MyD88 和p-NF-κB p65 表达明显升高,而SCP 能够有效降低TLR4、MyD88 和p-NF-κB p65 表达。提示SCP 可能通过阻断TLR4/NF-κB 信号通路激活抑制TGF-β1 诱导的肾小球系膜细胞炎症反应和ECM积累。
本研究表明,SCP 能够抑制TGF-β1诱导的肾小球系膜细胞增殖、炎症和ECM 积累,其作用机制可能与抑制TLR4/NF-κB信号通路有关,表明SCP可能成为MesPGN 的潜在治疗药物。但本研究存在一定局限性,未涉及信号传导途径的特异性抑制剂和动物体内实验,因此有必要进一步研究以了解SCP 在MesPGN 中的作用及机制。此外,本研究显示炎症因子表达降低,但是短暂抑制还是消除了炎症反应尚不清楚,后续将对此进行深入探究。