防己黄芪汤对CIA大鼠关节PI3K-Akt通路的调控作用研究①
2023-03-17姬霄霄郝慧琴高玉亭山西中医药大学中西医结合基础实验室晋中030619
姬霄霄 李 振 郝慧琴 高玉亭 (山西中医药大学中西医结合基础实验室,晋中 030619)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性疾病,主要病理特征为持续性滑膜炎、血管炎和软骨破坏,后期可侵犯骨关节,引起不可逆关节损伤,严重者可导致残疾[1-2]。RA 西医治疗集中于非甾体抗炎药、改善病情抗风湿药、糖皮质激素等药物,虽可改善RA 症状,但其不良反应极大降低了患者用药依从性[3]。中药复方在中医传统辨证思想指导下具有多靶点多疗效特点,在中药复方中寻找安全有效的RA 治疗措施具有潜在研究价值。
防己黄芪汤(Fangji Huangqi Decoction,FHD)首见于《金匮要略》,由防己、黄芪、白术、甘草组成,加生姜和大枣煎服,可祛风除湿、健脾利水,是临床治疗RA 的经典方剂。研究表明,FHD 具有抗氧化、杀菌、抗炎、镇痛作用,在风湿免疫、肾病、循环系统疾病中应用广泛[4]。另有研究证实,FHD 可有效缓解胶原诱导性关节炎(collagen-induced arthritis,CIA)小鼠关节肿胀度,抑制关节滑膜血管新生,降低TNF-α 体外诱导的滑膜成纤维细胞MH7A 迁移、侵袭及黏附能力[5-6]。FHD 治疗RA 的药理学机制尚未见报道。本研究采用网络药理学方法预测得到FHD 治疗RA 的核心通路为PI3K-Akt 通路,通过构建CIA大鼠模型,进一步探索FHD对CIA大鼠PI3KAkt 通路的调控作用,为后期FHD 临床治疗RA 提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 60 只6~8 周龄SPF 级健康雌性Wistar 大鼠,体质量(200±10) g,购自北京市昌扬西山养殖场,动物许可证号:SCXK(京)2019-0010, 实验大鼠饲养于山西中医药大学实验动物中心,(23±2) ℃,(50±15)%湿度,自由进食饮水。本实验经山西中医药大学伦理委员会批准(2019LL156)。
1.1.2 药材及试剂 防己、黄芪、白术、甘草均购自山西中医药大学附属医院;牛Ⅱ型胶原(Chondrex,20022);弗 氏 完 全/不 完 全 佐 剂(Sigma, SLBR3877V、SLBM9362V);大鼠TNF-α、IL-1、IL-6 ELISA 试剂盒(上海酶联生物,202105);HE 染色液(雷根生物,DH0006);一抗PI3K、Akt、p-Akt(Ser473,CST,4257、4685、4060);p-PI3K(Y607,Abcam,AB182651);β-actin(ABclonal,AC038);二抗羊抗兔IgG(Solarbio,SE134);RIPA 裂解液、PMSF、蛋白磷酸酶 抑 制剂、BSA、EDTA 脱钙液(Solarbio,R0020、P0100、P1260、SW3015、E1171);BCA、SDS-PAGE 试剂盒(Boster,AR0146、AR0138);ECL 发光液(百奥生物,M1033)。
1.2 方法
1.2.1 动物分组及CIA 造模 60 只Wistar 大鼠随机分为健康对照组(Control)、CIA 模型组(CIA)、低剂量FHD 治疗组(Low-FHD)、中剂量FHD 治疗组(Medium-FHD)、高剂量FHD治疗组(High-FHD),每组12 只。牛Ⅱ型胶原和弗氏完全/不完全佐剂诱导CIA 大鼠模型[7]。初次免疫:冰上将牛Ⅱ型胶原与弗氏完全佐剂混匀乳化,终浓度为1 mg/ml,除Control 组外,分别在大鼠背部、尾跟部2 cm 处和右后足掌中心行5点皮下注射乳化剂(0.1 ml/点)。加强免疫:1 周后,牛Ⅱ型胶原和弗氏不完全佐剂等量混合,腹腔注射乳化剂(0.3 ml/只)。
1.2.2 给药方法及取材 初次免疫2周后(0周)开始给药,FHD(防己∶黄芪∶白术∶甘草=4∶5∶3∶2)传统水煎法煎煮。按照人体表面积公式将人的用药剂量转换为大鼠用药剂量,低、中、高FHD 剂量分别为2.2、4.4、8.8 g/(kg·d),2 次/d,连续灌胃6 周,Control组和CIA组大鼠灌胃4.4 g/(kg·d)生理盐水。治疗结束后,10%水合氯醛(0.3 ml/100 g)麻醉大鼠,腹主动脉取血,离心,取上清,-80 ℃保存,脱颈处死大鼠,取左踝关节-80 ℃保存,右踝关节和脾脏用4%多聚甲醛固定。
1.2.3 大鼠体质量及关节炎评分 给药0~6周,根据表1 关节炎评分标准,每周记录各组大鼠体质量和关节炎评分,四肢累积得分即为每只大鼠关节炎指数[8]。
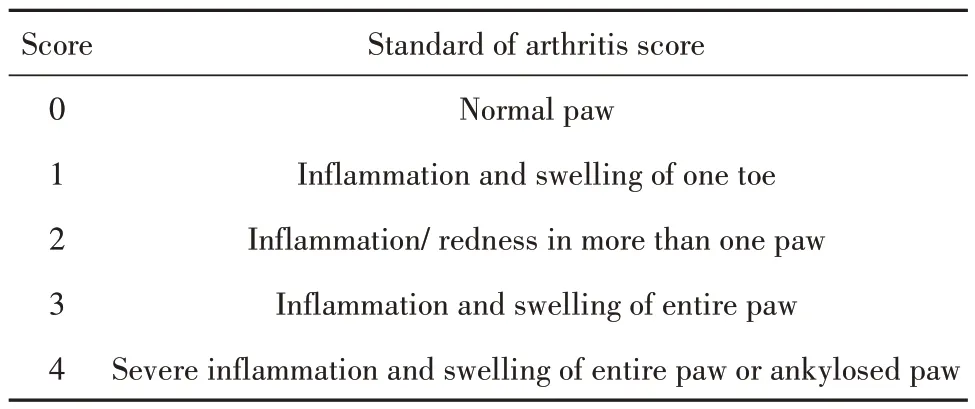
表1 关节炎评分标准Tab.1 Standard of arthritis score
1.2.4 不同实验组大鼠关节和脾脏病理学检测 取4%多聚甲醛固定的大鼠踝关节(10%EDTA 脱钙5 周)和脾脏,梯度乙醇脱水→二甲苯透明→石蜡包埋→4 µm 切片→脱蜡至水→HE 染色,显微镜下观察关节和脾脏病理变化。关节组织以滑膜增生、细胞浸润、血管翳形成和软骨侵蚀4 个特征进行病理评分,评分范围为0 分(无影响)至3 分(严重影响),脾脏组织以淋巴样白髓增生和生发中心总数2个特征进行病理评分,评分范围为0 分(无影响)至4 分(严重影响)[9]。
1.2.5 血清炎症因子检测 ELISA 试剂盒检测各组大鼠血清炎症因子TNF-α、IL-1、IL-6 表达。按照说明书依次稀释标准品,取各组大鼠血清各50 µl,450 nm 处检测OD 值,绘制标准曲线,计算样品浓度。
1.2.6 网络药理学预测FHD 治疗RA 的核心信号通路 借助PubMed、TCMSP、BATAMAN-TCM 数据库收集FHD 化学成分[10-11]。TCMSP 数据库以OB≥30%、DL≥0.18、AlogP≤5、MW≤500 为标准进行筛选,BATMAN-TCM 数 据 库 以Score cut off>30,P<0.05 为标准筛选[12]。Swiss Target Prediction 数据库进行活性成分-靶标预测[13]。Uniprot 数据库对预测靶点进行标准化处理[14]。利用OMIM、GeneCards、Dis-GeNET 数据库以score>平均值筛选RA 疾病靶点[15-17]。将FHD 治疗RA 的作用靶点导入STRING数据库,设置蛋白互作评分≥0.9,获得PPI 数据,构建PPI 网络并进行网络拓扑分析,以各节点度值(degree)、介数中心值(closeness)及紧密关系值 (betweenness)参数>平均值筛选FHD 治疗RA 的核心靶点[18]。以P<0.01 为条件,DAVID 数据库对核心靶点进行信号通路富集分析,获得FHD 治疗RA的核心信号通路[19]。
1.2.7 基于PI3K-Akt 信号通路检测各组大鼠关节PI3K、p-PI3K、Akt、p-Akt 蛋白表达 液氮研磨大鼠关节滑膜组织至粉末状,RIPA 裂解液提取总蛋白,BCA 检测蛋白浓度和纯度,取30 µg 蛋白上样,SDSPAGE电泳,5%浓缩胶(80 V,30 min)和10%分离胶(120 V,90 min)湿转(230 mA,90 min)至PVDF 膜,5%BSA 室 温封 闭1 h,分 别 加入 兔 源PI3K、Akt、 p-PI3K(Y607)、p-Akt(Ser473)抗体(1∶1 000)、β-actin 抗体(1∶5 000) 4 ℃孵育过夜(12~16 h),加入羊抗兔IgG 二抗(1∶5 000)室温孵育2 h,TBST 充分洗膜,eECL(A 液、B 液各500 µl)避光显色,Image J 软件分析蛋白条带灰度值。
1.3 统计学分析 采用SPSS24.0软件进行数据分析,结果以±s表示,不同时间段各组比较采用重复测量数据的两因素方差分析,多组间比较采用单因素方差分析,符合方差齐性采用LSD-t检验,不符合方差齐性采用Dunnett T3 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠体质量和关节炎评分 给药0~6周,CIA 组大鼠体质量较Control 组显著降低(P<0.01),给药4 周后,不同剂量FHD 治疗组较CIA 组大鼠体质量显著增加(P<0.01),FHD 高剂量组大鼠体质量呈下降趋势(图1A)。CIA 组与不同剂量FHD 治疗组关节炎评分显著高于Control 组(P<0.01),给药 5 周后,不同剂量FHD 治疗组关节炎评分显著降低(P<0.01,图1B)。

图1 各组大鼠体质量和关节炎评分Fig.1 Body weight and arthritis score of rats in each group
2.2 各组大鼠关节和脾脏病理学检测 HE 染色结果显示,Control 组大鼠关节组织结构完整。CIA组关节腔内大量炎症细胞浸润,皮下滑膜组织增生伴血管翳形成,关节面粗糙,软骨破坏明显;与CIA组相比,不同剂量FHD 组大鼠关节软骨形态改善,无明显滑膜血管翳形成,可显著抑制滑膜增生和炎症细胞浸润(图2A)。CIA 大鼠脾脏内淋巴样白髓和主要生发中心增生明显,不同剂量FHD 均可显著减少生发中心总数并抑制白髓增生(图2B)。
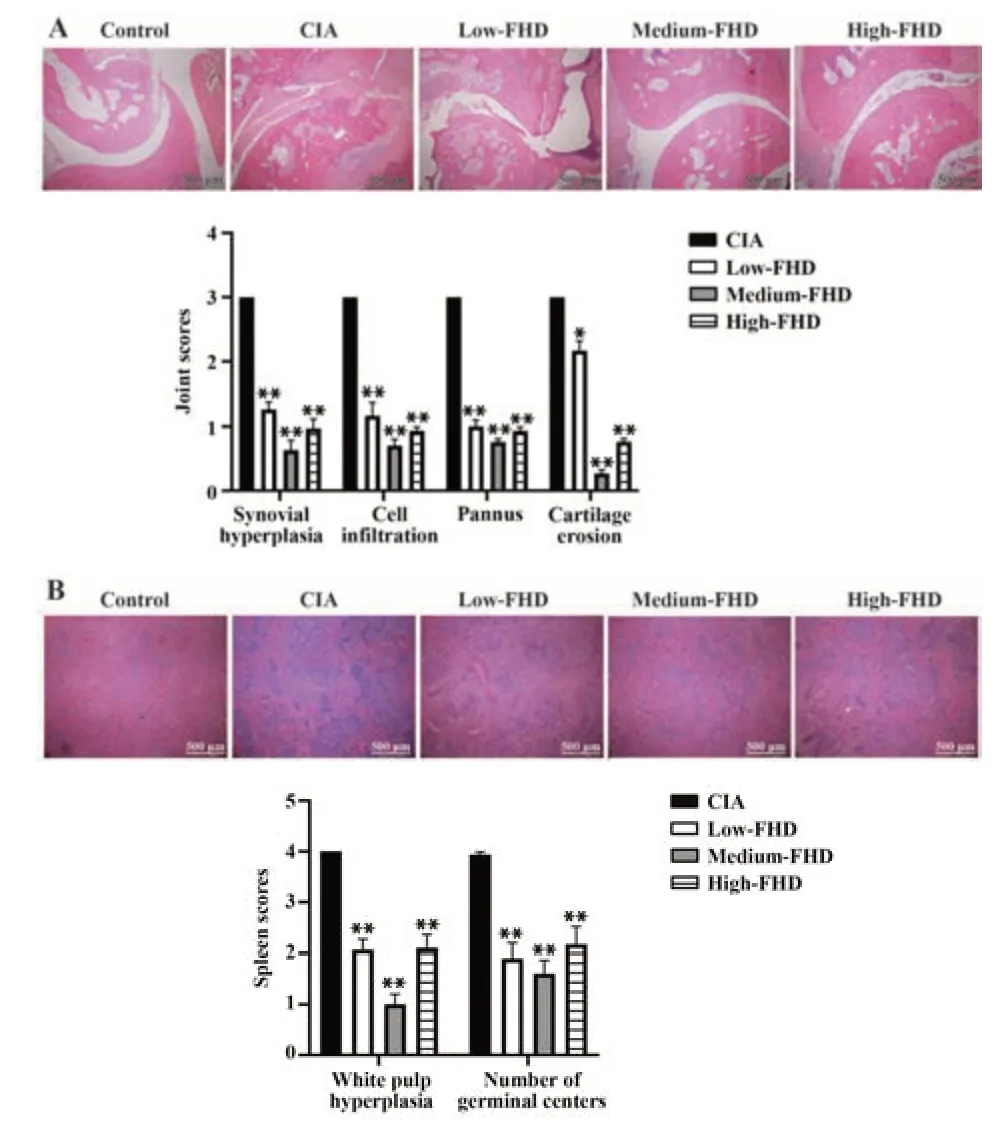
图2 各组大鼠关节和脾脏病理改变及评分(×40)Fig.2 Pathological changes and scores of joints and spleen of rats in each group (×40)
2.3 各组大鼠血清炎症因子表达 ELISA 结果显示,与Control 组相比,CIA 组大鼠血清TNF-α、IL-1和IL-6 表达显著升高(P<0.05,P<0.01);与CIA 组相比,低、中FHD剂量组大鼠血清TNF-α、IL-1和IL-6表达显著降低(P<0.05,P<0.01),高剂量组TNF-α、IL-1表达差异无统计学意义(P>0.05,图3)。
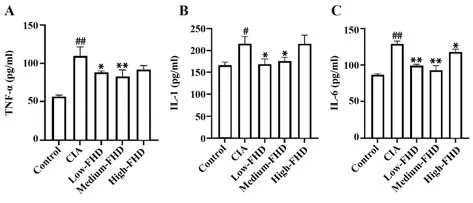
图3 各组大鼠血清细胞因子水平Fig.3 Serum cytokine level of rats in each group
2.4 FHD 治疗RA 的核心信号通路预测 网络药理学分析显示,FHD 有效活性成分共270 个(防己 30 个、黄芪44 个、白术14 个、甘草190 个,黄芪和甘草共有成分8 个),潜在作用靶点762 个,RA 疾病靶点1 670 个,FHD 治疗RA 潜在靶点250 个(图4)。网络拓扑分析结果显示(表2),PPI网络中各蛋白节点degree、closeness 和betweenness 平 均 值 分 别 为13.26、0.35、0.018,筛选出FHD 治疗RA 的核心靶点30 个。核心靶点KEGG 富集分析结果表明:PI3K-Akt 通路为核心靶点富集最多的通路,提示FHD可能通过该通路发挥RA治疗作用(图5)。
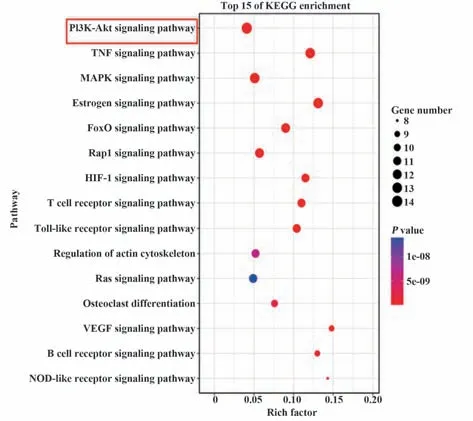
图5 核心靶点KEGG信号通路富集分析Fig.5 Enrichment analysis of core target KEGG signaling pathway

表2 核心靶点网络拓扑参数Tab.2 Network topology parameters of core targets

图4 FHD治疗RA的PPI网络Fig.4 PPI network in FHD therapy of RA
2.5 各组大鼠关节PI3K-Akt通路蛋白表达 Western blot结果显示,与Control组比较,CIA组p-PI3K、p-Akt表达显著升高(P<0.01),与CIA 组相比,不同剂量FHD 组大鼠关节PI3K、Akt 蛋白磷酸化水平显著降低(P<0.01),各组大鼠PI3K、Akt表达差异无统计学意义(P>0.05,图6A)。PI3K-Akt信号通路激活可调控细胞的存活、凋亡、增殖和分化,FHD 可能通过抑制p-PI3K、p-Akt 蛋白表达负调控PI3K-Akt 信号通路,进而抑制CIA 大鼠关节滑膜细胞增殖和破骨细胞分化、脾脏中淋巴细胞增殖、炎症因子释放缓解CIA 大鼠关节和脾病理损伤,发挥治疗作用 (图6C)。
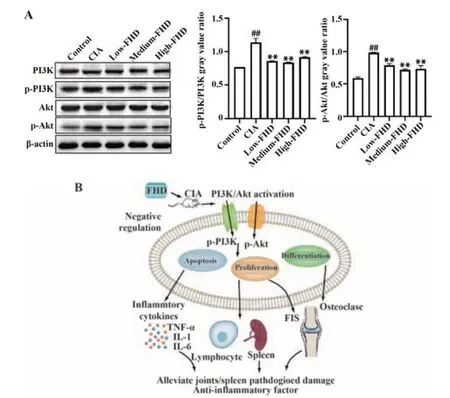
图6 各组大鼠关节PI3K、p-PI3K、Akt、p-Akt 蛋白表达 及FHD治疗CIA大鼠的调控机制Fig.6 Protein expressions of PI3K, p-PI3K, Akt and p-Akt in joints of rats in each group and regulatory mechanism of FHD in CIA rats
3 讨论
中医经典复方治疗RA 具有独特优势,临床控制中药用量对疾病治疗十分重要,坚持“效毒权衡”原则才能达到最佳量效关系,指导临床辨治疾病[20]。本研究发现,不同剂量FHD 均可显著缓解CIA 大鼠关节炎症状,但高剂量FHD 组大鼠体质量自给药4 周后呈下降趋势,血清TNF-α 和IL-1 表达较CIA 组无明显变化,提示8.8 g/(kg·d)FHD 可能产生毒副作用进而影响大鼠体质量且尚未影响血清TNF-α 和IL-1 炎症因子表达,推荐FHD 安全用药剂量为2.2~4.4 g/(kg·d)。
TNF-α 主要由巨噬细胞和Th1 细胞分泌,在RA滑膜中广泛存在,能够促进IL-1、IL-6 等炎症因子产生并形成级联反应,加重RA 炎症反应[21-22]。研究证实,RA 成纤维样滑膜细胞(FLS)可被IL-1、IL-6、TNF-α 在内的各种细胞因子激活,组织蛋白酶(CAT)和基质金属蛋白酶(MMP)高表达,胶原蛋白和蛋白聚糖分解,导致软骨和骨骼破坏及关节侵蚀[23]。本研究发现,FHD 可显著缓解CIA 大鼠关节炎症状,抑制关节炎症细胞浸润、滑膜增生和软骨破坏,降低血清TNF-α、IL-1、IL-6 表达,提示FHD 可能通过抑制炎症因子生成缓解CIA 大鼠关节炎症状。
PI3K-Akt 通路可调控RA-FLS 增殖和凋亡,在RA炎症反应中发挥重要作用[24-25]。研究表明,TNF-α等炎症因子通过激活PI3K/Akt 通路大量释放IL-1、IL-6等促炎因子,持续诱导FLS 增殖和炎症反应,加重RA 病情[26]。进一步研究发现,PI3K/Akt 通过促进破骨细胞形成与分化进而破坏骨质与关节软骨,导致关节畸形、僵硬,抑制该通路活化可能成为RA治疗的新途径[27]。MENG等[28]研究发现,抑制PI3KAkt 信号通路可促进IL-1β 刺激的RA-FLS 凋亡,降低TNF-α 和IL-6 表达。FENG 等[29]研究发现,抑制PI3K/Akt/mTOR 途径可减少CIA 大鼠关节软骨细胞增殖并加速细胞凋亡和自噬,有效改善关节炎症状。本研究发现,CIA组大鼠关节p-PI3K和p-Akt表达显著增多,PI3K-Akt 通路异常激活,而不同剂量FHD 组p-PI3K 和p-Akt 表达较CIA 显著降低,推测FHD 通过抑制PI3K-Akt 信号通路活化缓解CIA 大鼠炎症反应和改善病理破坏。
综上,不同剂量FHD 均可缓解CIA 大鼠关节炎症状,抑制关节腔内滑膜增生和软骨破坏,减少脾脏中白髓增生,降低血清炎症因子表达,安全用药范围为2.2~4.4 g/(kg·d),其作用机制可能与抑制PI3K-Akt 信号通路活化有关。本研究对阐明FHD治疗RA 的作用机制,及通过PI3K-Akt 信号通路靶向治疗RA具有重要意义。