乳腺癌并发抑郁症模型小鼠血液及组织中白介素类细胞因子含量的变化①
2023-03-17罗薇絮蔺晓源赵洪庆王宇红
孟 盼 罗薇絮 蔺晓源 刘 检 赵洪庆 凌 佳 骆 妍 王宇红
(湖南中医药大学科技创新中心,长沙 410208)
乳腺癌是全球女性最常见的恶性肿瘤,在我国 女性恶性肿瘤中居首位[1]。乳腺癌的治愈率虽有提高,但从发病到诊断再到治疗期间患者极易出现抑郁症。研究显示,乳腺癌并发抑郁症(breast cancer with depression,BCRD)的患病率占乳腺癌患者的12%~25%,且病死率提高10%~15%[2-3]。细胞因子是一种调节免疫应答的信号分子,同时可作为一种神经调质调节神经生化、神经内分泌及行为改变。乳腺肿瘤生长及侵袭能力由弱到强伴随机体免疫功能紊乱,但抗肿瘤免疫应答主要依赖于微环境中的抑制性细胞因子[4-5]。抑郁症的炎症应答假说认为激活的外周免疫系统通过释放促炎细胞因子导致抑郁症发生[6]。因此,体内促炎、抗炎细胞因子的含量可直接影响BCRD 的发生发展。基于此,本研究采用高通量、高精度的悬液芯片技术分析BCRD模型小鼠不同组织中白介素类细胞因子的变化,为BCRD的治疗及预后评估提供新的策略。
1 材料与方法
1.1 材料
1.1.1 实 验 动 物 SPF 级BALB/c 雌 性 小 鼠, 4~6 周龄,购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2013-0004,合格证号:43004700024756。在光暗周期为12 h/12 h 环境中适应性喂养5 d,自由获取饲料与水。
1.1.2 主要试剂与仪器 4T1 炎症乳腺癌细胞株(上海科学院细胞库);皮质酮、BSA(北京索莱宝);双抗、胰酶、胎牛血清(HyClone);PBS 缓冲液(中杉金桥);DMSO(上海蓝润化学有限公司)。悬液芯片系统、洗板机、细胞因子7 项试剂盒(美国Bio-Rad);多功能酶标仪(美国Thermo Fisher)。
1.2 方法
1.2.1 4T1 炎症乳腺癌细胞的培养 显微镜下观察4T1 炎症乳腺癌细胞株生长状态,0.22 µm 过滤器过滤,加入RPMI 培养液(内含10%胎牛血清,1%双抗)10 ml,转移至25 cm2培养瓶,置于37 ℃恒温培养,对数期细胞用0.25%胰蛋白酶消化传代。采用胰酶消化细胞,用PBS将细胞吹打成单个悬浮状态,并将其浓度调整为1×107个/ml。
1.2.2 BCRD 动物模型制备[7]以BALB/c 小鼠为研究对象,腋下接种1×106个4T1 炎症乳腺癌细胞,并于接种7 d 后观察其成瘤情况。成瘤后,背部皮下注射皮质酮混悬液(每300 mg 皮质酮用5 ml DMSO 预溶解,将皮质酮在DMSO 中充分溶解后,加入95 ml生理盐水),小鼠等效剂量为30 mg/kg,给药体积为20 ml/kg,连续注射21 d,制备BCRD模型。
1.2.3 动物分组 小鼠适应性饲养5 d 后,将小鼠按糖水消耗量随机分为4组,即空白组、乳腺癌模型组、抑郁模型组、BCRD组,每组10只。
1.2.4 指标检测
1.2.4.1 糖水偏好 将小鼠饲养于单笼,2 瓶饮用水供其选择性饮用,适应1 d后,再换成2瓶1%的蔗糖溶液,同样再选择性适应1 d。1 瓶糖水、1 瓶蒸馏水选择性饮水共进行1 d,期间交换2 瓶水的位置,适应完成后正式进行糖水偏爱实验。禁食禁水12 h后,给予事先称重的1%蔗糖水和蒸馏水各1 瓶,1 h后取出水瓶称量剩余的蔗糖水瓶与蒸馏水瓶重量。糖水消耗度(%)=糖水消耗量/(蒸馏水+糖水消耗量)×100%。
1.2.4.2 旷场实验 将动物面壁放入箱的左角,试验箱规格为50 cm×50 cm×40 cm。适应30 s后,观察并记录3 min 内小鼠双后肢跨越方格的个数(水平运动)与前肢腾空或攀爬壁的次数(垂直运动)。试验在无明显光源的黑暗环境中进行,并于每天11点前结束,为避免上次动物余留的气味等信息影响测试结果,每只小鼠观察完后需擦拭箱内壁及底面。
1.2.4.3 悬液芯片检测细胞因子含量 血清、组织匀浆液样本进行处理,包被不同抗体的微球与标准品、样品和对照品25 ℃温浴孵育10 min;接入生物素标记的抗体并孵育30 min;采用洗板机洗3 次孔板,洗液分别为70%乙醇、30%乙醇、蒸馏水;加 入SA-PE荧光报告分子,25 ℃温浴孵育10 min;进入Bio-Plex系统,设置程序,进行读板并检测。
1.3 统计学分析 检验水准α=0.05。采用SPSS21.0软件对数据进行统计分析。服从正态分布的指标采用±s表示,不服从正态分布的计量资料用中位数M(P25,P75)表示。多组比较服从正态分布且方差齐性,否则采用H 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠快感缺失的变化 与空白组比较,各模型组糖水偏嗜度均下降,以抑郁症、BCRD 组最为显著(P<0.01 或P<0.05),提示模型动物核心快感缺失。与乳腺癌组比较,抑郁症组糖水偏嗜度轻度下降(P>0.05),BCRD 组糖水偏嗜度下降更为显著 (P<0.05)。与抑郁症组比较,BCRD 组糖水偏嗜度差异无统计学意义(P>0.05)。提示BCRD 小鼠明显存在快感缺乏症状。见表1。
表1 各组小鼠糖水偏嗜度的变化(±s,n=10,%)Tab.1 Changes in degree of sugar water partial ingestion in each group (±s,n=10,%)

表1 各组小鼠糖水偏嗜度的变化(±s,n=10,%)Tab.1 Changes in degree of sugar water partial ingestion in each group (±s,n=10,%)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05.
2.2 各组小鼠自主行为变化 与空白组比较,各组水平活动、垂直活动数均下降,抑郁症组、BCRD组下降更为显著(P<0.01 或P<0.05),提示模型动物自主活动量下降。与乳腺癌组比较,抑郁症组水平活动、垂直活动数轻度下降,而BCRD 组水平活动下降更为显著(P<0.05)。与抑郁症组比较,BCRD组水平活动、垂直活动数,差异无统计学意义(P>0.05)。提示BCRD 小鼠明显存在自主活动量减少情况。见表2。
表2 各组小鼠旷场实验结果(±s,n=10,次数)Tab.2 Open field test results of mice in each group (±s,n=10,times)
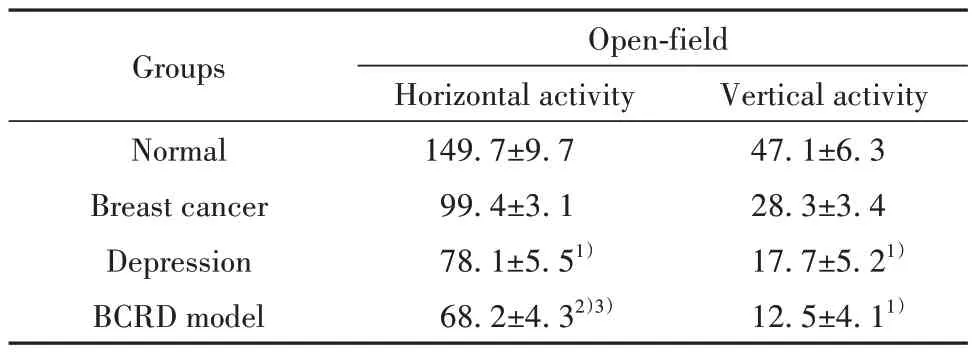
表2 各组小鼠旷场实验结果(±s,n=10,次数)Tab.2 Open field test results of mice in each group (±s,n=10,times)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05.
2.3 细胞因子变化
2.3.1 IL-1β 变化 与空白组比较,抑郁症组血清、海马、皮质中IL-1β 含量显著增加(P<0.01 或P<0.05),乳腺癌组、BCRD 组血清、海马、皮质中IL-1β含量差异无统计学意义(P>0.05)。与乳腺癌组比较,抑郁症组血清、海马、皮质中IL-1β 含量增加(P>0.05),BCRD 组血清、海马、皮质、肿瘤中IL-1β 含量轻度下降(P>0.05)。与抑郁症组比较,BCRD 组 IL-1β含量差异无统计学意义(P>0.05)。提示IL-1β在抑郁症组血清、海马、皮质中含量显著增加,而在乳腺癌组和BCRD 组中血液及不同靶组织中无显著变化。见表3。
表3 小鼠血清、肿瘤、海马、皮质中IL-1β 含量变化(±s, n=10)Tab.3 Changes of IL-1β in serum, tumor, hippocampus and cortex of mice (±s,n=10)

表3 小鼠血清、肿瘤、海马、皮质中IL-1β 含量变化(±s, n=10)Tab.3 Changes of IL-1β in serum, tumor, hippocampus and cortex of mice (±s,n=10)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01.
2.3.2 IL-2 变化 与空白组比较,抑郁症组血清、海马、皮质中IL-2 含量显著增加(P<0.01 或P<0.05),BCRD 组血清、海马中IL-2含量显著增加(P<0.01或P<0.05)。与乳腺癌组比较,抑郁症组血清、海马、皮质中IL-2 含量增加(P>0.05),BCRD 组血清、海马中IL-2 含量增加(P<0.05)。与抑郁症组比较,BCRD 组血清、海马、皮质中IL-2 含量差异无统计学意义(P>0.05)。提示IL-2 在抑郁症、BCRD 组血清、海马中的含量显著增加,而在乳腺癌组血液及不同靶组织中无显著变化;同时,皮质中的IL-2在抑郁症组中有显著变化,而在BCRD 模型中无显著变化。见表4。
表4 小鼠血清、肿瘤、海马、皮质中IL-2 含量变化(±s, n=10)Tab.4 Changes of IL-2 in serum, tumor, hippocampus and cortex of mice (±s,n=10)

表4 小鼠血清、肿瘤、海马、皮质中IL-2 含量变化(±s, n=10)Tab.4 Changes of IL-2 in serum, tumor, hippocampus and cortex of mice (±s,n=10)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05.
2.3.3 IL-6 变化 与空白组比较,抑郁症组、乳腺癌组、BCRD 组血清、海马、皮质中IL-6 的含量显著增加(P<0.01 或P<0.05)。与乳腺癌组比较,BCRD组血清、海马、皮质中IL-6 含量显著增加(P<0.05),肿瘤组织中IL-6 含量差异无统计学意义;抑郁症组血清、海马、皮质中IL-6 含量增加,差异无统计学意义(P>0.05)。与抑郁症组比较,BCRD 组血清、海马、皮质中IL-6 含量差异无统计学意义(P>0.05)。提示抑郁症、乳腺癌、BCRD 组血清、海马、皮质中IL-6 含量显著增加,且IL-6 在BCRD 模型不同靶组织中增加更为显著。见表5。
表5 小鼠血清、肿瘤、海马、皮质中IL-6 含量变化(±s, n=10)Tab.5 Changes of IL-6 in serum, tumor, hippocampus and cortex of mice (±s,n=10)

表5 小鼠血清、肿瘤、海马、皮质中IL-6 含量变化(±s, n=10)Tab.5 Changes of IL-6 in serum, tumor, hippocampus and cortex of mice (±s,n=10)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05.
2.3.4 IL-10 变化 与空白组比较,抑郁症、乳腺癌、BCRD 组血清、海马、皮质中IL-10 含量显著增加(P<0.01 或P<0.05)。与乳腺癌组比较,BCRD 组海马组织中IL-10 的含量显著增加(P<0.05),抑郁症组血清、海马、皮质中IL-10 含量增加(P>0.05)。与抑郁症组比较,BCRD 组血清、海马、皮质中IL-10 含量增加,差异无统计学意义(P>0.05)。提示BCRD组海马组织中IL-10水平提高更为显著。见表6。
表6 小鼠血清、肿瘤、海马、皮质中IL-10 含量变化(±s, n=10)Tab.6 Changes of IL-10 in serum, tumor, hippocampus and cortex of mice (±s,n=10)

表6 小鼠血清、肿瘤、海马、皮质中IL-10 含量变化(±s, n=10)Tab.6 Changes of IL-10 in serum, tumor, hippocampus and cortex of mice (±s,n=10)
Note:Compared with normal group, 1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05.
2.3.5 IL-12 变化 与空白组比较,抑郁症、BCRD组血清、海马、皮质中IL-12 含量显著增加(P<0.01或P<0.05)。与乳腺癌组比较,抑郁症组血清、海马、皮质中IL-12 含量显著增加(P<0.05,P<0.01),BCRD 组血清、海马中IL-12 含量显著增加(P<0.01或P<0.05)。与抑郁症组比较,BCRD 组血清、海马、皮质中IL-12 含量降低,差异无统计学意义(P>0.05)。提示BCRD 组血清、海马中IL-12 含量明显增加,但较抑郁症组表达降低。见表7。
表7 小鼠血清、肿瘤、海马、皮质中IL-12 含量变化(±s, n=10)Tab.7 Changes of IL-12 in serum, tumor, hippocampus and cortex of mice (±s,n=10)

表7 小鼠血清、肿瘤、海马、皮质中IL-12 含量变化(±s, n=10)Tab.7 Changes of IL-12 in serum, tumor, hippocampus and cortex of mice (±s,n=10)
Note:Compared with normal group,1)P<0.05, 2)P<0.01; compared with breast cancer group, 3)P<0.05, 4)P<0.01.
3 讨论
行为学评价可以重现临床上患者行为学的特征,在某种程度上可以很好地评价动物模型的表征改变。抑郁症常见的行为学检测主要从奖赏、探索、绝望等多个层次展开。其中,奖赏方面主要有糖水偏嗜度,可反映抑郁症的核心症状快感缺失[8];探索方面主要有旷场实验,其中自主、探究活动下降及紧张度增高是抑郁症的重要表征[7]。本研究表明,与抑郁症组、乳腺癌组比较,BCRD 模型小鼠糖水偏嗜度、自主活动显著下降,进一步说明BCRD 模型小鼠存在显著的抑郁样行为。
外周免疫激活驱动大脑中的免疫激活,与癌症患者的行为(如疲劳)和精神疾病(包括抑郁症和认知障碍)密切相关。研究发现,乳腺癌术前和术后 6 个月患者的细胞因子基因变异与抑郁症状存在紧密关系[9]。肿瘤患者放疗或化疗后疲乏,抑郁量表评分升高,同时NF-κB、IL-6 水平升高,进一步证明了BCRD 与免疫紊乱的直接相关性[10]。细胞因子根据其在炎症反应中的不同作用可分为促炎、抗炎因子。促炎因子包括IL-1、IL-2、IL-6、IL-12 等,其作用是通过激活免疫细胞在局部或远隔部位发挥作用;抗炎因子包括IL-10、IL-19 等。IL-1β 是一种单核因子,可增强宿主对体内外刺激的应答能力[11]。IL-2是一种由活化的淋巴细胞分泌的淋巴因子,有促进和维持T细胞增殖与分化的功能[12]。IL-10 可以激活NK 细胞以维持CD4+T 细胞和CD8+T 细胞的抗肿瘤应答[13]。IL-6 主要是由活化的T 细胞产生的淋巴因子,可促进自然杀伤细胞裂解,并诱导T 细胞增殖、分化,是炎症反应的促发剂[14]。IL-12 主要来源于树突状细胞及B淋巴细胞,可参与机体感染、肿瘤、自身免疫性疾病的免疫调节[15]。
本实验发现:①BCRD 模型的炎症状态为:同 一个炎症因子在不同组织中含量显著不同,即同 一个细胞因子在血清和海马中的含量较高,肿瘤次之,皮质中含量最低;血清中IL-12 含量高于其在海马、皮质、肿瘤中的表达,海马中IL-2、IL-10 含量高于其在血清、肿瘤、皮质中的表达,说明细胞因子在体内的分布呈不均一状态,不同部位的细胞因子在疾病发生发展中起不同效应;②与乳腺癌组比较,BCRD 组肿瘤组织中IL-1β、IL-2、IL-6、IL-10、IL-12含量无显著变化,说明乳腺癌继发抑郁症后不会对原有癌组织中的细胞因子产生影响。上述研究结果与临床上观测到的癌症伴发抑郁症患者细胞因子变化结果一致[16]。同时,通过对数据的纵向比较发现,IL-6 在血清、海马、皮质中的含量均较高且均一,可能是BCRD的重要指征。
综上,本课题组认为细胞因子在BCRD 的发病机制中起重要作用,探讨细胞因子变化对明确BCRD 的预防及治疗有着极为重要的意义。下一步将继续以IL-6 为核心,探讨其在BCRD 发生发展中的分子机制。