薄荷脑通过miR-1247-3p/PI3K/Akt 通路影响LPS 诱导的Ⅱ型肺泡上皮 细胞凋亡和炎症反应的分子机制研究①
2023-03-17朱丹娜河南中医药大学肺病科郑州450046
朱丹娜 孟 泳 (河南中医药大学肺病科,郑州 450046)
肺泡Ⅱ型上皮细胞(alveolar type Ⅱ epithelial cells,AT-Ⅱ)是肺泡壁的重要组成部分,具有维持肺表面活性物质动态平衡和肺免疫功能,其过度凋亡可导致肺泡上皮屏障破坏,肺上皮细胞异常损伤与急性肺损伤、肺结核、慢性阻塞性肺疾病等肺部疾病的发生发展密切相关[1-2]。因此,研究肺泡上皮细胞损伤的分子机制对肺部相关疾病的治疗具有重要意义。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性杆菌细胞壁的重要成分,可诱导肺泡上皮细胞损伤[3]。研究表明中药在防治肺部疾病上具有重要作用[4]。薄荷脑是从薄荷的叶和茎中提取的一种饱和环状醇,又名薄荷醇、薄荷冰;研究报道雾化吸入薄荷醇可减轻哮喘小鼠气道炎症,降低气道高反应性[5]。薄荷醇通过MAPK、NF-κB 和AKT 信号通路抑制神经炎症反应,可保护多巴胺能神经元免受LPS 诱发的帕金森病模型中炎症介导的损伤[6]。然而薄荷脑对LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应的影响及机制尚不清楚。研究报道LPS 处理的A549 细胞中miR-1247-3p 相对表达量升高[7]。抑制miR-1247-3p 表达通过靶向SFTPC 基因抑制LPS 诱导的肺泡上皮细胞损伤[8]。磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)信号通路与肺损伤发生有关,如氢可通过激活PI3K/Akt/Foxo3a 信号通路防止高氧诱导的AT-Ⅱ细胞凋亡[9]。右美托咪定通过激活PI3K/Akt 通路可改善LPS 诱导的大鼠急性肺损伤[10]。川芎嗪可通过抑制PI3K/Akt/mTOR信号通路活化减轻内毒素诱导的急性肺损伤大鼠炎症反应[11]。而 薄 荷 脑 是 否 通 过 调 控miR-1247-3p 及PI3K/Akt通路影响LPS 诱导的肺泡上皮细胞损伤尚未可知。因此,本实验旨在研究薄荷脑对LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应的影响及机制是否与miR-1247-3p及PI3K/Akt通路有关。
1 材料与方法
1.1 材料 AT-Ⅱ细胞购自上海雅吉生物科技有限公司;DMEM 培养基购自美国Hyclone 公司;LPS购自北京伊塔生物科技有限公司;薄荷脑购自滁州仕诺达生物科技有限公司;CCK-8 试剂盒购自北京利维平生物科技有限公司;凋亡检测试剂盒购自上海信帆生物科技有限公司;蛋白提取试剂盒购自南京恩晶生物科技有限公司;ELISA 试剂盒购自深圳子科生物科技有限公司;荧光定量试剂盒购自上海科敏生物科技有限公司。
1.2 方法
1.2.1 LPS 诱导AT-Ⅱ细胞损伤模型的建立 将AT-Ⅱ细胞分别用5、10、15 mg/L的LPS处理,以未经LPS 处理的细胞作为对照(NC)组,发现不同浓度LPS均可减弱AT-Ⅱ细胞活性,后续实验选用浓度为15 mg/L。
1.2.2 细胞分组 分别采用1、5、10 µmol/L的薄荷脑和15 mg/L LPS 处理AT-Ⅱ细胞,分别设为1、5、 10 µmol/L 薄荷脑+15 mg/L LPS 组;将anti-miR-NC、anti-miR-1247-3p 转染至AT-Ⅱ细胞后用15 mg/L LPS 处理,设为anti-miR-NC+15 mg/L LPS 组、antimiR-1247-3p+15 mg/L LPS 组;将miR-NC、miR-1247-3p 转染至AT-Ⅱ细胞后用0 µmol/L 的薄荷脑和 15 mg/L 的LPS 处理,设为miR-NC+10 µmol/L 薄荷脑+15 mg/L LPS 组、miR-1247-3p+10 µmol/L 薄荷脑+ 15 mg/L LPS组。
1.2.3 CCK-8 法检测细胞活性 将AT-Ⅱ细胞以2×103个/孔接种于96 孔板培养12 h,分别加入0、5、10、15 mg/L的LPS,培养24 h后每孔加入10 µl CCK-8试剂孵育2 h,酶标仪检测450 nm 波长处的吸光度值(A)。
1.2.4 流式细胞术检测细胞凋亡 NC 组、15 mg/L LPS 组、1、5、10 µmol/L 薄荷脑+15 mg/L LPS 组、antimiR-NC+15 mg/L LPS 组、anti-miR-1247-3p+15 mg/L LPS 组、miR-NC+10 µmol/L 薄荷脑+15 mg/L LPS 组、miR-1247-3p+10 µmol/L 薄荷 脑+15 mg/L LPS 组 细胞培养48 h,收集细胞,用预冷的PBS 漂洗2 次,加入300 µl 结合缓冲,然后加入Annexin V-FITC 和PI孵育10 min,流式细胞仪检测细胞凋亡率。
1.2.5 ELISA 检测TNF-α、IL-6、IL-1β 水平 取各组细胞培养48 h 后上清液,ELISA 法检测TNF-α、 IL-6、IL-1β 水平,具体操作按照试剂盒说明进行,先测量标准品吸光度值并绘制标准曲线,然后测量样品吸光度值,根据所得吸光度值在标准曲线上读取样品浓度。
1.2.6 Western blot 检测蛋白表达 提取各组细胞总蛋白,进行聚丙烯酰胺凝胶电泳分离蛋白,然后将蛋白转至PVDF 膜,5%脱脂奶粉室温封闭1 h,加入一抗(1∶800) 4 ℃孵育过夜,洗膜后加入二抗 (1∶2 000)室温孵育2 h,曝光显影后用Quantity One分析蛋白条带灰度值,以β-actin 为内参计算蛋白相对表达水平。
1.2.7 RT-qPCR 检测miR-1247-3p 表达水平 提取细胞总RNA,反转录成cDNA 后以U6为内参进行PCR 扩增,扩增条件:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40 个循环;60 ℃延长5 min。相对表达量采用2-ΔΔCt法计算。miR-1247-3p 正 向序列:5'-CCCCGGGAACGTCGAGACTGGAGC-3',反向序列:5'-CAGTGCGTGTCGTGGAGT-3';U6 正向序列:5'-TGGAACGCTTCACGAATTTGCG-3',反向序列:5'-GGAACGATACAGAGAAGATTAGC-3'。
1.3 统计学分析 采用SPSS20.0软件进行统计学分析,符合正态分布的计量资料以±s表示,两组比较行t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度LPS 对AT-Ⅱ细胞活性的影响 与NC组相比,不同浓度LPS处理后AT-Ⅱ细胞活性降低(P<0.05,图1)。后续研究浓度选用15 mg/L的LPS。
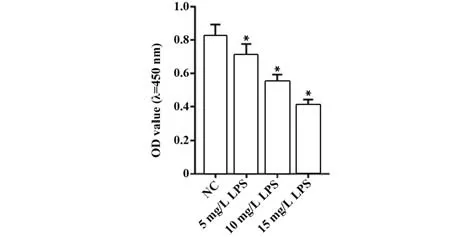
图1 不同浓度LPS对AT-Ⅱ细胞活性的影响Fig.1 Effect of different concentrations of LPS on AT-Ⅱ cell activity
2.2 不同浓度薄荷脑对LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应的影响 与NC 组相比,LPS 组Cleaved-caspase-3 表达水平及细胞凋亡率升高,TNF-α、IL-6、IL-1β 水平升高(P<0.05);与LPS 组相比,不同浓度薄荷脑组Cleaved-caspase-3 表达水平及细胞凋亡率降低,TNF-α、IL-6、IL-1β 水平降低 (P<0.05,图2)。
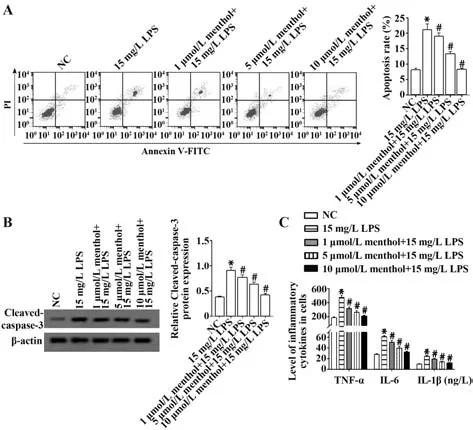
图2 不同浓度薄荷脑对LPS诱导的AT-Ⅱ细胞凋亡和炎症反应的影响Fig.2 Effect of different concentrations of menthol on apoptosis and inflammation of AT-Ⅱ cells induced by LPS
2.3 不同浓度薄荷脑对LPS 诱导的AT-Ⅱ细胞中miR-1247-3p表达水平的影响 与NC组相比,15 mg/L LPS 组miR-1247-3p 表达水平升高(P<0.05);与 15 mg/L LPS组相比,不同浓度薄荷脑组miR-1247-3p表达水平降低(P<0.05,图3)。

图3 不同浓度薄荷脑对LPS 诱导的AT-Ⅱ细胞中miR-1247-3p表达的影响Fig.3 Effects of different concentrations of menthol on expression of miR-1247-3p in AT-Ⅱ cells induced by LPS
2.4 miR-1247-3p 低表达对LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应的影响 与anti-miR-NC+15 mg/L LPS 组相比,anti-miR-1247-3p+15 mg/L LPS 组miR-1247-3p 表达水平降低,Cleaved-caspase-3 表达水平及细胞凋亡率降低,TNF-α、IL-6、IL-1β 水平降低 (P<0.05,图4)。
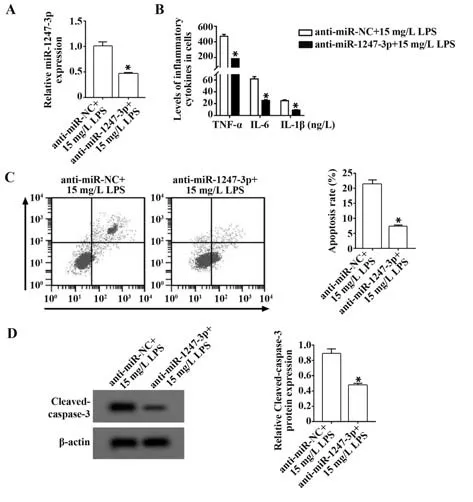
图4 miR-1247-3p 低表达对LPS 诱导的AT-Ⅱ细胞凋亡 和炎症反应的影响Fig.4 Effect of low expression of miR-1247-3p on LPS-induced apoptosis and inflammation of AT-Ⅱ cells
2.5 miR-1247-3p 可逆转薄荷脑对LPS 诱导的 AT-Ⅱ细胞凋亡和炎症反应的影响 与miR-NC+ 10 µmol/L 薄荷脑+15 mg/L LPS 组相比,miR-1247-3p+10 µmol/L 薄荷脑+15 mg/L LPS 组miR-1247-3p表达水平升高,Cleaved-caspase-3 表达水平及细胞凋亡率升高,TNF-α、IL-6、IL-1β 水平升高(P<0.05,图5)。
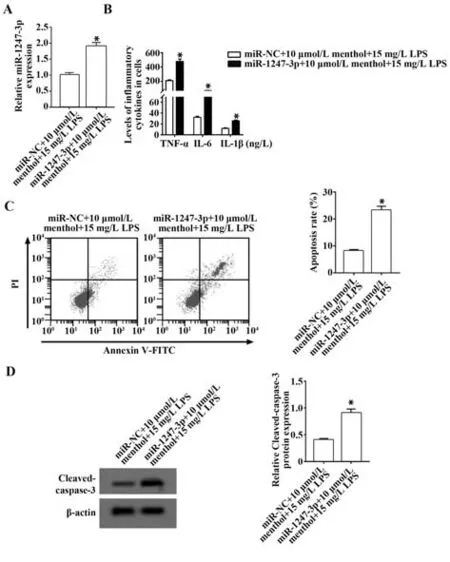
图5 miR-1247-3p 可逆转薄荷脑对LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应的影响Fig.5 miR-1247-3p can reverse effect of menthol on LPSinduced apoptosis and inflammation of AT-Ⅱ cells
2.6 PI3K/Akt信号通路蛋白表达情况 与NC组相比,15 mg/L LPS 组p-PI3K、p-Akt 蛋白表达水平降低(P<0.05),PI3K 和Akt 蛋白表达差异无统计学意义;与15 mg/L LPS 组 相 比,10 µmol/L menthol+ 15 mg/L LPS 组p-PI3K、p-Akt蛋白表达水平升高(P<0.05),PI3K 和Akt 蛋白表达差异无统计学意义;与miR-NC+10 µmol/L menthol+15 mg/L LPS 组 相 比,miR-1247-3p+10 µmol/L menthol+15 mg/L LPS 组 p-PI3K、p-Akt 蛋白表达水平降低(P<0.05),PI3K 和Akt蛋白表达差异无统计学意义(图6)。
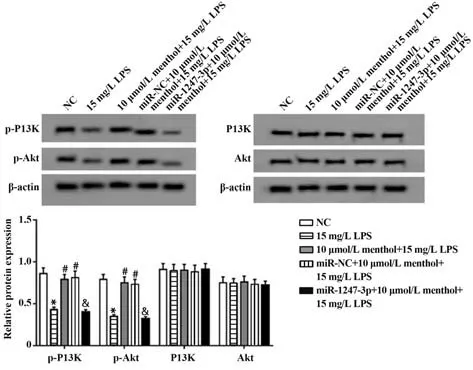
图6 Western blot检测p-PI3K、p-Akt、PI3K、Akt蛋白表达Fig.6 Western blot detection of p-PI3K, p-Akt, PI3K, Akt protein expressions
3 讨论
研究表明中药有效成分可减轻肺泡上皮细胞损伤,防治急性肺损伤效果显著,筛选疗效显著的中药以指导临床治疗相关肺部疾病具有重要意义[12-13]。肺损伤与炎症细胞浸润有关,AT-Ⅱ在创伤或应激条件下经巨噬细胞刺激可产生促炎细胞因子IL-6、IL-1β 及TNF-α 等[14]。因此,抑制AT-Ⅱ细胞凋亡和炎症因子的产生可防治肺损伤。研究报道法舒地尔和薄荷脑联合治疗可显著抑制炎症反应和细胞凋亡,改善模型大鼠脊髓损伤[15]。薄荷脑通过激活TRPM8 来预防心肌梗死后的炎症和心脏重塑[16]。薄荷醇还可降低乙酸诱导的大鼠结肠黏膜结肠炎中促炎细胞因子(IL-1、IL-23 和TNF-α)分泌[17]。本实验用不同浓度LPS 处理后AT-Ⅱ细胞活性降低,Cleaved-caspase-3 蛋白表达水平及细胞凋亡率升高,TNF-α、IL-6、IL-1β 水平升高,表明LPS 诱导了AT-Ⅱ细胞凋亡和炎症反应。因此采用LPS 诱导AT-Ⅱ细胞建立损伤模型。不同浓度薄荷脑处理后,Cleaved-caspase-3 表达水平及细胞凋亡率降低,TNF-α、IL-6、IL-1β 水平降低,表明薄荷脑可抑制LPS诱导的AT-Ⅱ细胞凋亡和炎症反应,抑制LPS诱导的AT-Ⅱ细胞损伤。
研究报道miR-1247-3p过表达可减轻缺氧/复氧诱导的H9c2 细胞损伤[18]。本实验结果显示,miR-1247-3p 低表达后,Cleaved-caspase-3 表达水平及细胞凋亡率降低,TNF-α、IL-6、IL-1β 水平降低,说明miR-1247-3p 低表达可抑制LPS 诱导的AT-Ⅱ细胞凋亡和炎症反应,与文献[8]研究结果相符。研究报道1,6-O,O-二乙酰大花旋覆花内酯通过调节miR-1247-3p/LXRα/ABCA1 信号传导抑制口腔鳞状细胞癌进展,说明药物可调控miR-1247-3p 表达[19]。本实验结果显示,薄荷脑可降低LPS 诱导的AT-Ⅱ细胞中miR-1247-3p 表达水平;而miR-1247-3p 高表达逆转了薄荷脑对LPS 诱导的AT-Ⅱ细胞凋亡、炎症反应,表明薄荷脑可调控miR-1247-3p表达。
研究报道FGF-2通过激活PI3K/Akt信号通路减轻肺泡上皮细胞的炎症、氧化应激和细胞凋亡[20]。桑黄素可通过抑制PI3K/Akt/NF-κB 信号通路减轻LPS 诱导的大鼠急性肺损伤[21]。本实验结果显示,薄荷脑处理后的AT-Ⅱ细胞中p-PI3K、p-Akt 蛋白表达水平升高,说明薄荷脑可激活PI3K/Akt 信号通路。此外,miR-1247-3p 高表达逆转了薄荷脑对 p-PI3K、p-Akt蛋白表达的影响。
综上所述,薄荷脑通过miR-1247-3p/PI3K/Akt通路抑制LPS诱导的AT-Ⅱ细胞凋亡和炎症反应。