淀粉型甘薯RS3制备工艺及体外抗消化特性
2023-01-30郝世娟宋静蕾裴家伟郭润芳
郝世娟,宋静蕾,裴家伟,郭润芳
(河北农业大学食品科技学院,河北 保定 071000)
三型抗性淀粉(resistant starch type 3,RS3),又名抗酶解淀粉、难消化淀粉,是将淀粉颗粒在一定温度以下糊化而后在低温下冷却形成,是安全性较高的一种物理变性淀粉[1-2]。由于其热稳定性好、抗酶解以及多种营养保健功能而备受关注[3]。RS3除了具备其他类型抗性淀粉的降血糖血脂[4]、改善肠道微环境[5]、促进有益菌生长[6]及预防疾病[7]等生理功效,还具有结构紧密、热稳定性高、持水性低、色泽白皙、无异味、口感细腻等优势[8],在食品研究与生产中应用潜力大,因此开发不同来源的RS3备受国内外学者和加工企业关注。
甘薯是我国主要的粮食作物之一,含有丰富的营养成分和生物活性物质。甘薯种类较多,有淀粉型、鲜食型、饲用型等不同用途的品种,甘薯生长周期短、价格低廉,工业应用的潜在供应量大、成本低[9]。目前高淀粉型甘薯主要用于生产淀粉,而甘薯淀粉被用于甘薯粉丝(条)加工或被用作食品添加剂,如增稠剂和稳定剂,但由于其具有易降解、稳定性低等特点,在食品加工业有一定局限性。而且甘薯淀粉加工仍处于初级阶段[10],产品形式单一、营养开发不全面、资源浪费严重。甘薯中的直链淀粉含量高达17.5%~26.7%[11],高含量直链淀粉是制备抗性淀粉的前提。利用甘薯淀粉制备RS3,不仅丰富甘薯淀粉加工产品种类、提高甘薯淀粉的附加值,而且也能拓宽其应用范围,对于延长甘薯加工产业链、促进农民增收、企业增效具有重要意义。因此,本研究以淀粉型甘薯为原料,通过单因素试验研究不同处理条件对RS3得率的影响,然后利用响应面分析法优化甘薯RS3制备工艺,并对甘薯RS3的体外消化特性及其结构表征进行分析,为甘薯RS3在食品中的合理应用提供参考。
1 材料与方法
1.1 材料与试剂
甘薯(冀薯98):金沙河集团-红薯岭农业开发有限公司;pH1.5 KCl-HCl缓冲液、pH6.9 Tris-Maleate缓冲液、pH4.75醋酸钠缓冲液:河北农业大学粮油大分子生物加工实验室自制;胃蛋白酶(3 000 U/g):北京索莱宝科技有限公司;α-淀粉酶(10 000 U/g):邢台万达生物科技有限公司;胰酶(4 000 U/g):阿拉丁试剂有限公司;猪胰α-淀粉酶(50 000 U/g):合肥博美生物科技有限公司;糖苷酶(100 000 U/mL)、溴化钾(光谱纯):上海麦克林试剂有限公司;酒石酸钾钠、3,5-二硝基水杨酸、苯酚、亚硫酸钠、浓盐酸(均为分析纯):福晨(天津)化学试剂有限公司;氢氧化钠、氢氧化钾、氯化钙(均为分析纯):天津市大茂化学试剂厂。
1.2 仪器与设备
水浴恒温振荡器(THZ-82A):常州润华电器有限公司;紫外可见分光光度计(UV752N):上海佑科仪器仪表有限公司;环境扫描电镜(Prisma E):北京欧波同光学技术有限公司;傅里叶红外光谱仪(FLAME-NIR):美国海洋光学公司;X-射线扫描(TD-3700):丹东通达科技有限公司。
1.3 试验方法
制备工艺流程:甘薯去皮切块→打浆过滤→滤液冷藏(4℃)静置24 h→弃上清、水洗沉淀→50℃烘干→粉碎过筛→甘薯原淀粉→用水调制淀粉乳→调pH值→压热一定时间→冷却至室温(约25℃)→4℃冷却回生24 h→70℃烘干→粉碎过筛→甘薯RS3粉。
1.3.1 甘薯原淀粉(native starch,NS)的制备
甘薯清洗干净后,去皮切成小块,放入打浆机,加适量蒸馏水后打浆并用纱网过滤,用蒸馏水多次冲洗滤渣直至滤液无白色淀粉颗粒,合并滤液后于4℃冰箱静置24 h,弃去上层液体,沉淀用蒸馏水洗涤2次~3次,同样条件静置,弃上清液,于70℃烘箱烘干后粉碎即为甘薯原淀粉。
1.3.2 甘薯RS3的制备
RS3制备基础条件为12%淀粉乳(甘薯原淀粉/蒸馏水),用KCI-HCI缓冲液调节pH值为7.0,于灭菌锅121℃处理15 min,冷却至室温(约25℃)后,置于4℃冷却回生24 h,70℃烘干后粉碎并过100目筛,即为甘薯RS3。
1.3.3 单因素试验
在基础制备条件下,分别研究淀粉乳浓度(4%、8%、12%和 16%)、pH 值(3、5、7、9和 11)、压热温度(100、110、115、120 ℃)、压热时间(15、25、35、45、55 min)以及冷却回生时间(12、24、36、48、60 h)对 RS3 得率的影响,每个试验重复3次。
1.3.4 响应面试验
通过单因素试验分析,选择对RS3得率影响较大的淀粉乳浓度、pH值、压热温度和压热时间(编号分别为 A、B、C、D)4 个因素作为因子,RS3 得率为响应值,进行响应面优化试验,确定制备甘薯RS3的最优工艺条件,响应面因素水平见表1。

表1 响应面因素水平Table 1 Factors and levels of response surface test
1.3.5 RS3得率的测定
采用 Goñi法[12]结合 3,5-二硝基水杨酸(3,5-dintrosalicylic,DNS)法测定样品中的还原糖含量,再换算成RS3含量,计算公式如下。

式中:W为甘薯RS3得率,%;M为由标准曲线求得的样品中还原糖含量,mg;M0为淀粉样品的干质量,mg。
1.3.6 抗消化特性
1.3.6.1 抗酶解特性
参考Miao等[13]的方法略作修改。分别称取200 mg甘薯NS和RS3,加入20 mL醋酸钠缓冲液(pH4.75)混匀,沸水浴糊化后于90℃水浴保温30 min,取出晾至室温(约25℃)加入5 mL混合酶液(含猪胰α-淀粉酶600 U/mL,糖苷酶 15 U/mL),分别在 0、10、20、30、45、60、90、120、150、180 min 时取出,沸水浴灭酶 10 min后8 000 r/min离心15 min,采用DNS法测定上清液还原糖含量,根据如下公式计算样品中快速消化淀粉(rapidly digestig starch,RDS)、慢速消化淀粉(slowly digestig starch,SDS)和抗性淀粉(resistant starch,RS)含量及各个时间段的水解率。

式中:G0、G20、G120分别为消化 0、20、120 min 时释放的还原糖含量,mg;Gt为t时刻上清中还原糖含量,mg;TS为总淀粉质量,mg;m 为淀粉样品质量,mg。
参照Goñi等[14]的方法,0~90 min计算样品的水解指数(hydrolysisindex,HI)和预测血糖指数(forecast glycemic index,eGI),HI以葡萄糖为参比样品。计算公式如下。

1.3.6.2 体外模拟消化
3种消化液(人工唾液、人工胃液、人工小肠液)及三段式体外消化模型参考Bornhorst等[15]的方法并略作修改。分别称取100 mg甘薯NS和RS3样品于1号~14号离心管中,加入1 mL蒸馏水混匀,沸水浴糊化后于90℃水浴中保温30min,取出冷却至室温(约25℃),用超声波粉碎仪粉碎;口腔段消化:加入1 mL人工唾液,37℃水浴振荡90 s,取出1号管;胃部消化:2号~14号管立即用2mol/L盐酸调节pH值至2.0,加入2mL人工胃液,37℃水浴振荡1h,分别在20、40、60min时取出2号~4号管;小肠段消化:5号~14号管用0.5 mol/L NaOH溶液调节pH值至7.0,加入4 mL人工小肠液,37℃水浴振荡 3h,分别在 10、20、30、40、50、60、90、120、150、180 min时取出;每次取出离心管后立即沸水浴灭酶10 min,8 000 r/min离心15 min,用DNS法测定上清液中还原糖含量,计算样品水解率和经不同部位消化后的失重率,计算公式如下。
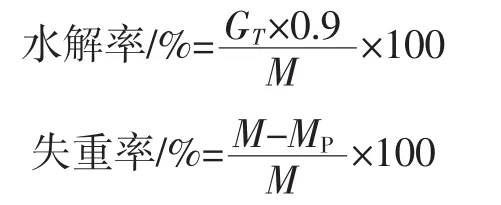
式中:GT为T时刻上清液中还原糖含量,mg;M为样品质量,mg;MP为经不同部位消化后的剩余淀粉质量,mg。
1.3.7 结构表征
1.3.7.1 扫描电镜(scanning electron microscope,SEM)检测
将干燥NS、RS3样品均匀分散在粘有导电胶的载物台上,真空条件下喷金固定120 s后在扫描电镜中观察,分别拍摄放大600×、5 000×的清晰照片。
1.3.7.2 傅里叶红外光谱(Fourier transform infraredv spectrometer,FT-IR)检测
将干燥的NS、RS3样品分别与溴化钾以1∶100质量比研磨后压片测试,溴化钾为背景,扫描范围4 000 cm-1~400 cm-1,分辨率 4 cm-1。
1.3.7.3 X-射线衍射(X-ray diffraction,XRD)测定
将NS、RS3粉末放入样品槽铺平,置于样品台进行扫描,采用Cu-Ka靶,设置电压25 kV,步长0.02 s,测量角度2θ为4°~40°,根据如下公式计算结晶度(Xc)[16]。
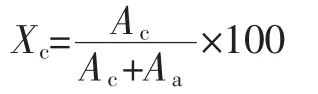
式中:Ac为结晶区面积;Aa为非晶区面积。
1.4 数据处理
采用SPSS 17.0软件进行方差分析和最小显著性检验(least significant difference,LSD),Origin 2019软件绘图,利用软件Design-expert 8.0中的Box-Behnken Design设计法对29个试验组合进行回归分析拟合,所有的试验数据均为3次重复试验的平均值。
2 结果与分析
2.1 单因素试验结果
不同因素对RS3得率的影响见图1。

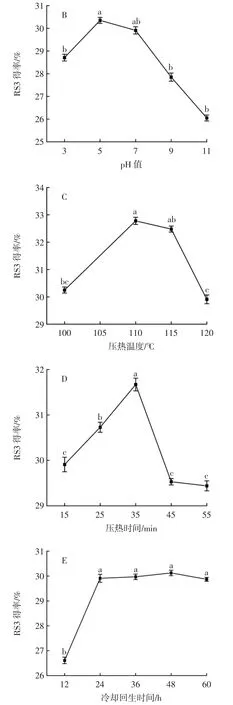
图1 不同因素对RS3得率的影响Fig.1 Effect of different factors on the extraction yield of RS3
2.1.1 淀粉乳浓度对RS3得率的影响
由图1A可以看出,RS3得率随淀粉乳浓度的增大先升高后降低,淀粉乳浓度为12%时得率最大,为(29.91±0.16)%,淀粉乳浓度过高过低均会影响RS3得率,因此选择8%、12%和16%进行后续的响应面优化试验。
2.1.2 pH值对RS3得率的影响
由图1B可以看出,RS3得率随pH值的增大先升高后降低,pH5时得率达到最高值(30.35±0.12)%,明显高于其他pH值。因此选择pH3、5、7进行后续响应面优化试验。
2.1.3 压热温度对RS3得率的影响
由图1C可知,随着压热温度的升高,RS3得率增大,在 110℃时达到最大值(32.78±0.13)%,当温度升高到115℃时,RS3略有减少,120℃时显著降低(p<0.05)。适宜的压热温度有助于淀粉糊化,强化RS3的生成,然而当压热温度过高时,会使淀粉颗粒破裂,淀粉分子逸出,导致螺旋结构中的部分氢键断裂,范德华力被削弱[17],难以形成RS3。综合考虑,选择100、110、120℃进行后续的响应面优化试验。
2.1.4 压热时间对RS3得率的影响
由图1D可以看出,在一定的时间内,RS3得率随着压热时间的延长而升高,这可能是由于直链淀粉逐渐释放,分子之间相互接近易于形成RS3,35 min后继续延长压热时间,RS3得率降低。因此,压热时间为35 min时效果最好,选择25、35、45 min进行后续的响应面优化试验。
2.1.5 冷却回生时间对RS3得率的影响
由图1E可以看出,冷却回生时间低于24 h时,RS3得率增长明显,超过24 h后,RS3得率增长缓慢,在48 h得率最高,这种变化符合晶核形成理论[18]。因此,考虑到经济效益的问题,后续的响应面优化试验冷却回生时间选择24 h。
2.2 响应面试验
2.2.1 响应面试验结果及方差分析
制备工艺Box-Behnken试验设计及结果见表2。

表2 制备工艺Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken test for extraction process

续表2 制备工艺Box-Behnken试验设计及结果Continue table 2 Design and results of Box-Behnken test for extraction process
采用Box-Behnken中心组合设计法对29组试验数据进行回归分析,得到回归方程:得率=38.31+1.85A+0.016B-1.85C+0.65D+1.62AB-0.32AC-0.75AD-1.74BC-0.30BD+0.54CD-3.47A2-2.52B2-4.51C2-2.31D2。该方程的校正决定系数R2=0.951 0,说明该模型能精确预测响应值。方差分析见表3。

表3 方差分析Table 3 Analysis of variance

续表3 方差分析Continue table 3 Analysis of variance
由表3可知,影响甘薯RS3得率大小的因素依次为压热温度>淀粉乳浓度>压热时间>pH值;利用De sign-expert软件的响应面结果预测得到甘薯RS3的最优制备工艺条件为淀粉乳浓度13%、pH5.38、压热温度107.5℃、压热时间35.47 min,此条件下RS3得率为38.86%。
2.2.2 最优工艺条件验证
考虑到实际操作条件,将预测的工艺参数调整为淀粉乳浓度13%、pH5.5、压热温度110℃、压热时间35 min,此条件下进行3组重复试验,得到RS3得率为37.94%,与预测值仅相差0.92%,表明实际试验结果与预测值接近,表明采用响应面法优化甘薯RS3的制备工艺具有可靠性。
2.3 抗消化特性测定结果
2.3.1 抗酶解特性
RS3、NS的消化水解率见图2。NS和RS3中的RDS、SDS、RS含量、HI、eGI以及三段式消化失重率见表4。

表4 NS和RS3中的RDS、SDS、RS含量、HI、eGI以及三段式消化失重率Table 4 RDS,SDS and RS content,HI,eGI and three-stage digestion weight loss of NS and RS3
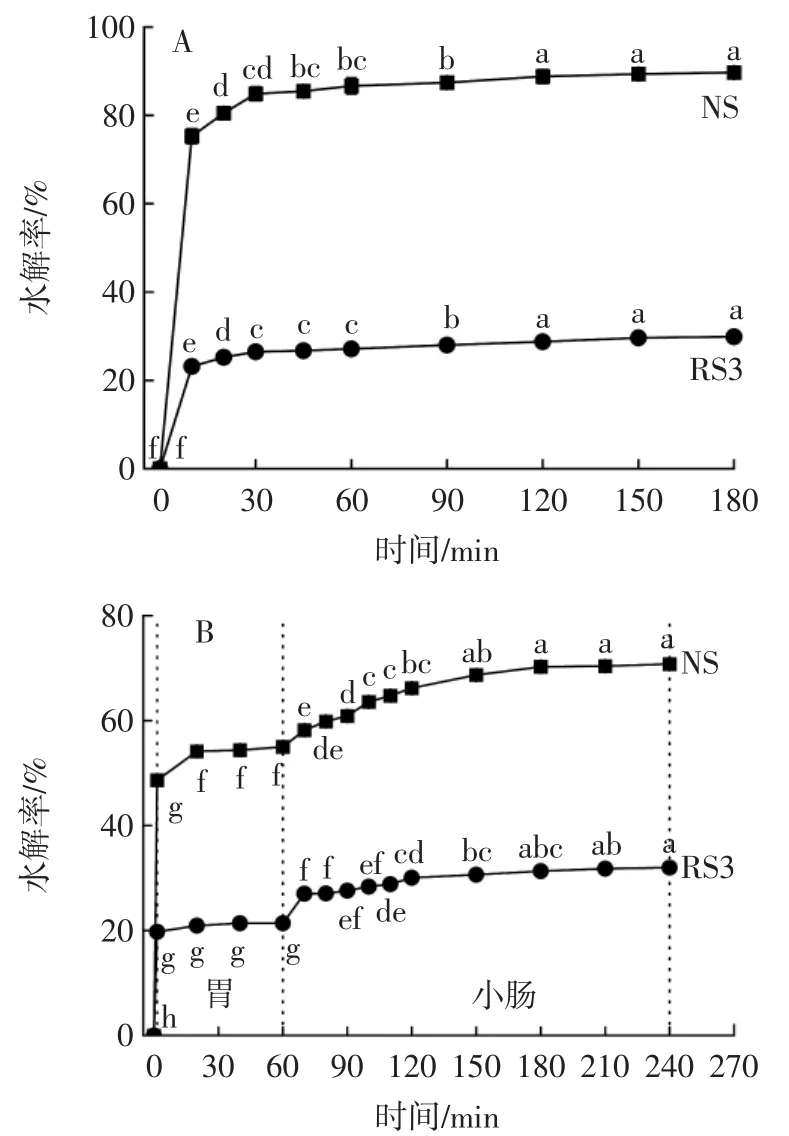
图2 RS3、NS的消化水解率Fig.2 Digestible hydrolysis rate of RS3 and NS
淀粉根据其水解速率可分为快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)[19]。由图2A可以看出,前20 min内酶解快速,RS3的水解率为24.31%,对照NS的水解率达到81.52%,此部分属于快速消化淀粉RDS;超过20 min后水解速率增长缓慢并在120 min后趋于平稳(p>0.05),整体来看,RS3的水解率(31.43%)远低于对照NS(90.42%),可见RS3主要成分是抗性淀粉,而甘薯原淀粉NS中主要是快速消化淀粉RDS(表4),这可能与其形态结构有关,原淀粉的无定形结构更容易被α-淀粉酶降解[20];而RS3为B+V型结晶,双螺旋程度和结晶度高,结构紧密,α-淀粉酶无法进入结晶区内部水解其中的α-1,4糖苷键。甘薯NS的eGI为83.49,RS3为53.71,根据Jenkins等[21]提出的概念,甘薯天然淀粉为高血糖指数食品(eGI>70),RS3为低血糖指数食品(eGI<55),因此,RS3在进入人体后具有较慢的消化吸收速率,不会引起血糖迅速升高,有利于餐后血糖平稳。
2.3.2 体外模拟消化
图2B显示,RS3和NS在口腔的水解率分别为19.77%和48.65%;进入胃部消化后,pH2的环境抑制了α-淀粉酶的活力,RS3和NS在胃部消化后与口腔消化后失重率差值仅为0.5%和1.0%;在进入小肠后的水解率基本稳定,RS3和NS在240 min时消化率分别为31.99%和70.77%,且RS3在口腔、胃部、小肠段消化的失重率均小于NS,RS3展现出比NS更强的抗消化性,这与样品的酶解特性结论一致。结果表明,甘薯RS3可以抵抗小肠中消化酶的消化而进入结肠,具备在结肠被发酵、充当益生元的潜能。
2.4 结构特性
2.4.1 扫描电镜观察
图3分别为两种淀粉放大600倍和5 000倍的扫描电镜图。


图3 NS、RS3的扫描电镜图Fig.3 SEM images of NS and RS3
如图3所示,RS3和甘薯原淀粉NS的颗粒形态差异明显,NS多为表面光滑,球形或近球形,而甘薯RS3多为不规则块状,且表面凹凸不平,颗粒相对较大。这是因为在压热法制备RS3的过程中,直链淀粉浸出,在冷却回生过程中重新结合而失去了支链淀粉结晶区[22],纯化过程中α-淀粉酶除去其表面的直链淀粉和支链淀粉,形成层状条带[23],RS3的紧密结构使其具有更强的抗酶解性。
2.4.2 X-射线衍射
NS、RS3的X-射线衍射图谱见图4。
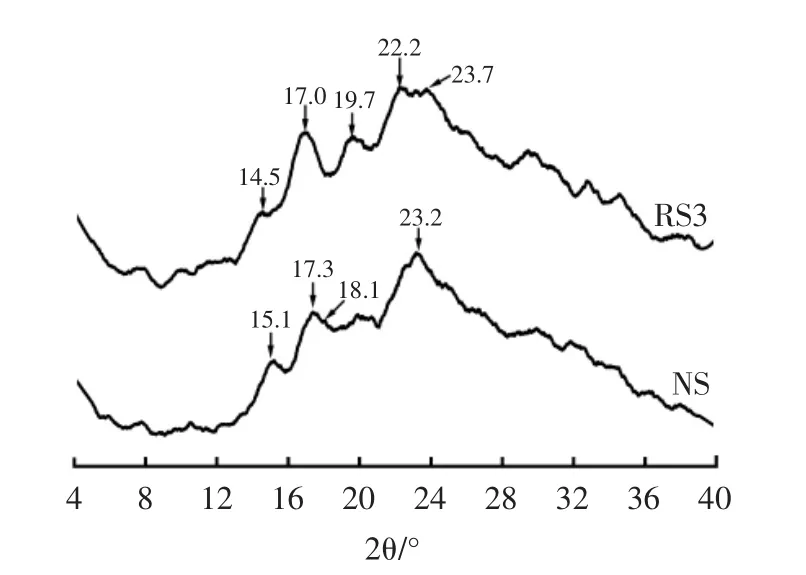
图4 NS、RS3的X-射线衍射图谱Fig.4 X-ray diffraction pattern of NS and RS3
淀粉由无定形、亚结晶和结晶结构组成[24],XRD衍射图谱中的衍射峰可反映淀粉的无定形结构和微晶结构。如图 4 所示,RS3 在 14.5°、17.0°、22.2°、23.7°处产生衍射峰,为典型的B型结晶,结晶度为22.87%;NS在 15.1°、17.3°、18.1°和 23.2°出现明显的衍射峰,天然的甘薯淀粉为A型结晶,结晶度为18.41%,说明压热冷却回生处理可促使甘薯淀粉由A型向B型结晶转变,并伴有部分V型结晶形成,这与Guo等[25]的报道一致;不同晶型酶解性能不同,其中A型淀粉抗酶解能力最弱,V型结晶抗酶解能力最强[26],这也是甘薯RS3具有更强抗消化能力的原因。
2.4.3 傅里叶红外光谱
RS3、NS的红外光谱图见图5。NS和RS3的DO、DD值以及结晶度见表5。
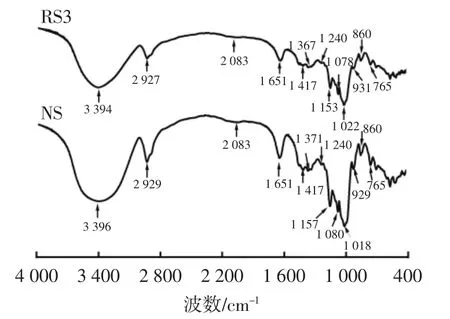
图5 RS3、NS的红外光谱Fig.5 Infrared spectrogram of RS3 and NS

表5 NS和RS3的DO、DD值以及结晶度Table 5 DO,DD values and crystallinity of NS and RS3
由图5可知,相较于原淀粉NS,RS3的红外光谱图中个别吸收峰发生位移,如NS中1 080、1 157 cm-1处的吸收峰转变为RS3中的1 078、1 153 cm-1处吸收峰,说明甘薯淀粉经过压热后伯-仲醇羟基相连的C-O和吡喃糖环的C-O发生了伸缩振动。经过压热后的淀粉在1 022、1 153、1 240 cm-1处吸收强度增加,说明这两个键收缩振动加强;波长1 050 cm-1~950 cm-1与淀粉的有序和非晶结构有关[27],其中1 047、1 022 cm-1和995 cm-1为反映淀粉结构变化的3个主要吸收峰,常用DO值和DD值来表示淀粉颗粒的有序度和双螺旋结构程度[28],如表5所示,压热处理使淀粉颗粒脱支糊化、导致有序度降低,直链淀粉在低温下重新聚集成更为紧密的双螺旋结构,从而抵抗酶解消化。
3 结论
本文以甘薯淀粉为原料,采用压热法制备抗性淀粉RS3,通过单因素和响应面优化试验得出,影响甘薯RS3得率大小的因素依次为压热温度>淀粉乳浓度>压热时间>pH值。利用压热法制备甘薯RS3的最优工艺条件为淀粉乳浓度13%、pH5.5、压热温度110℃、压热时间35 min,然后冷却至室温(25℃)后,置于4℃冷却回生24 h,此条件下的RS3得率为37.94%,与预测值接近;经过压热回生处理后,RS3结晶度提高,结构更加紧密,因此比NS更能抵抗酶的水解;RS3酶解120 min仍保留31.43%,属于抗性淀粉,经过模拟口腔、胃部、小肠消化,失重率为31.99%,而保留下来的抗性淀粉能够进入结肠发挥作用;本研究建立的甘薯抗性淀粉RS3制备工艺易于实现规模化操作,得率高,抗性淀粉含量高,抗消化能力强,在甘薯深加工产业以及食品配料中的应用前景广阔。
