香菜CsEF-1α基因克隆与表达分析
2023-01-04谢芳杰轩正英王新建吴翠云杜红斌
谢芳杰,轩正英,张 娟,王新建,2,3,吴翠云,2,3,杜红斌*
(1 塔里木大学 园艺与林学学院,新疆阿拉尔 843300;2 塔里木大学 南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆阿拉尔 843300;3 塔里木大学 新疆生产建设兵团塔里木盆地生物资源保护利用兵团重点实验室,新疆阿拉尔 843300)
蛋白质的生物合成是需要启动因子、延伸因子、终止因子、核糖体等许多大分子共同作用的复杂生理过程[1-2]。在真核生物中,延伸因子分为EF-1和EF-2。其中EF-1(elongation factor 1)包括α、β和γ等3个亚基[3]。EF-1作为重要的翻译因子,携带GTP蛋白催化氨酰基-RNA与核糖体上A位点的结合促进肽链的延伸,从而调控蛋白质的合成[4-5]。EF-1α是真核生物中较多的一类蛋白,仅次于肌动蛋白,目前在拟南芥、大豆、牵牛花和番茄等多种植物中已被分离[6-7],且植物间EF-1α氨基酸序列具有较高的保守性,因此被广泛用于不同作物研究的内参基因。如朱海生等[8]研究发现CmEF-1α基因在印度南瓜不同组织和不同胁迫处理下均能稳定表达。Zi等[9]研究发现在白桦不同组织中EF-1α是最稳定的内参基因。武志娟等[10]在大针茅根中发现最稳定的内参基因组合为18S rRNA和EF-1α。在水稻根中,OsEF-1α的稳定表达量最高[11],与甘蔗在盐度和干旱胁迫下的表达结果一样[12]。
随着越来越多物种的EF-1α基因的挖掘和鉴定,发现EF-1α是一种多功能蛋白,与其他蛋白互作调控植物生长发育。如ZmEF-1α可以在特定pH条件下(6.0-8.0)与肌动蛋白相互作用,调节植物细胞生长过程[13]。范心诚[14]研究发现,EF-1α在矮牵牛根茎叶中都有表达,且沉默EF-1α导致植株部分叶片出现畸形坏死的现象。EF-1α不仅参与植物病毒的复制和繁殖、介导细胞凋亡和早叶衰老等,还调控非生物应激反应。如Wang等[15]发现OsEF-1α通过增强先天免疫相关受体基因的表达和不可控地激活某些信号分子,提高对稻瘟病菌和黄单胞菌的抗性。拟南芥AtEF-1α敲除对NaCl胁迫表现出更高的敏感性,而过表达AtEF-1α植物对盐的耐受性更高[16]。干旱和盐胁迫下可大量诱导大豆GmEF-1α的积累[7]。以上研究表明,EF-1α基因可能在非生物胁迫期间对翻译的调节起重要作用。
香菜(CoriandrumsativumL.)别名芫荽,为伞形科芫荽属一、二年生草本植物,嫩茎和鲜叶有特殊浓厚的芳香气味,具有较高的食用和药用价值。香菜发育过程中,涉及到形态、生理生化和遗传等多方面的变化。目前,国内外有关香菜研究的报道多集中在栽培技术、有效物质的提取、功能及作用机制等方面[17]。而EF-1α基因对香菜生长发育的调控机理还未揭示。本研究利用RT-PCR技术克隆香菜中延伸因子EF-1α基因,结合生物信息分析方法对EF-1α基因进行分析,并利用qRT-PCR技术研究该基因在不同发育时期和非生物胁迫下的表达变化,旨在为进一步研究香菜的分子机制奠定基础。
1 材料和方法
1.1 植物材料与RNA提取
香菜种植于塔里木大学园艺试验站教学实践基地,常规管理。待香菜生长至30,60和90 d时取地上部分作为实验材料,分别命名为S1、S2和S3时期,用于检测不同发育时期基因表达量。香菜生长至5~7片叶时,分别进行低温(4 ℃)、高温(38 ℃)、干旱(10% PEG-8000)、高盐(200 mmol·L-1NaCl)胁迫处理,各处理0、2和10 h,每个样品设3次生物学重复,取香菜地上部分,经液氮速冻后按照RNA提取试剂盒(Tsingke,北京)说明书的步骤从香菜中提取总RNA,用1%琼脂胶检测所有样品RNA的完整性。随后,利用反转录试剂盒(Tsingke,北京)将提取的总RNA取1 μg进行反转录得到cDNA,保存在-20 ℃冰箱中备用。
1.2 方 法
1.2.1 基因克隆从香菜转录组数据中,筛选到一个在不同发育时期差异表达的EF-1α基因(Cs08G01350)。从香菜基因组数据中找到该基因序列,利用Primer Premier 6.0软件设计,CsEF-1α基因引物(F:5′-ATGGGTAAGGAAAAGATTCATATC-3′;R:5′-TCACTTCTTCTTGATGGCAGC-3′),以反转录cDNA为模板,用EasyTaqDNA聚合酶(TransGene,北京)进行PCR扩增。反应过程:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后延伸72 ℃延伸10 min。经1%琼脂糖电泳检测PCR扩增产物后确定条带大小正确,PCR产物切胶回收后连接到pEASY-T1克隆载体(Tsingke,北京)上送至擎科生物有限公司测序。
1.2.2 香菜CsEF-1α基因生物信息学分析利用在线工具ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对CsEF-1α基因进行翻译获得其蛋白序列。ProtParam(http://web.expasy.org/protparam/)对CsEF-1α蛋白的氨基酸序列、蛋白质分子量、原子总数、分子式、理论等电点、稳定性指数和疏水性进行预测和分析。利用NCBI数据库的Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)查找与CsEF-1α基因同源的其他物种的相关序列,并用DNAMAN蛋白序列同源性分析,利用MEGA 5.0软件中Neighbor-Joining(NJ)法构建进化树。用SOPMA进行分析基因的二级结构。通过在线软件phyre(http: //www.sbg.bio.ic.ac.uk/)对EF-1α基因的三级结构进行预测。利用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),分析启动子序列上的顺式作用元件。利用WoLF PSORT对EF-1α进行亚细胞定位分析进行[18]。
1.2.3 基因表达分析利用Primer Premier 6.0设计基因特异引物(F:5′-CCACCCTGGTCAGATTGGAAACG-3′;R:5′-GCCTCATGTCTCGCACAGCAA-3′)。以DNAJ为内参基因,引物序列为(F:5′-CACGAGTGTGCCAAGCAGTTCTT-3′;R:5′-CCTTCACGGCGGAGACTGTTCT-3′)。反转录产物稀释10倍作为qRT-PCR反应模板。qRT-PCR采用Bio-Rad-CFX96TM实时PCR系统(Bio-Rad,CA,USA)和2×T5 Fast qPCR Mix(SYBR Green I)(TransGene,北京)。每个反应3个技术重复。每个反应体系为20 μL,包括10 μL SYBR Green I mix,上下游引物各0.4 μL,稀释后的cDNA 2.0 μL,dd H2O 7.2 μL。PCR程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火和延伸30 s,共40个循环。溶解曲线分析从65 ℃到95 ℃。以Ct值为纵标,对基因表达水平使用2-ΔΔCt法进行数据分析[19]。
2 结果与分析
2.1 香菜EF-1α基因的克隆
基于香菜基因组和转录组数据库,以香菜叶片cDNA为模板,设计引物PCR扩增得到目的基因(图1),条带大小为1 344 bp,与预期长度一致,将其命名为CsEF-1α基因(GenBank登录号为OL962478)。
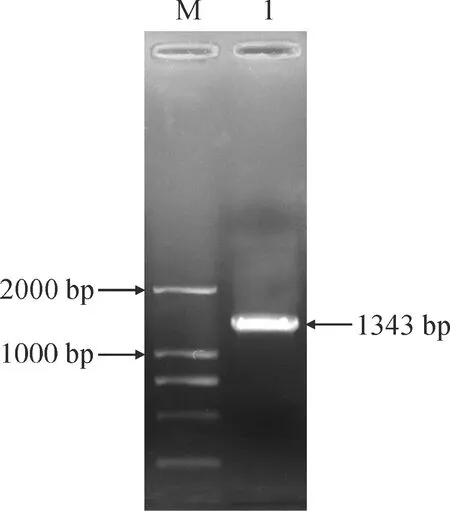
M. DNA Marker 2000; 1. CsEF-1α图1 CsEF-1α基因扩增Fig.1 Amplification of CsEF-1α gene
2.2 CsEF-1α基因编码蛋白质的理化性质分析
由图2可知,CsEF-1α基因包含一个1 344 bp的完整开放阅读框,预测编码447个氨基酸,原子总数为7 004,分子式为C2202H3544N594O644S20,蛋白质分子量为49.29 kD,等电点为9.12,属于碱性蛋白。如图2所示,该基因的氨基酸序列分别由赖氨酸(Lys,49个,占11.0%)、甘氨酸(Gly,38个,占8.5%)、缬氨酸(Val,37个,占8.3%)、色氨酸(Trp,3,占0.7%)等20种氨基酸组成。其中,赖氨酸数量最多,色氨酸数量最少。进一步分析发现,共有76个碱性氨基酸和78个酸性氨基酸。CsEF-1α蛋白质的总平均疏水性(GRAVY)为-0.273,预测为亲水性蛋白质,蛋白质不稳定系数为30.21,脂溶性指数为84.16,是稳定性蛋白。

图2 CsEF-1α蛋白的氨基酸序列组成Fig.2 Amino acid sequence composition of CsEF-1α protein
2.3 二级结构和亚细胞定位分析
如图3所示,二级结构预测分析发现CsEF-1α蛋白的高级结构以无规则卷曲和α-螺旋为主,分别占36.91%和30.43%,其中β转角所占比例10.74%。利用WoLF PSORT网站对CsEF-1α亚细胞定位预测,发现CsEF-1α基因编码的蛋白定位于细胞质。CsEF-1α蛋白主要由无规则卷曲和α螺旋构成,预测分析结果与二级分析结果一致(图4)。
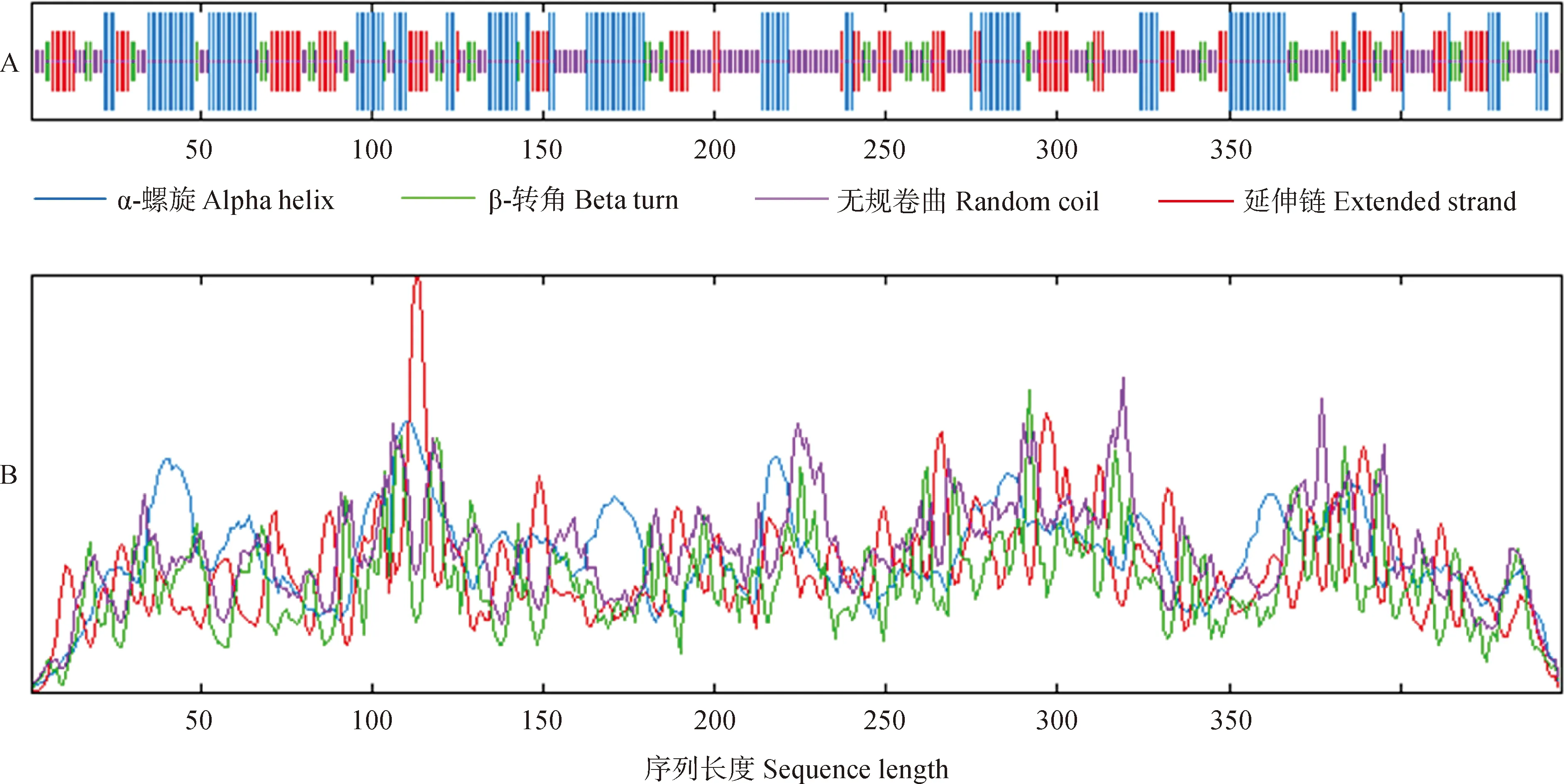
A. CsEF-1α蛋白二级结构类型;B.二级结构曲线趋势图3 CsEF-1α蛋白的二级结构A. Prediction of secondary structure types of CsEF-1α protein; B. Secondary structure curve trendFig.3 Prediction of secondary structure of CsEF-1α protein
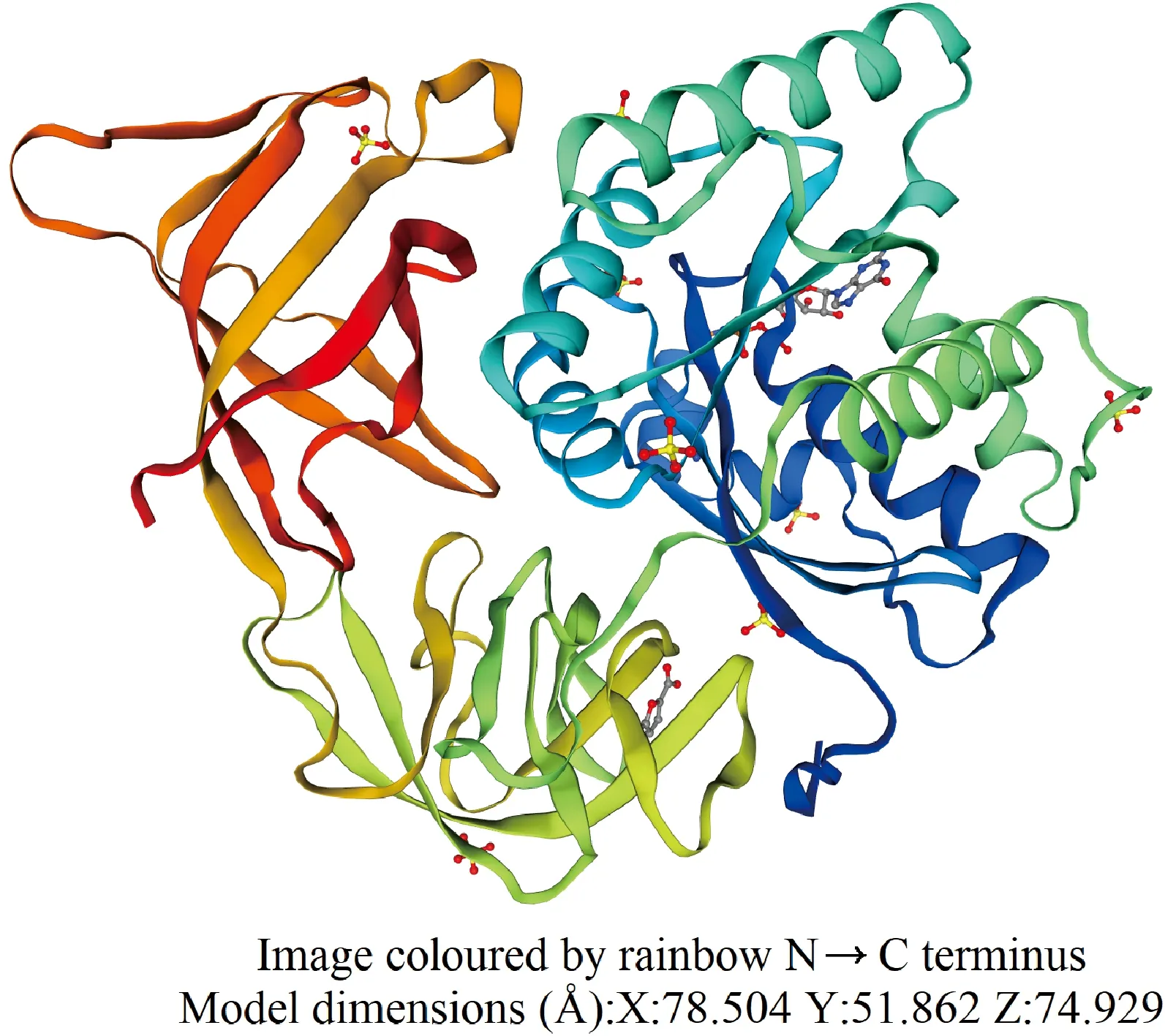
图4 CsEF-1α蛋白质三级结构Fig.4 Tertiary structure of CsEF-1α protein
2.4 CsEF-1α蛋白质的同源比对和进化分析
将香菜CsEF-1α基因编码的蛋白质与其他植物EF-1α同源性比对。结果发现,CsEF-1α与其他植物EF-1α氨基酸具有较高相似性,仅有少数氨基酸差异(图5)。其中,与胡萝卜(Daucuscarota,XP_017247334.1)、蓖麻(Ricinuscommunis,XP_002518073.1)和玉米(Zeamays,NP_001338678.1)等氨基酸序列相似性分别为99.78%、95.96%和95.97%,推测他们可能具有相同的生物学功能。为进一步明确香菜CsEF-1α的功能与进化关系,利用MEGA 5.0软件对与CsEF-1α相似的蛋白序列对比(图6)。结果表明,CsEF-1α与胡萝卜、野生番茄、青蒿素和非洲菊的亲缘关系较接近,与博落回、睡莲、蓖麻和巨桉等其他物种亲缘关系较远。

图5 香菜CsEF-1α与其他植物EF-1α蛋白同源序列比对Fig.5 Alignment of homologous sequences between CsEF-1α and other plant EF-1α proteins
2.5 启动子分析
启动子区的顺式作用元件可调控基因的转录活性,通过分析顺式作用元件组成,可了解基因的功能及其表达潜力。利用在线软件PLANTCARE分析了香菜EF-1α基因的启动子序列。结果发现10种顺式元件,包括4种植物生长发育元件、3种激素响应元件、3种胁迫响应元件(表1)。其中生长发育元件在3种元件占了最大的比例,共有6个顺式作用元件,其中光敏元件GATA-motif和G-Box分别含有2个,I-box和TCT-motif分别含有1个。在激素相关元件中,发现ABA响应元件(ABRE)2个,赤霉素响应元件(GARE-motif)2个,水杨酸响应元件(TCA-element)1个。CsEF-1α基因启动子中检测到2个厌氧诱导元件(ARE)、1个应激反应元件(STRE)、1个干旱诱导元件(W-box),总的来说,这些结果推测CsEF-1α可能参与了香菜对生长发育和非生物胁迫的响应。
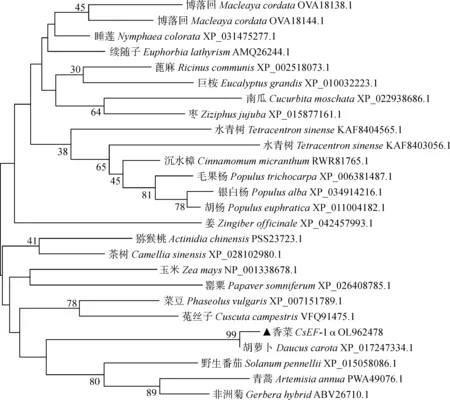
图6 基于26个不同科属EF-1α蛋白氨基酸序列构建的进化树Fig.6 The phylogenetic tree constructed based on the amino acid sequences of EF-1α proteins from 26 different families and genera
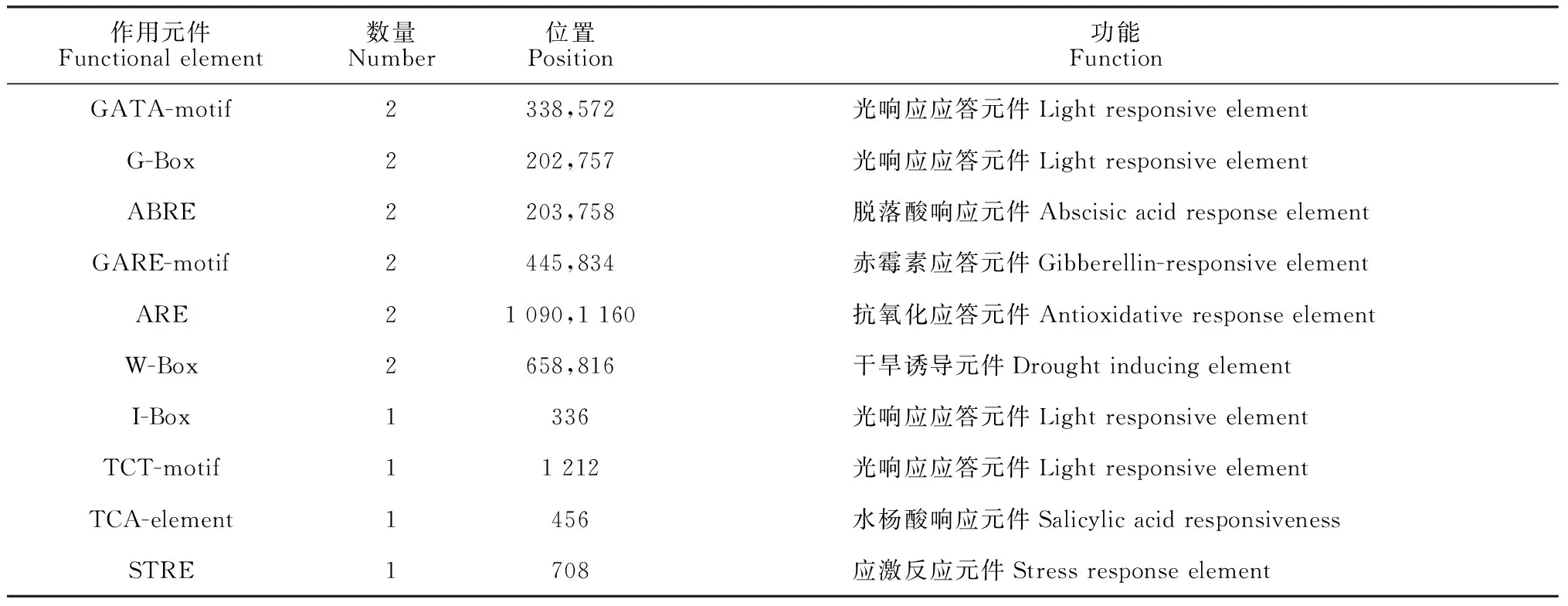
表1 CsEF-1α基因启动子区顺式调控元件分析
2.6 香菜CsEF-1α基因不同发育时期表达模式分析
本研究结合转录组数据,并且利用qPCR验证香菜CsEF-1α基因不同发育时期表达模式分析。如图7所示,从S1到S3阶段,CsEF-1α基因转录丰度增加。随着香菜生长时期的增加,CsEF-1α基因表达量表现出升高趋势,其中S1到S2时期基因表达量上升幅度最大,S2到S3上升幅度较小,该实验结果与转录组数据保持良好的一致性。
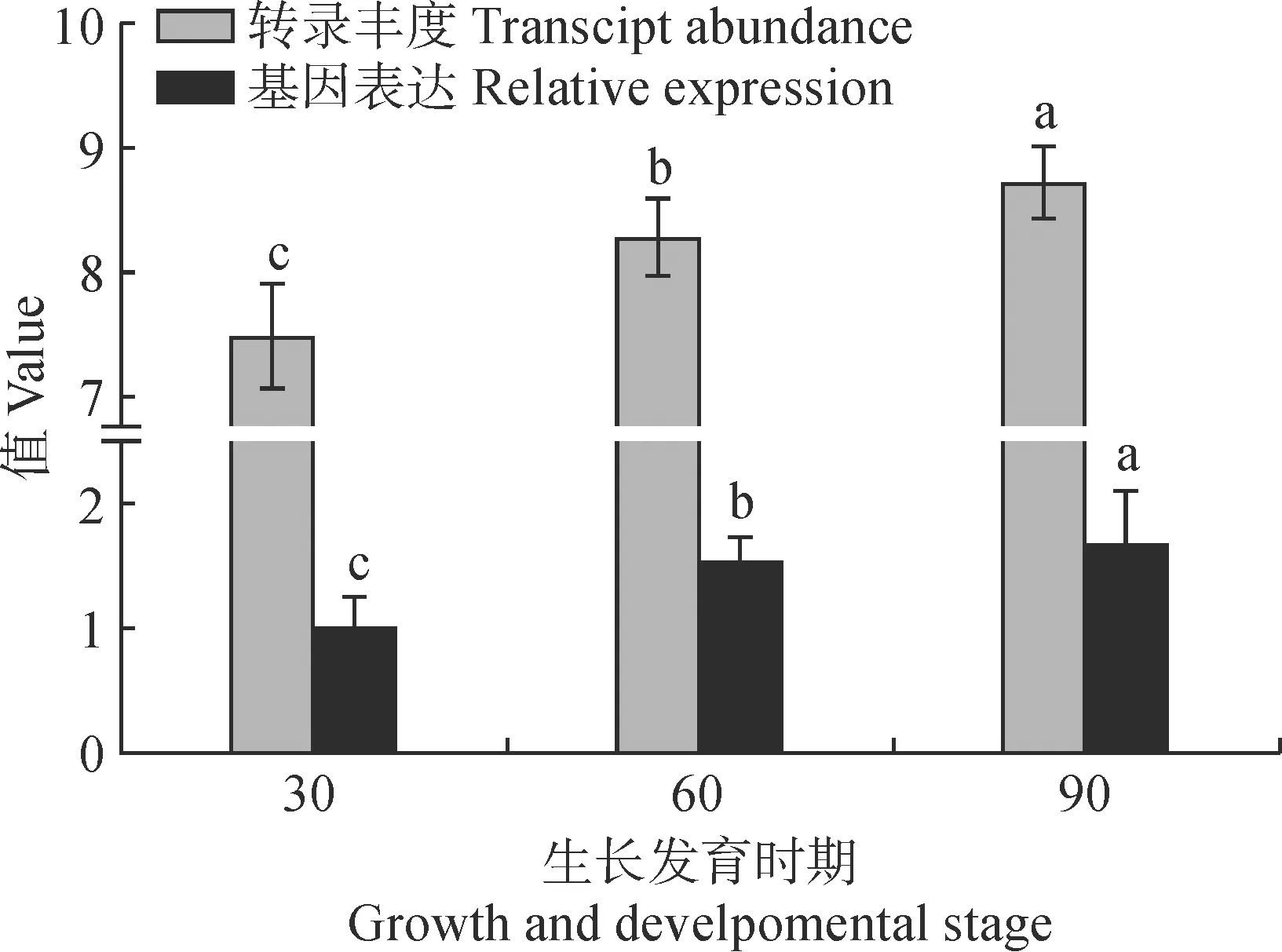
不同小写字母表示基因在不同发育时期下的相对表达差异显著(P<0.05)图7 香菜CsEF-1α基因不同发育时期的转录本丰度和qPCR分析The different normal letters indicate the relative expression of gene at different development stages is significantly different (P<0.05)Fig.7 Transcript abundance and qPCR analysis of coriander CsEF-1α gene at different developmental stages
2.7 香菜CsEF-1α基因非生物逆境诱导表达模式分析
为明确香菜CsEF-1α基因香菜抵御非生物逆境胁迫中应答机制,本研究利用qRT-PCR技术检测CsEF-1α在不同胁迫下的表达模式。结果表明(图8),在不同诱导模式下,CsEF-1α基因均有不同程度的表达。与CK相比,随着盐胁迫(NaCl)时间增加,CsEF-1α基因表达量表现先升高再降低的趋势,处理2 h时,CsEF-1α基因的相对表达量升高,是CK的1.2倍,而处理10 h后,基因表达量反而呈现下降趋势,较CK下降了50%。而在其他3种胁迫处理下,随着胁迫时间的增加,CsEF-1α基因表达量表现出先下降再升高的趋势。其中低温处理2 h时,基因表达量显著下调,较CK下降了70%,当处理10 h后,CsEF-1α基因表达量升高,与CK几乎一致。干旱胁迫2 h后,CsEF-1α基因表达量较CK下降了40%。处理10 h,该基因表达量与CK一致。高温胁迫2 h后,CsEF-1α基因表达量较CK下降了30%。表明CsEF-1α基因参与了香菜对非生物胁迫的应答,在香菜生长发育和非生物胁迫中具有重要调控作用。
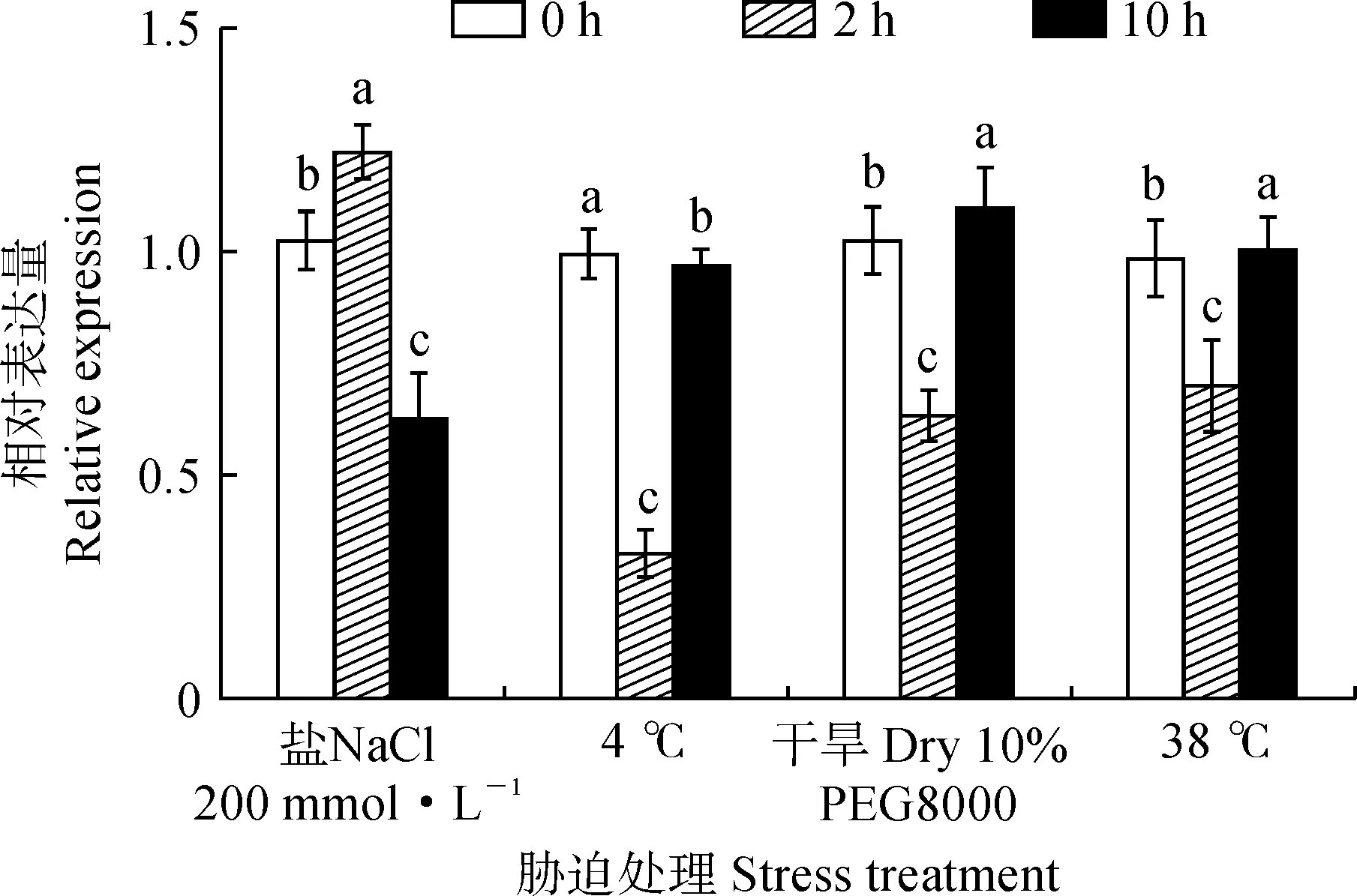
不同小写字母表示基因在同一胁迫处理不同时间的基因表达差异显著(P<0.05)图8 CsEF-1α基因在不同非生物胁迫条件下的表达分析Different normal letters indicate significant difference of gene expression levels at different time points under same stress (P<0.05)Fig.8 Expression analysis of CsEF-1α gene under different abiotic stress conditions
3 讨 论
EF-1α参与植物体内蛋白质的生物合成,同时是构成细胞骨架的一种高度保守蛋白,在细胞中发挥着重要作用[20-21]。EF-1α参与植物生长发育,且植物间EF-1α在非生物胁迫下表达模式有所差异。本研究中获得的香菜CsEF-1α基因,编码的蛋白序列中赖氨酸数量最多。有研究表明,EF-1α与玉米胚乳赖氨酸含量高度相关,在高粱和大麦中同样如此[22]。本研究推测CsEF-1α可能与赖氨酸关系密切。CsEF-1α与其他EF-1α保守型较高,表明植物间在进化过程中具有较高的保守性,暗示EF-1α基因可能具有相似性。
为了解CsEF-1α的功能,对该基因启动子序列进行了系统的分析。结果发现CsEF-1α含4种植物生长发育元件、3种激素响应元件和3种胁迫响应元件,推断该基因可能参与生长发育的调控网络,并能够对逆境胁迫作出应答。因此,结合qPCR分别检测了香菜中CsEF-1α基因在不同发育时期和非生物胁迫下的表达情况。CsEF-1α基因随着发育时期呈现不断升高趋势。其中在30~60 d时,CsEF-1α基因表达量快速升高,与棉花纤维早期发育中的GhEF-1α基因表达结果研究一致[23]。推测香菜在此生长阶段,体内细胞数量分裂和体积膨大速度加快,需要诱导大量的延伸因子来翻译合成蛋白质,满足香菜形态建成和能量代谢。在生长期60~90 d时,CsEF-1α表达量缓慢上升,可能由于香菜此阶段生长缓慢并趋于成熟,蛋白质合成速度变慢,延伸因子需求量降低。由此可见,EF-1α可与蛋白质互作,参与植物细胞骨架的形成及生长发育蛋白质的合成。
香菜CsEF-1α基因响应4种非生物胁迫且表达模式有所差异,尤其能够响应低温和盐胁迫,这与Li等[24]在盐胁迫中能够明显诱导水稻EF-1α基因和张妮[25]对香蕉苗胁迫处理研究结果相似。早期有报道称EF-1α在大麦和玉米中表达与冷胁迫相关[26-27]。Chung等[28]利用减法抑制杂交技术分离出低温、高盐或干旱胁迫诱导的大豆EF-1α基因,认为EF-1α可能在非生物胁迫下的翻译调控中发挥重要作用。孙伟等[29]发现盐地碱蓬SsEF-1α基因可以被高盐、高渗和低温胁迫等条件诱导。综上,在其他植物中EF-1α基因在非生物胁迫下均会被诱导表达,这和本研究结果有一定的相似。有研究表明,当植物受到逆境胁迫时,可能通过诱导或降低基因的表达量来控制蛋白的活性,以缓解或提高对逆境胁迫的抵抗能力[30-32]。以上结果推测CsEF-1α基因参与了香菜的非生物胁迫,这可能是由于香菜受到逆境胁迫后,细胞为了抵御胁迫带来的伤害会及时调整细胞内基因组的表达结构,启动子响应非生物胁迫元件来调控CsEF-1α基因的表达,影响转录水平或mRNA的稳定性,在细胞内短期大量合成多种抗逆蛋白,从而参与植物的各种防卫反应,并调节植物的各个生长发育阶段和代谢功能。但该基因在香菜中生长发育以及逆境胁迫中的作用机制仍需进一步探究。综上所述,EF-1α基因对香菜发育和抗逆性具有重要意义,为提高香菜品质和抗逆性提供理论依据。
