酪氨酸激酶抑制剂引起Ph+急性淋巴细胞白血病儿童身高增长障碍1例病例报告
2022-12-15郑方圆薛宾阁张乐萍
郑方圆 王 淼 薛宾阁 张乐萍
1 病例报告
男,7岁11月,以“发现颈部肿物2 d”起病,不伴其他不适,于当地医院行血常规检查WBC 33.2×109·L-1,Hb 103 g·L-1,PLT 75×109·L-1,可见幼稚细胞,考虑急性白血病可能,即转至北京大学人民医院儿科进一步诊治。
个人及家族史:患儿系G1P1,足月顺产娩出,出生体重3.3 kg,出生身长50 cm,生后生长发育与同龄儿相仿。患儿父亲身高170 cm,遗精年龄18岁;母亲身高160 cm,月经初潮年龄13岁。
查体:身高134 cm(P75),体重40 kg,双侧颈部、颌下可触及多枚肿大的淋巴结,肝脾肋下未扪及。
实验室及辅助检查:血常规WBC 26.1×109·L-1,Hb 94.5 g·L-1,PLT 96×109·L-1;骨髓穿刺形态学原始幼稚淋巴细胞36%;免疫分型示44.1%异常淋巴细胞表型,白血病基因:BCR/ABL(P210)=108.2%,其余常见白血病融合基因均为阴性。染色体核型:46,XY,t(9;22)[2]/45-46,XY, t(9;22),+mar,inc[5]。
诊疗经过:结合患儿血常规、骨髓形态学、免疫学、细胞及分子遗传学检查,明确诊断为Ph+ALL。在患儿家属签署化疗知情同意书后,住院第2天起采用BFM方案治疗[1]。诱导缓解、巩固强化及再诱导治疗采用环磷酰胺、长春新碱、地塞米松(或醋酸泼尼松)、去甲氧柔红霉素、左旋门冬酰胺酶(或培门冬酶)、大剂量甲氨蝶呤、大剂量阿糖胞苷等药物序贯交替治疗。维持治疗采用巯嘌呤及甲氨蝶呤。在诱导化疗第7天加用酪氨酸激酶抑制剂(TKI)伊马替尼(340 mg·m-2)治疗,中枢神经系统白血病的防治采用甲氨蝶呤+阿糖胞苷+地塞米松三联鞘内注射,共25次。患儿脑脊液常规、生化、免疫残留等检查均未见异常,头颅增强MR未见异常。
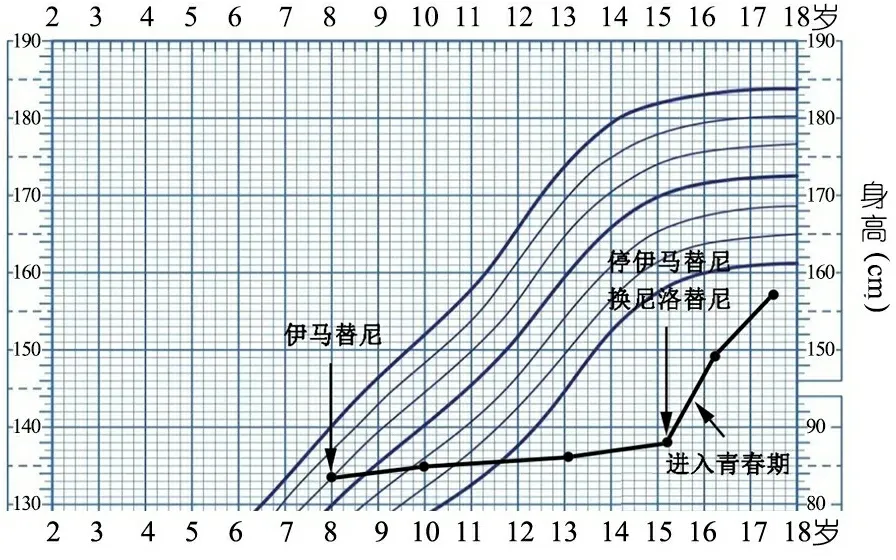
患儿诱导化疗结束后骨髓形态学完全缓解,BCR/ABL融合基因下降至3.6%(图1)。巩固化疗期定期复查骨髓形态学显示持续完全缓解,但BCR/ABL融合基因转阴慢(伊马替尼治疗后11个月)且很快转阳(图1)。期间与家长交流骨髓移植相关事宜、告知Ph +ALL诊疗新进展以及长期应用靶向药的不良反应,家长拒绝行骨髓移植治疗。遂在维持化疗结束后,持续单药应用伊马替尼靶向治疗。在伊马替尼治疗期间,家长已注意到伊马替尼对患儿身高的抑制作用,但因未达伊马替尼停药标准以及当时不能获得其他TKI替代治疗,故仍持续口服伊马替尼。因考虑到对正在抗肿瘤治疗的患者禁止应用生长激素(GH),综合考虑后未予患儿GH治疗。指导患儿尽量补充营养素、充足睡眠、适当运动以促进身高的增长。规律监测Tanner分期,均处于Tanner 1期,体重增长处于P25~P50。患儿15岁2月龄时(伊马替尼应用7年3月)监测BCR/ABL基因为阳性,此时身高137.5 cm( 图1 患儿诱导化疗结束后BCR/ABL融合基因(%)下降及酪氨酸激酶抑制剂治疗情况 随访:患儿随访至17岁6月龄,身高157 cm(接近于P3),体重60 kg,Tanner分期3~4期。定期监测血常规均未见异常,血生化提示肝肾功能、钙磷水平无异常;末次骨髓穿刺BCR/ABL融合基因阴性。甲状腺功能正常,性激素各项检查结果均未见异常,左手腕关节X线片骨龄延迟约2年。因血清胰岛素样生长因子1(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)水平均处于正常范围,且患儿暂无GH替代治疗的意愿,因此,未行生长激素激发试验。患儿自服用靶向药后身高指标变化趋势见图2。 图2 患儿在酪氨酸激酶抑制剂治疗期间身高指标变化趋势 众所周知,恶性肿瘤患儿的身高受父母遗传、恶性肿瘤本身、治疗过程中的药物、特殊饮食、体育锻炼、睡眠情况等因素影响。本例Ph+ALL患儿在常规化疗联合伊马替尼治疗后,即出现身高增长速度下降,且在常规化疗结束后,患儿身高增长速度仍未见恢复,提示伊马替尼对身高有抑制作用,后更换为尼洛替尼,且患儿进入青春期,身高增长速度较前有所恢复。该患儿在服用TKI期间定期复查骨髓细胞学形态均为完全缓解状态,且自发病以来未出现营养不良、肝肾功能损害、钙磷代谢紊乱等合并症,可除外肿瘤疾病活动及其他慢性疾病对身高的影响。故考虑该患儿在发病后的前7年中,身高增长障碍为伊马替尼所致。后患儿身高出现追赶生长,是停用伊马替尼换用尼洛替尼还是进入青春期所致,还是两者的结合作用,以及现在所服用的尼洛替尼是否仍存在生长抑制作用,尚不明确。在整个治疗期间,患儿体重增长处于P25~P50,未发现TKI对体重的影响。该患儿规律监测Tanner分期,于15岁7月左右进入青春期,已达男性青春期发育延迟标准[2],青春期启动后按序进行发育,未出现进程受阻,结合该患儿父亲遗精年龄较晚,以及该患儿存在恶性肿瘤,故考虑存在体质性青春期生长发育延迟、功能性低促性腺激素性性腺功能减退可能,因性激素水平正常,且疾病处于缓解状态,未给予针对性发育相关治疗。 关于TKI调节骨骼生长的机制,目前尚无统一认识。TKI 对身高的影响可能是使得骨矿物质和维生素 D 代谢紊乱、促进生长板提前闭合以及破坏生长激素轴所致[3-5]。本文患儿定期监测钙磷代谢和25(OH)D3,均未见异常,但遗憾的是,未于单独应用伊马替尼治疗期间行生长激素激发试验,因此,尚不清楚该患儿存在生长障碍的具体机制是否为生长激素轴的影响。 目前关于TKI对身高的影响,多为对伊马替尼抑制儿童身高增长的研究,法国CML工作组[6]、Shima等[7]、Rastogi等[8]等发现71.4%~93.0%的CML儿童在应用伊马替尼期间身高受影响。本课题组曾对国内伊马替尼影响儿童身高的状况进行研究,发现有71.0%的CML儿童出现身高增长减慢[9]。此外,Sabnis等[10]报告19例Ph+ALL患儿,中位年龄9.0岁,伊马替尼应用中位时间2.5年,94.7%出现身高增长减慢。临床研究均显示在青春期前即开始伊马替尼治疗的儿童会出现身高增长障碍[6, 7, 11, 12],但关于伊马替尼能否影响青春期CML儿童的身高增长,目前存在争议。Bansal等[11]的研究中,青春期组身高SDS前后比较差异无统计学意义,即青春期开始后才开始应用伊马替尼治疗的儿童身高增长未受到伊马替尼的影响。Shima等[7]的研究纳入48例CML儿童,27例在青春期前开始使用伊马替尼,随访时有8例进入青春期,其中4例在达到青春期年龄时出现追赶生长,进而推断生长受损的青春期前儿童会随着青春期的到来而出现追赶性生长。而Millot等[6,13]研究发现伊马替尼所导致的CML儿童生长减速在青春期前和青春期均可发生。此外,Narayanan等[4]对18例伊马替尼引起生长迟缓的CML儿童进行血清IGF-1水平测定,发现青春期患者IGF-1水平显著降低,提示存在生长障碍的儿童在青春期无法恢复身高或追赶生长。本课题组结果显示青春期后开始应用靶向药的儿童,伊马替尼对其身高影响小甚至无影响[9]。 尼洛替尼作为二代TKI,临床应用较晚,目前对儿童身高的影响研究较少。Samis等[14]在2020年欧洲血液病年会上报道一项尼洛替尼治疗CML儿童的二期试验(NCT01077544),将CML儿童(中位年龄为13岁)分为伊马替尼/达沙替尼耐药/不耐受组和新诊断组,应用尼洛替尼的中位时间44月,结果发现3/58例出现生长不良事件。48个治疗周期(每个周期28 d)后,两组身高SDS较基线变化的中位数分别为-0.54 SDS和-0.91 SDS。青春期开始前应用尼洛替尼的患儿,身高SDS减低更明显。性别对生长减速无明显影响。但Hijiya等[15]的研究纳入应用尼洛替尼治疗的11例CML和4例Ph+ALL儿童,中位年龄9岁,未发现身高增长障碍事件。 目前,很少有研究探讨一代或二代TKI治疗对青春期发育的影响。Giona等[16]根据Tanner分期和促性腺激素和性类固醇水平评估了4例接受TKI治疗的CML儿童,不论男女均有正常的青春期发育。Tauer等[16]报道了13例接受伊马替尼治疗的男孩(中位年龄13岁),中位随访时间18个月,血清睾酮和抑制素B水平均正常。 综上所述,TKI治疗对儿童身高增长有抑制作用,且影响不容忽视,故临床医生在应用TKI治疗儿童白血病的同时,应该密切监测身高增长速度及性发育情况,必要时需要考虑联合儿科内分泌医生制定个体化治疗方案,以期改善儿童白血病生存者的生活质量。 利益冲突本文所有作者均声明不存在利益冲突。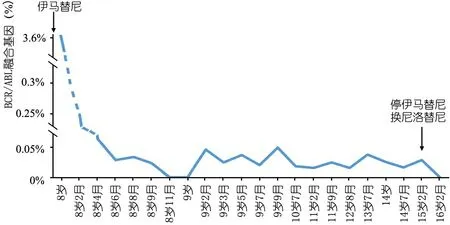
2 讨论
