闽楠PLR基因家族鉴定及响应激素的表达分析
2022-12-07王倩清张毓婷张俊红童再康
王倩清,张毓婷,张俊红,刘 慧,童再康
(浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300)
不同树种木材的天然耐腐性差异大,据统计每年全球因木材腐朽造成的损失占采伐利用木材的10%以上,严重影响木材的加工利用[1]。木材腐朽主要由腐朽菌和变色菌等真菌侵蚀木材细胞所引起,而木材的天然耐腐性则依靠自身代谢物的生物杀菌、抑菌活性来实现[2]。闽楠Phoebe bournei为樟科Lauraceae楠属Phoebe植物,是中国特有的珍稀用材与绿化树种。楠木具有极强耐腐性,阴沉木历经千年不腐,被誉为“木中之玉”,市场俗称“金丝楠乌木”[3]。闽楠和桢楠Phoebe zhennan作为“金丝楠木”最主要的产材树种,树干挺拔,木材颜色呈淡黄色,坚硬细密,纹理美观具有芳香香气,属上等家具良材[4]。因此,闽楠可作为研究木材天然耐腐性的良好材料,闽楠全基因组测序的完成为基因挖掘和功能研究提供了重要基础。
已有研究发现:从木材分离的木脂素(lignan)类化合物具有抗菌活性,参与植物防御系统,增强木材耐久性和抗真菌能力。例如北美乔柏Thuja plicata心材中提取的木脂素通过清除自由基和螯合亚铁来干扰真菌氧化还原循环提高木材耐腐性[5],南洋杉Araucaria araucana中提取的松脂素(pinoresinol)和开环落叶松脂素(secoisolariciresinol)对木材腐朽菌具有较好抗性[6]。然而,关于木脂素生物合成调控途径尚不明确,从而限制其深入研究与生产应用。
松脂素还原酶Pinoresinol-lariciresinol reductase(PLR)是一种编码松脂醇的落叶松脂素还原酶基因,属木脂素生物合成的关键酶,一分子松脂素在PLR松脂素-落叶松脂素还原酶作用下经两步还原成落叶松脂素和异落叶松脂素,也是木脂素生物合成途径中重要限速步骤之一。目前已从模式植物拟南芥Arabidopsis thaliana[7]和富含木脂素的植物(连翘Forsythia suspense[8−9]、菘蓝Isatis indigotica[10]、亚麻属Linum[11−13])中克隆得到PLR基因。迄今为止,所有以重组纯化蛋白为特征的PLR均可以将松脂素还原为落叶松树脂素以及将落叶松树脂素还原为异落叶松树脂素,但AtPrR1对落叶松树脂素的活性比松脂素低约35倍,AtPrR2对作为底物的落叶松树脂素完全没有催化活性。因此,MIN等[14]将它们命名为松脂醇还原酶,而不是松脂醇-落叶松树脂醇还原酶。PLR的表达受激素的调控,不同物种在不同激素处理下松脂醇-落叶松树脂醇还原酶的表达模式有所不同。在脱落酸(ABA)处理下,LuPLR1的表达增强,LuPLR1的表达似乎是由在种子成熟和休眠中起关键作用的植物激素ABA触发的[12−13]。所以赤霉酸(GA)对LuPLR1的表达具有相反的调节作用[13]。在茉莉酸甲酯(MeJA)的处理下,LuPLR2的表达量有明显提高,因为亚麻在MeJA处理和伤害后,LuPLR2基因表达和叶酸蛋白产量增加,这与这些木脂素参与植物防御反应一致。本研究选择耐腐性强的闽楠解析木脂素合成重要限速酶PLR基因,利用闽楠基因组数据,对PLR基因家族成员进行鉴定和基因结构、保守基序及染色体定位分析,构建系统发育进化树预测闽楠PLR(PbPLR)催化酶的立体选择性,为进一步研究PbPLR基因在闽楠木脂素合成过程中的生物学功能提供基础。
1 材料与方法
1.1 闽楠PLR基因家族成员鉴定
采用BLAST和hmmsearch鉴定闽楠PLR家族成员。首先在美国国家生物技术信息中心(NCBI)数据库(https://www.ncbi.nlm.nih.gov/)下载拟南芥PLR家族蛋白序列,通过BLASTP同源比对检索,用HMMER 3.1软件[15]搜索闽楠PLR基因家族的候选序列。搜索获得的基因成员在人工筛选后提交至SMART数据库[16]确认保守结构域,确定PLR基因成员,并依据染色体位置进行命名。
1.2 PbPLR基因染色体定位与基因复制分析
采用MapChart软件绘制PbPLR基因在闽楠基因组上的位置信息,并利用MCScanX软件分析PbPLR基因的共线性区域和复制情况。
1.3 PbPLR基因结构及蛋白保守基序分析
根据PbPLR基因编码区序列和基因组序列,采用在线GSDS (http://gsds.gao-lab.org)分析PbPLR基因结构。并通过在线工具MEME Suite (http://meme-suite.org/)分析PbPLR氨基酸序列中保守基序,设置保守基序个数为20。最后利用SnapGene软件进行PbPLR蛋白序列比对。
1.4 PbPLR家族成员的系统发育树构建及聚类分析
利用植物蛋白数据库下载的拟南芥、亚麻、台湾杉Taiwania cryptomerioides等物种PLR蛋白序列,与PbPLR家族成员进行系统进化分析。利用MEGA X软件构建进化树,采用邻接法(neighbor-joining method,NJ),重复1 000次(Bootstrap为1 000),利用在线工具ITOL (https://itol.embl.de/)美化MEGA X软件输出的进化树。
1.5 PbPLR基因的启动子分析
根据闽楠基因组数据,利用TBtools软件提取PbPLR基因序列转录起始位点上游2 000 bp序列,使用在线软件PlantCARE (http://intra.psb.ugent.be:8080/PlantCARE/)预测PbPLR基因启动子序列中的顺式调控元件。
1.6 PbPLR基因对激素处理的响应
选取1.5年生长势一致的闽楠半同胞家系苗进行激素处理,分别采集叶、茎和根进行PbPLRs基因表达分析。基于前期预实验结果,本研究分别使用1 mmol·L−1ABA、1 mmol·L−1水杨酸(SA)和2 mmol·L−1MeJA处理闽楠实生苗,对土壤上部植株均匀喷洒激素,使土壤表面被激素浸湿,同时,以喷洒水为对照(ck)。激素喷施时间为2021年10月1日9:30、10月2日11:00、10月3日11:30、10月3 日 22:00、10 月 4 日 9:00、10 月 4 日 9:30。在处理后 1、3、12、24、48 和 72 h 取样并液氮速冻。采用CTAB法提取RNA,使用Takara公司的PrimeScriptTMRT reagent Kit (Perfect Real Time)试剂盒反转录合成cDNA。利用在线网站(http://primer3.ut.ee/)设计PbPLRs特异性引物(表1)用于实时荧光定量PCR 实验。定量PCR 反应体系(10 μL)为:SYBR Green 5.0 μL,上下游引物(10 μmol·L−1)各0.2 μL,模板0.8 μL,双蒸水3.8 μL。反应程序为:95 ℃预变性3 min,95 ℃ 5 s,60 ℃ 30 s (此步完成时采集荧光信号),共40个循环。利用CFX96™ Real-Time PCR检测系统(Bio-Rad,美国)。内参基因为PbEF1α,按照2−∆∆Ct法计算目的基因相对表达量。运用SPSS软件对定量数据进行分析。

表1 实时荧光定量PCR (RT-qPCR)引物信息Table 1 RT-qPCR primer information
2 结果与分析
2.1 闽楠PLR家族成员鉴定
基于拟南芥AtPrRs蛋白序列,应用BLAST和HMMER 3.1软件在闽楠基因组中搜索PLR家族成员。利用BLAST在闽楠基因组中鉴定出12个候选PLR基因,通过HMMER 3.1鉴定出10个成员,去除重复和结构域鉴定后,共鉴定出8个PLR基因家族成员(表2),按照其在染色体上位置命名为PbPLR1~PbPLR8。
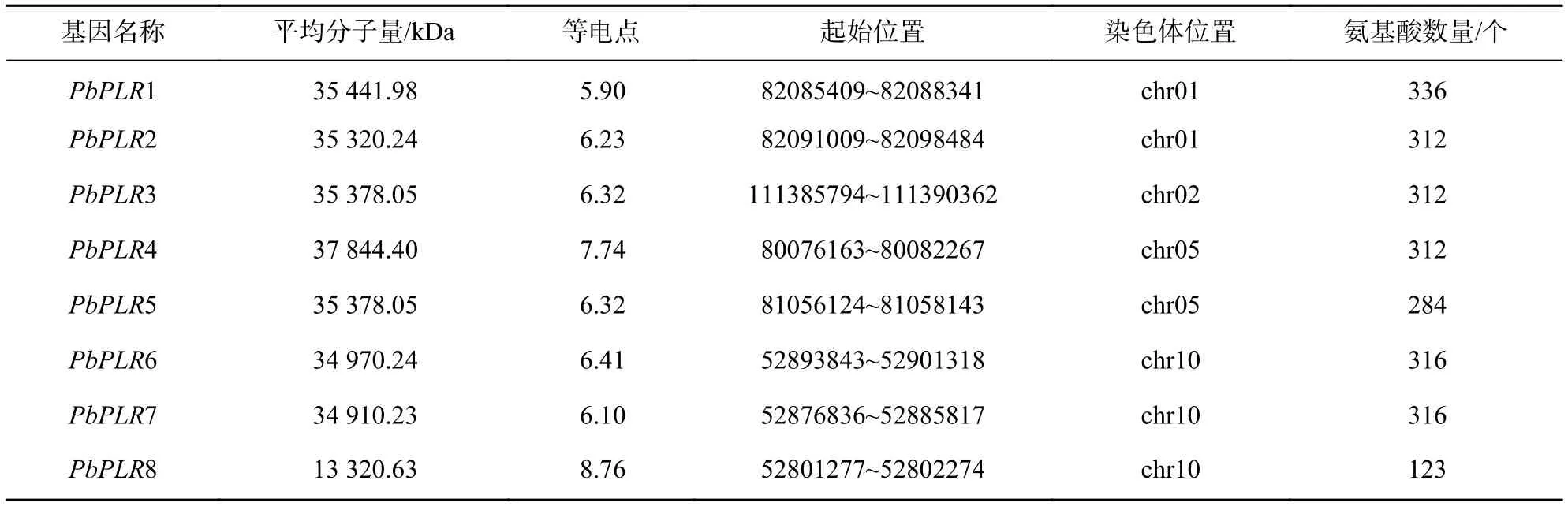
表2 闽楠PLR基因家族的基本信息Table 2 Basic information of PLR gene family in P. bournei
2.2 PbPLR基因染色体定位与基因复制分析
PbPLRs基因不均匀地分布在闽楠第1、2、5和10号染色体,其中10号染色体上数目最多,含3个PbPLRs成员,2号染色体仅1个成员。闽楠基因复制事件检测结果表明:PbPLR1和PbPLR3经历了片段复制,而PbPLR1和PbPLR2以及PbPLR6、PbPLR7和PbPLR8经历了串联复制。
2.3 PbPLR基因结构及蛋白保守基序的分析
利用GSDS软件绘制PbPLRs基因结构图(图1A)可见:8个PbPLRs均含有至少2个外显子,其中PbPLR2、PbPLR3、PbPLR4和PbPLR7各含4个外显子,每个成员均有内含子。

图1 PbPLR基因结构及蛋白保守基序分析Figure 1 Analysis of PbPLR gene structure and protein conserved motifs
对PbPLR蛋白序列进行保守基序(Motif)分析,共检测到14个保守基序(图1B)。多序列比对分析发现:PbPLRs都具有保守的NADPH结合位点和赖氨酸(Lys)活性位点(图1C),PbPLR1含有特异Motif 11、Motif 13和Motif 14;PbPLR 6和PbPLR 8含有特有的Motif 10。
2.4 PbPLR家族系统进化分析
为研究PbPLRs家族的进化关系并预测其催化酶功能,选取裸子植物台湾杉、北美乔柏,以及被子植物拟南芥、连翘和亚麻等物种的PLR蛋白序列构建系统进化树(图2)。系统进化分析表明:裸子植物的台湾杉TcPLRs和北美乔柏TpPLRs属同一分支,即裸子植物和被子植物PLRs不论其底物立体选择性如何,均可分为2分支群[17−20]。然而,被子植物PLRs根据其底物立体选择性而分属不同支群,根据位于同一分支的LcPLR1、LaPLR1和LuPLR2的底物偏好,推测PbPLR1、PbPLR6、PbPLR7和PbPLR8偏好(+)-松脂醇[(+)-pinoresinol]和(+)-落叶松脂醇[(+)-lariciresinol];而PbPLR2、PbPLR3和PbPLR4同属于一个小分支,与偏好(−)-松脂醇和(−)-落叶松脂醇的LuPLR1和偏好(+)-松脂醇和(−)-落叶松脂醇的LpPLR1亲缘关系较近,推测PbPLR2、PbPLR3和PbPLR4可将 (−)-松脂醇还原为(−)-落叶松脂醇。PbPLR5与其他PLR成员亲缘关系较远,不能预测其选择性。
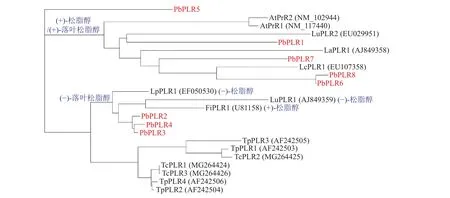
图2 闽楠和多个物种的PLR家族系统发育树Figure 2 PLR family phylogenetic tree of P. bournei and several species
2.5 PbPLR基因顺式作用元件分析
启动子区域的顺式调控元件可能影响基因表达模式。分别提取PbPLR基因上游2 000 bp序列进行顺式作用元件分析,发现启动子区域具多种类型响应元件(图3A),主要包括激素响应元件如脱落酸(ABA)响应元件、赤霉素(GA)响应元件、茉莉酸甲酯(MeJA)响应元件和水杨酸(SA)响应元件,与环境胁迫响应元件等,对PbPLR基因启动子区的激素响应元件统计分析表明:PbPLRs含有5种激素响应元件:脱落酸、水杨酸、赤霉素、茉莉酸甲酯和生长素(Auxin),每个PbPLRs至少含有2个激素响应元件,其中PbPLR2激素响应元件最多(6个),PbPLR4仅2个(图3B)。在全部PbPLR启动子区域的响应元件中,激素响应元件最多的是脱落酸(9个),其次为赤霉素(7个),生长素最少仅2个(图3C)。
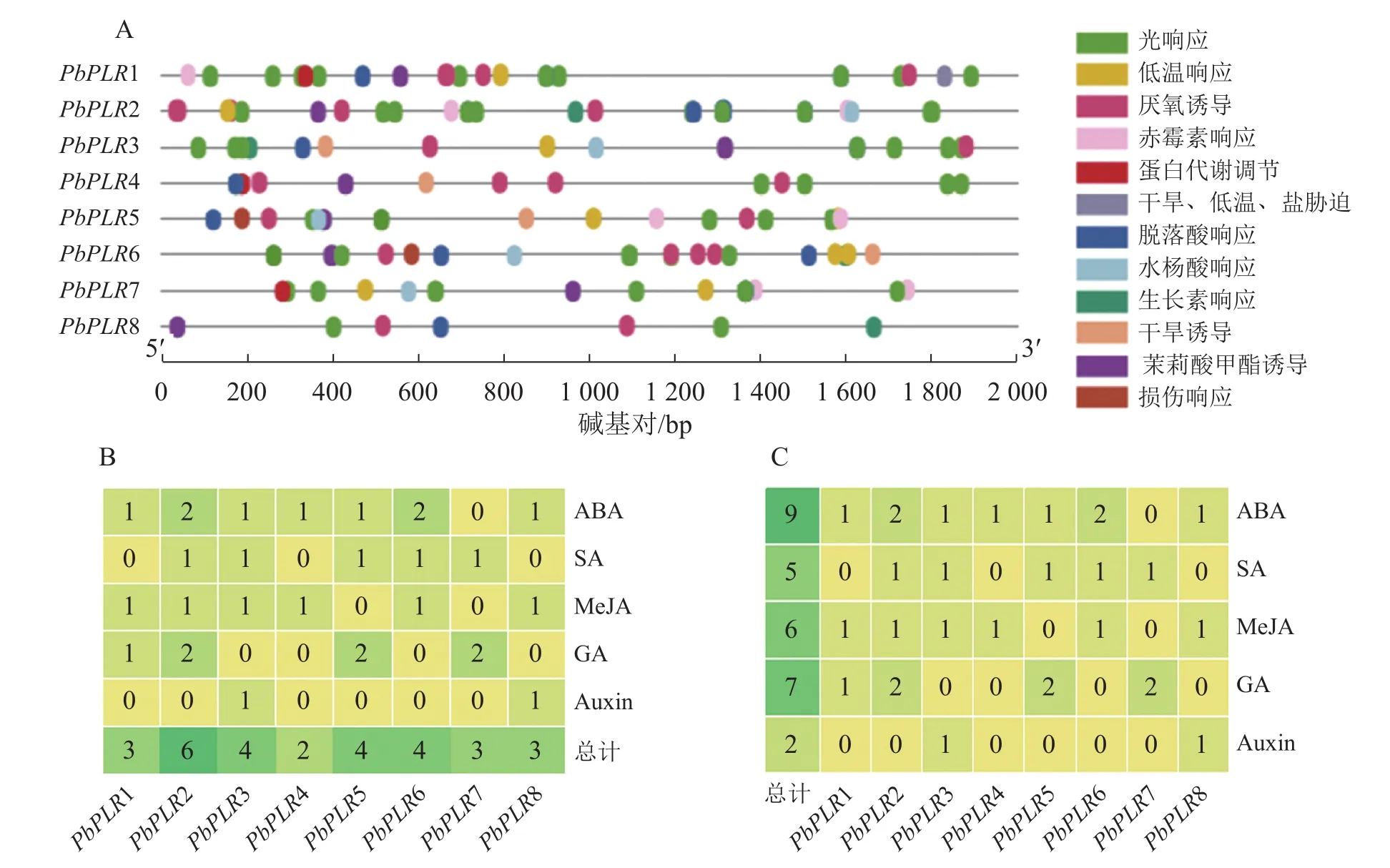
图3 PbPLR家族基因的顺式作用元件分析Figure 3 Analysis of putative cis-elements in the promoter regions of PbPLRs
2.6 不同激素处理下的PbPLR表达分析
应用实时荧光定量PCR (RT-qPCR)反应检测了ABA、SA和MeJA处理后根、茎和叶中的PbPLRs基因的表达水平(图4~6)。结果表明:8个PbPLRs基因对ABA、SA和MeJA均有响应,处理1 ~48 h,基因表达水平显著上调,48 h时达最高值,之后上调幅度降低。其中,ABA处理48 h后根部PbPLR2表达量上调倍数最大,为ck的400倍,茎部表达水平上调为ck的300倍,但叶片中表达上调不明显。相较于在根部和叶部,ABA处理后的PbPLR6在茎部表达量上调倍数最大,48 h时的表达量上调倍数为ck的35倍;ABA处理48 h后的PbPLR4在叶中上调倍数最大,为ck的30倍(图4)。
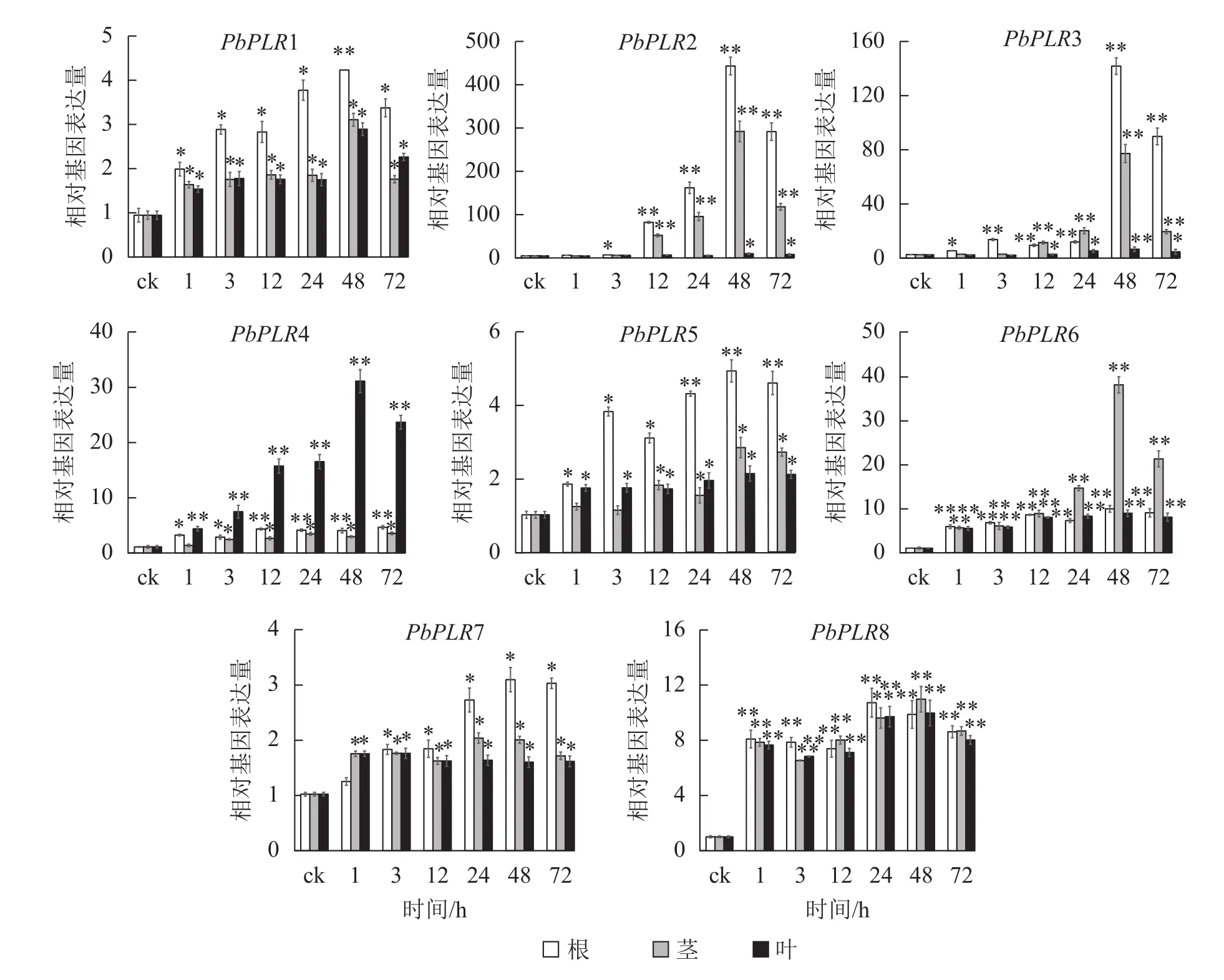
图4 PbPLRs基因在ABA处理下的表达模式Figure 4 Expression patterns of PbPLRs under ABA treatment
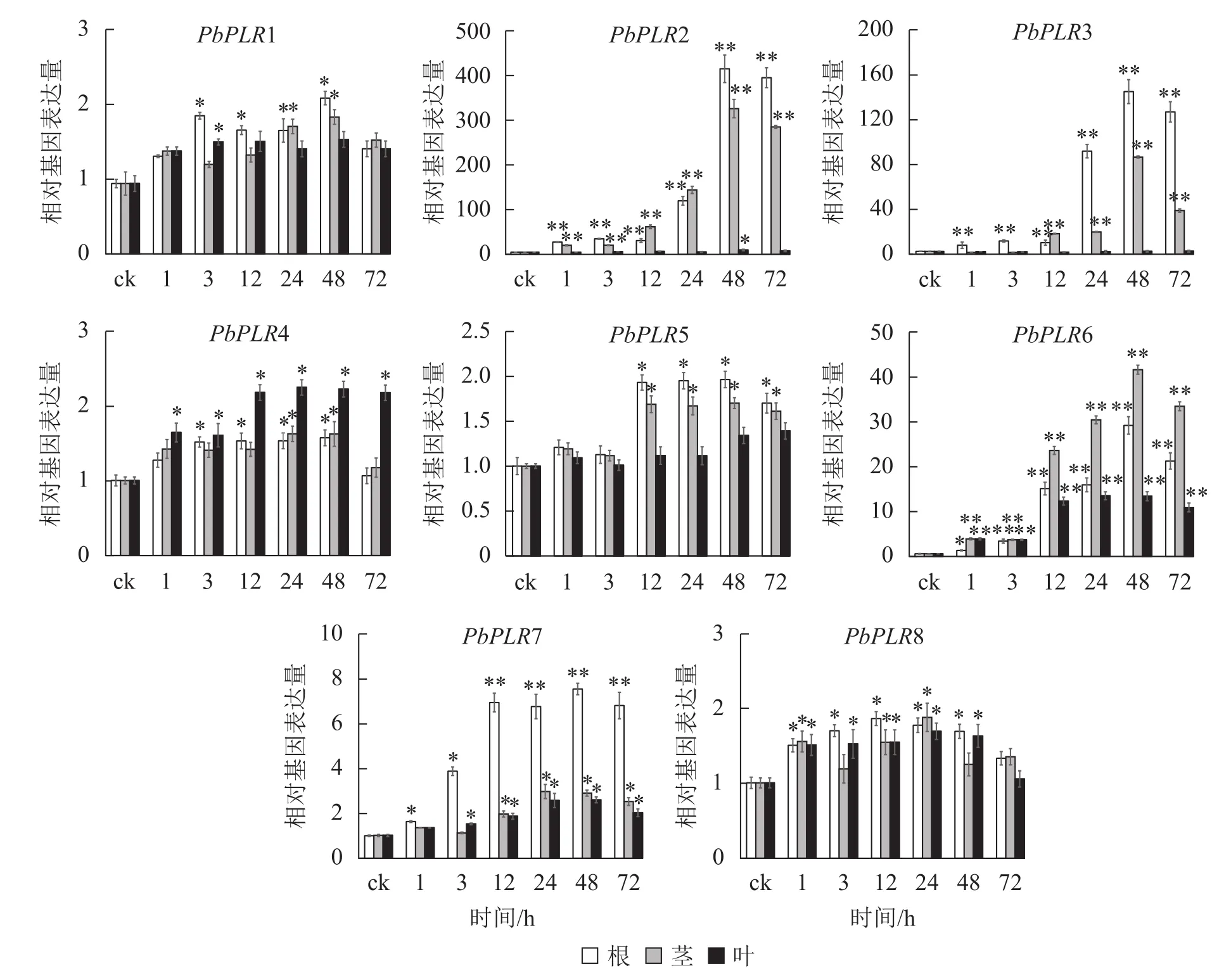
图5 PbPLRs基因在SA处理下的表达模式Figure 5 Expression patterns of PbPLRs under SA treatment
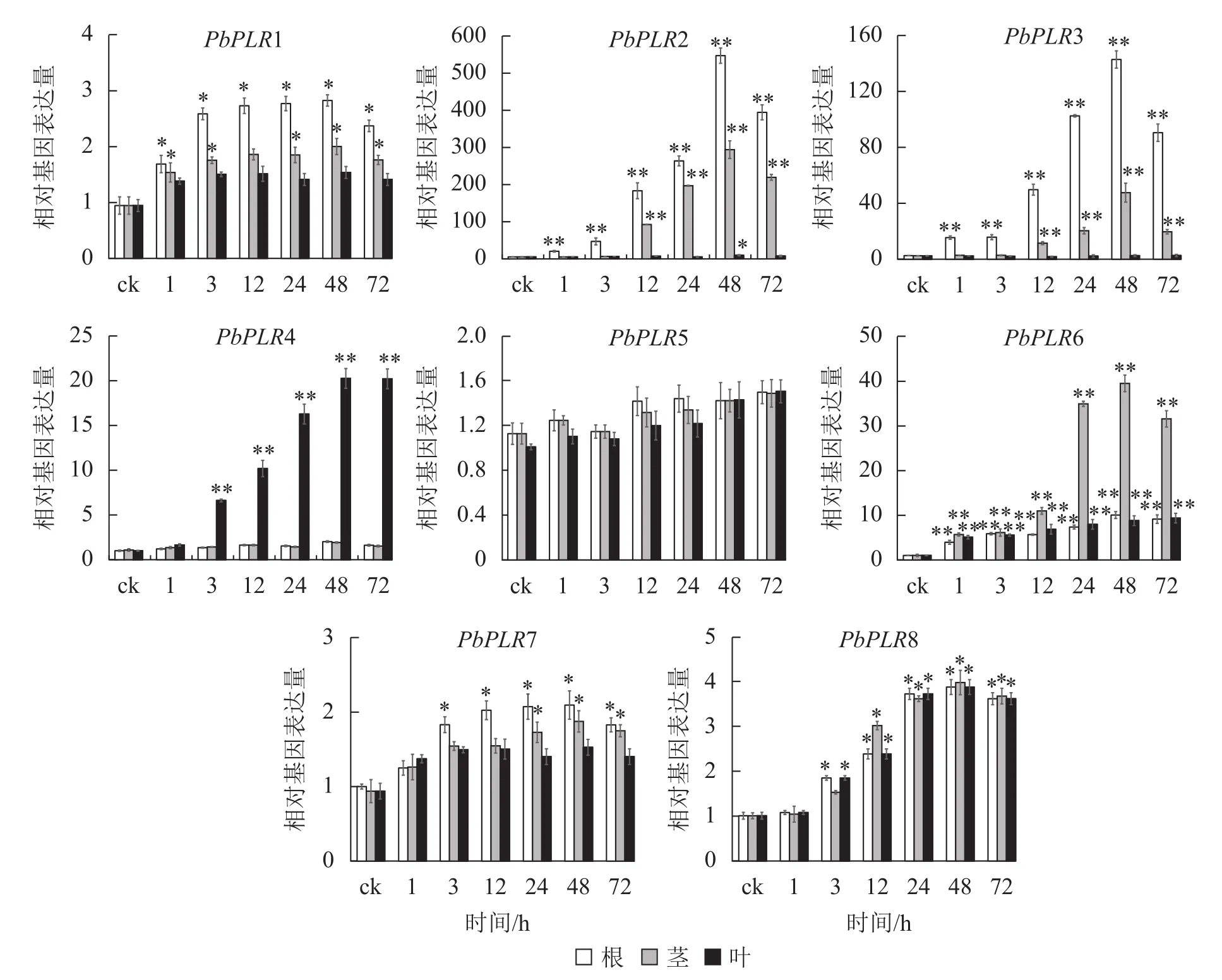
图6 PbPLRs基因在MeJA处理下的表达模式Figure 6 Expression patterns of PbPLRs under MeJA treatment
SA处理后,根中PbPLR2表达量上调倍数最大,为ck的400倍,PbPLR6在根、茎、叶中均上调表达,而PbPLR1、PbPLR4和PbPLR8上调倍数较低(图5)。
MeJA处理48 h后,根中PbPLR2表达量上调倍数为ck的500倍,且茎中也达400倍;PbPLR3在根中表达上调为ck的140倍(图6)。PbPLR5对MeJA处理响应不明显,茎和根中表达量上调幅度均较低,但ABA(图4)和SA(图5)处理后PbPLR5的表达量上调显著(P<0.05),该结果与PbPLR5启动子区域含有的激素响应元件一致。
3 讨论
木脂素类化合物具有较为广泛的应用前景,PLR作为植物木脂素生物合成的重要限速酶基因之一,引起了广泛的关注。例如,在亚麻中鉴定到2个PLR基因(LuPLR1和LuPLR2)[12],模式植物拟南芥中共有2个PrR基因(AtPrR1和AtPrR2)[7],台湾杉中发现了3个PLR基因(TcPLR1、TcPLR2和TcPLR3)等[21]。本研究从闽楠基因组中共鉴定到8个PbPLRs基因,不均等分布于闽楠的4条染色体上,且均含有PLR家族保守的NADPH结合位点和赖氨酸活化位点。PLR属于short-chain dehydrogenase/reductase(SDR)超级家族,该家族广泛参与植物初级代谢和次级代谢过程,且在高等植物中具有明显功能分化[22]。闽楠中数量较多的PLR成员可能参与不同代谢通路,并发生功能分化。
利用不同物种PLR蛋白构建系统进化树,发现裸子植物PLR蛋白单独聚为一类,而被子植物PLR系统聚类与催化酶的立体选择性相关,该结果与前人研究结果相一致。NAKATSUBO等[7]发现被子植物PLR(FiPLR1、LaPLR1、LuPLR1、LpPLR1、AtPrR1和AtPrR2)和裸子植物PLR(TpPLR1和TpPLR2)分别聚类。PLR催化酶的底物立体选择性直接决定了下游木脂素的结构骨架,是形成木脂素类化合物结构多样性的关键节点。PLR立体选择性最早是在金钟连翘Forsythia intermedia中发现,功能研究发现2个FiPLR都偏好选择催化(+)-松脂醇和(+)-落叶松脂醇为(−)-异落叶松脂醇[9]。随后,在其他物种中鉴定的PLRs同样具有明显立体选择性[23]。拟南芥AtPrR1可催化2种松脂醇异构体,而AtPrR2仅能催化(−)-松脂醇形成(−)-落叶松脂醇[7]。根据已有催化酶的功能研究,推测闽楠PbPLR1、PbPLR6、PbPLR7和PbPLR8偏好选择(+)-松脂醇和(+)-落叶松脂醇,而PbPLR2、PbPLR3、PbPLR4和PbPLR5聚类的PLR蛋白的立体选择性不同,无法通过系统进化树推测其底物偏好性。FUJITA等[24]研究发现:北美乔柏的TpPLRs聚类为一个分支却具有相反的立体选择性。PLR家族成员的蛋白序列差异与底物立体选择性并不完全等同,对底物的选择偏好性可能随物种共同经历多次进化;或形成于物种进化的早期,随后的碱基突变并不影响其催化功能[25]。
通过启动子顺式作用元件分析发现:PbPLR基因的启动子区域具有多种响应元件,推测PbPLR表达模式可能受生物及非生物因素调控。例如光响应、厌氧诱导、耐旱和防御等响应元件,推测PbPLR表达可能受光信号及非生物胁迫等因素影响,并通过次生代谢物的催化合成而参与植物防御系统。此外,PbPLRs基因启动子区域具有多种激素响应调控元件,其中ABA、MeJA和SA等3种响应元件数目最多。不同物种PLR基因表达受不同激素调控。例如,ABA处理下亚麻LuPLR1和菘蓝LiPLR1表达显著上调[10,12−13];MeJA诱导LuPLR2、IiPLR1和鬼臼草Podophyllum hexandrumPhPLR表达量上调[10,25];而GA对LuPLR1表达起抑制作用[21]。对PbPLR表达分析表明:PbPLR对ABA、MeJA和SA均有响应,这与启动子元件分析相吻合。MeJA处理下PbPLR2响应最显著,在处理48 h根部表达量最高;ABA处理下PbPLR4响应最为显著,在处理48 h时叶片表达量最高;SA处理下PbPLR6响应最为显著,在处理48 h时茎表达量最高。本研究表明:PbPLR调控模式较为复杂,可能受不同植物激素诱导,同时PbPLRs组织特异性表达可能与其结构功能分化相关但与系统进化分支无关。推测闽楠木脂素合成具有较为复杂的调控网络,需进一步研究其生物合成调控机制。
