文蛤防御素基因的克隆及其免疫表达特征研究
2022-11-10周烨
周烨
(通州区兴仁镇农业农村和社会事业局,江苏 南通 226300)
防御素(Defensins)是一类阳离子抗菌活性肽,广泛存在于各种生物体中,是生物体先天免疫防御和适应性免疫防御机制的重要组成部分[1-3]。通常防御素都是小分子肽,由12~50个氨基酸构成,分子内富含精氨酸和由半胱氨酸形成的分子内二硫键[4]。最初在鲎(Tachypleus tridentatus)中发现了一个具有79 aa的防御素基因,被命名为Big Defensin(MmBD),作为抗菌肽家族(AMPs)的一员,该基因具有显著的抗菌活性[5]。随后在多个软体动物中开展了big Defensin基因的相关研究,包括菲律宾蛤仔(Ruditapes philippinesis)[6]、海湾扇贝(Argopecten irradians)[7]、美洲帘蛤(Mercenaria mercenaria)[8]、魁蚶(Scapharca broughtonii)[9]等。以上研究表明,big defensin基因在免疫应答中发挥着重要作用。目前在关于文蛤(Meretrix meretrix)的研究中,还未见该基因的相关报道。
文蛤,属软体动物门,瓣鳃纲,帘蛤目,帘蛤科,文蛤属,是我国沿海滩涂重要的经济贝类之一。但由于近年来沿海重工业的发展和临港船舶运输等,造成海洋环境污染,文蛤养殖病害不断发生,由此造成巨大的经济损失,也严重影响了贝类养殖产业的可持续发展。目前认为,重金属污染是近年渔业环境污染的公害之一,是导致贝类死亡的直接原因。有关重金属对文蛤抗氧化酶影响的研究已有一些报道,任虹等[10]研究了铁(Fe)、铜(Cu)、锌(Zn)和铅(Pb)等重金属离子对文蛤肝脏过氧化氢酶(CAT)和细胞色素氧化酶(CCO)2种酶活性的影响;田镇等[11]研究了在铜离子(Cu2+)胁迫下,不同群体文蛤超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力的变化。但重金属对文蛤防御系统分子机制的影响尚未见报道。现克隆了文蛤MmBD基因,分析其特征和组织分布规律,研究了在Cu2+胁迫下,该基因应对环境压力的免疫应答变化,以期为文蛤免疫防御机制研究提供基础资料。
1 材料与方法
1.1 试验材料
本试验所用文蛤来自江苏省通州湾海区。选取4个健康成熟的文蛤个体,置于冰上麻醉,分别取其外套膜、鳃、肝胰腺、足、闭壳肌以及性腺等6个组织样品。待文蛤性腺发育成熟后,进行催产,获取4细胞期、囊胚期、原肠胚、D形幼虫、壳顶幼虫和稚贝6个不同胚胎发育时期样品。设置对照组与试验组,开展Cu2+胁迫试验。使用CuSO4·5H2O(AR)制备1 g/L Cu2+母液,设置Cu2+质量浓度为0.5 mg/L的海水为试验组,不加Cu2+的正常海水为对照组,每组30个文蛤个体,并设置3个平行试验。每个组分别于12、36和72 h取3个文蛤个体的鳃组织,均用液氮速冻,并置于-80℃冰箱中保存。
1.2 MmBD基因cDNA序列全长克隆及序列分析
从转录组文库中获得MmBD的EST序列,采用cDNA末端快速扩增技术(RACE)进行基因cDNA序列全长克隆,设计3'RACE和5'RACE特异性引物进行扩增(表1),将获得的PCR产物进行纯化、回收,随后连接到pMD-18T(TaKaRa)载体,37℃过夜培养,转化到大肠杆菌DH5α(TaKaRa)中克隆,将筛选的阳性克隆送至生工生物有限公司测序,拼接获得结果。使用ORF Finder、SMART、ExPASY、TMHMM等在线网页和工具,开展序列结构特征分析;使用MEGA 5.0构建系统进化树。

表1 试验所用引物
1.3 荧光定量分析
根据RNA提取纯化试剂盒和反转录试剂盒(天根)的说明书,分别获取各个组织的总RNA,测定OD260/OD280值、1.2%琼脂糖凝胶电泳评估RNA浓度和质量,再将总RNA反转录为cDNA,于-20℃保存。根据荧光定量预混试剂盒(天根)说明书配置体系,同时设置ABI7300系统扩增程序。每个cDNA样品做3个平行,β-actin为内参,扩增产物的解离曲线分析保证扩增质量。荧光定量数据按照文献[12]的2-ΔΔCt方法计算,试验数据均以平均值±标准差(Mean±SD)表示。使用SPSS 19.0软件的单因素方差(One-Way ANOVA)对数据进行分析,在单因素方差分析的基础上,采用Duncan多重比较法进行分析,P<0.05为结果差异显著。
2 结果与分析
2.1 MmBD基因序列分析
采用RACE技术克隆获得MmBD基因(Gen Bank:ON351576)的cDNA全长序列,共758 bp,其中5'非翻译区(UTR)长181 bp,3'UTR长214 bp,开放阅读框(,ORF)长363 bp,共编码120氨基酸(图1)。预测蛋白分子质量为13.22 kD,理论等电点pI为7.55。MmBD的预测氨基酸序列包含1个信号肽(1~23 aa)、2个跨膜结构域(7~24 aa,44~66 aa)、高度保守的Cys残基C-X6-C-X3-C-X13(14)-C-X4-C-C和kex2样蛋白酶(KEKR-AV)的裂解位点。预测蛋白前端信号肽区具有较强的疏水性,在成熟肽区均有疏水氨基酸和亲水氨基酸分布(图2)。预测三级结构包含3个α螺旋和6个β折叠。氨基酸序列对比、系统进化树和系统进化树所用物种序列登录号分别见图3、4和表2。由图3、4可见,文蛤MmBD基因与菲律宾蛤仔的亲缘关系最近,先与菲律宾蛤仔聚为一支,再与牡蛎、贻贝聚为一大支,最后再与扇贝等软体动物聚为一大支。

图1 文蛤Big Defesin基因cDNA全长序列及其结构特征
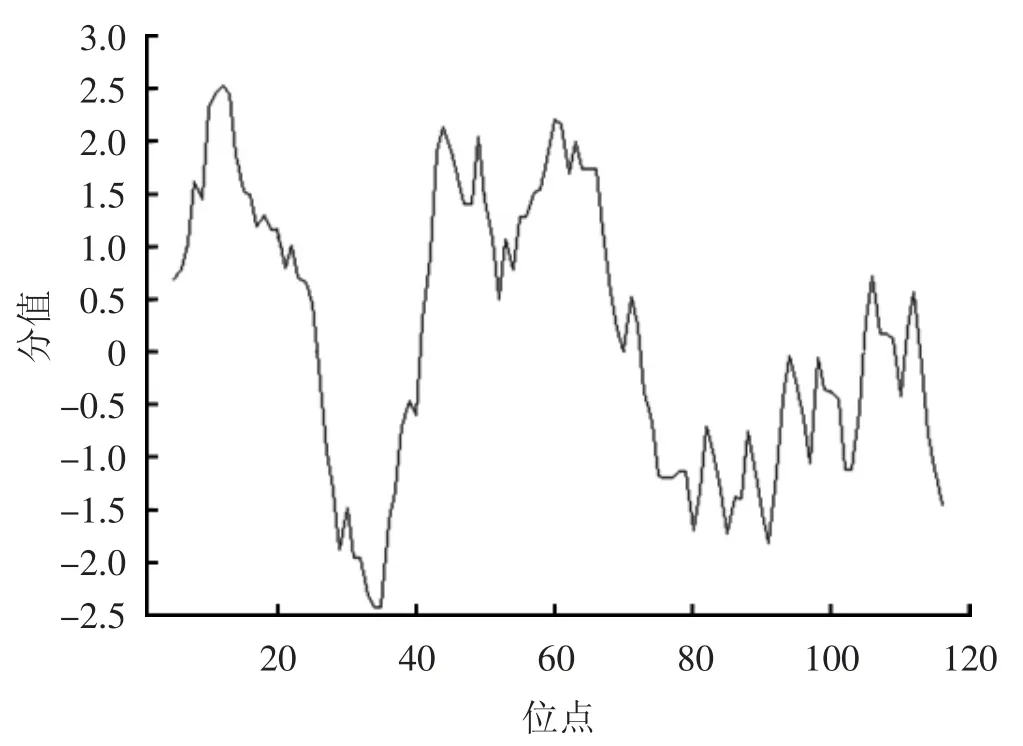
图2 MmBD亲水性与疏水性分析

图3 文蛤与其他物种Big Defesin基因构建的系统进化树

图4 文蛤MmBD与其他软体物种Big Defesin基因氨基酸序列对比
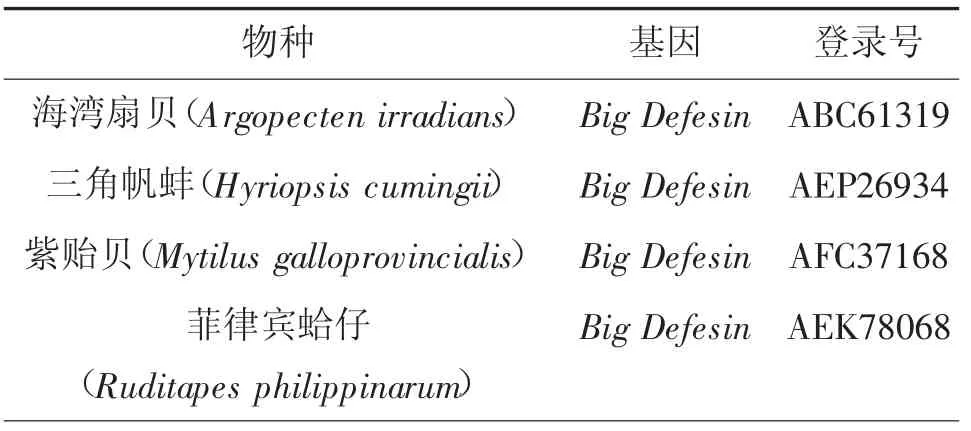
表2 系统进化树所用物种序列登录号
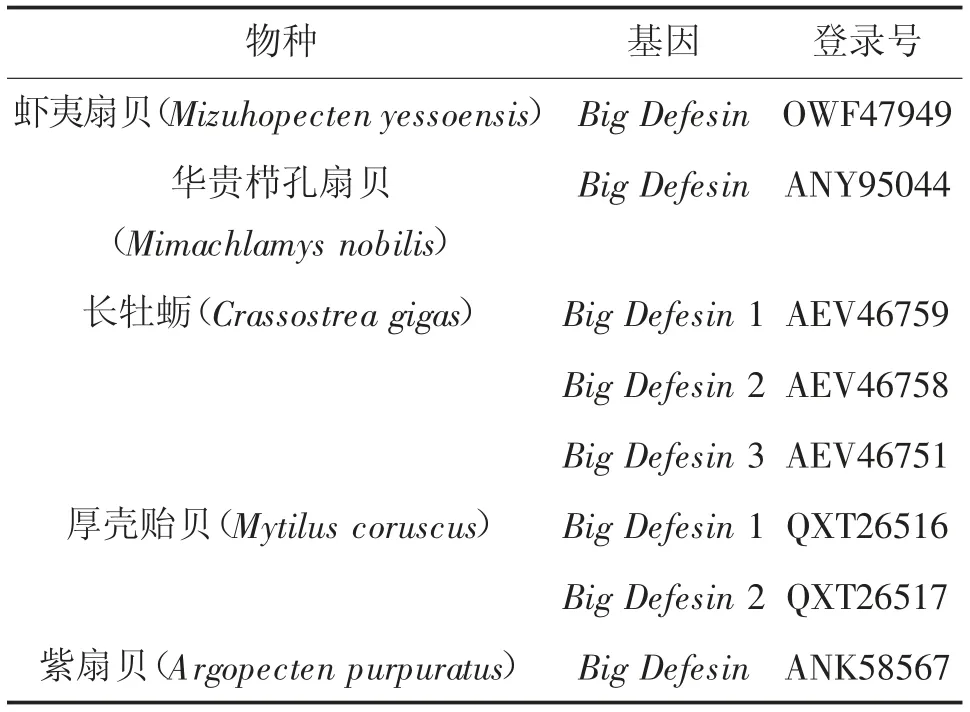
续表
2.2 MmBD基因的组织表达
使用qPCR(实时荧光定量核酸扩增检测系统)分析MmBD基因在文蛤不同组织中(性腺、鳃、外套膜、肝胰腺、闭壳肌、足)的分布规律,结果见图5。由图5可见,MmBD在所检测的各个组织中均有表达,该基因在鳃组织中的表达量最高(P<0.05),其次是在外套膜和肝胰腺,而在闭壳肌、性腺和足中的表达量较低。
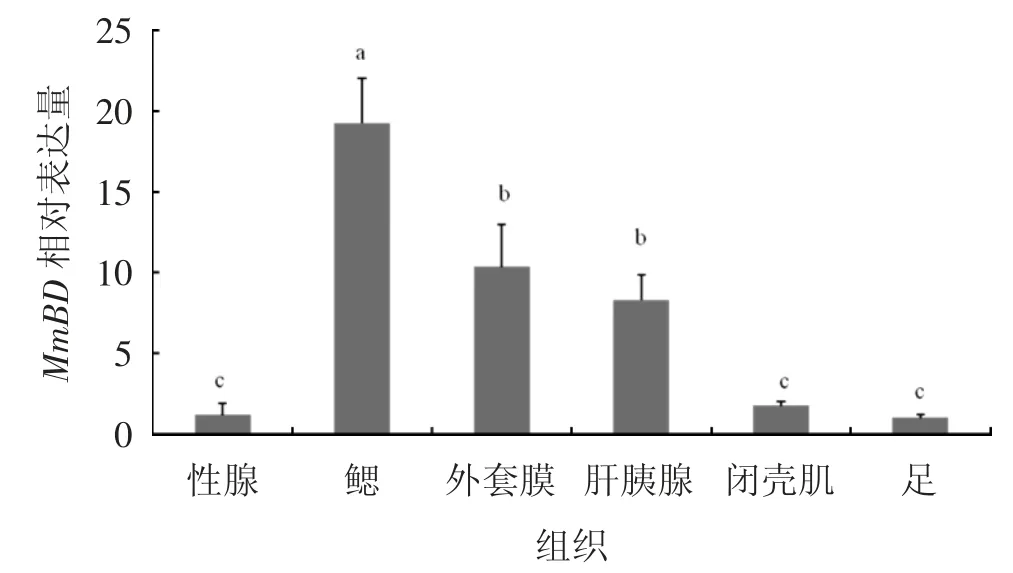
图5 MmBD基因在文蛤各组织的分布情况
2.3 MmBD基因在胚胎发育时期的表达
MmBD基因在文蛤不同胚胎发育时期(4细胞期、囊胚期、原肠胚、D形幼虫、壳顶幼虫和稚贝)表达见图6。由图6可见,MmBD基因在D形幼虫期表达量最高(P<0.05),其次是原肠胚期,稚贝期表达量最低(P<0.05)。
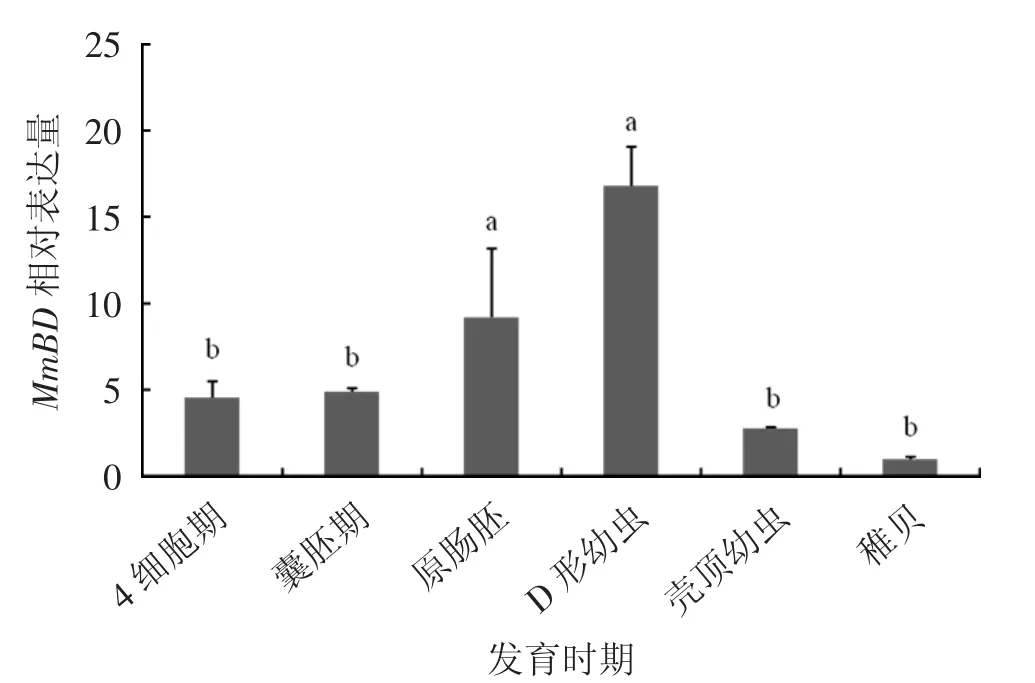
图6 MmBD在不同胚胎发育时期的表达特征
2.4 Cu2+胁迫下MmBD基因的表达特征
高浓度Cu2+胁迫试验结果表明,对照组文蛤的MmBD基因表达量无显著变化,试验组MmBD基因表达量明显升高(图7)。尤其是36和72 h,试验组MmBD基因表达量极显著高于对照组(P<0.01)。

图7 MmBD基因在Cu2+胁迫下的表达规律
3 讨论
克隆获得了文蛤Big Defensin基因的cDNA全长序列,结果显示,该基因的氨基酸序列N末端是一段具有较强疏水性的信号肽序列(23 aa),主要起到引导防御素前体蛋白通过脂膜的作用[13];C端包含1个高度保守的防御素结构,该结构由6个特定位置的保守半胱氨酸残基C-X6-C-X3-C-X13(14)-C-X4-C-C组成,这与魁蚶、紫贻贝、海湾扇贝等其他贝类的Big Defensin基因的结构相似,都具有防御素基因家族的典型特征。由此推测,文蛤MmBD基因可能发挥着与其他物种Big Defensin基因相似的功能。
MmBD在不同组织中的表达结果显示,MmBD在性腺、腮等6个组织中均有表达。这与魁蚶[9]、文昌鱼(Branchiostoma japonicum)[14]、杂色鲍(Halitotis diversicolor)[15]等的研究结果相似,Big Defensin基因在不同组织中广泛表达。文蛤MmBD基因在鳃中的表达量最高(P<0.05),其次是外套膜和肝胰腺。在魁蚶中,Big Defensin基因在肝胰腺中表达量最高,随后是鳃、性腺以及外套膜;在杂色鲍中,Big Defensin基因在肝胰腺中表达量最高,其次是外套膜、足和鳃。在双壳贝类中,鳃组织的主要功能是过滤和呼吸作用,外套膜是暴露于外部环境最多的组织之一,是免疫防御的第一道防线;肝胰腺的主要功能是消化代谢,是一种重要的免疫组织,可合成免疫因子启动免疫反应;这几个组织对调节贝类自身的免疫机制至关重要,可有效抵抗外来有害物质的入侵[16-17]。由此可推测,文蛤MmBD基因与其他物种的Big Defensin基因一样,在鳃、外套膜和肝胰腺等组织器官中起到重要作用,在机体免疫中发挥重要功能。MmBD在不同胚胎发育时期的表达结果显示,MmBD在原肠胚期表达量突然上升,D形幼虫期表达量最高(P<0.05)。文蛤幼体在原肠胚后期整个胚胎形态逐渐发生变化,形成担轮幼虫,随后再变态形成D形幼虫,D形幼虫开始从外界摄食[18],MmBD在在原肠胚期开始大量表达,主要在D形幼虫期起到重要作用,这可能是MmBD基因在这一过程中对幼体自身开展的自我保护机制。
防御素主要参与调节机体免疫系统,具有多项免疫功能,是生物体防御系统的重要成分。多项研究报道,Big Defensin基因与软体动物免疫防御密切相关。文献[7,19]研究表明,海湾扇贝和蛤仔(Venerupis philippinarum)面对细菌攻击时,两者血细胞内的Big Defensin基因表达量显著上调,显示出该基因较强的抗菌活性;Li等[9]研究表明,魁蚶SbBDef1基因参与了自身的免疫应答过程,细菌侵染后其血细胞和肝胰腺中的SbBDef1基因均出现大量表达。此外,三角帆蚌(Hyriopsis cumingii)[20]、栉孔扇贝(Chlamys nobilis)[21]等研究中显示,Big Defensin基因同样在自身的机体免疫中起到重要作用。本试验结果与以往的研究结果相似,文蛤MmBD基因在重金属Cu2+胁迫下出现明显上调,尤其是36和72 h时,试验组MmBD基因表达量约为对照组表达量的5倍,2组差异极显著(P<0.01)。此结果说明,文蛤MmBD基因响应Cu2+胁迫下的免疫应答,该基因可能在文蛤抵御外界环境刺激时发挥一定功能,其免疫防御机制有待继续深入研究。
