植物类赖氨酸/组氨酸转运蛋白LHT基因家族的进化及在大豆中的功能研究
2022-11-01郝艳林周梦鑫李梦鸽韩群威李凤英
程 琳,郝艳林,周梦鑫,李梦鸽,韩群威,李凤英
(1. 信阳师范学院 生命科学学院, 河南 信阳 464000; 2. 信阳市林业科学研究所, 河南 信阳 464000)
0 引言
被子植物又称为开花植物,有超过30万种组成,占整个植物界的一半,为人类提供食物、氧气、能源、医药等资源[1-2]。所有的被子植物都发生过全基因组重复(whole genome duplication, WGD)事件[3-4]。在进化过程中,基因重复为物种进化提供充足的遗传物质,也是新基因产生的主要方式[5-6]。基因重复有多种类型,如串联重复、片段重复、全基因组重复(WGD)等[7]。其中WGD能够使基因组中所有基因增加一个拷贝,推动物种在生化和分子层面的根本性变革,导致物种的快速分化,影响最为深远[8-9]。在目前种质资源最丰富也是扩张最为成功的被子植物中,WGD事件更是普遍,为植物适应环境和物种分化提供了非常丰富的资源[10-12]。因而,对近期重复产生的基因拷贝丢失或保留的规律以及保留下来的旁系同源基因之间功能分化进行研究具有重要的意义。
植物体内的氨基酸在维持植物正常生长发育、代谢及抗逆反应中发挥着重要的作用。氨基酸转运蛋白(amino acid transporter, AAT)是一种膜整合蛋白,成员众多,在不同植物中其表达模式和功能表现出强烈的多样化[13]。近期氨基酸转运蛋白的工作证实其在细胞之间物质运输方面具有重要功能,如调节植物细胞内氧化还原反应平衡和防御反应相关基因的表达[14],负责氨基酸的输入、输出以及在韧皮部中的长距离转运等,对植物的生长发育及种子和果实中蛋白质含量起重要调控作用[15-17]。类似赖氨酸/组氨酸转运蛋白(lysine-histidine-like transporters,LHTs)基因家族属于氨基酸/生长素透性酶(amino acid/auxin permease,AAAP)超家族的一个分支,在拟南芥中AtLHT1参与根对土壤中氨基酸的吸收以及向库器官的转运过程[18]。AtLHT2具有对天冬氨酸和脯氨酸的高亲和力,参与氨基酸向孢子细胞的运输过程[19]。
在全球范围内,根瘤菌每年为农业提供4 000万吨的氮源[20-21]。然而,共生固氮具有严格的宿主专一性,仅限于豆科植物和少数非豆科植物。目前尚无法通过基因工程的方法实现重要禾谷类作物的共生固氮[22],因而进一步揭示共生固氮的分子机理,并最终通过遗传改良提高豆科植物与根瘤菌的结瘤固氮效率,对于实施农业资源的可持续发展具有重要意义。
大豆起源于中国,也是中国主要农作物之一,目前尚无大豆LHT同源基因及其编码蛋白家族其他成员的报道。自2010年大豆基因组公布至今[23],大豆基因组数据库不断完善。本文利用Phytozome数据库和相关生物信息学技术,对被子植物LHT基因家族的进化历史进行了分析,并对大豆中LHT同源基因的表达进行了探索,以期为进一步揭示和利用大豆LHT基因的功能提供理论依据。
1 材料与方法
1.1 实验材料
大豆根瘤菌USDA110由复旦大学生命科学学院王应祥教授惠赠;栽培大豆Willimas82由中科院东北地理所孔凡江研究员惠赠;百脉根种子(MG-20)、大肠杆菌菌株DH5α、发根农杆菌LBA1334、根瘤菌M.lotiMAFF303099和植物超表达载体p1301U均由华中农业大学微生物国家重点实验室生物固氮分子研究室惠赠;其余克隆载体、限制性内切酶、PCR所用试剂等购自Promega、TaKaRa等公司。
1.2 LHT蛋白氨基酸成员鉴定
从Phytozome v12.0(https://phytozome.jgi.doe.gov/pz/portal.html)下载目前已经完成基因组测序的被子植物代表物种,为了获得LHT基因家族全部的成员数目,采用BLASTP和HMMsearch相结合的方法在本地数据库中检索LHT基因家族成员。首先,利用已报道的拟南芥LHT家族成员蛋白序列[22]作为诱饵序列,本地BLASTP搜索数据库。其次,从Pfam数据库(http://pfam.xfam.org/)下载LHT蛋白质结构域的种子文件(PF00324和PF01490),使用HMMER(HMMER 3.1b1)的Hmmsearch程序,采用默认参数,搜寻蛋白质数据库。综合这两种方法获得LHT基因家族候选蛋白序列,通过Pfam和SMART(http://smart.embl-heidelberg.de/)[24]在线分析手动验证,最终确定该家族成员的数目。
1.3 序列比对及系统发生分析
采用mafft v7.215 (http://mafft.cbrc.jp/alignment/software/)对获取的LHT蛋白质序列进行比对,用RaxML v8.2.8 构建最终的最大似然法(maximum likehood,ML)树,参数设置为:JTT(jones, taylor and thorton)氨基酸替换模型,gamma分布以及进行100次bootstrap replicates。
1.4 大豆LHT同源基因及编码的蛋白质的生物信息学分析
利用生物信息学分析软件GSDS和TMHMM(http://gsds.cbi.pku.edu.cn/;http://www.cbs.dtu.dk/services/TMHMM/)分别对LHT基因内含子与外显子结构、跨膜区进行分析。利用MEME(http://meme-suite.org/index.html)在线平台对LHT蛋白序列进行保守基序(motif)分析,最大基序检索数值设为20,最适基序长度在6~50个氨基酸残基之间。
1.5 大豆LHT同源基因表达分析
对大豆不同发育时期和组织的RNA-seq数据进行了分析,包括根、茎、幼苗、叶、花发育的4期、种子等[24]。利用R语言绘制基因的表达热图。
1.6 大豆幼苗培养和荧光定量PCR分析
用Trizol Reagent(Invitrogen)提取不同时期大豆材料不同组织材料的总RNA。使用NANODROP ONE(Thermo)检测RNA样品浓度和纯度,样品置于-80 ℃保存。使用TIANGEN公司反转录试剂盒操作说明反转录获得cDNA第1链,随后以其为模板按照BIOTAKE公司Power 2×SYBR Real-time PCR Premixture操作说明进行qRT-PCR反应(LightCycler 96, Roche)。内参为大豆β-actin基因。qRT-PCR反应体系为10 μL Power 2×SYBR Premixture,0.4 μL Forward Primer(10 μm),0.4 μL Reverse Primer(10 μm),1 μL cDNA,0.4 μL ROX,7.8 μL超纯水至20 μL反应体系。采用三步法反应,PCR反应程序为95 ℃预变性2 min;95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s;45个循环。每个样品进行3次生物学重复,根据CT值进行目标基因相对表达量2-ΔΔCT进行目标的计算[25]。
1.7 大豆GmaLHT17基因的克隆及植物超表达载体的构建
参照MiniBEST Plant RNA Extraction Kit (TaKaRa)说明书的操作流程,提取大豆总RNA。取500 ng总RNA,使用FastQuant RT Kit (TIANGEN)合成cDNA第一条链。根据大豆基因组注释信息(Phytozome)获得大豆LHT17基因的序列,利用Primer Primer 5.0软件进行引物设计,随后进行PCR扩增。将扩增获得的目的片段连接到T载体上测序。将测序结果正确的GmaLHT17基因插入到植物表达载体p1301U中,酶切位点为KpnI和BamHI。构建完成的p1301U-GmaLHT17超表达载体经过酶切鉴定和测序后,将重组质粒经冻融法转入发根农杆菌菌株LBA1334中,用于百脉根的发根转化。
1.8 百脉根毛根转化及“复合体”植株的获得
百脉根种子用次氯酸钠进行表面消毒,无菌水冲洗5次后,22 ℃暗培养2~3 d,待种子萌发后移入MS培养基。待幼苗胚根长约1 cm时将其剪掉,收集子叶作为待侵染外植体。将剪掉胚根的子叶在发根农杆菌菌悬液(OD6000.6)中侵染15~20 min,将外植体移入MS培养基中,暗培养3~5 d,然后将其转移至含有300 mg/L 羧苄的MS筛选培养基中,培养2周。然后进行GUS染色鉴定,将不显蓝色的阴性毛根切除,此时获得的植株即为百脉根“复合体”植株。
1.9 百脉根“复合体”植株的结瘤处理
在YMA培养基中培养百脉根中生根瘤菌M.lotiMAFF303099至OD600大于1.0, 4 000 r/min离心10 min,用YMA液体培养基将菌体重悬,然后接种至1.8节中获得的百脉根“复合体”植株中。接种28 d后,将沙盆中的百脉根植株用流动水冲洗干净,置于平皿中统计结瘤数目,进行显著性差异分析。然后提取根瘤RNA,方法同1.7节中所描述。
2 结果与分析
2.1 被子植物代表物种中LHT基因家族成员的数量与全基因组重复有关
目前已有的基因家族研究主要是基于某单个物种,如大豆、水稻、拟南芥、马铃薯等。但是单个物种中LHT基因并不足以建立起整个被子植物的LHT基因分子进化关系。为了重建被子植物中该基因家族的分子进化结构,利用隐马尔可夫模型(HMM)在被挑选的物种中搜寻LHT基因。这些物种包括5种核心真双子叶植物和4种单子叶植物,这9个物种均已完成了全基因组测序。之后,根据序列比对,手动去除质量较差的序列,最终获得114个LHT基因,如表1所示。很明显,这些物种中祖先经历过更多全基因组重复事件的物种基因组内有更多的LHT基因成员(表1),多经历了两轮全基因组重复的豆科植物大豆的基因数目(25)高于同科的苜蓿(19)、菜豆(14)和百脉根(8)。这些结果暗示LHT基因家族在植物进化的过程中一直在持续扩张,并且其扩张与全基因组重复密切相关。
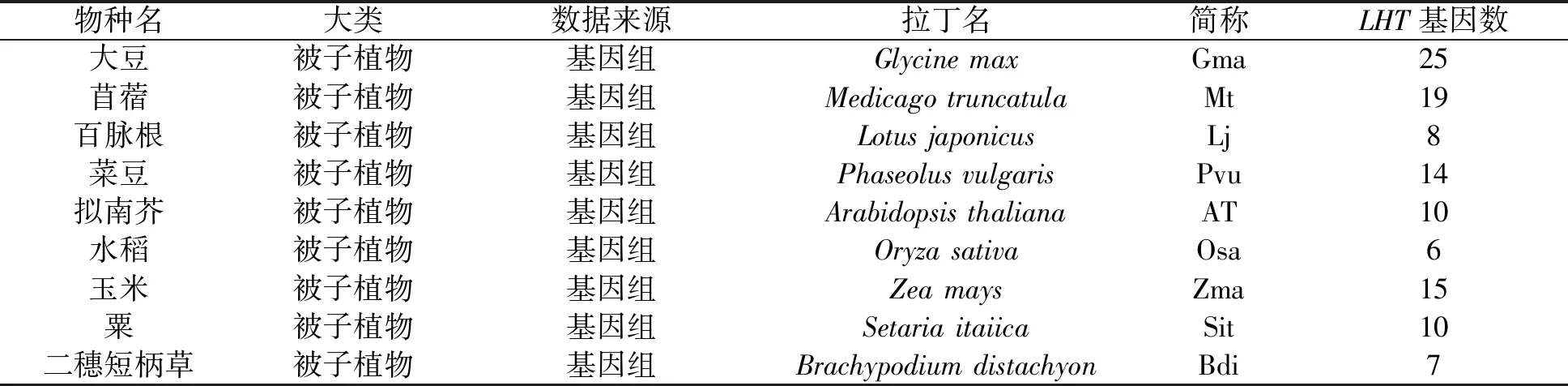
表1 选取的被子植物分类及数据情况Tab. 1 The classification and data of the selected angiosperms
2.2 被子植物中LHT基因家族的系统发生
选取代表物种的LHT蛋白全长序列,利用ML对其进行系统发生树的构建。基于蛋白质全长序列的系统发生分析结果显示,LHT基因可以分为具有不同支持率(43%~98%)的7大类:Ⅰ—Ⅶ。除分支Ⅱ和Ⅲ外,其余均含有单子叶和双子叶植物成员。分支Ⅱ为双子叶植物特有,分支Ⅲ为单子叶植物特有。分支Ⅲ中来自水稻、玉米、粟和二穗短柄草的LHT基因并未严格按照物种界限聚类,而是混合分布(图1)。

图1 LHT系统发生树和基因结构Fig. 1 Phylogenetic tree and gene structure of LHT
这些分析表明,该分支基因的起源应该在水稻、玉米、粟等禾本科植物分开之前,且有可能经历了禾本科植物祖先的多次全基因组加倍事件以及后期各自独立进化过程中的谱系筛选。其余分支(Ⅰ、Ⅳ—Ⅶ)是具有单子叶植物和双子叶植物成员的复杂分支。在这些分支中,双子叶植物和单子叶植物的LHT基因成员并未按照谱系差异分开,而是互相混合在一起,形成支持度高低不同的小分支。这种拓扑结构暗示这些基因可能经历了被子植物的WGD事件。
2.3 大豆LHT旁系同源基因共线性及进化历史构建
染色体定位分析表明,LHT基因在被子植物基因组中的分布没有特定的规律,多散布在多个染色体上。如在大豆中含有25个LHT基因,这25个基因毫无规律地分布在1号、2号、4号、5号、6号、10号、11号、12号等染色体上(表2)。另外,进一步的共线性分析表明,大豆LHT基因扩增过程中,WGD或串联重复扮演了极为重要的角色,鉴定出大豆的25个LHT基因,64%的同源拷贝是WGD或串联重复的结果(图2A)。根据进化树拓扑结构和共线性分析,重构了大豆LHT旁系同源基因的进化历史(图1,图2B)。在单双子叶植物分化之前,存在有4个LHT祖先基因,第一和二个祖先基因在13×106a之前又分别经历了一次加倍,而第四个则在单双子叶植物分化前首先经历了一次基因加倍事件。随后,分别经历了13×106a的豆科植物的全基因组重复事件,最终在大豆基因组中保留了8对旁系同源基因(图2B)。
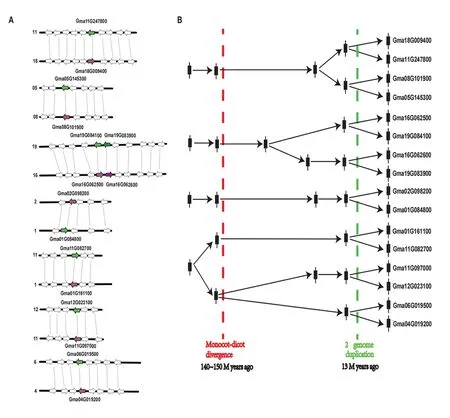
图2 大豆LHT基因的共线性分析及进化分析Fig. 2 Collinearity analysis and evolution analysis of soybean LHT genes
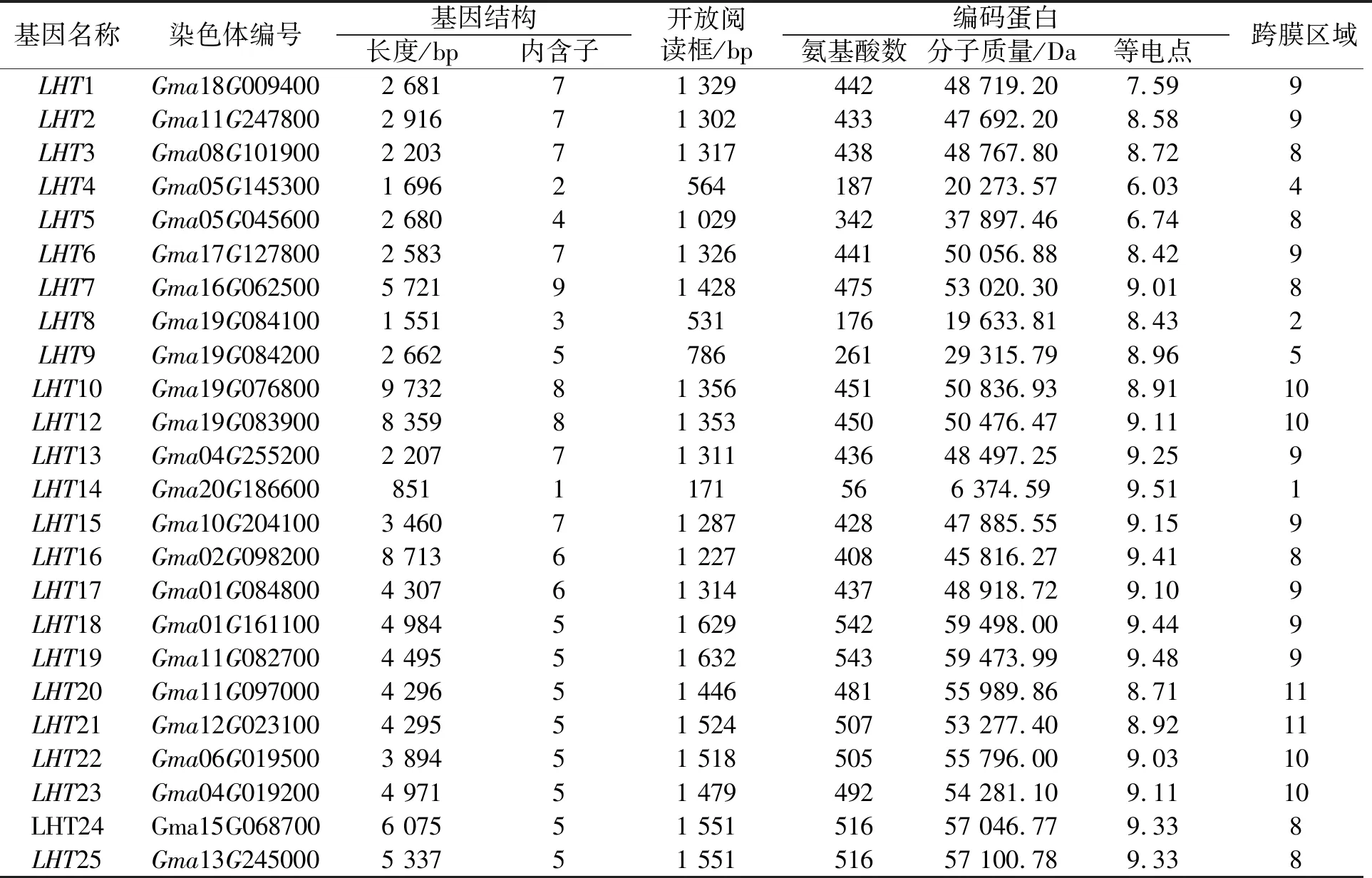
表2 大豆LHT基因成员信息Tab. 2 Member information of soybean LHT genes
2.4 大豆旁系同源基因Ka/Ks和功能分化分析
非同义替换率(Ka)与同义替换率(Ks)的比值是鉴定蛋白质在进化过程中所承受选择压力的一个重要指标。当Ka/Ks>1时为正达尔文选择,Ka/Ks=1时为中性进化,Ka/Ks<1时为净化选择。为了研究大豆LHT旁系同源基因功能分化机制,对大豆8对旁系同源基因编码序列的Ka和Ks进行计算(表3),Ka/Ks值均小于1(0.15~0.47),平均值为0.30,表明较强的净化选择在全基因组复制后基因功能的分化中发挥着关键作用。
2.5 大豆LHT同源基因结构及其编码蛋白的跨膜区、结构域分析
为了研究大豆LHT基因的序列特征,分别对Ⅰ—Ⅶ类的序列进行基因结构及跨膜区进行分析。可以看出(图1、图3),在同一类群内部,大部分成员具有共同或类似的结构域(数据未列出)组成,提示它们可能具有相似的功能。进一步蛋白结构分析表明,除Gma20G186600外,其余成员完整的二级结构均具有2个及以上跨膜区(图3),推测这与其主要行使氨基酸转运的功能相关。同时,对不同类群的LHT基因组序列进行了内含子/外显子组成分析。
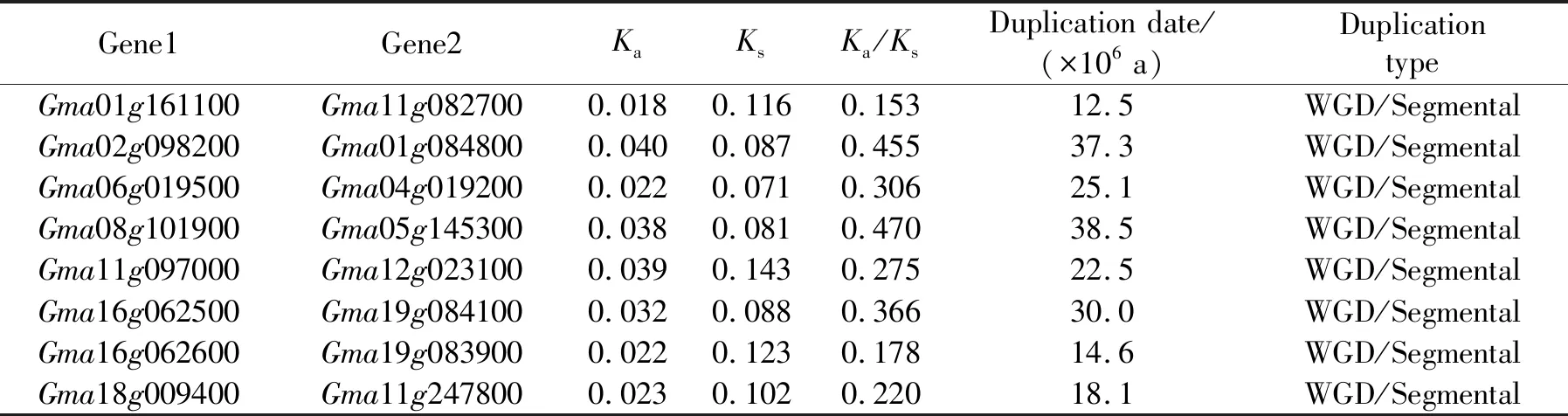
表3 大豆LHT基因Ka、Ks估算Tab. 3 Estimation of Ka and Ks of soybean LHT genes
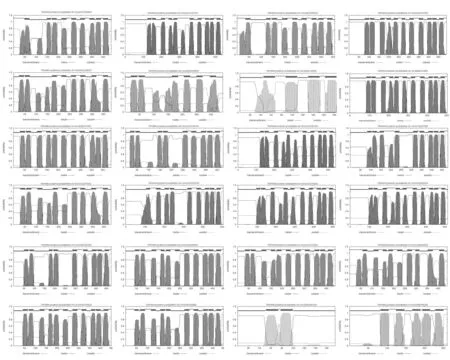
图3 大豆LHT基因跨膜分析Fig. 3 Transmembrane analysis of soybean LHT gene
结果表明,每一个类群内部,其大部分成员具有相似的内含子/外显子组成,包括内含子类型、内含子数量以及外显子长度。而编码保守蛋白质结构域的序列,内含子/外显子结构的相似度更高,如类群Ⅳ的6个成员均具有相同的基因结构和motif组成。另一方面,不同类群之间内含子数目构成差异较大,从1个(类群Ⅴ)到9个(类群Ⅱ)(图2)。
2.6 大豆GmLHT基因的表达模式分析
对大豆LHT家族基因在子叶、根、茎、叶、花、花蕾、种子、根瘤等部位中的表达情况进行分析发现:除Gma20G186600外,其余成员的表达可以分为两类:一类为组织特异性表达基因,如Gma18G009400/Gma11G247800和Gma08G101900/Gma05G145300,在花发育过程中表达量最高,在其他组织中表达量很低,推测这些成员可能参与了大豆花的发育过程;Gma06G019500/Gma04G019200分别在花和叶芽中表达量最高,暗示着其可能在花芽分化过程中发挥着重要作用。第二类主要是一些非组织特异性表达的基因,如Gma15G068700、Gma13G245000在多个组织中均有低水平表达。进一步对表达特性不同的成员的进化簇分布情况分析发现:一些组织特异性表达的基因主要分布在Group Ⅰ、Ⅱ和Ⅶ(图4)。
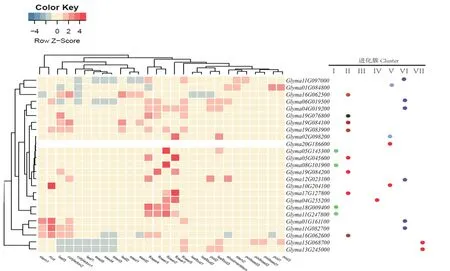
图4 大豆LHT家族成员的表达模式分析及亚家族分布Fig. 4 Expression pattern analysis and sub-family distribution of LHT family members in soybean
2.7 大豆GmLHT基因的组织表达分析
基于qRT-PCR技术,进一步分析这25个LHT基因在大豆的根、茎、叶,接种根瘤菌的根、茎、叶和根瘤等7个组织中的表达特征。以持家基因β-actin为内参,定量分析表明,25个大豆LHT基因具有完全不同的表达模式,呈现多样化(图5)。GmaLHT1/2/3/6/19/19在接种根瘤菌后大豆叶片中表达量较高,如GmaLHT2在接种根瘤菌后大豆叶片中的表达量是未接种的叶片的近400倍;GmaLHT4/13接种后的茎中特异性表达,特别是GmaLHT4,表达量升高了近1 560倍;GmaLHT9/15在接种根瘤菌后大豆的根中特异性表达。属于同一组的不同基因具有不同的表达特征,表明其在进化的过程中,家族内同类基因表现出结构的相似性和功能分化的多样性。
2.8 GmaLHT的超表达促进结瘤
为了检测GmaLHT基因的生物学功能,利用农杆菌介导的毛根转化技术,将构建的超表达载体和空载体分别导入百脉根毛根中,然后接种M.lotiMAFF303099根瘤菌4周后统计结瘤数目。结果显示,GmaLHT17-OX植株的结瘤数目与对照相比明显增加,对照组平均每棵植株结瘤数目为4.9,GmaLHT17-OX为11.2(图6)。百脉根超表达植株根瘤的实时荧光定量PCR检测结果显示(图6D),在超表达GmaLHT17-OX中GmaLHT17基因 mRNA的表达水平为对照的13.6倍,表明超表达载体的构建有效。因此,GmaLHT17基因的超表达能够引起植株结瘤数目的增加。
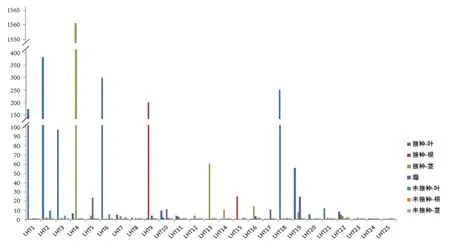
图5 LHT基因在大豆不同组织中的qRT-PCR分析Fig. 5 qRT-PCR analyses of LHT genes in different tissues of soybean
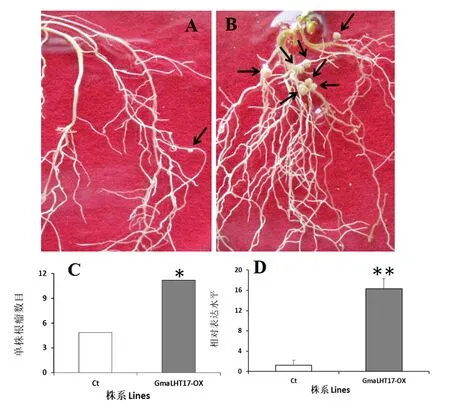
注:A)对照,Ct. p1302G (对照);B)转基因根毛结瘤,GmaLHT17-OX. GmaLHT17-p1302;C)转基因毛根的结瘤数目;D)转基因毛根中GmaLHT17的转录水平。*和**分别表示对照与超表达株系间在0.05和0.01水平存在显著性差异。
3 讨论
3.1 LHT基因家族的起源和进化
LHT基因在植物防御、发育等方面承担着多种重要的生理功能[18-20]。通过全基因组扫描,在被子植物代表物种中获得114个LHT基因,但是在绿藻中没有找到LHT基因的同源拷贝,说明该基因家族为陆生植物所特有,而且该基因数量的大规模扩增主要发生在后期的谱系进化过程中。对大豆LHT基因染色体定位和共线性分析表明,染色体片段的复制和全基因组加倍事件可能对其在不同进化阶段的扩增产生重要影响。目前有更多的证据证实,在植物进化的历史中存在多次全基因组重复事件,其中包括发生在十字花科谱系的2次比较近的α和β事件[10,12,26],所有真双子叶植物共有的一次三倍化事件(γ)[4],以及发生在单子叶植物的谷物和其他禾本科草类分化之前的ρ和σ事件[8-9]。在豆科的历史上也发生过一次全基因组重复事件,2010年完成的大豆全基因组测序不仅确认了这次全基因组重复(53 ×106a),还发现了一次大豆特有的更近期的全基因组重复(13×106a)[23]。根据系统发育树,结合染色体定位和共线性等资料表明,大豆LHT基因家族中的很多片段重复可能都源自植物进化过程中不同阶段发生的全基因组重复事件。因此,LHT基因家族在大豆中是一个比较古老的基因家族,其成员经历了大范围的WGD、染色体片段重复等扩增方式,在大豆基因组中保留下来,进而分化出不同的功能。从进化树还可看出,几乎所有的基因在9个物种中都有分布,少见有大规模丢失的情况,这表明,在被子植物的共同祖先中,多拷贝的保留或丢失可能在物种分化前就已经完成,而不是在物种分化完成后在不同物种中独立丢失。
3.2 大豆LHT基因家族的扩张与全基因组重复相关
从图1可以看出,基因组重复对LHT基因家族的扩张具有重要意义,经历过全基因组重复的物种类群中LHT基因数量相对高于其他近缘物种,特别是大豆,其数量约是同科物种菜豆的2倍,百脉根的3倍。大豆特有的全基因组重复约发生在13×106a前,距今时间短,大量基因得以保留。结合转录组数据分析可知,这些复制后保留下来的基因序列同源性较高,但表达模式已出现分化。同时,还发现在分子进化树中,几乎所有基因拷贝数增加的事件都能够与已知的全基因组重复事件对应,表明在被子植物种WGD对基因家族扩张的贡献要远远大于其他类型的基因重复。
3.3 大豆重复基因进化过程中的功能分化
植物遭遇环境胁迫或者掠食者时不能像动物一样移动逃离,只能依靠自己遗传变异来抵抗外界伤害。全基因重复是进化的主要驱动力之一,而基因重复及重复后的分化是新基因产生、提高物种适应性以及产生新物种的基础[27-28]。基因家族的扩张依赖基因拷贝数的增加,而基因拷贝数的增加则与基因功能分化密切相关。基因重复后会发生基因的丢失和保留,保留下来的基因则可以维持原有功能或发生分化[29-30]。大部分保留下来的重复基因存在一定的功能偏好性,与物种自身的生理变化相关,帮助其更好地适应环境,同时,也会推动基因调控网络的进化[31-32]。根据对大豆LHT旁系同源基因对表达数据的分析,不难发现,8对旁系同源基因的表达情况有所不同,有的具有相同表达模式,有的则明显不同。这些结果表明,这些基因在大豆中已经发生了功能分化,并且对应了基因功能分化的不同类型。
3.4 大豆LHT基因促进豆科植物结瘤效率
豆科植物固氮占整个生物固氮量的75%,而共生固氮涉及根瘤菌与植物根部细胞之间的识别、互作、结瘤和固氮基因的表达以及二者之间信息网络的建成和传递,因而共生结瘤固氮始终是生物固氮研究领域中最受关注的部分之一。目前,发根农杆菌介导的毛根转化方法已成为根系生物学研究的一种高效快捷的方法。本研究中构建了大豆GmaLHT17基因的超表达载体,通过发根农杆菌LBA1334菌株介导的遗传转化法,获得了百脉根超表达阳性毛根。首次通过实验证实了超表达大豆GmaLHT17能够显著增加百脉根的结瘤数目,结合实时荧光定量PCR结果,推测GmaLHT17基因可能在根瘤菌与植物互作共生的早期阶段发挥作用,从而正调控结瘤的过程。而该基因通过哪种调控途径来影响植株结瘤,还需要后期的大量实验数据来揭示其具体调控机制。
4 结论
基于9种已全基因组测序的被子植物代表物种的数据库,发掘出114个LHT家族成员,属于7个亚家族,在染色体上的分布没有明显规律。大豆中含有25个成员,成员数目远多于其他物种,其中有8对旁系同源基因,共线性分析表明大豆LHT基因家族的扩张与全基因组重复相关。大豆中LHT编码的蛋白在56~543个氨基酸残基之间,含有1~11个不等的跨膜结构域,跨膜结构域对功能具有重要作用。它们在大豆中不同发育阶段的表达模式各不相同,通过在百脉根毛根中超表达GmaLHT17基因证实,其参与豆科植物结瘤固氮过程,推测可能在根瘤菌与植物互作共生的早期阶段发挥作用,正调控结瘤的过程。对大豆LHT基因家族的分析及成员的功能研究,为提高大豆氨基酸含量及大豆氮肥利用效率的大豆新品种培育,提供重要的基因资源和理论基础,具有重要的理论意义和应用前景。
