多奈哌齐血药浓度及其代谢酶CYP3A4基因多态性在轻中度Alzheimer’s病治疗中的应用
2022-10-29李倩马文颖汤凡宇肖红赵连东石静萍
李倩,马文颖,汤凡宇,肖红,赵连东,石静萍
Alzheimer’s病(AD)是最常见的痴呆类型,其胆碱能系统的异常是最为突出和严重的,胆碱能神经退行性病变的程度与记忆障碍的严重程度密切相关[1]。多奈哌齐(DNP)是目前临床常用的胆碱酯酶抑制剂,该药具有半衰期长,不良反应小,患者耐受性好等特点[2-3]。但文献[2-3]报道,不同患者对DNP治疗的反应不同,其有效应答率相差20%~60%。DNP血药浓度的变化及其代谢酶的基因多态性可能是造成个体疗效差异较大的原因之一。肝药酶CYP3A4是DNP的主要代谢酶[3-4],国人多态频率较高的位点为CYP3A4*18B和CYP3A4*1G。有研究[3-4]表明CYP3A4酶活性可影响患者DNP血药浓度,但目前关于CYP3A4*18B和CYP3A4*1G基因多态性对患者DNP血药浓度的影响并不清楚。国外研究[5]认为将DNP血药浓度控制在50~75 ng/ml较为合适。国内目前尚无DNP治疗AD有效血药浓度的推荐范围。考虑到人种及药物代谢等差异,欧美国家的标准未必适合国人,故本研究将探讨DNP治疗AD的有效血药浓度,并分析其代谢酶CYP3A4基因多态性对DNP血药浓度的影响,为AD的DNP个体化治疗提供参考。
1 对象与方法
1.1 对象 筛选2019年10月至2021年4月于南京医科大学附属脑科医院神经内科首次就诊未服药的轻中度AD患者,并收集其临床资料。入组标准:(1)符合美国国立老化研究所与AD协会诊断标准(2011)中很可能的AD标准[6];(2)年龄50~85岁;(3)MMSE评分为10~26分且无听力视力等障碍;(4)能够基本理解并完成本实验中的各项检测。排除标准:(1)其他原因导致的非AD型痴呆;(2)服用其他胆碱酯酶抑制剂或美金刚者;(3)既往有甲状腺功能减退、抑郁症、强迫症、焦虑症等精神症状病史;(4)不能长期耐受服用DNP或长期服用被CYP3A4广泛代谢的药物(抗胆碱能药、抗惊厥药、抗精神病药等)者。本研究经过南京医科大学附属脑科医院伦理委员会批准(2020-KY097-01),所有受试者在入组前均签署了知情同意书。
1.2 方法
1.2.1 神经认知心理量表检测 所有受试者均在服药前由南京医科大学附属脑科医院心理测评室专业测评医师进行认知量表检测,包括MMSE、汉密尔顿抑郁量表(HAMD)和汉密尔顿焦虑量表(HAMA)。服药6个月后,再次对患者进行MMSE量表复评及临床印象变化量表(CIBIC-plus)评定。其中,MMSE评估患者总体认知功能;HAMD和HAMA进一步排除患者存在抑郁、焦虑等情绪问题;CIBIC-plus评估患者服药6个月后的临床症状变化情况。
1.2.2 给药方案 所有受试者量表评估后即开始于晚间21:00~22:00服用DNP[商品名:安理申,卫材(中国)药业有限公司]5 mg,服药1个月后门诊空腹检查受试者肝肾、凝血功能等排除药物不良反应,并根据患者和照料者对患者认知、生活能力变化情况及药物不良反应等综合分析,将可耐受DNP、认知、生活能力较服药前无改善的患者,剂量调至10 mg,服药6个月后进行DNP血药浓度、代谢酶CYP3A4基因多态性检测。
1.2.3 疗效评判标准及有效血药浓度 根据国际临床健康研究所标准[7],有效组患者需同时满足以下两个条件:复评时MMSE评分较前无下降;6个月复诊时CIBIC-plus评定为好转或无变化。不满足上述条件之一者则属于无效组。取所有有效组患者DNP血药浓度平均值作为本次研究的最终结果,即DNP治疗AD的有效血药浓度范围。
1.2.4 测定DNP血药浓度 采用高效液相色谱-串联质谱法检测药物浓度,采血时间为早晨9:00~10:00餐后。以0.1%甲酸水溶液为流动相A,0.1%甲酸甲醇溶液为流动相B。取标线,质控,内标。取血清样品100 μl,加入400 μl内标液,涡旋混合3 min,于4 ℃ 11 000 r/min离心15 min,取上清液300 μl,于4 ℃ 11 000 r/min离心15 min,取100 μl上清液上样分析[8]。
1.2.5CYP3A4基因多态性测定 采用数字荧光分子杂交技术检测基因多态性。在1.5 ml离心管中分别加入1.2 ml 1×NH4CL预处理液及150 μl静脉血混匀,上下颠倒10次,室温静置5 min。3 000 r/min离心5 min,弃上清。取1.5 μl耀金保处理过的白细胞混悬液,加到1支短暂离心后的耀金分/耀金染试剂中,充分混匀并短暂离心,上机检测SNP位点:CYP3A4*18B(A>G, rs28371759)、CYP3A4*1G(C>T, rs2740574)。
以上检测过程均严格遵守试剂及仪器的使用规范及《全国临床检验操作规程》。
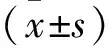
2 结 果
2.1 分组及临床资料比较 见表1。本研究对70例服药的AD患者进行定期随访,其中有效患者49例,无效患者21例,两组间性别、年龄、受教育程度及MMSE初始得分差异无统计学意义。
表1 有效组和无效组临床资料比较[±s,例(%)]
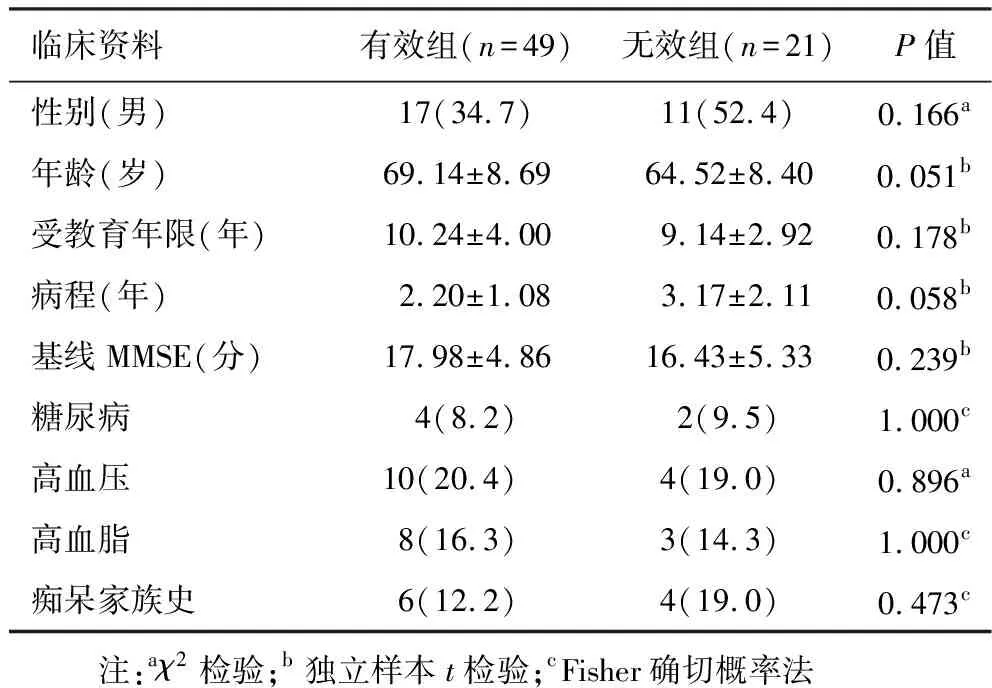
表1 有效组和无效组临床资料比较[±s,例(%)]
临床资料有效组(n=49)无效组(n=21)P值性别(男)17(34.7)11(52.4)0.166a年龄(岁)69.14±8.6964.52±8.400.051b受教育年限(年)10.24±4.009.14±2.920.178b病程(年)2.20±1.083.17±2.110.058b基线MMSE(分)17.98±4.8616.43±5.330.239b糖尿病4(8.2)2(9.5)1.000c高血压10(20.4)4(19.0)0.896a高血脂8(16.3)3(14.3)1.000c痴呆家族史6(12.2)4(19.0)0.473c 注:aχ2检验;b独立样本t检验;cFisher确切概率法
2.2 AD患者DNP血药浓度分析 本组AD患者DNP血药浓度个体差异性大。其中,服药5 mg DNP的平均血药浓度为(25.68±10.57)ng/ml(最大值56.69 ng/ml,最小值8.41 ng/ml),服药10 mg DNP的平均血药浓度为(51.36±9.47)ng/ml(最大值69.95 ng/ml,最小值25.10 ng/ml)。患者治疗前后MMSE平均分值和DNP治疗血药浓度无明显相关性(r=0.228,P=0.057)。
2.3 两组DNP血药浓度的比较 有效组中,6例患者服药5 mg,平均血药浓度为(47.63±8.13)ng/ml;43例患者服药10 mg,平均血药浓度为(52.80±6.85)ng/ml;所有有效组患者DNP的平均血药浓度为(52.17±7.13)ng/ml,DNP治疗AD的有效血药浓度范围为45~59 ng/ml。无效组中,7例患者服药5 mg,平均血药浓度为(23.83±4.13)ng/ml;14例患者服药10 mg,平均血药浓度为(46.92±16.39)ng/ml;所有无效组患者DNP平均血药浓度为(39.23±16.25)ng/ml。无效组患者血药浓度明显低于有效组(均P<0.01)。
2.4 无效组DNP血药浓度分析 无效组21例患者中,12例患者DNP血药浓度明显低于45 ng/ml,5例患者DNP血药浓度明显高于59 ng/ml。4例DNP血药浓度在有效范围中的患者,其中1例患者存在血管紧张转化酶ACE基因突变(有研究[9]表明,ACE为AD的易感基因);1例患者颅脑MRI提示额叶低灌注,早期存在精神行为症状,额颞叶痴呆不能排除;另外2例患者原因不明,但临床症状发展较快,半年随访量表评分下降≥4分。
2.5CYP3A4基因多态性 见表2。患者CYP3A4*18B和CYP3A4*1G基因多态性分布符合Hardy-Weinberg群体遗传学平衡定律[10](均P>0.05),样本具有代表性。
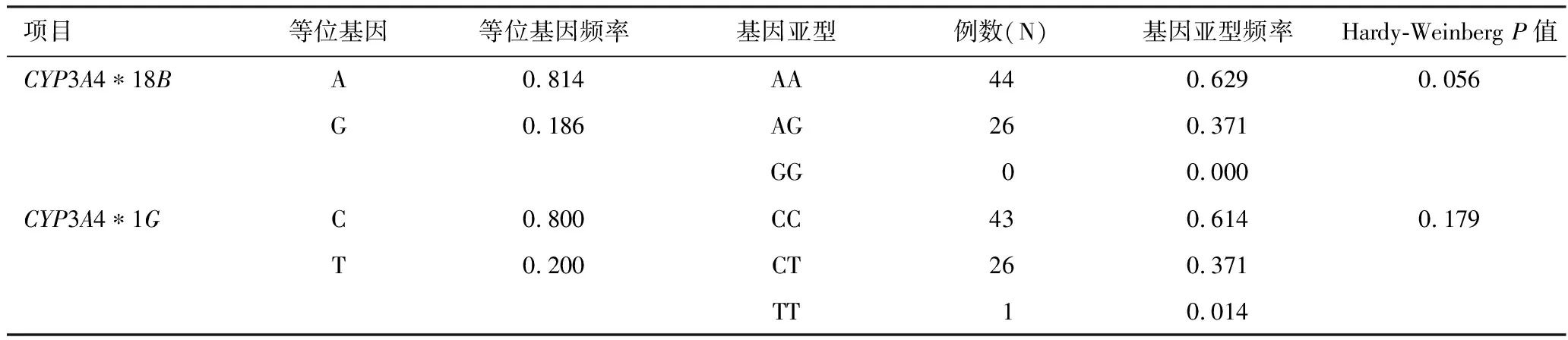
表2 CYP3A4基因多态性检测分布表
2.6CYP3A4基因多态性对DNP血药浓度的影响 由于GG和TT型携带者较少,故主要对AA、AG、CC和CT基因亚型进行分析。服用DNP 5 mg时,AG型携带者血药浓度[(29.41±11.72)ng/ml]明显高于AA型携带者[(23.63±9.37)ng/ml](P<0.01);CT型携带者血药浓度[(28.81±10.24)ng/ml]与CC型携带者[(24.43±10.84)ng/ml]差异无统计学意义。服用DNP 10 mg时,AG型携带者血药浓度[(59.62±5.41)ng/ml]明显高于AA型携带者[(46.54±7.88)ng/ml],CT型携带者血药浓度[(58.09±5.47)ng/ml]明显高于CC型携带者[(47.79±8.40)ng/ml](均P<0.01)。
此外,将CYP3A4*18B和CYP3A4*1G联合比较分析。服药5 mg时,同时携带AA、CC型患者DNP血药浓度[(23.14±9.65)ng/ml]与同时携带AG、CC型患者[(26.21±9.32)ng/ml]、同时携带AA、CT型患者[(27.50±6.18)ng/ml]和同时携带AG、CT型患者[(29.12±11.11)ng/ml]差异无统计学意义;服药10 mg时,同时携带AA、CC型患者DNP血药浓度[(44.83±7.66)ng/ml]明显低于同时携带AA、CT型患者[(54.14±3.97ng/ml)]、同时携带AG、CC型患者[(56.24±4.7)ng/ml]和同时携带AG、CT型患者[(60.32±4.75)ng/ml](均P<0.01)。
2.7CYP3A4基因多态性与MMSE治疗前后平均分值的相关性 相关性分析结果显示,CYP3A4*18B基因AA、AG基因亚型和CYP3A4*1G基因CC、CT基因亚型与MMSE治疗前后平均分值均不存在相关性(P=0.479;P=0.744),排除入组患者的认知水平对本研究基因结果的可能偏倚。
3 讨 论
DNP是治疗AD的一线用药,有效的药物浓度是提高大脑皮质乙酰胆碱含量、改善认知的关键。然而,相同剂量下DNP的血药浓度个体差异性较大,考虑可能与其主要代谢酶的基因多态性有关。介于以往对DNP血药浓度和肝药酶CYP2D6基因多态性的相关性已有较为一致的结论[4,10],故本文仅探讨CYP3A4基因多态性对DNP血药浓度的影响。
研究[11]发现,DNP血药浓度波动大,且血药浓度影响疗效。服用5 mg DNP 3周后,血药浓度为7.8~65.4 ng/ml,而服用10 mg DNP 3周后,血药浓度则为17.2~53.7 ng/ml[11]。本研究观察结果也得出相似结果,服用DNP 5 mg,患者血药浓度最大值56.69 ng/ml,最小值8.41 ng/ml,而服药10 mg时,血药浓度最大值69.95 ng/ml,最小值25.10 ng/ml,个体差异性极大,表明在治疗过程中定期对患者血药浓度进行监测很有必要,尤其对于这种存在记忆障碍且已知服药依从性差的AD患者,适当增加血药浓度监测次数,进行个体化药物浓度的调节,有利于提高患者临床疗效和服药依从性。在无效组中,部分患者血药浓度明显较低,服药效果不明显,部分患者血药浓度在正常值范围内,但存在AD的易感基因,部分患者血药浓度较高,但并未如期产生增强效应,反而易产生不良反应。此外,在监测的过程中,本研究发现4例血药浓度超过87 ng/ml的患者出现恶心、呕吐等较严重的胃肠道反应。本研究根据定期随访进行药物浓度监测发现,使用DNP治疗AD的有效血药浓度范围为45~59 ng/ml。通过有效组和无效组血药浓度比较可以看出,DNP治疗AD,血药浓度过高或过低都将弱化临床疗效,无效组患者DNP血药浓度大部分偏低,离散程度大,而有效组DNP血药浓度明显趋势集中,表明AD治疗期间,DNP血药浓度需要达到一定范围方能起效。
CYP3A4是广泛分布于成人肝脏和肠道的代谢酶,具有多种遗传表型,可导致高达十倍以上的药物个体差异性[12]。目前关于CYP3A4基因多态性对AD患者DNP血药浓度及体内代谢影响的研究并不多。有研究[13]表明,CYP3A4基因多态性和AD患者DNP血药浓度及临床疗效间无显著相关性。但Lu等[13]通过高效液相色谱法对77例AD患者进行检测发现,CYP3A4多态性对左旋-DNP的代谢产物6-ODD浓度无影响,但可提高右旋-DNP的代谢产物6-ODD浓度。本研究结果发现,CYP3A4基因多态性影响DNP血药浓度。CYP3A4*18B-G等位基因和CYP3A4*1G-T等位基因携带者的血药浓度均高于未携带者,在服药10 mg患者中,差异更显著。浓度差异可能是因为CYP3A4*18B-G和CYP3A4*1G-T等位基因可降低CYP3A4代谢酶活性,从而增加DNP血药浓度。故临床用药需要根据CYP3A4基因多态性,适当调整服药剂量。
本研究存在以下不足:(1)未对DNP代谢产物浓度进一步检测;(2)总体样本量较小,分析CYP3A4基因多态性存在一定局限性。
综上所述,服用DNP治疗AD时,有效血药浓度范围为45~59 ng/ml。CYP3A4*18B和CYP3A4*1G的不同基因亚型,对DNP的药物浓度产生不同的影响。血药浓度监测和CYP3A4基因多态性检测可为指导AD患者DNP个体化治疗提供参考。
