不同月龄C57BL/6J小鼠耳蜗线粒体和NAD+水平比较
2022-10-21冯宝怡董庭婷郑晓飞
冯宝怡,董庭婷,郑晓飞,陶 永,吴 皓
1.上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海 200011;2.上海交通大学医学院耳科学研究所,上海 200092;3.上海市耳鼻疾病转化医学重点实验室,上海 200092;4.上海交通大学医学院附属第九人民医院样本库,上海 200092
WHO 调查显示,年龄相关性听力下降在60 岁以上人群中发病率达42%,可造成严重的社会及经济负担[1]。年龄相关性听力下降病因复杂,其危险因素包括耳蜗老化、环境因素、遗传易感性、家族史和合并疾病等[2]。年龄相关性听力下降可伴有耳蜗感觉毛细胞和螺旋神经节的丢失,以及血管纹萎缩等一系列听觉系统的退行性病变。SCHUKNECHT 根据人类内耳病理分型将年龄相关性听力下降分成4 型,分别是感音性、神经性、血管纹性及机械性年龄相关性听力下降,但导致年龄相关性听力下降的机制尚无定论。线粒体的受损、氧化还原失衡及线粒体DNA 的损伤导致耳蜗老化及感觉细胞的退行性病变很可能是年龄相关性听力下降的原因[3]。已有研究[4]表明,线粒体在多个方面参与年龄相关性听力下降的发生发展,包括线粒体DNA 突变、线粒体能量代谢异常及凋亡调节异常等。而烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)参与线粒体重要的能量代谢活动及多种细胞活动,在细胞衰老中也起到重要作用[5]。本研究拟通过观察不同月龄C57BL/6J 小鼠耳蜗中的线粒体能量代谢中氧化磷酸化 相 关 基 因Ndufb5(NADH: ubiquinone oxidoreductase subunit B5) 、Sdha(succinate dehydrogenase complex flavoprotein subunit A)、Sdhc(succinate dehydrogenase complex subunit C)和Atp5b(ATP synthase, H+transporting mitochondrial F1 complex,beta subunit)的表达水平及NAD+水平的变化,听性脑干反应(auditory brain response,ABR)、畸变产物耳声发射(distortion product otoacoustic emission,DPOAE)的听阈改变,以及耳蜗线粒体超微结构受损的情况,探讨耳蜗线粒体能量代谢对年龄相关性听力下降发生发展的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 不同月龄雄性C57BL/6J 小鼠购自上海吉辉实验动物饲养有限公司,生产许可证号为SCXK(沪)2017-0012,无噪声暴露史。小鼠饲养及动物实验操作在上海交通大学医学院附属第九人民医院动物饲养中心进行,实验动物使用许可证号为SYXK(沪)2020-0025。
1.1.2 主要试剂及仪器 RNA提取试剂盒(#74136,德国Qiagen),反转录试剂盒、SYBR Green Premix Pro Taq HS qPCR Kit(艾科瑞生物工程有限公司),NAD+/NADH 定量比色试剂盒(K337-100,美国BioVision)。 抗 小 清 蛋 白(parvalbumin) 抗 体(#P3088,美国Sigma)和抗热休克蛋白60(HSP60)抗体(#12165,美国CST),二抗(Donkey antirabbit Alexa Fluor 488 和Donkey anti-mouse Alexa Fluor 594)及封片剂(美国Invitrogen),驴血清(美国Abbkine)。
TDT 听觉诱发电位工作站(TDT System3 RZ6 workstation)、MF1扬声器(美国Tucker-Davis Tech),共聚焦显微镜(DMi8,德国Leica),120 kV 透射电子显微镜(透射电镜,美国赛默飞),多功能酶标仪(瑞士Tecan)。
1.2 方法
1.2.1 小鼠分组与处理 将40 只C57BL/6J雄性小鼠按月龄分为4 个组:1 月龄组、4 月龄组、8 月龄组及12月龄组。通过ABR和DPOAE检测小鼠听力,实时荧光定量PCR 检测小鼠线粒体功能相关基因的表达,透射电镜下观察小鼠耳蜗各类细胞的超微结构,比色试剂盒检测不同组小鼠耳蜗的NAD+/NADH水平。
1.2.2 ABR 及DPOAE 的检测 采用TDT System3 RZ6 workstation 对小鼠进行ABR 及DPOAE 检测。通过赛拉嗪(20 mg/kg)和氯胺酮(100 mg/kg)混合腹腔注射对小鼠进行麻醉,并将小鼠放置到隔声屏蔽室的恒温直流加热垫上维持体温。以小鼠左耳为测试耳对小鼠进行ABR 检测:将3 种电极插入小鼠皮下,包括小鼠头顶正中(记录电极)、耳乳突区(参考电极)和臀部背侧(接地电极)。使用MF1 扬声器进行给声,扬声器前端接有3 cm 软管,将软管另一端放置于小鼠外耳道口,对小鼠进行5.66~45.00 kHz 范围内共7 个频率的闭合场短纯音(tone burst)刺激,声音强度自90 dB SPL 开始,以5 dB SPL 为1 个间隔递减;以能重复出现ABR 波形的最低刺激强度确定阈值。对小鼠进行DPOAE 检测:同时给予小鼠2 个不同频率(f1/f2=1.22)的声音刺激,2 个声音刺激强度相同,并在2f1-f2位置读取DPOAE 振幅;检测频率取5.66~32.00 kHz 范围内共6 个频率,声音强度自80 dB SPL 开始,以5 dB SPL 为1 个间隔递减;以可检测到振幅的最低刺激强度确定阈值。
1.2.3 实时荧光定量PCR 检测 对小鼠进行颈椎脱臼处死,迅速取出双侧耳蜗,将部分耳蜗组织放入预冷的RNA 保护液中避免RNA 降解。在解剖显微镜下去除前庭后液氮速冻保存于-80 ℃。对耳蜗进行研磨后按照TRIzol 法提取RNA,测定浓度后反转录合成为cDNA。使用SYBR Green Premix Pro Taq HS qPCR Kit 进行PCR 扩增,引物序列见表1,扩增程序为:95 ℃孵育5 min;随后95 ℃10 s,60 ℃10 s,72 ℃10 s,共45 个循环。将每个靶基因的相对表达量以Rpl19(ribosomal protein L19)为内参基因进行标准化,并使用2-ΔΔCt方法计算出Ndufb5、Sdha、Sdhc和Atp5b的相对量。

表1 实时荧光定量PCR引物序列Tab 1 Primer sequences for real-time qPCR
1.2.4 样品处理及免疫组织化学染色 将小鼠处死后取出的部分耳蜗放入4%多聚甲醛中,4 ℃固定过夜,随后置于0.5 mol/L EDTA 中,4 ℃脱钙12 h。在解剖显微镜下进行耳蜗铺片,并将耳蜗基底膜分为顶、中、底圈3 个部分。铺片组织在室温下用含8%驴 血 清 和0.5%Triton X-100 的PBS (10 mmol/L,pH7.4)封闭1 h,然后一抗4 ℃孵育过夜。一抗抗体:抗小清蛋白抗体(1∶300)和抗HSP60抗体(1∶200)。次日使用0.1%Triton X-100 清洗3 次,每次5 min;接着二抗室温孵育1 h。一抗和二抗均以8%驴血清和0.5%Triton X-100 稀释。PBS 洗3 遍后,封片、晾干,于共聚焦显微镜镜下观察。
1.2.5 透射电镜样品制备及观察 将部分小鼠耳蜗置于冰上,用4%多聚甲醛和0.5%戊二醛混合固定液进行耳蜗灌注,然后置于2.5%戊二醛中4 ℃固定过夜。随后将耳蜗置于0.5 mol/L EDTA 中,4 ℃脱钙5 h;1%四氧化锇室温固定2 h。0.1 mol/L PB 缓冲液洗涤后依次在乙醇和丙酮中进行梯度脱水,然后将样品包埋在Epon 812 树脂中,65 ℃聚合48 h。将耳蜗在螺旋器水平切成薄片,切片样品用乙酸双氧铀和柠檬酸铅双重染色,用120 kV透射电镜观察。
1.2.6 小鼠耳蜗NAD+水平检测 使用NAD+/NADH定量比色试剂盒检测耳蜗组织中的NAD+水平。一个样品需要2 个耳蜗,每个年龄组检测4 个样品,即8 个耳蜗。将耳蜗取出后,置于400 μL NAD+/NADH提取缓冲液中进行匀浆,16 000×g离心5 min。提取上清液并分成3 份,分别用于测量NADt(NAD+和NADH 的总和)、NADH 和蛋白质含量。NADH 的测定需要先置于60 ℃条件下30 min,将NAD+分解完全后进行。检测NADt和NADH 的样品上清液与反应液混合后,使用酶标仪检测450 nm 处的吸光度值[D(450 nm)];蛋白质浓度通过BCA 法检测。标准化的NAD+水平通过以下公式计算:(NADt-NADH)/蛋白质。
1.3 统计学方法
使用GraphPad Prism 9.0 程序进行数据统计分析,定量资料用表示,组间比较采用两样本t检验、单因素方差分析或两因素方差分析。所有实验至少重复3次。P<0.05表示差异有统计学意义。
2 结果
2.1 C57BL/6J小鼠听觉功能随月龄增长下降
通过TDT 系统分别检测了1、4、8、12 月龄4 个年龄组(每组5 只) C57BL/6J 小鼠的ABR 和DPOAE 阈值,结果提示小鼠听觉功能随年龄增长而下降,特别是高频听力(图1)。相较于1 月龄小鼠,C57BL/6J 小鼠自4 月龄起ABR 阈值在16.00~45.00 kHz 范围内出现显著升高(均P<0.05),在8 月龄ABR 阈值显著升高的频率范围扩展到8.00~45.00 kHz(均P<0.01),12 月龄时全频听力下降,ABR 阈值显著升高(均P<0.01)。同样,8 月龄和12 月龄C57BL/6J 小鼠的DPOAE 阈值在11.32~32.00 kHz 显著升高(均P<0.01)。
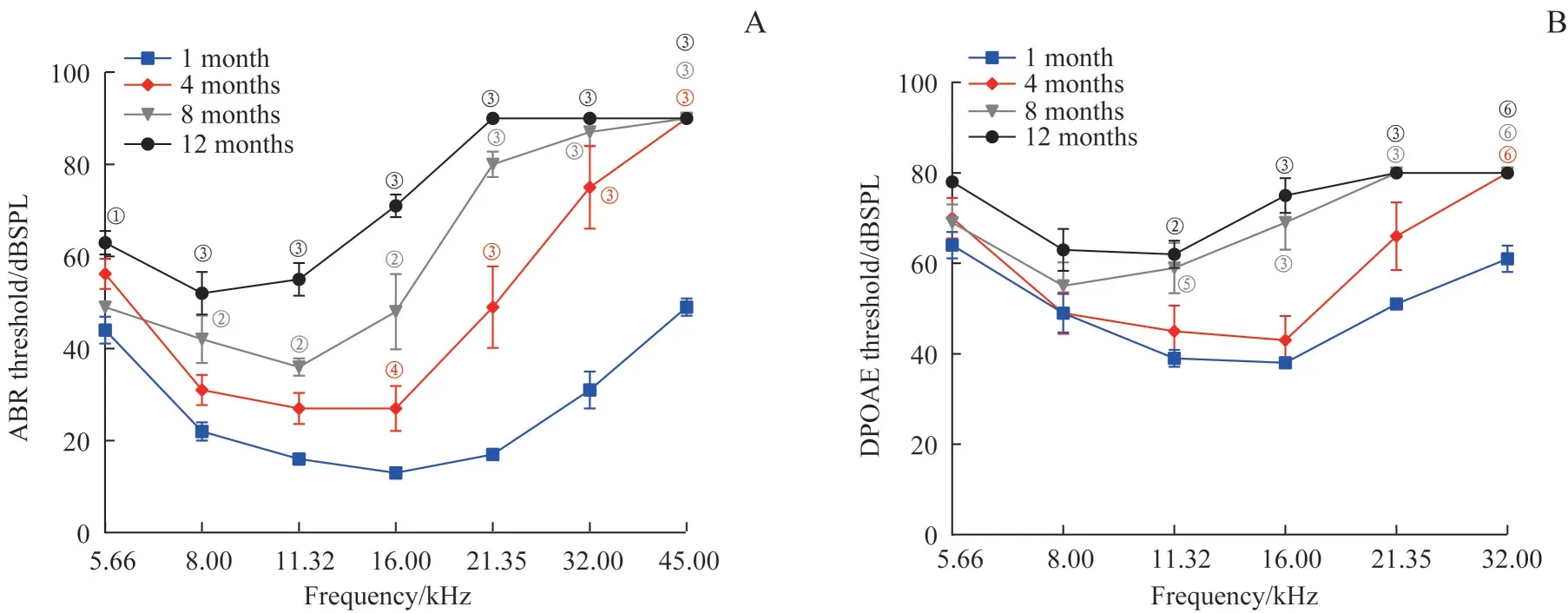
图1 不同月龄C57BL/6J小鼠听力比较(n=5)Fig 1 Comparison of auditory function in C57BL/6J mice at different ages(n=5)
2.2 C57BL/6J 小鼠耳蜗中线粒体功能随月龄增长逐渐下降
4 组小鼠耳蜗内线粒体能量代谢中氧化磷酸化相关基因Ndufb5、Sdha、Sdhc和Atp5b的表达水平见图2A。以1 月龄C57BL/6J 小鼠作为对照组,分别与4、8、12 月龄组的小鼠mRNA 相对表达量进行比较。结果表明,与1月龄小鼠相比,4、8、12月龄小鼠耳蜗中Ndufb5、Sdha、Sdhc和Atp5b这4 个基因的表达水平呈现随年龄下降的趋势,并从8 月龄开始差异有统计学意义(均P<0.05)。为进一步观察耳蜗毛细胞中的线粒体状态,对1月龄和12月龄小鼠的耳蜗毛细胞及线粒体进行染色和观察,HSP60抗体用于标记线粒体,小清蛋白抗体用于标记毛细胞,结果发现在12月龄小鼠耳蜗中,毛细胞中HSP60 表达数量减少,说明内毛细胞中线粒体数量较1 月龄明显减少(图2B)。

图2 不同月龄C57BL/6J小鼠耳蜗线粒体功能相关基因和蛋白表达水平的比较Fig 2 Comparison of expression levels of mitochondrial function-related genes and proteins in the cochleae of C57BL/6J mice at different ages
2.3 C57BL/6J衰老小鼠耳蜗中线粒体结构受损
透射电镜比较1 月龄和12 月龄小鼠耳蜗中内毛细胞、外毛细胞、螺旋神经节细胞及神经纤维中的线粒体超微结构。可见与1 月龄小鼠相比,12 月龄C57BL/6J 小鼠外毛细胞中的线粒体结构正常(图3),而在内毛细胞、螺旋神经节细胞及神经纤维中线粒体出现空泡样变性(图3),螺旋神经节细胞中线粒体体积变大,同时在胞质中可观察到较大的脂褐素形成。

图3 1月龄和12月龄C57BL/6J小鼠耳蜗中不同细胞的线粒体超微结构对比Fig 3 Comparison of mitochondrial ultrastructure in different cells in the cochleae of mice aged 1 month and 12 months
2.4 C57BL/6J 小鼠耳蜗NAD+水平随月龄增长逐渐下降
4 组小鼠耳蜗NAD+水平见图4。结果表明,与1月龄小鼠相比,4、8、12 月龄小鼠耳蜗NAD+水平呈现随月龄增长而下降的趋势,并自8 月龄开始与1 月龄NAD+水平相比差异有统计学意义(均P<0.01)。

图4 不同月龄C57BL/6J小鼠耳蜗NAD+水平比较Fig 4 Comparison of NAD+ levels in the cochleae of mice at different ages
3 讨论
年龄相关性听力下降的发生发展主要是由于内耳的不可逆改变。通过年龄相关性听力下降小鼠和人类的耳蜗组织病理研究,均发现随年龄增长的听觉感觉上皮细胞的丢失[6]。由于携带Cdh23(cadherin related 23)突变,C57BL/6J小鼠在3~6月龄开始出现高频听力损失,较其他野生近交系更早;在15月龄时表现为严重的全频听力损伤,伴随着内毛细胞、外毛细胞和螺旋神经节细胞的丢失,而这种丢失在高频和低频区域更为严重[7-8]。因此,C57BL/6J小鼠是研究年龄相关性听力下降的合适模型。而本研究也证明,相较于1月龄小鼠的ABR和DPOAE阈值,8月龄和12月龄小鼠出现了明显的听力阈移,说明小鼠听觉功能随月龄增长而下降。
年龄相关性听力下降与线粒体功能障碍密切相关。线粒体是活性氧(reactive oxygen species,ROS)的主要来源及储存场所,线粒体膜电位异常或膜受损可导致ROS释放到细胞质中,激活下游一系列细胞通路,如促分裂原活化的蛋白激酶(MAPK)等,还可导致促炎因子的产生和释放,对内耳结构造成损伤[9-10]。同时,线粒体本身也受到ROS诱导氧化应激的影响,出现线粒体DNA、线粒体呼吸链复合物蛋白、线粒体膜等的损伤,线粒体能量代谢功能受损[11]。促凋亡调节因子BAX、BCL-2等均位于线粒体膜上,线粒体的损伤还可导致细胞色素C的释放,诱导细胞凋亡[12]。已有研究[13]证明,在Idh2(isocitrate dehydrogenase 2)敲除小鼠中观察到早发的年龄相关性听力下降,伴随感觉上皮细胞的氧化损伤乃至严重丢失。这些损伤还会随着时间推移而堆积,导致一系列年龄相关性细胞损伤。线粒体氧化磷酸化功能相关基因Ndufb5、Sdha、Sdhc和Atp5b,是呼吸链复合体Ⅰ、Ⅱ、Ⅴ的组成亚基,可反映线粒体氧化磷酸化的功能[14-15]。本研究发现在C57BL/6J小鼠耳蜗中Ndufb5、Sdha、Sdhc和Atp5b的mRNA表达水平,随月龄增长而逐渐下降,提示耳蜗线粒体功能逐渐下降。老年小鼠的毛细胞会随年龄增长而丢失,我们也对耳蜗毛细胞及其线粒体进行染色观察,发现12月龄小鼠耳蜗毛细胞中线粒体数量明显减少,提示这可能影响耳蜗毛细胞功能。而透射电镜观察也发现在12月龄小鼠的内毛细胞、神经纤维和螺旋神经节细胞中观察到线粒体的空泡样变性,并且出现较大的脂褐素。线粒体大多数呼吸复合物嵌合在线粒体嵴中,线粒体嵴是线粒体进行能量代谢的重要场所。电镜下线粒体结构出现异常,线粒体嵴的丢失、变宽均反映了老年小鼠线粒体功能的受损[16]。同时线粒体功能的异常及随年龄增长发生的自噬功能异常也会诱发脂褐素的形成,说明随年龄增长,出现线粒体损伤和功能障碍,并进一步导致小鼠听觉功能异常。
NAD+是细胞中氧化还原酶的氢载体和细胞信号分子,参与了包括线粒体功能和代谢、氧化还原反应、DNA修复等细胞活动,并可作为底物调控细胞信号转导。NAD+水平在多个器官中被发现会随着年龄的增长而下降,包括心脏、中枢神经、肝脏等[17],这主要是由于NAD+合成和消耗相关的酶和蛋白的功能随年龄发生变化。NAD+影响着从能量代谢到细胞存活的数百个关键生物学功能,衰老和疾病状态下NAD+水平的下降可影响机体代谢和稳态,参与衰老相关疾病的发生发展,如动脉粥样硬化、糖尿病、癌症、神经退行性变性疾病等[5]。有报道[18]指出,在老年或疾病动物体内恢复NAD+水平可以恢复动物健康并且延长动物寿命。NAD+补充治疗已经被证明可以保护阿尔茨海默病小鼠模型中的神经元损伤,改善认知功能,可改善心力衰竭小鼠的心肌功能以及预防脂肪肝等疾病[19-21]。除此以外,通过多种手段实现小鼠体内NAD+水平的提高在听觉领域也多有应用,并证明对噪声性、老年性及顺铂引起的听力损失均有一定的保护作用[22-24]。本研究检测了不同月龄C57BL/6J小鼠耳蜗中的NAD+水平,结果提示NAD+水平随月龄增长而逐渐下降。这也为使用NAD+补充剂增强线粒体功能、保护小鼠年龄相关性听力下降的可行性提供了理论依据。
本研究通过比较不同月龄小鼠听觉功能、耳蜗中线粒体功能和形态及NAD+水平,发现小鼠外周听觉关键细胞线粒体功能和结构随月龄增长而改变,耳蜗NAD+水平随月龄增加而下降,与年龄相关性听力下降一致;提示线粒体功能障碍、NAD+减少可能是小鼠年龄相关性听力下降的原因,推测补充NAD+增强线粒体功能可能有助于改善小鼠年龄相关性听力下降。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有动物实验均已通过上海交通大学医学院附属第九人民医院动物伦理委员会的审核批准(批件号SH9H-2020-A102-1)。所有实验过程均遵照《实验动物饲养管理和使用指南》及《上海交通大学医学院附属第九人民医院动物中心管理手册》进行。
All experimental animal protocols in this study were reviewed and approved by Ethics Committee of Shanghai Ninth People's Hospital,Shanghai Jiao Tong University School of Medicine(Approval Letter SH9H-2020-A102-1). And all experimental animal protocols were carried out by followingGuide for the Care and Use of Laboratory AnimalsandManual for Laboratory Animals Management of Shanghai Ninth People's Hospital,Shanghai Jiao Tong University School of Medicine.
作者贡献/Authors'Contributions
吴皓参与了课题指导;陶永、董庭婷、冯宝怡参与了实验设计;冯宝怡、董庭婷、郑晓飞参与了实验操作;冯宝怡参与了数据整理、论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was instructed by WU Hao,designed by TAO Yong,DONG Tingting and FENG Baoyi and conducted by FENG Baoyi,DONG Tingting and ZHENG Xiaofei.The manuscript was drafted and revised by FENG Baoyi. All the authors have read the last version of paper and consented for submission.
·Received:2022-01-27
·Accepted:2022-06-05
·Published online:2022-08-12
参·考·文·献
[1] CHADHA S, KAMENOV K, CIEZA A. The world report on hearing,2021[J]. Bull World Health Organ,2021,99(4):242-242A.
[2] JAFARI Z,KOLB B E,MOHAJERANI M H. Age-related hearing loss and tinnitus, dementia risk, and auditory amplification outcomes[J].Ageing Res Rev,2019,56:100963.
[3] KEITHLEY E M. Pathology and mechanisms of cochlear aging[J].J Neurosci Res,2020,98(9):1674-1684.
[4] FUJIMOTO C, YAMASOBA T. Mitochondria-targeted antioxidants for treatment of hearing loss: a systematic review[J]. Antioxidants(Basel),2019,8(4):109.
[5] COVARRUBIAS A J, PERRONE R, GROZIO A, et al. NAD+metabolism and its roles in cellular processes during ageing[J]. Nat Rev Mol Cell Biol,2021,22(2):119-141.
[6] WU P Z, O'MALLEY J T, DE GRUTTOLA V, et al. Age-related hearing loss is dominated by damage to inner ear sensory cells, not the cellular battery that powers them[J]. J Neurosci, 2020, 40(33):6357-6366.
[7] LYU A R, KIM T H, PARK S J, et al. Mitochondrial damage and necroptosis in aging cochlea[J]. Int J Mol Sci,2020,21(7):2505.
[8] HEQUEMBOURG S,LIBERMAN M C. Spiral ligament pathology:a major aspect of age-related cochlear degeneration in C57BL/6 mice[J].J Assoc Res Otolaryngol,2001,2(2):118-129.
[9] TAN W J T, THORNE P R, VLAJKOVIC S M. Characterisation of cochlear inflammation in mice following acute and chronic noise exposure[J]. Histochem Cell Biol,2016,146(2):219-230.
[10] DRÖSE S, BRANDT U. Molecular mechanisms of superoxide production by the mitochondrial respiratory chain[J]. Adv Exp Med Biol,2012,748:145-169.
[11] LIN M T,BEAL M F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J]. Nature,2006,443(7113):787-795.
[12] RENTON J P, XU N Y, CLARK J J, et al. Interaction of neurotrophin signaling with Bcl-2 localized to the mitochondria and endoplasmic reticulum on spiral ganglion neuron survival and neurite growth[J]. J Neurosci Res,2010,88(10):2239-2251.
[13] WHITE K, KIM M J, HAN C, et al. Loss of IDH2 accelerates agerelated hearing loss in male mice[J]. Sci Rep,2018,8(1):5039.
[14] SONG X,CHEN Z Z,JIA R Y,et al. Transcriptomics and proteomic studies reveal acaricidal mechanism of octadecanoic acid-3, 4 -tetrahydrofuran diester againstSarcoptes scabieivar.cuniculi[J].Sci Rep,2017,7:45479.
[15] GO Y M, SUTLIFF R L, CHANDLER J D, et al. Low-dose cadmium causes metabolic and genetic dysregulation associated with fatty liver disease in mice[J]. Toxicol Sci,2015,147(2):524-534.
[16] QUINTANA-CABRERA R, MEHROTRA A, RIGONI G, et al.Who and how in the regulation of mitochondrial cristae shape and function[J]. Biochem Biophys Res Commun,2018,500(1):94-101.
[17] LAUTRUP S,SINCLAIR D A,MATTSON M P,et al. NAD+in brain aging and neurodegenerative disorders[J]. Cell Metab, 2019, 30(4):630-655.
[18] FANG E F, KASSAHUN H, CROTEAU D L, et al. NAD+replenishment improves lifespan and healthspan in ataxia telangiectasia modelsviamitophagy and DNA repair[J]. Cell Metab,2016,24(4):566-581.
[19] LIU D, PITTA M, JIANG H Y, et al. Nicotinamide forestalls pathology and cognitive decline in Alzheimer mice: evidence for improved neuronal bioenergetics and autophagy procession[J].Neurobiol Aging,2013,34(6):1564-1580.
[20] LEE C F,CHAVEZ J D,GARCIA-MENENDEZ L,et al. Normalization of NAD+redox balance as a therapy for heart failure[J]. Circulation,2016,134(12):883-894.
[21] MUKHERJEE S, CHELLAPPA K, MOFFITT A, et al.Nicotinamide adenine dinucleotide biosynthesis promotes liver regeneration[J]. Hepatology,2017,65(2):616-630.
[22] BROWN K D, MAQSOOD S, HUANG J Y, et al. Activation of SIRT3 by the NAD+precursor nicotinamide riboside protects from noise-induced hearing loss[J]. Cell Metab,2014,20(6):1059-1068.
[23] KIM H J, OH G S, SHEN A, et al. Augmentation of NAD+by NQO1 attenuates cisplatin-mediated hearing impairment[J]. Cell Death Dis,2014,5(6):e1292.
[24] KIM H J,CAO W,OH G S,et al. Augmentation of cellular NAD+by NQO1 enzymatic action improves age-related hearing impairment[J].Aging Cell,2019,18(5):e13016.
