红螯光壳螯虾(Cherax quadricarinatus)血细胞生成的初步研究
2022-10-15尹文娟王丽燕孙金生
刘 芳,苏 慧,尹文娟,王丽燕,孙金生
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
甲壳动物像其他无脊椎动物一样缺乏获得性免疫(acquired or adaptive immunity)系统,仅拥有天然免疫(innate immunity)系统.各种血细胞通过吞噬、包囊、结节、黑化以及分泌免疫活性分子等反应在整个免疫系统中发挥着至关重要的作用[1].甲壳动物的血细胞通常可分为颗粒细胞(granular cells,GC)、半颗粒细胞(semigranular cells,SGC)和透明细胞(hyaline cells,HC)[2].根据胞质颗粒的大小、数量、遮光性和特定的核质比等特征,一些甲壳动物如格鲁西东欧螯虾、锯缘青蟹和中华绒螯蟹等的血细胞又进一步分为透明细胞、小颗粒细胞、中颗粒细胞和大颗粒细胞[3-4],它们都在机体固定或破坏外来微生物过程中起着关键作用[1].甲壳动物生存环境复杂,经常面对外界环境压力、病原感染、争斗以及蜕皮等生理过程,其血细胞数量和组成常会发生急剧变化,机体需不断造血以更新和补充损耗的血细胞,因此,活跃的造血机能对甲壳动物来说尤为重要[5].由造血干细胞产生成熟血细胞并释放到循环系统中的过程就是造血过程,造血过程生成形态各异的血细胞,构成了甲壳动物免疫的核心和基础.了解造血过程中血细胞的产生、分化和免疫功能是探究甲壳动物免疫防御机制的前提和关键.甲壳动物血细胞主要是由造血组织(hemopoietic tissue,HPT)分化产生[6],研究者根据造血组织中细胞的形态学特征如细胞大小、胞质颗粒以及细胞器发育情况等,对其进行了初步分类,主要包括4~5种不同的细胞类型[2,7].Van de Braak等[2]发现对虾的造血组织中有4种主要的细胞类型:1型细胞为前体细胞,可进一步分化为2型(未成熟SGC)和3型(未成熟GC)细胞,4型细胞为间质细胞,1~3型细胞均可分裂.为更清楚地了解血细胞在造血组织中是如何分化产生的,研究人员尝试寻找不同发育阶段血细胞的特异标志物来鉴定甲壳动物的造血组织和血细胞谱系.近年来有研究者依据血细胞的形态学分类,从mRNA和蛋白水平对相应的分子标记进行筛选,获得了一些在不同血细胞中特异性表达的标记分子,为研究甲壳动物血细胞的功能分型奠定了基础[8],但这些标记分子与血细胞分化过程中造血组织细胞的对应关系以及在不同甲壳动物中的适用性还有待进一步研究.因此,同果蝇和其他模式动物相比,甲壳类动物的研究由于缺乏明确的遗传和分子标记而受到阻碍.
红螯光壳螯虾(Cherax quadricarinatus)隶属甲壳动物亚门(Crustacea)软甲纲(Malacostraca)十足目(Decapoda)拟螯虾科(Parastacidae)滑螯虾属(Cherax),原产于澳大利亚北部,又名澳洲淡水龙虾,是一种适应性极强的淡水虾种[9],其造血组织位于胃背侧,呈半透明薄膜状,整体由许多卵形小叶构成,每个卵形小叶均由结缔组织环绕构成[10].本研究对失血刺激后红螯光壳螯虾造血组织细胞的增殖变化进行观察,利用流式细胞技术对失血和脂多糖(LPS)刺激后的螯虾血细胞组成变化进行研究,分析了红螯光壳螯虾血细胞的可能生成过程,研究结果为进一步揭示甲壳动物的造血作用提供实验依据,也为无脊椎动物免疫系统的研究提供参考.
1 材料与方法
1.1 实验材料与试剂
红螯光壳螯虾购自苏州傲龙生态水产养殖有限公司,体质量为(73.4±10.2)g,体长为(10.0±2.3)cm.实验前将螯虾置于深缸内暂养7 d,养殖温度为25℃,24 h连续充气,每天喂食1次,使其适应新环境.
固定液(4%多聚甲醛)、甘氨酸,生工生物工程(上海)股份有限公司;LPS,西格玛奥德里奇(上海)贸易有限公司;Cell-Light EdU Apollo488 In Vitro Kit、EdU检测试剂盒,广州锐博生物技术有限公司.磷酸缓冲液(CPBS)[11]:10 mmol/L Na2HPO4、10 mmol/L KH2PO4、150 mmol/L NaCl、10 mmol/L CaCl2、10 mmol/L MnCl2、2.7 mmol/L KCl,pH值为6.8.抗凝剂:29.6 mmol/L柠檬酸钠、167.7 mmol/L NaCl、100 mmol/L葡萄糖、30 mmol/L柠檬酸、10 mmol/L EDTA(Na2),pH值为7.2.所有试剂均为国产分析纯.
1.2 实验方法
1.2.1 失血刺激下红螯光壳螯虾造血组织的细胞增殖
随机选取健康且活力较好的红螯光壳螯虾18只,9只为对照组,9只为实验组.向对照组螯虾的腹节注射150 μL 0.3 mg/mL的EdU(参考Cell-Light EdU Apollo488 In Vitro Kit使用说明).实验组中,先用含2 mL预冷抗凝剂的注射器从每只螯虾第2腹节的腹侧血腔中抽血2 mL,之后注射EdU.在处理后的6、12、24 h,分别从对照组和实验组取3只螯虾获取其造血组织,参照文献[5]中的方法分离螯虾造血组织细胞,将细胞按照1×106个/孔的密度平铺于24孔细胞培养板中,用Cell-Light EdU Apollo488 In Vitro Kit试剂盒进行染色,置于荧光显微镜下观察.
1.2.2 红螯光壳螯虾的血细胞再生标记
取3只健康、活力较好的红螯光壳螯虾,注射150μL 0.3 mg/mL的EdU于腹节,每隔3 d补充注射EdU.分别在注射后2、4、6、8 d时抽血1.5 mL,置于等量的4%多聚甲醛中固定30 min,在4℃、3 000 r/min条件下离心5min,收集血淋巴细胞,利用Cell-LightEdUApollo488 In Vitro Kit试剂盒对其进行染色,并在显微镜下观察.
1.2.3 失血刺激下红螯光壳螯虾血淋巴细胞的变化
取12只健康的红螯光壳螯虾,分别抽血1 mL.在抽血0、12、24、36 h后分别取3只螯虾,各抽取血淋巴2 mL,于4%多聚甲醛中固定10 min,后悬于CPBS中,利用流式细胞仪(FlowSight多维全景分析仪,美国Merck Millipore公司)检测各时间点各类型血细胞的变化情况.
1.2.4 LPS刺激下红螯光壳螯虾血淋巴细胞的变化
取18只健康的红螯光壳螯虾,9只为对照组,9只为实验组.对照组中每只螯虾分别注射100μLCPBS,实验组中每只螯虾分别注射100 μL 1 mg/mL的LPS.在对照组和实验组螯虾注射12、24、36 h后,分别各取3只螯虾,每只螯虾抽取血淋巴2 mL,在4%多聚甲醛中固定10 min,后悬于CPBS中,利用流式细胞仪检测各时间点各类型血细胞的变化情况.
1.2.5 数据处理与分析
利用IDEAS Application软件处理和分析各类型血细胞的变化情况,利用SPSS软件对差异进行统计分析,P<0.05为差异具有统计学意义.
2 结果与分析
2.1 失血刺激对造血组织细胞增殖的影响
利用EdU对红螯光壳螯虾造血组织细胞的增殖进行检测,结果如图1和表1所示.
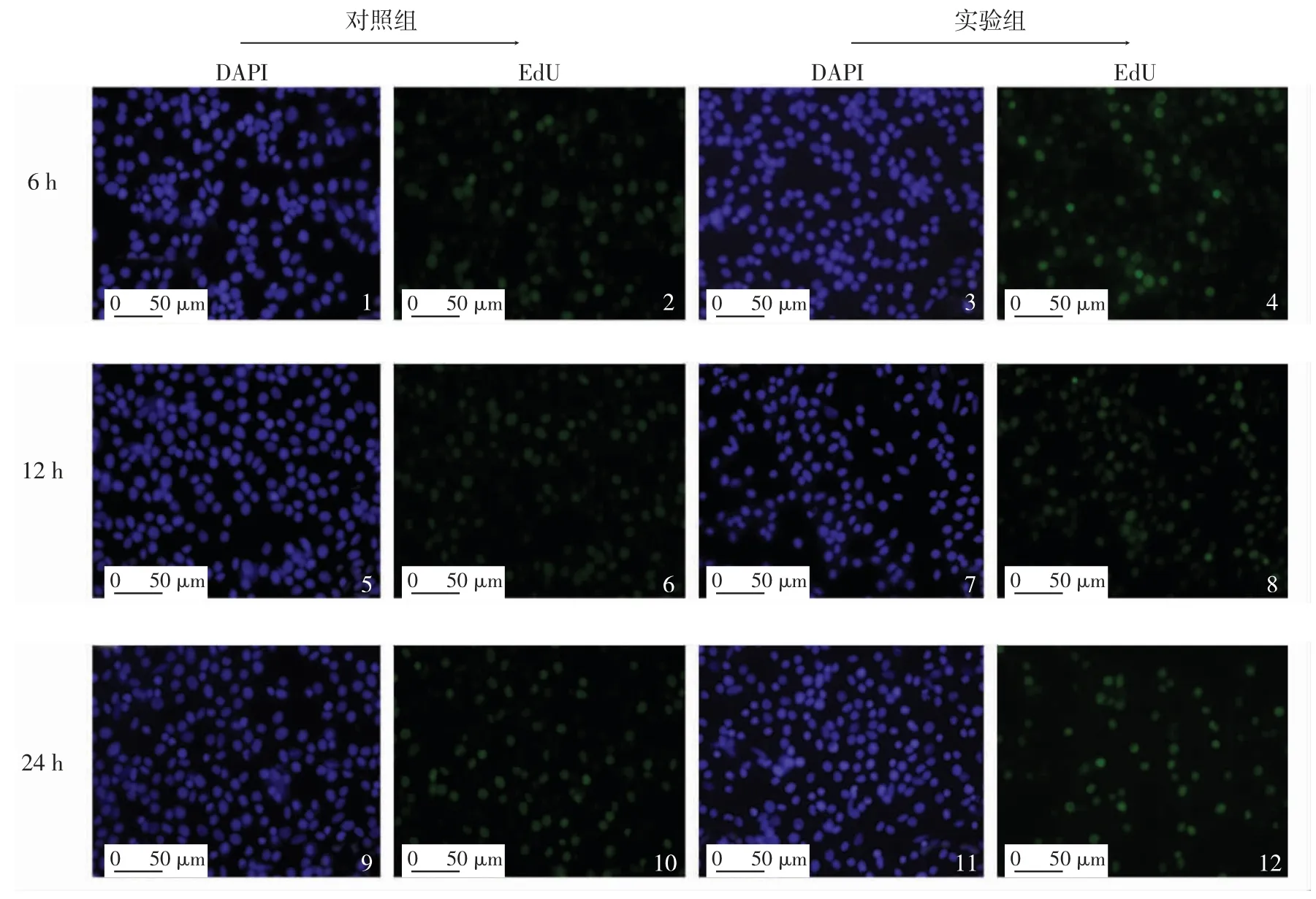
图1 失血刺激后红螯光壳螯虾造血组织细胞的EdU标记情况Fig.1 EdU labeling of hemopoietic tissue cells of C.quadricarinatus after exsanguination stimulation
由图1和表1可以看出,在失血处理后的6、12和24 h,无论失血与否,红螯光壳螯虾造血组织细胞都处于活跃的增殖状态,无明显增殖差异,说明正常情况下造血组织始终处于活跃的分裂状态.

表1 失血刺激后红螯光壳螯虾造血组织细胞增殖的比例Tab.1 Proliferation proportion of hemopoietic tissue cells of C.quadricarinatusafterexsanguination stimulation %
2.2 失血刺激对血淋巴细胞的影响
2.2.1 红螯光壳螯虾血细胞的再生
用EdU标记红螯光壳螯虾后,每隔2 d抽血1.5 mL,在荧光显微镜下观察,结果如图2所示.从图2可以看出,在第6天时,血细胞中出现被EdU标记的新生血细胞;第8天时被标记的血细胞数目增多,且被标记的新生血细胞较其他血细胞体积小,核质比高,大多呈圆形.
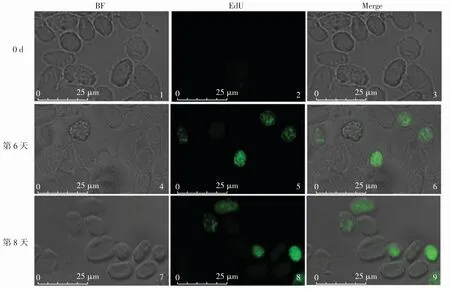
图2 失血刺激后红螯光壳螯虾血细胞的EdU标记情况Fig.2 EdU labeling of hemocytes regeneration of C.quadricarinatus after exsanguination stimulation
2.2.2 失血刺激对血淋巴细胞比例的影响
利用流式细胞仪对红螯光壳螯虾血淋巴细胞进行检测分析,根据侧向散射值可将血细胞分为4类:透明细胞(R4)、小颗粒细胞(R5)、中颗粒细胞(R6)以及大颗粒细胞(R7),如图3所示.失血刺激后各类血细胞比例如表2所示.由表2可知,失血刺激12 h后,透明细胞和小颗粒细胞的比例明显升高,而中颗粒和大颗粒细胞的比例明显降低;至24 h时,各类血细胞的比例基本恢复至正常水平.
表2 失血刺激后各类血细胞的比例Tab.2 Proportion of four types of hemocytes after exsanguination stimulation %
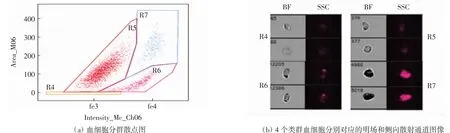
图3 红螯光壳螯虾各类血细胞图像流式分类分析Fig.3 Classification of all kinds of hemocytes in C.quadricarinatus by imaging flow cytometry
运用流式细胞仪所得数据对红螯光壳螯虾的各类型血淋巴细胞大小进行分析,结果如图4所示.由图4可以看出,透明细胞和小颗粒细胞主要分布在300~400 μm2之间,中颗粒细胞和大颗粒细胞主要分布在400~500 μm2之间.将各类细胞按200~300、300~400、400~500和500~600 μm2分为Ⅰ类、Ⅱ类、Ⅲ类和Ⅳ类,失血刺激后各类细胞所占比例的变化如表3所示.

表3 失血刺激后各类型血细胞中不同大小细胞的比例Tab.3 Proportion of hemocytes with different size in four types of hemocytes after exsanguination simulation %
由表3可知,失血12 h时,透明细胞和小颗粒细胞中Ⅰ类细胞的比例显著增加,透明细胞中Ⅲ类和Ⅳ类细胞、小颗粒细胞中Ⅲ类细胞的比例显著下降,中颗粒细胞中Ⅲ类细胞的比例在失血12和36 h时显著下降.
2.3 LPS刺激对血淋巴细胞比例的影响
模拟病原刺激对红螯光壳螯虾进行LPS刺激后,利用流式细胞仪对血淋巴细胞的比例进行检测分析,结果如表4所示.
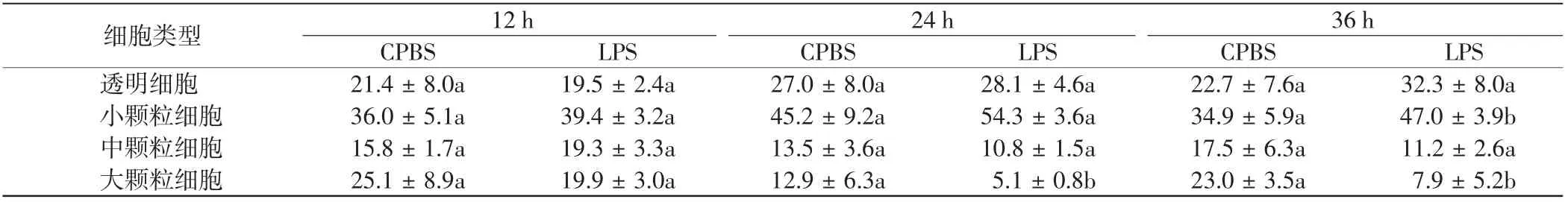
表4 LPS刺激后各类型血细胞的比例Tab.4 Proportion of hemocytes in four types of hemocytes after LPS stimulation %
由表4可知,LPS刺激36 h时,小颗粒细胞的比例显著升高;大颗粒细胞的比例在LPS刺激24和36 h时显著降低.进一步对各类型细胞中不同大小细胞的比例进行分析,结果如表5所示.
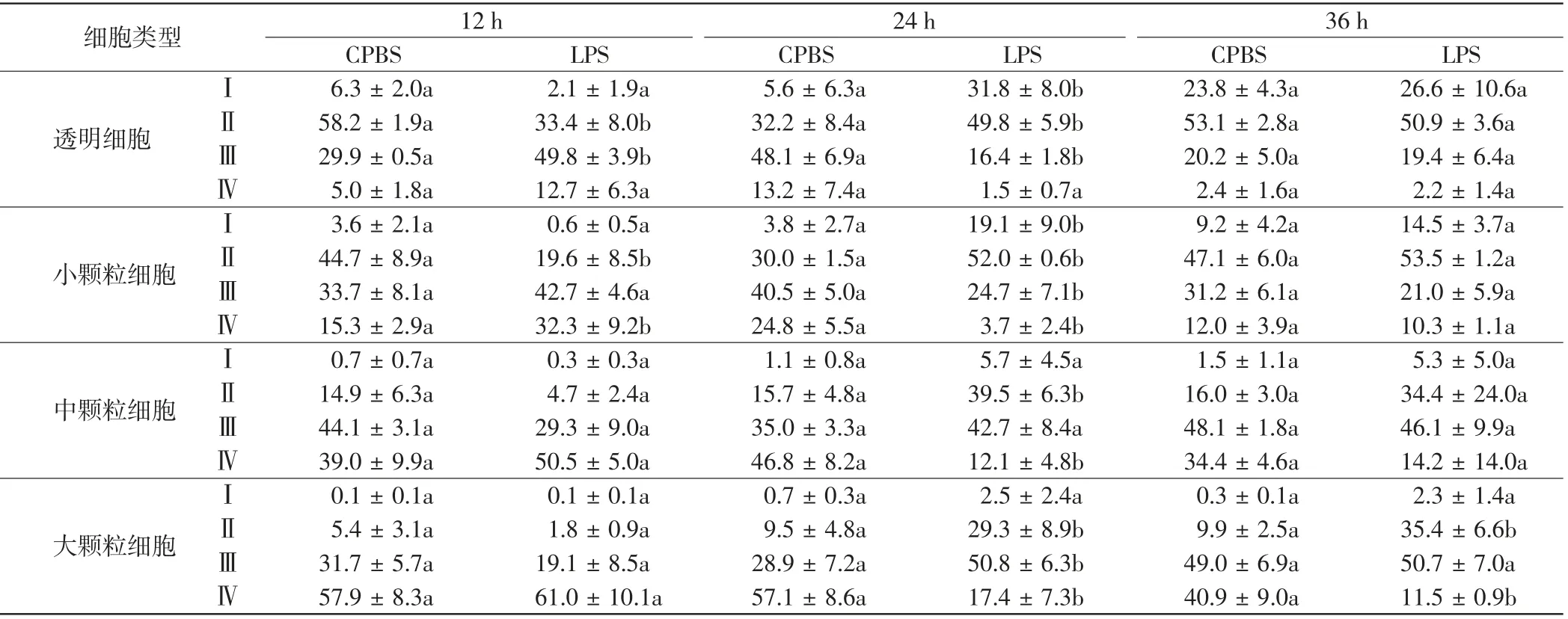
表5 LPS刺激后各类型血细胞中不同大小细胞的比例Tab.5 Proportion of hemocytes with different size in four types of hemocytes after LPS stimulation%
由表5可知,在LPS刺激12 h时透明细胞和小颗粒细胞中Ⅱ类细胞的比例均显著下降,而透明细胞中Ⅲ类细胞和小颗粒细胞中Ⅳ类细胞的比例显著升高.至24 h时,透明细胞和小颗粒细胞中Ⅰ类和Ⅱ类细胞的比例都在LPS刺激后显著升高,而透明细胞中Ⅲ类细胞和小颗粒细胞中Ⅲ类与Ⅳ类细胞的比例均显著下降.中颗粒细胞中Ⅱ类细胞和大颗粒细胞中Ⅱ、Ⅲ类细胞的比例也在LPS刺激24 h时显著上升,大颗粒细胞中Ⅳ类细胞的比例在LPS刺激24 h和36 h时显著下降.
3 讨论
血细胞是甲壳动物的主要免疫细胞,由造血组织产生.红螯光壳螯虾的造血组织由造血干细胞、原血细胞以及一些接近成熟的血细胞构成[10,12].为了维持免疫系统功能,甲壳动物整个生命周期都需要连续且成比例地补充形成新的血细胞[13],因此新生血细胞的产生、分化与释放对于甲壳动物免疫防御具有重要意义.BrdU和EdU法常用于细胞增殖检测,可测出S期细胞的比例[10],而病原刺激易导致机体血细胞总数显著降低[11,14],并刺激造血组织细胞分裂以及释放血细胞.为了探讨红螯光壳螯虾造血组织在血细胞生成过程中的细胞增殖活性变化,本研究利用EdU法对失血刺激下红螯光壳螯虾造血组织细胞的增殖情况进行了检测,发现在失血刺激6~24 h时,无论失血与否,螯虾造血组织细胞都处于活跃的增殖状态,无明显增殖差异,说明正常情况下的红螯光壳螯虾造血组织始终处于活跃的分裂状态,维持正常的造血功能.对失血的红螯光壳螯虾新生血细胞进行持续标记,在失血刺激6 d后发现,螯虾血淋巴中出现的EdU标记的新生血细胞较其他成熟血细胞小且圆.这些较小的血细胞在其他十足类动物,如小龙虾(Homarus americanus)和蜘蛛蟹(Hyas araneus)的循环血细胞中也有发现,它们具有体积较小、球形、高核质比的特征[15-16].由于这些血细胞体积小且未明显分化,具有未成熟细胞的典型形态特征,因此Van de Braak等[2]和Wu等[8]认为它们是前血细胞.
血细胞内的稳态对所有生物的健康至关重要,当甲壳动物受到外伤或者外来微生物入侵时,血细胞会发挥免疫功能,导致循环血淋巴细胞数目下降,从而启动造血过程.本研究模拟红螯光壳螯虾自然生存面临的失血和感染危机,分别对其进行失血和LPS刺激,利用流式细胞仪对血细胞的类型及大小变化进行分析.结果发现,失血刺激12 h时,透明细胞和小颗粒细胞增多,而中颗粒和大颗粒细胞减少.鉴于本研究利用EdU标记发现的新生血细胞形态较小,为深入分析各种血细胞的形成过程,进一步将各类型血细胞按大小分为Ⅰ类(200~300 μm2)、Ⅱ类(300~400 μm2)、Ⅲ类(400~500 μm2)和Ⅳ类(500~600 μm2),发现透明细胞和小颗粒细胞主要为Ⅱ类细胞,分布在300~400 μm2之间,中颗粒细胞和大颗粒细胞主要为Ⅲ类细胞,分布在400~500 μm2之间.随着血细胞颗粒性的增加,细胞逐渐增大,同一类群不同细胞大小的差异暗示了血细胞在血淋巴中存在“成长”.失血刺激12 h时,发现透明细胞和小颗粒细胞的增加主要由各自的Ⅰ类细胞比例显著增加造成,推测失血后螯虾启动造血过程可能最先产生释放的为此类较小的前血细胞,在血淋巴循环系统中可进一步分化形成较大的成熟血细胞.这与Li等[17]报道的螯虾成熟血细胞的形成模式比较类似,即由造血组织细胞产生的前血细胞在造血组织中分化产生,未成熟的血细胞从造血组织中释放出来后,在循环系统中经过1~3个月的时间分化成熟,循环血细胞中的半颗粒细胞和颗粒细胞可能代表血细胞的不同发育阶段.另有一些原始甲壳类动物在血液循环中有血细胞分裂的现象,但这种现象在较高级的甲壳类动物中比较少见[18],因此,循环系统中的S期血细胞反映了未成熟血细胞或原血细胞的过早释放[16,19].蜘蛛蟹(Hyas araneus)的反复出血也会出现类似未成熟血细胞的产生,这些细胞被鉴定为原血细胞,在血淋巴丢失后被诱导释放[16].Van de Braak等[2]认为对虾造血组织中的2、3型细胞与传统意义上循环血淋巴中的透明血细胞类似,推测2、3型细胞以透明细胞的形式释放到循环血淋巴后,成熟为SGC和GC.
病原侵染引起的血细胞免疫反应是造成甲壳动物大量血细胞损失的另一重要因素[20].中颗粒和大颗粒细胞在参与免疫过程中,通常会伴随着脱颗粒破裂而释放一些酶类,如酚氧化酶、酸性磷酸酶、溶菌酶等,可以直接杀灭外来病原菌[21],这种细胞特性导致感染早期中颗粒和大颗粒细胞数量急剧减少.血细胞的恢复最终主要依赖于潜在造血组织不断地产生血细胞,维持循环中的血细胞稳态[22].本研究对红螯光壳螯虾进行LPS刺激以模拟病原刺激,发现LPS刺激36 h时,小颗粒细胞的比例显著升高,大颗粒细胞的比例显著下降.进一步分析发现,LPS刺激12 h时,透明细胞和小颗粒细胞中的Ⅱ类细胞比例明显下降,至24 h时Ⅰ类和Ⅱ类细胞比例开始显著升高.由此认为,LPS刺激与失血刺激对螯虾血细胞类群产生的影响不同,可能通过不同方式作用于血细胞的生成以及成熟.Hammond等[23]对梭子蟹进行研究,发现LPS注射液可以诱导血细胞释放进入S期循环.Van de Braak等[2]发现LPS刺激和重复出血可促进对虾血淋巴细胞的释放.Zhou等[24]研究发现,拟穴青蟹在溶藻弧菌和Poly(I∶C)的刺激下,透明细胞的比例显著升高,细菌攻毒组48 h和病毒攻毒组24 h、96 h时半颗粒细胞的比例显著下降,推测不同病原刺激会引起不同血细胞类群的变化,可能跟各血细胞类群在防御不同病原体感染方面发挥着不同作用有关.
综上,本研究发现红螯光壳螯虾造血组织细胞无论失血与否一直处于活跃的增殖状态;中颗粒和大颗粒细胞的体积比透明细胞和小颗粒细胞的体积大,同种类型血细胞体积也存在差异,表明螯虾血细胞在血淋巴中可能存在由小到大的“成长”.失血刺激12 h时发现有较小的新生血细胞释放到循环系统中,推测为前血细胞.LPS刺激12 h时发现,透明细胞和小颗粒细胞中Ⅱ类细胞的比例显著下降;至24 h时,Ⅰ类和Ⅱ类细胞比例开始显著增多.由此可知,失血刺激和LPS刺激对血细胞生成具有不同的促进作用,可能通过不同的作用方式调控造血.这些结果为甲壳动物血细胞生成及其他相关研究提供了一定的理论依据.
