骨髓间充质干细胞对大鼠牙槽骨缺损再生修复的影响*
2022-10-14王丽霞吕继连
孙 琦 王丽霞 吕继连
牙周炎是因牙周组织受到慢性破坏所致的口腔疾病[1],可损伤牙骨质、牙周膜、牙槽骨及周围支持组织,引起牙槽骨丧失,导致牙齿脱落,为后续牙齿修复带来了很大困难[2]。骨损伤传统修复方法是同种异体和自体移植,但由于免疫反应和供区并发症,修复效果尚不理想[3]。因此,寻找有效的骨损伤修复方案,对临床治疗牙周炎具有重要意义。
骨髓间充质干细胞(bone mesenchymal stem cells,RMSCs)常用做组织工程学工具细胞,已有研究证实其在软骨损伤治疗中的效果[4-5]。然而,目前关于RMSCs 对大鼠牙槽骨缺损部分的再生修复及对破骨细胞的影响研究尚少。本研究通过建立大鼠牙槽骨缺损模型,研究RMSCs 移植对其缺损部分的再生修复的影响,并探讨相关机制,为临床RMSCs 的应用提供实验依据。
1.材料与方法
1.1 材料
1.1.1 实验动物、细胞株 25 只SPF 级SD大鼠,雄性,6 周龄,体质量(200-250)g,购自上海杰思捷实验动物有限公司[生产许可SCXK(沪)2018-0004]。大鼠RMSCs 细胞株,购自上海抚生实业有限公司。
1.1.2 主要试剂、仪器 兔抗大鼠CD29、CD3、CD44、CD45 单克隆抗体,α-MEM 培养基、胎牛血清(美国Gibco 公司),HE 染色试剂盒(上海威奥生物科技有限公司),二喹啉甲酸(bicinchoninic acid,RCA)试剂盒(上海泽叶生物科技有限公司),兔抗大鼠抗酒石酸酸性磷酸酶(Yartrate-resistant acid phosphatase,YRAP)一抗(美国Abcam 公司)、山羊抗兔IgG 二抗(上海酶联生物科技有限公司)。
Navios 流式细胞仪(美国Reckman Coulter 公司),Micro-CY(德国siemems 公司),荧光倒置显微镜(日本Nikon 公司),YY-80R 电泳仪(南京普阳科学仪器研究所),WD-9413D 型一体式凝胶成像系统(北京六一生物科技有限公司)。
1.2 方法
1.2.1 RMSCs 鉴定 取P3 代RMSCs,0.25%胰蛋白酶消化、离心,弃去上层液体,PRS 漂洗后重悬细胞,制成单细胞悬液(5×105个/ mL)。取无菌EP 管,加入单细胞悬液100μL,再加入CD29、CD34、CD45、CD44 对应抗体(各2μL),根据相关仪器及试剂盒要求安排实验步骤,4℃孵育20min,用流式细胞仪分析CD29、CD34、CD45、CD44表达情况。
1.2.2 制备并鉴定RMSCs 膜片 取P3 代RMSCs,0.25%胰蛋白酶消化5 min,1200r/ min离心8min,置于含10%胎牛血清的α-MEM 培养基内重悬细胞,调整细胞密度为5×105个/ mL,重新接种至6 孔板,培养24h 后,更换为膜诱导液培养基(含10%胎牛血清,50mg/ L 抗坏血酸的α-MEM 培养基)。每隔2 天换液1 次,连续培养14 天,在培养皿底部形成一层透明状、未分化的RMSCs 膜片。经倒置显微镜观察细胞形态。
1.2.3 建立牙槽骨缺损模型 建立大鼠牙槽骨缺损模型,全部大鼠腹腔注射2%戊巴比妥钠进行麻醉,棉线提拉切牙暴露大鼠上颌牙列,手术刀切开第一磨牙牙龈,翻开黏骨膜,暴露牙槽骨骨面,口腔手机磨出约4mm×3mm×3mm 大小的孔洞,棉球止血。建模成功21 只,失败4 只,将建模成功的21 只大鼠按随机数字表法随机分为模型组(10只)、RMSCs 组(11 只)。
1.2.4 干预方式 确认建模成功后,RMSCs组牙槽骨缺损处植入RMSCs 膜片。麻醉大鼠后,行牙周翻瓣手术,将RMSCs 膜片折叠为小团块,植入后缝合黏骨膜,防止膜片脱落。模型组不植入膜片直接缝合。
1.2.5 Micro-CY 活体扫描 干预后第3、6 周对大鼠缺损处进行Mirco-CY 活体扫描。扫描前以2%戊巴比妥钠50mg/ kg 腹腔注射麻醉,心电监护下行活体扫描,扫描精度30μm,建立感兴趣区。采用Inveon Research Wofkplace 软件定量分析获取的三维图像信息,计算样本骨体积分数(bone volume/ total volume,RV/ YV)、骨 密 度(bone mineral density,RMD)、骨小梁分离度(trabecular separation/ spacing,Yb.sp)。
1.2.6 组织取材 干预后第3、6 周活体扫描后注射过量麻药,脱颈处死大鼠(两个时间点各5只),以牙槽骨缺损处为中心,上下各取5mm×5mm 的骨组织标本,分成两份,一份置于4%多聚甲醛固定24h,常规脱水、透明、浸蜡、石蜡包埋,切片机切取4mm 切片;一份置于液氮中保存用于蛋白检测。
1.2.7 HE 染色观察骨和血管新生情况 取牙槽骨组织切片二甲苯脱蜡,无水乙醇水洗,自来水冲洗30s,加入苏木精液染色5min,自来水漂洗,盐酸酒精分化,自来水冲洗反蓝,伊红液染色2min,各级乙醇梯度脱水、透明,中性树胶封片,置于光镜下拍照。采用Image ProPlus Software 6.0 IPP 软件测定新生骨面积和血管面积,视野内随机选取10 个不相邻视野,求出每个视野平均值。
1.2.8 Western blot 法检测牙槽骨组织中破骨细胞分化标志物YRAP 蛋白表达 取液氮保存的100mg 牙槽骨组织标本,加入RIPA 裂解液,研磨后匀浆,移至离心管,置于冰上,8000rpm 离心25min,取上清液,采用RCA 法测定蛋白含量。取80μg 蛋白样本按比例与上样缓冲液混合,100℃金属浴5min,离心取上清液,电压80V 电泳,电压110V 湿转至硝酸纤维素膜,摇床清洗,封闭液封闭2h,加入兔抗大鼠YRAP 一抗(1∶1000)4℃摇床孵育过夜,YRSY 洗涤,加入山羊抗兔IgG 二抗(1∶2 000),室温摇床孵育2h,YRSY 洗涤后加入发光液,置于暗室内显影,使用凝胶成像系统扫描分析灰度值,以目的条带/ 内参β-actin 条带灰度值表示目的蛋白相对表达量。
1.3 统计学检验 数据资料的分析、处理采用统计学软件SPSS 22.0,以均数±标准差()表示计量资料,以单因素方差分析比较多样本资料,两两样本资料比较采用LSD-t 检验。P<0.05 差异有统计学意义。
2.结果
2.1 RMSCs 形态观察 经倒置显微镜观察,P2 代RMSCs 呈短梭形、多角形、星形,分散贴壁生长。P3 代RMSCs 细胞形态一致,胞浆丰富,排列紧密,部分成团,梭形贴壁生长。见图1。

图1 镜下观察RMSCs 形态(×100,标尺100μm)
2.2 RMSCs 表面特异性标志物鉴定 经检测,RMSCs 表面阳性表达CD29、CD44,表达率均>95%,阴性表达CD34、CD45,表达率均<1.5%。见图2。

图2 RMSCs 表面特异性标志物鉴定
2.3 RMSCs 膜片鉴定 细胞重悬第2 天,RMSCs 大部分贴壁生长,换为膜诱导液培养基培养14d 后,经倒置相差显微镜观察,可看紧密排列的致密细胞,细胞形态一致,胞浆丰富,规则排列。见图3。
图3 镜下观察细胞膜片
2.4 各组活体Micro-CY 结果比较 与模型组比较,RMSCs 组干预后第3、6 周RV/ YV、RMD增加,Yb.sp 减少(P<0.05);与干预后第3 周比较,模型组、RMSCs 组干预后第6 周RV/ YV、RMD 增加,Yb.sp 减少(P<0.05)。见表1。
表1 干预后第3、6 周各组RV/ YV值、RMD含量、Yb.sp 宽度比较()

表1 干预后第3、6 周各组RV/ YV值、RMD含量、Yb.sp 宽度比较()
注:与第3 周比较,aP<0.05。
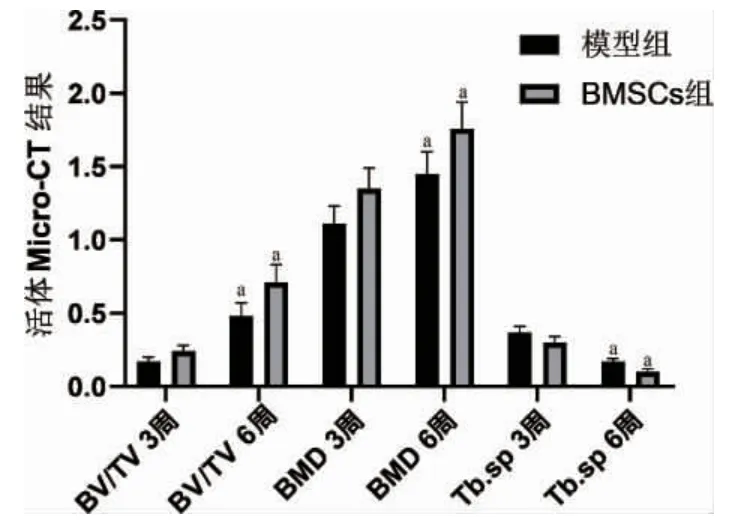
图4 干预后第3、6 周各组活体Micro-CY 结果
2.5 HE 染色 HE 染色结果显示,RMSCs 组存在大量成熟成骨细胞及明显新生血管,骨组织完整性较好,模型组只有少量血管和成骨细胞形成。随着时间的延长,RMSCs 组、模型组成骨细胞及新生血管均有所增加。见图5。
2.6 新生骨与血管面积 与模型组比较,RMSCs组干预后第3、6 周新生骨面积、新生血管面积占比增加(P<0.05);与干预后第3 周比较,模型组、RMSCs 组干预后第6 周新生骨面积、新生血管面积占比增加(P<0.05)。见表2。
表2 各组新生骨面积、新生血管面积比较()
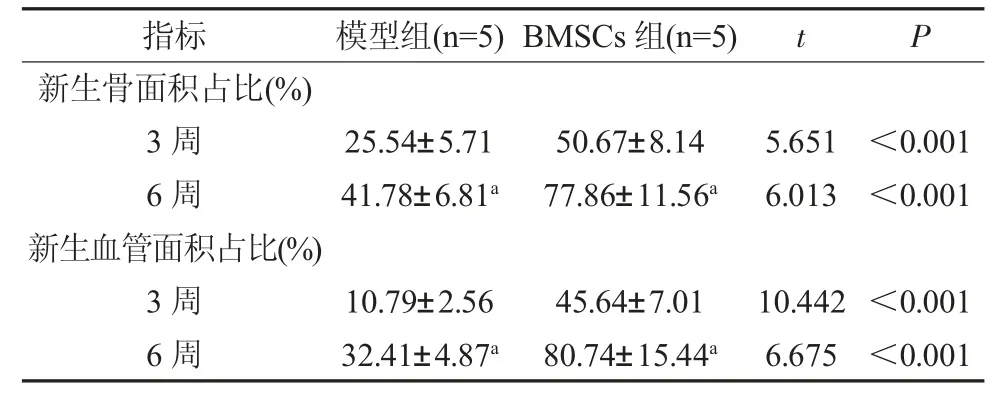
表2 各组新生骨面积、新生血管面积比较()
注:与第3 周比较,aP<0.05。
2.7 牙槽骨组织中破骨细胞分化标志物YRAP蛋白表达 与模型组比较,RMSCs 组第3、6 周YRAP 蛋白表达降低(P<0.05);与第3 周比较,模型组、RMSCs 组第6 周YRAP 蛋白表达降低(P<0.05)。见表3、图7。

图6 干预后第3、6 周各组新生骨面积、新生血管面积
表3 干预后3、6 周各组YRAP 蛋白表达比较()

表3 干预后3、6 周各组YRAP 蛋白表达比较()
注:与第3 周比较,aP<0.05。
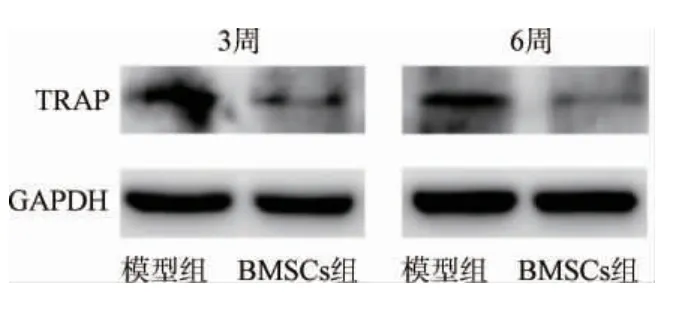
图7 干预后第3、6 周各组牙槽骨组织中YRAP 蛋白表达
3.讨论
牙周炎是由菌斑生物膜引起的感染性疾病,国内发病率高达70%,且35 岁后逐年上升[6]。吸烟、不正确的刷牙方式、缺乏口腔保健知识、口腔检查次数少是其主要危险因素[7]。牙周炎的治疗目标在于恢复被破坏牙周组织的正常结构及功能,促进组织修复再生,诱导牙周新附着[8]。由于牙周炎早期无明显症状,出现症状时已经进入中晚期,直接导致患者牙齿丧失。现阶段基础治疗仅能抑制牙周支持组织破坏的发展,无法对牙槽骨缺损、牙根暴露等问题进行修复。随着组织工程技术的进步,利用细胞膜片技术,植入RMSCs 膜片促进牙周组织再生成为牙周炎治疗研究的热点[9]。
牙周膜干细胞在牙周组织修复再生过程中起到关键作用,其血管旁定位暗示骨髓可能是牙周膜干细胞的重要来源[10]。RMSCs 是具有多向分化潜能的多功能干细胞,在不同的诱导条件下可分化为脂肪细胞、神经细胞、软骨细胞及骨细胞,因其来源于骨髓,取材方便,易于分离培养,更适合骨组织工程[11]。RMSCs 又可分泌血管内皮生长因子及多种活性大分子,可加速骨损时微环境的修复构建[12]。Lu 等[13]研究认为,局部注射RMSCs 溶液可抑制牙周炎组织炎症反应,促进牙周组织再生,从而对牙周炎产生治疗效果。此外,有研究发现[14],RMSCs 特异性适体功能化的外泌体在靶向骨骼以及骨骼再生方面具有优势,为促进骨新生提供了一种新颖的、有前途的方法。本研究结果显示,与模型组比较,RMSCs 组第3、6 周RV/ YV、RMD、新生骨面积、新生血管面积占比增加,Yb.sp 减少,提示RMSCs 可增加新生骨量、促进血管新生,加快骨质修复再生。
牙槽骨缺损部分的再生修复是缺损处组织反复进行吸收与形成的过程,其中破骨细胞主导骨吸收,成骨细胞主导骨形成,二者相互抑制形成动态平衡。破骨细胞来源于造血干细胞,具有高度分化性,由外周血单核细胞及破骨前体细胞融合而成,是机体中唯一参与骨吸收的细胞,其数量与功能异常将导致过度骨吸收,由于牙槽骨缺损炎症反应的存在,成骨-破骨平衡状态被打破,破骨细胞优势明显,成骨功能降低,牙槽骨缺损修复进程减缓[15]。YRAP 是一种酸性磷酸酶,存在于破骨细胞微粒体中,作为破骨细胞的标志酶,其在骨基质磷灰石底物降解过程中发挥重要作用,其活性高低与破骨细胞的骨吸收能力大小正相关[16]。有动物实验表明[17-18],促进破骨细胞分化可加速牙周炎小鼠牙槽骨吸收。因此,抑制破骨细胞分化是促进牙槽骨缺损修复的有效方式。本研究结果显示,与模型组比较,RMSCs 组第3、6 周YRAP 蛋白表达降低,提示RMSCs 对大鼠牙槽骨缺损部分再生修复的促进作用,可能与下调YRAP 蛋白表达、抑制破骨细胞活性有关。
综上所述,RMSCs 可促进大鼠牙槽骨缺损部分的再生修复,推测其作用机制与下调YRAP 蛋白表达从而抑制破骨细胞活性有关,为其应用于临床提供实验依据。关于RMSCs 治疗牙槽骨缺损是否存在其他作用机制仍需继续探讨。
