斑马鱼zgc113227多克隆抗体及卵形鲳鲹EVM0008813多肽抗体的制备
2022-10-11张永德宋漫玲罗辉余燕玲林勇陈晓汉冯鹏霏罗洪林
张永德,宋漫玲,罗辉,余燕玲,林勇,陈晓汉,冯鹏霏,罗洪林*
(1广西水产科学研究院/广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;2西南大学水产学院,重庆 402460)
0 引言
【研究意义】斑马鱼()原产于印度、巴基斯坦等热带地区,除了具有较高的经济价值外,其生理组织结构及分子调控等与人类相似,与人类基因的同源性高达87%,且饲养成本低、繁殖周期短、产量高,已广泛应用于脊椎动物发育机制、免疫学、药物研发、毒理学评估及人类疾病模型研究等领域(Cross et al.,2003;吴唯维等,2014;段蕊和吴昊泽,2017;程祖春等,2019;钱星宇,2019)。卵形鲳鲹()俗名金鲳,已被列为名贵食用鱼类,主要生活在热带、亚热带海域;随着国内外消费市场需求的不断上升,卵形鲳鲹将发展成为最具潜力的海水经济养殖鱼类之一(林川等,2018;张永德等,2020;段家文等,2021)。抗体是脊椎动物在应对内外抗原刺激的免疫应答中,由浆细胞(效应B细胞)分泌的一类能与相应抗原特异性结合、具有免疫功能的球蛋白。除了本身作为生物学功能的概念,抗体还可作为一种研究工具应用于科研、医学、农业、环境保护和食品检测等领域,按其来源可分为天然抗体、单克隆抗体、多克隆抗体及基因工程抗体四大类(贾慧娜和罗海玲,2012;赵久刚等,2018),其中,多克隆抗体反应强度大,且制备技术简单,省时省力,价格低廉,因此在科研领域已得到广泛应用。【前人研究进展】目前,有关多克隆抗体制备的工艺已较成熟(张佳凤等,2015;何丽番和高海,2016;李歌等,2019;冯鹏霏等,2021),在水生生物研究领域也取得长足进展。王雪妹(2015)制备获得的抗鳗弧菌多克隆抗体为实现快速、灵敏检测鳗弧菌提供了可靠工具。张永德等(2018)为研究罗非鱼淋巴细胞特异性蛋白酪氨酸激酶(Lck)蛋白功能及其作用机制,制备了尼罗罗非鱼Lck多克隆抗体并进行鉴定。何明旺等(2019)通过克隆卵形鲳鲹抗菌肽基因,构建原核表达载体并体外诱导表达重组融合蛋白,成功制备获得高效的hepcidin-5蛋白多克隆抗体,为深入探究卵形鲳鲹hepcidin-5的生物学功能奠定了基础。潘传燕等(2019)通过构建原核表达载体、大肠杆菌融合表达及免疫日本大耳兔,成功制备获得尼罗罗非鱼过氧化物酶体增殖物激活受体δ(PPARδ)多克隆抗体。丁宁(2020)通过制备大黄鱼鼠抗CD3ε多克隆抗体,探究了细胞毒性因子CD3分子在硬骨鱼T细胞活化及免疫应答中的功能作用。刘倩等(2020)制备获得抗鼠源类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein,StAR)多克隆抗体并应用于中华鳖卵巢组织中StAR蛋白表达和定位分析,结果显示StAR蛋白在卵巢间质细胞和精巢的间质细胞、精原细胞及胞质中均有表达。王鹭等(2020)构建了卵形鲳鲹肿瘤坏死因子超家族成员6(Tumor necrosis factor superfamily 6,TNFSF6)原核表达系统并成功制备获得TNFSF6多克隆抗体。Nguyen-Phuoc等(2021)成功制备获得虾急性肝胰坏死病(AHPND)ToxA特异性多克隆抗体,为下一步研发基于抗原—抗体相互作用的AHPND检测试剂盒奠定了基础。【本研究切入点】本课题组前期研究卵形鲳鲹转录组时通过加权基因共表达网络分析(Weighted correlation network analysis,WGCNA)发现1个与卵形鲳鲹胚胎发育相关基因(EVM0008813),同时经同源序列查找获得斑马鱼同源基因zgc113227(NP_001014341),但至今未见有关斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因功能特性的研究报道。【拟解决的关键问题】为深入研究斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因的生物学功能,根据其基因序列人工合成斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因,构建对应的原核表达载体,经大肠杆菌融合表达后免疫日本大耳兔以制备多克隆抗体,为后续深入研究这2个基因的功能特性提供重要工具。
1 材料与方法
1.1 试验材料
TRIzol试剂购自Invitrogen公司,ET-B2m表达载体和大肠杆菌B21感受态细胞购自武汉金开瑞生物工程有限公司,质粒提取试剂盒(DP116)和胶回收试剂盒(DP209)购自天根生化科技(北京)有限公司,亲和层析柱料购自美国GE Healthcare公司,T4 DNA连接酶、DNA聚合酶、蛋白分子量标准(Marker)及限制性内切酶(H I和I)购自美国Fermentas公司,羊抗兔-HRP抗体购自美国Jackson公司,弗式完全佐剂和弗氏不完全佐剂购自美国Sigma公司。
1.2 试验方法
1.2.1 目的基因合成从卵形鲳鲹转录组中筛选出1个与胚胎发育相关的基因(EVM0008813),以EVM0008813基因为查询序列,对斑马鱼全基因组序列进行BLASTp搜索(E<e-10),获得斑马鱼同源基因zgc113227(NP_001014341)。利用Primer Premier 5.0设计特异性引物(表1)用于检测表达载体中的斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因,委托生工生物工程(上海)股份有限公司合成基因序列及PCR扩增引物。

表1 斑马鱼zgc113227和卵形鲳鲹EVM0008813基因的PCR扩增引物Table 1 PCR amplification primers of zebrafish zgc113227 and T.ovatus EVM0008813 genes
1.2.2 蛋白结构分析及抗原表位预测采用ExPASy(https://web.expasy.org/protparam/)预测蛋白亲/疏水性等理化性质,运用TMHMM 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行蛋白跨膜结构和信号肽预测,利用DNASTAR中的Protean模块对蛋白抗原指数、柔性区域、表面可及性等参数进行预测,使用SMART(http://smart.embl.de/)和MEME(https://meme-suite.org/meme/)预测分析蛋白结构域,并以Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行序列同源比对分析。
1.2.3 原核表达载体构建及鉴定以同源重组方式构建原核表达载体pET-B2m-zgc113227和pETB2m-EVM0008813,然后转化B21感受态细胞;筛选阳性克隆并提取质粒进行PCR扩增,具体PCR反应体系及扩增程序参照潘传燕等(2019)的研究方法。PCR扩增产物经2.0%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司测序。
1.2.4 融合蛋白表达与鉴定以原核表达载体pET-B2m-zgc113227和pET-B2m-EVM0008813分别转化B21感受态细胞,挑选阳性菌体接种至含抗生素的LB液体培养基中,37℃恒温培养至A≈0.6;取部分菌液为对照,剩余菌液加入IPTG(终浓度0.5 mmol/L),继续诱导培养3 h;两组菌液各取0.15 mL,12000×g离心2 min,菌体沉淀以40μL 1×Loading Buffer重悬裂解,12000×g离心10 min后收集上清液进行SDS-PAGE检测。
1.2.5 zgc113227蛋白和EVM0008813多肽大量表达与纯化阳性菌体经IPTG诱导大量表达后,收集发酵液,8000×g离心5 min并收集菌体。将菌体悬浮于预冷的NTA-0缓冲液中冰浴30 min,超声波破碎菌体,12000×g离心10 min,收集上清液及菌体沉淀。菌体沉淀根据Ni-NTA操作说明进行蛋白纯化,并以SDS-PAGE检测斑马鱼zgc113227蛋白和卵形鲳鲹EVM0008813多肽的纯化情况。
1.2.6 zgc113227蛋白和EVM0008813多肽抗体制备选用健康级成年日本大耳白兔为试验动物,将纯化的zgc113227蛋白及EVM0008813多肽与牛血清白蛋白(BSA)偶联物分别与等容积弗氏完全佐剂充分乳化后,于日本大耳白兔皮下进行多点注射,各免疫2只,免疫剂量为500µg/只。每只日本大耳白兔免疫5~6次,每次免疫间隔14 d,待抗体表达恒定后采血分离血清,分装,-80℃保存备用。
1.2.7 免疫效价测定采用间接ELISA测定抗血清效价。以纯化zgc113227蛋白为包被抗原(2μg/mL),吸取样品按100μL/孔的剂量包被96孔酶联板,4℃过夜;弃孔内液体,洗涤3次,加入待测血清,37℃温育1 h;洗涤,再加入1∶5000稀释的酶标二抗(100μL/孔),37℃温育1 h,洗涤后每孔加入100μL显色液(TMB),37℃温育20 min,加入50μL终止液终止反应,采用全波长酶标仪测定吸光值(OD)。阳性反应的最大稀释度即为待测抗体效价。抗EVM0008813多肽血清效价测定方法同上。
1.2.8 斑马鱼zgc113227多克隆抗体鉴定及纯化采用Western blotting鉴定zgc113227蛋白:分别取10和25 ng纯化的融合蛋白进行SDS-PAGE电泳,并转印至PVDF膜,封闭液中37℃封闭2 h后加入稀释1000倍的兔抗血清,37℃摇床孵育1 h,洗膜,然后加入羊抗兔-HRP二抗(1∶10000倍稀释),37℃孵育1 h,采用ECL化学发光试剂盒发光显影,暗室反应2 min,取出胶片立即浸入显影液中显色1 min,再浸入定影液中定影1 min,晾干,拍照分析。采用Protein G亲和层析柱对抗体进行纯化,将收集的抗zgc113227血清与4倍体积的1% NaAc混合后上样,1% NaAc洗杂,以3.5%冰乙酸冲洗至无蛋白流出检出,收集洗脱产物,测定OD并估算抗体浓度;采用饱和碳酸钠调节洗脱产物pH至7.0,使用10 kD超滤管进行纯化浓缩,经SDS-PAGE检测后-20℃保存备用。
1.2.9 卵形鲳鲹EVM0008813多肽抗体鉴定及纯化采用高效液相色谱—质谱联用(HPLC-MS)纯化鉴定卵形鲳鲹EVM0008813多肽抗体。通过査阅相关文献,确定选用乙腈三氟乙酸水溶液系统,色谱流动相为0.1%三氟乙酸水溶液—乙腈系统,梯度洗脱,参照孟迂(2010)以HPLC分离纯化蜂毒多肽的方式进行具体操作。
2 结果与分析
2.1 斑马鱼zgc113227和卵形鲳鲹EVM0008813跨膜结构、信号肽及理化性质预测结果
斑马鱼zgc113227基因编码415个氨基酸残基,编码蛋白分子量为48091.58 Da,理论等电点(pI)为9.02,不稳定性指数为55.00,脂肪指数为92.22。卵形鲳鲹EVM0008813基因编码395个氨基酸残基,编码蛋白分子量为45397.07 Da,pI为9.05,不稳定性指数为46.33,脂肪指数为87.11。跨膜结构及信号肽预测结果显示,斑马鱼zgc113227和卵形鲳鲹EVM0008813均无跨膜结构及信号肽存在。
2.2 斑马鱼zgc113227和卵形鲳鲹EVM0008813抗原表位参数预测结果
2.2.1 斑马鱼zgc113227亲/疏水性、抗原指数、柔性区域和表面可及性DNASTAR预测结果(图1)显示,斑马鱼zgc113227蛋白平均亲水性为-0.49,其中亲水性氨基酸占比较高,主要包括第30~45、55~72、78~112、129~138、168~188、205~220、244~253、264~273、287~290、292~296、303~321、323~345和360~400位氨基酸。抗原指数高低决定了蛋白抗原表位位点存在的可能性。斑马鱼zgc113227氨基酸序列潜在多个且均匀分布的抗原表位区域,且这些位点的抗原指数较高,分别是第36~48、53~58、62~69、75~82、87~111、115~121、129~136、170~187、205~220、229~232、241~255、261~277、297~331、336~350、360~401和406~411位氨基酸。此外,斑马鱼zgc113227蛋白柔性较强、表面可及性高,具有制备蛋白抗体的优势。
2.2.2 卵形鲳鲹EVM0008813亲/疏水性、抗原指数、柔性区域和表面可及性DNASTAR预测结果(图2)显示,卵形鲳鲹EVM0008813蛋白氨基酸序列中含有较多的亲水性氨基酸,平均亲水性为-0.49,亲水性区段较高的主要有第22~48、52~58、63~72、77~95、101~112、117~121、130~136、170~175、182~190、206~220、244~274、277~308、313~333、346~364、370~381和389~395位 氨 基 酸。卵 形 鲳 鲹EVM0008813氨基酸序列也潜在多个抗原表位位点且分布均匀,其中第30~47、52~58、63~69、75~80、87~94、103~111、117~121、130~136、170~177、183~189、196~199、205~220、228~233、242~252、261~308、311~337、346~363、372~385、391~395位氨基酸的抗原指数较高,同时具备较强的亲水区域,制备抗体的可行性较高。
2.3 斑马鱼zgc113227和卵形鲳鲹EVM0008813蛋白结构域预测结果
Clustal Omega预测得知斑马鱼zgc113227和卵形鲳鲹EVM0008813的氨基酸序列相似性为58.12%。利用SMART预测蛋白结构域,结果发现斑马鱼zgc113227氨基酸序列C端第195~358位氨基酸包含1个DDE_Tnp_4结构域,卵形鲳鲹EVM0008813氨基 酸 序 列C端 第195~344位 氨 基 酸 也 含 有1个DDE_Tnp_4结构域,故推测斑马鱼zgc113227和卵形鲳鲹EVM0008813均属于DDE_Tnp_4家族。采用MEME对斑马鱼zgc113227和卵形鲳鲹EVM000881进行保守结构域分析,结果(图3)均获得5个保守基序(Motif 1~Motif 5),且这5个基序是氨基酸序列中最保守的区域。
2.4 斑马鱼zgc113227和卵形鲳鲹EVM0008813表达载体鉴定结果
合成斑马鱼zgc113227和卵形鲳鲹EVM0008813基因序列,通过同源重组分别构建原核表达载体pET-B2m-zgc113227和pET-B2m-EVM0008813。然后以构建的2个表达载体为模板,PCR扩增zgc113227和EVM0008813基因,经2.0%琼脂糖凝胶电泳检测,分别获得约1500和1000 bp的扩增片段(图4),片段大小与预期结果一致。经测序与序列比对分析,证实斑马鱼zgc113227和卵形鲳鲹EVM0008813表达载体成功构建,目的基因片段插入位置正确。
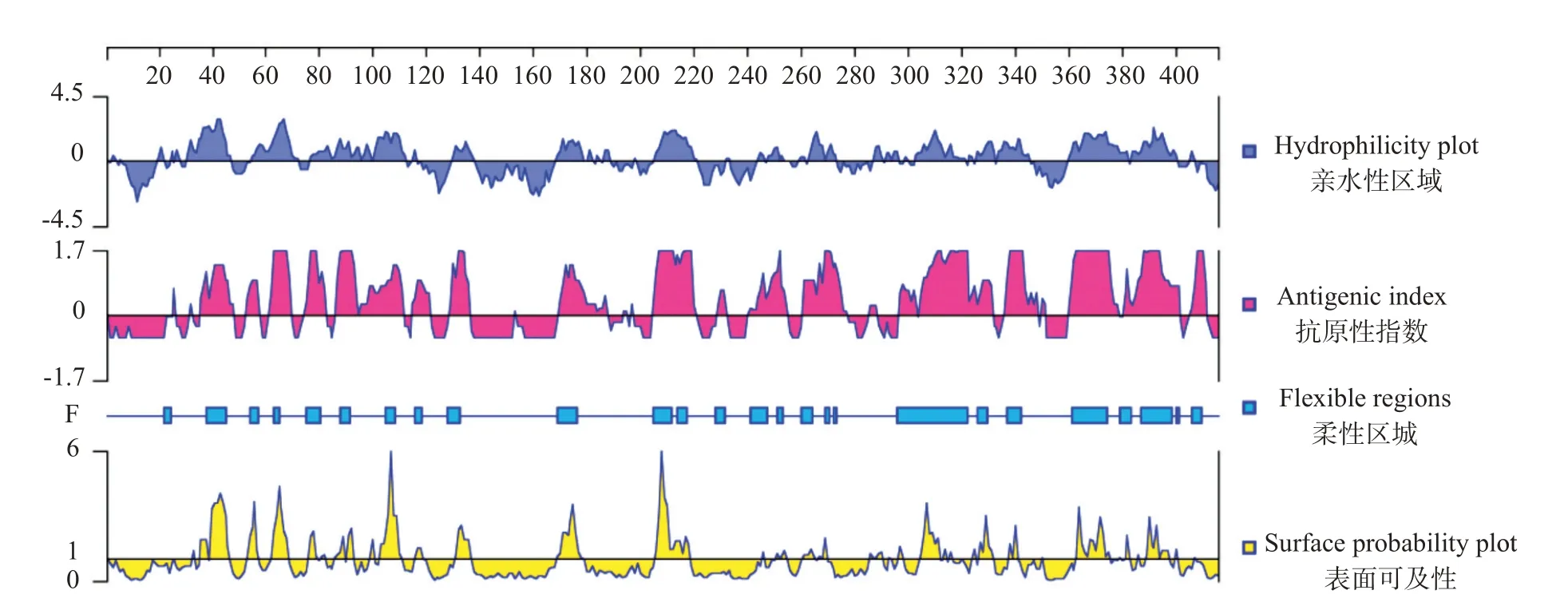
图1 斑马鱼zgc113227蛋白亲/疏水性、抗原指数、柔性区域和表面可及性等参数预测结果Fig.1 Parameter prediction of hydrophilicity,antigen index,flexible region and surface probability of zgc113227 protein in zebrafish
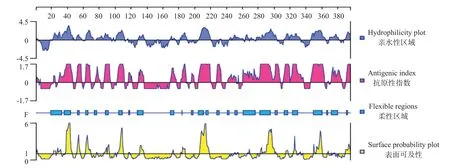
图2 卵形鲳鲹EVM0008813多肽亲/疏水性、抗原指数、柔性区域和表面可及性等参数预测结果Fig.2 Parameter prediction of hydrophilicity,antigen index,flexible region and surface probability of EVM0008813 polypeptide in T.ovatus
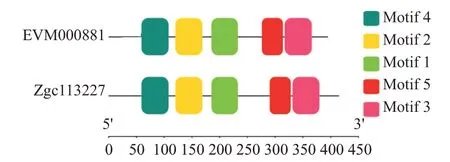
图3 斑马鱼zgc113227和卵形鲳鲹EVM0008813蛋白的保守基序预测结果Fig.3 Conserved motif prediction of zebrafish zgc113227 and T.ovatus EVM0008813
2.5 斑马鱼zgc113227和卵形鲳鲹EVM0008813原核表达鉴定结果
以构建的原核表达载体pET-B2m-zgc113227和pET-B2m-EVM0008813分别转化B21感受态细胞,经0.5 mmol/L IPTG诱导3 h,结果发现均能获得对应的目的蛋白条带,其中,zgc113227蛋白在62.0 kD处有1条明显的目的条带(图5-A),EVM0008813多肽在39.0 kD处出现1条明显的目的条带(图5-B)。
2.6 zgc113227蛋白和EVM0008813多肽的提取与纯化效果
收集成功表达融合蛋白的大肠杆菌进行裂解提取并纯化,稀释上样经SDS-PAGE检测,结果显示,在62.0 kD处有1条清晰条带(图6-A),与预期的斑马鱼zgc113227蛋白分子量相符;在39.0 kD处也出现明显的目的条带(图6-B),与预期的卵形鲳鲹EVM0008813多肽分子量相符。
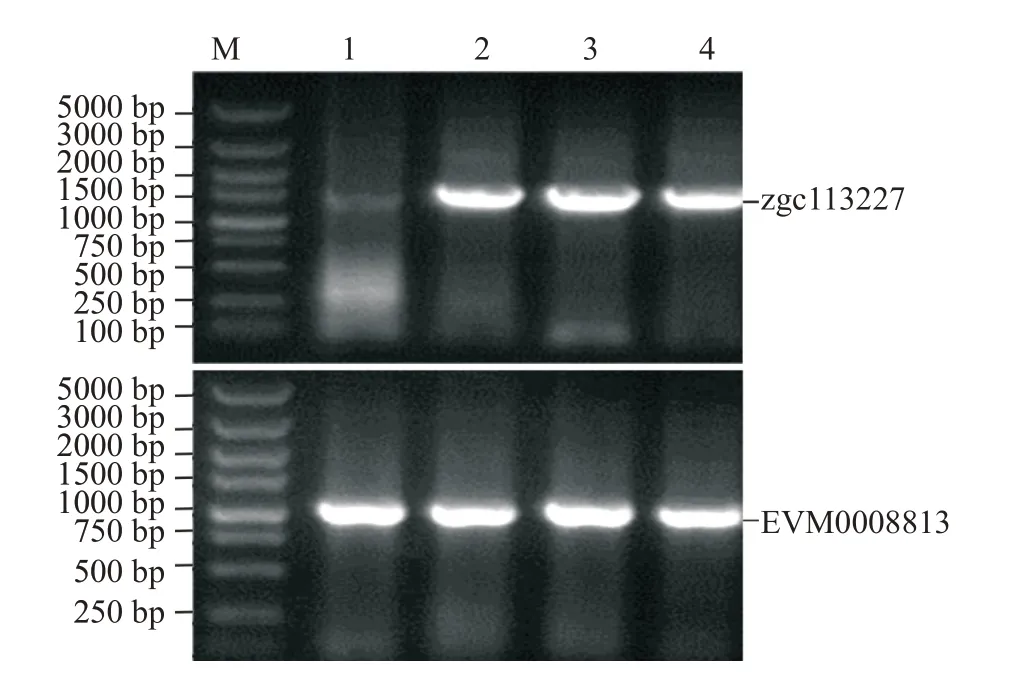
图4 斑马鱼zgc113227和卵形鲳鲹EVM0008813基因表达载体的PCR检测结果Fig.4 PCR detection of gene expression vector in zebrafish zgc113227 and T.ovatus EVM0008813
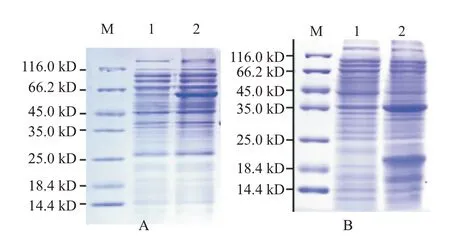
图5 斑马鱼zgc113227和卵形鲳鲹EVM0008813蛋白的诱导表达产物SDS-PAGE检测结果Fig.5 Induced expression product SDS-PAGE detection of zebrafish zgc113227 and T.ovatus EVM0008813
2.7 多克隆抗体效价测定结果
以免疫前的血清为阴性对照,通过间接ELISA测定抗血清效价。结果显示,zgc113227多克隆抗体效价为1∶256000(图7),具有高水平的特异性;将EVM0008813多肽与BSA偶联成完全抗原并免疫日本大耳兔制备的抗血清,抗体效价超过1∶256000(图8),说明EVM0008813多肽抗体具有良好的免疫效果。
2.8 zgc113227多克隆抗体特异性检测及纯化结果
采用Western blotting鉴定斑马鱼zgc113227多克隆抗体特异性,结果(图9-A)显示,在62.0 kD处有1条清晰的特异性蛋白条带,说明制备的zgc113227多克隆抗体有良好的特异性。经Protein G亲和层析柱纯化抗体,将纯化后的抗体进行SDS-PAGE鉴定,结果(图9-B)显示分别在62.0和31.0 kD处出现1条清晰重链条带和1条轻链条带,表明zgc113227蛋白多克隆抗体纯化成功。
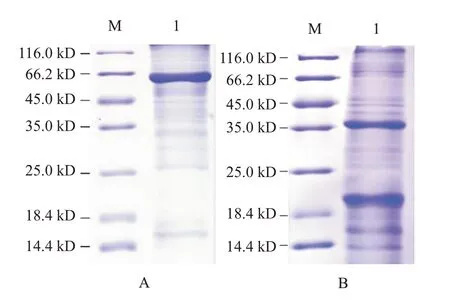
图6 斑马鱼zgc113227蛋白和卵形鲳鲹EVM0008813多肽纯化产物的SDS-PAGE检测结果Fig.6 Purified polypeptide product SDS-PAGE detection of zebrafish zgc113227 and T.Ovatus EVM0008813
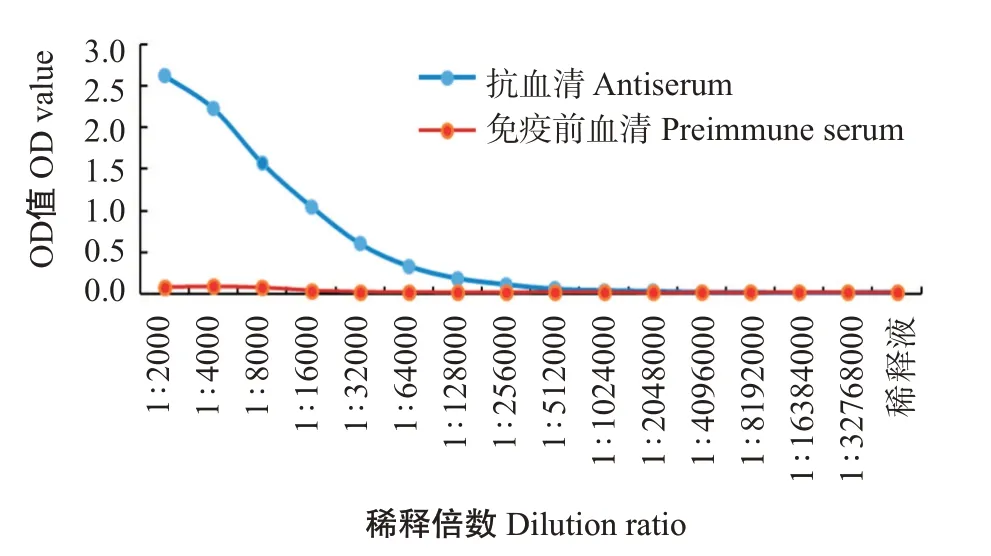
图7 斑马鱼zgc113227多克隆抗体效价曲线Fig.7 Titer curves of polyclonal antibody of zebrafish zgc113227 protein
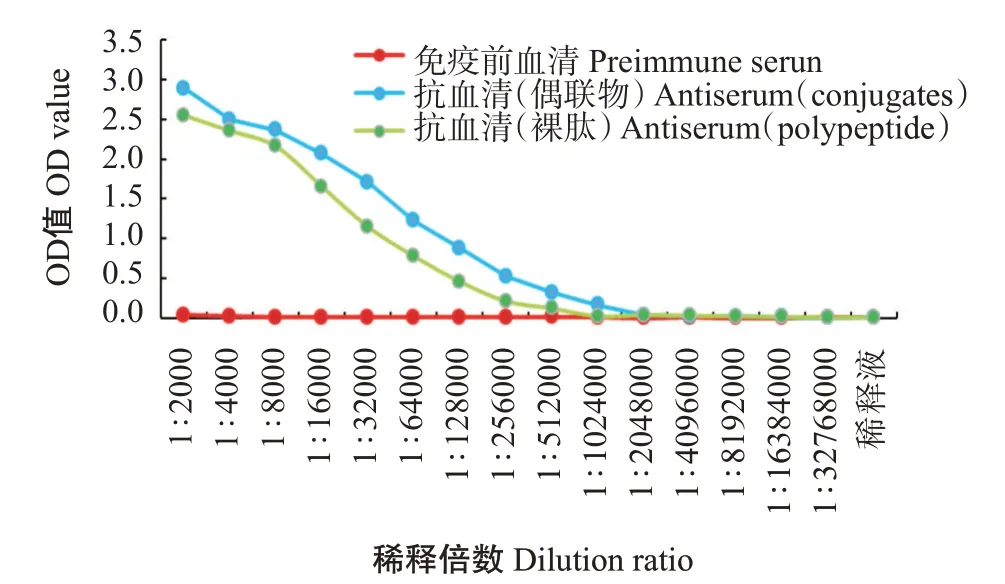
图8 卵形鲳鲹EVM0008813多肽抗体效价曲线Fig.8 Titer curves of polyclonal antibody of T.ovatus EVM0008813 polypeptide
2.9 EVM0008813多肽抗体纯化与鉴定结果
为获得高纯度的EVM0008813多肽抗体,采用HPLC-MS进行纯化鉴定,结果(表2)表明,EVM0008813多肽抗体主峰集中在8~9 min,平均为8.601 min,无杂峰出现,说明制备的多肽抗体纯度较高,由峰面积计算可知其纯度达95.35%,达到预期值。
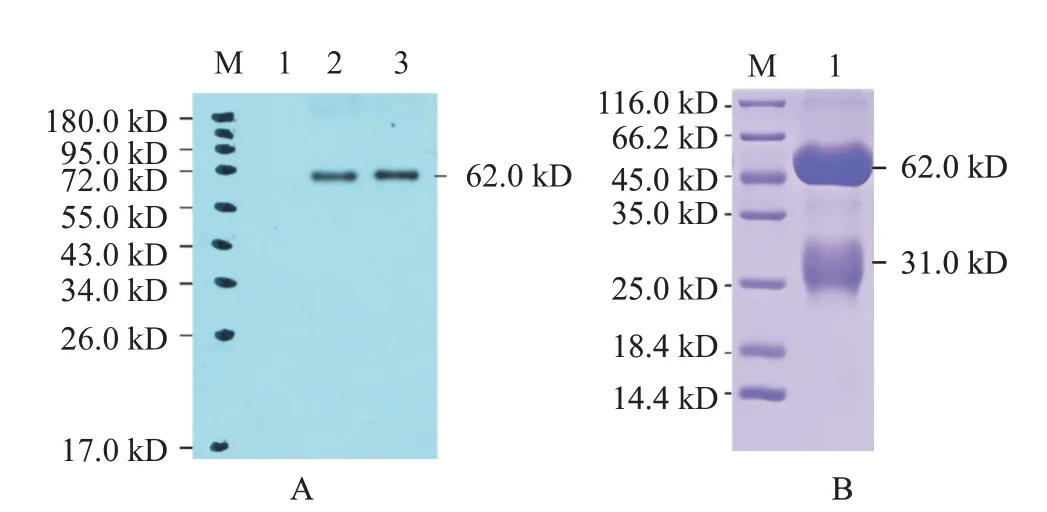
图9 zgc113227多克隆抗体Western blotting鉴定及SDS-PAGE检测结果Fig.9 Western blotting identification and SDS-PAGE detection of zgc113227 polyclonal antibody

表2 EVM0008813多肽抗体纯度HPLC-MS检测结果Table 2 Purity HPLC-MS detection of EVM0008813 polyclonal antibody
3 讨论
本课题组前期在卵形鲳鲹转录组研究中发现与胚胎发育相关的EVM0008813基因,以此为查询序列,通过BLASTp搜索获得斑马鱼同源基因zgc113227(NP_001014341)。生物信息学分析结果表明,斑马鱼zgc113227和卵形鲳鲹EVM0008813均属于亲水性蛋白,二者的氨基酸序列相似性达58.12%,同时表现为潜在抗原位点多、柔性较强、表面可及性高,且无跨膜结构和信号肽存在。基因表达调控的关键步骤是转录因子(TF)与其DNA识别位点的序列特异性结合(Huber and Bulyk,2006)。由于转录因子结合位点(TFBS)通常较短,且典型的序列特异性TF与彼此相似的位点结合,进而获得一个称为基序的保守模式,因此识别分析基序在研究调控基因转录表达方面具有重要意义(Bulyk,2003)。本研究采用MEME分析斑马鱼zgc113227和卵形鲳鲹EVM000881的保守结构域,结果均获得5个保守基序(Motif 1~Motif 5),且这5个基序是氨基酸序列中最保守的区域,故推测zgc113227基因和EVM0008813基因在转录表达过程中扮演着相似的角色。此外,在斑马鱼zgc113227和卵形鲳鲹EVM0008813的分子中均发现1个相同的保守结构域(DDE_Tnp_4),推测二者均属于DDE_Tnp_4家族。DDE_Tnp_4家族蛋白大部分为转座酶家族,在催化DNA断裂和重组过程中起关键作用(刘建政,2018)。DNA转座是基因多样性产生的关键步骤,其通过催化核酸酶结构域折叠进行DNA位移,以混合的α-螺旋特征性RNase H样折叠结构(RNase H-like catalytic domains)最常见,其催化中心由2个天冬氨酰(DD)残基和1个谷氨酸(E)残基组成,虽然残基的排列不同,但通过蛋白折叠可形成对移位所必需的DD(E/D)结构域参与催化(Rice and Mizuuchi,1995;Haren et al.,1999;de Palmenaer et al.,2008),即斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因均参与基因转录。
本研究在设计卵形鲳鲹EVM0008813基因扩增引物时,通过软件预测和分析该蛋白的结构特征与抗原表位,选择其编码蛋白三维结构无法暴露且抗原性高的非跨膜区,兼顾处于连接二级结构(SS)基序长环中的肽链,又避免位于螺旋区域中的肽链,其目的是增加抗体识别天然蛋白的概率,同时与斑马鱼zgc113227基因同源性高、具有稳定构象的B细胞线性表位(张佳凤等,2015)的多肽基因序列作为扩增引物。对斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因进行人工合成,然后分别克隆至表达载体pET-B2m(+)上,构建原核表达载体进行IPTG诱导表达。融合蛋白的表达效果受温度及诱导时间的影响尤为重要,为了确保表达的融合蛋白具备良好活性且产量高,本研究选择在37℃、A=0.6的条件下进行zgc113227蛋白和EVM0008813多肽诱导表达。此外,在免疫环节由于EVM0008813多肽仅由12个氨基酸组成,分子量较小,稳定性较差,在动物体内易被降解,且小分子多肽的抗原性普遍不高,无法激起足量的免疫反应诱导动物产生抗体。本研究中,zgc113227蛋白与等容积弗氏完全佐剂混合为抗原,而EVM0008813多肽与BSA偶联成完全抗原,然后经皮下多点注射方式免疫日本大耳兔,间接ELISA检测结果证实,兔抗zgc113227血清和兔抗EVM0008813血清效价均达1∶256000,表明获得了高效价的多克隆抗体。
经Western blotting鉴定和Protein G亲和层析柱纯化,zgc113227多克隆抗体特异性好,纯度高,可满足后续实验需求;而采用Protein G亲和层析柱纯化EVM0008813多肽抗体,发现所得目的多肽纯度较低,质量差,可能是EVM0008813多肽与层析介质不能特异性结合,或链接载体后表位暴露不充分造成结合效果不理想,或亲和层析柱方法不适宜大量多肽纯化等原因所造成。本研究将亲和层析柱纯化法换成HPLC-MS进行纯化,得到的EVM0008813多肽抗体纯度达95.35%,纯度较高。此外,在检测EVM0008813多肽抗体特异性时发现以纯化后的EVM0008813多肽抗体进行Western blotting检测无法检测到特异性条带,可能是EVM0008813多肽仅含有12个氨基酸,而目的蛋白氨基酸数量大(395个),二者结合概率较小,或对该蛋白结构和抗原表位预测不精确等原因所引起。因此,后续研究将考虑采取其他方式对EVM0008813多肽抗体进行特异性检测。
4 结论
制备获得的斑马鱼zgc113227多克隆抗体和卵形鲳鲹EVM0008813多肽抗体纯度高、抗体效价高、特异性良好,可为斑马鱼zgc113227基因和卵形鲳鲹EVM0008813基因功能研究提供有利工具。
