水稻WOX家族基因鉴定及其种子在逆境萌发中的表达分析
2022-10-11张琪张爱霞贾俊婷赵华刘军陈兵先
张琪,张爱霞,贾俊婷,赵华,刘军*,陈兵先*
(1广东省农业科学院农业生物基因研究中心/广东省农作物种质资源保护与利用重点实验室,广东广州 510640;2广州国家现代农业产业科技创新中心/农业农村部华南现代生物种业重点实验室,广东广州 510520)
0 引言
【研究意义】水稻(L.)作为主粮作物在保障我国粮食有效供给中发挥重要作用,其种子萌发和成苗质量在很大程度上决定着植株的营养状况和产量,因此,关于水稻萌发机理探究一直以来都是研究热点之一(陈雅玲等,2020;常彦鹏等,2021;王丹丹和李娟,2021)。WOX(WUSCHELrelated homobox)蛋白是植物特有的转录因子,在植物干细胞稳态维持、胚胎发生与胚胎后期发育、激素信号转导、初生和次生物质代谢及抗逆响应中均发挥重要的调节作用(Wang et al.,2019;朱满喜等,2020)。WOX蛋白含有60~66个氨基酸残基组成的同源异型结构域,具有“螺旋—环—螺旋—转—螺旋”结构,其中,第2个和3个螺旋组合形成的“螺旋—转角—螺旋”能与特定DNA序列结合(Haecker et al.,2004;Mukherjee et al.,2009)。但目前家族基因在水稻生长发育和逆境胁迫下的功能仍不清楚,因此,鉴定水稻家族基因,并分析其在种子逆境萌发过程中的表达模式,对探究基因功能及培育水稻抗性品种具有重要意义。【前人研究进展】已有较多植物基因组中基因家族被鉴定,如从拟南芥(Lian et al.,2014)、番茄(李晓旭等,2016)、棉花(吕有军等,2017)、玉米(郑玲等,2019)、大豆(Hao et al.,2019)中分别鉴定获得15、10、37、31和33个基因家族成员。近年来,较多非大宗作物的家族基因也被鉴定,如从苦荞中鉴定获得30个基因家族成员,不均匀分布在8条染色体上(候思宇等,2021);从藜麦中鉴定获得13个WOX转录因子,均含由34~60个氨基酸组成的Homeobox保守结构域(朱满喜等,2020);从中华猕猴桃中鉴定获得16个WOX转录因子,均属于Homodomain超家族,系统进化分析结果显示其与菠萝WOX转录因子的亲缘关系最近,与番茄WOX转录因子的亲缘关系最远(付春等,2021);从苹果中鉴定获得12个家族成员,其中,有11个基因分别定位在7条染色体上,1个基因未准确定位(王楚堃等,2019)。有关植物基因功能的研究较多。在拟南芥中,和冗余调控花瓣和叶片的发育(Vandenbussche et al.,2009),基因在维持维管形成层的干细胞数量和形态中发挥重要作用(Hirakawa et al.,2010);基因受生长素诱导后在根中表达,推测其在维持根尖分生组织干细胞的稳定性方面 发 挥 作 用(Gonzali et al.,2005;Sarkar et al.,2007);和基因调控胚早期顶端子叶原基发育(Wu et al.,2007)。在水稻中,基因参与叶腋分生组织的形成(Tanaka et al.,2015);基因在器官发育中发挥重要作用,包括叶片侧轴生长和维管系统形成、小穗内外稃形态发生,以及分蘖和侧根形成(Yoo et al.,2013);基因促进水稻分生组织向未分化状态转化,其功能与细胞分裂素的作用有关(Ohmori et al.,2013);基因沉默后主根数量显著增加,而过表达该基因可显著抑制主根伸长,说明该基因也与根的发育有关(Li et al.,2020);基因表达下调会导致叶片发育严重缺陷,同时也降低了维管束发育过程中参与活性细胞分裂素合成基因的表达水平(Yasui et al.,2018);和基因可能在重力刺激反应中发挥生长素下游靶标的作用,并在控制水稻分蘖角度过程中发挥冗余作用(Zhang et al.,2018);基因在新生冠根中表达,随后在根分生组织的细胞分裂区域表达,从而参与调控水稻冠根的发生和生长(Zhao et al.,2009);和基因在调控水稻侧根原基发育中发挥相反作用,基因过表达可促进侧根直径的增加,而突变体降低L型侧根的直径(Kawai et al.,2022);干旱胁迫下水稻叶片和根中基因表达量上调,过表达基因可提高水稻的抗旱能力并可将开花期提早7~10 d(Minh-Thu et al.,2018)。【本研究切入点】虽然已有研究发现,水稻基 因 家 族 具 有13个 成 员(Nardmann et al.,2007),且部分基因在水稻发育中的功能已明确,但鲜见关于水稻家族基因的生物信息学分析及其在种子逆境萌发过程中表达模式的研究报道。【拟解决的关键问题】对水稻家族基因进行鉴定,对其结构特征、进化关系、保守序列等进行生物信息学分析,并通过实时荧光定量PCR(qRTPCR)检测其在种子萌发期的时空表达模式及非生物胁迫下的表达模式,为深入探究水稻基因家族的生物学功能及水稻品种的遗传改良提供理论参考。
1 材料与方法
1.1 试验材料
供试的水稻品种为日本晴,其种子为本课题组种植生产。主要试剂:通用植物RNA提取试剂盒(RP3302)购自北京百泰克生物技术有限公司;Rever-Tra Ace Qpcr RT Master Mix with gDNA Remover试剂盒(FSQ-301)购自东洋纺(上海)生物科技有限公司;2×RealStar Green Fast Mixture(A301-10)购自北京康润诚业生物科技有限公司;其他生化试剂均购自生工生物工程(上海)股份有限公司。主要仪器设备:Climacell人工气候箱(MMM,德国)、Chemi-Doc XRS+凝胶成像系统(Bio-Rad,美国)、Nano-Drop ND2000超微量核酸蛋白分析仪(Thermo,美国)、实时荧光定量PCR仪(Bio-Rad,美国)、电泳仪(Bio-Rad,美国)和PCR仪(Bio-Rad,美国)。
1.2 材料处理
选取100粒饱满的水稻种子放入覆盖两层滤纸的透明方形发芽盒中,加入10 mL种子吸胀溶液(即ddHO),置于培养箱,光/暗为12 h/12 h,温度设置为:28℃(对照,CK)、15℃(低温处理,T1)和42℃(高温处理,T2)。将10 mL ddHO(CK)、200 mL ddHO(水淹处理,T3)、10 mL 100 mmol/L NaCl(盐处理,T4)、10 mL 20% PEG6000(干旱处理,T5)分别加入发芽盒中,置于培养箱28℃,分别于2 d取种子和5 d取幼苗,用于后续RNA提取和qRT-PCR检测。
1.3 水稻WOX基因家族成员鉴定及进化分析
在植物信息数据库(http://plants.ensembl.org/index.html)中下载水稻全基因组DNA序列、蛋白序列、gff3文件和编码区(CDS)序列。水稻、拟南芥、玉米、番茄和杨树WOX转录因子的蛋白序列来自PlantTFDB(http://planttfdb.gao-lab.org/)。利用在线软件Pfam(http://pfam.xfam.org/)、NCBI CDD(https://www.ncbi.nlm.nih.gov/cdd/)和SMART(http://smart.embl.de/)对候选序列蛋白质结构进行分析,剔除不含完整同源异型结构域的候选序列。利用MAGE 7.0中的ClustalW对上述物种中的基因家族成员进行多序列比对,以邻接法(Nerghbor-joining)构建系统发育进化树,并利用Evolview 2.0(https://evolgenius.info//evolview-v2/#login)进行注释。
1.4 水稻WOX基因家族成员理化性质分析
运用ExPASy ProtParam(https://web.expasy.org/protparam/)在线工具分析水稻WOX家族蛋白的氨基酸序列长度、分子量和等电点(Gasteiger,2003)。利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对该家族蛋白进行亚细胞定位分析。
1.5 水稻WOX家族基因结构、染色体定位及蛋白结构域分析
利用在线网站GSDS 2.0(http://gsds.cbi.pku.edu.cn/)绘制水稻基因家族成员的内含子、非编码区(UTR)和外显子结构图。根据水稻全基因组测序信息和标注信息文件,对家族基因染色体位置可视化分析和精准定位,并利用MapChart作图。利用在线软件Pfam(https://pfam.xfam.org/)和MEME(http://meme-suite.org)对水稻WOX家族蛋白序列的保守基序和功能结构域进行分析,其中,MEME的参数设置Maxi-mum number of motifs为10,Occurrences of a single motif为zero or one per sequence。
1.6 水稻WOX家族基因启动子顺式作用元件分析
选取家族基因上游2000 bp的序列,利用在线工具plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其顺式作用元件进行分析,参数为软件默认,相关数据使用TBtools作图。
1.7 水稻WOX家族基因组织表达分析
利用Genevestigator(https://www.genevestigator.com/gv/)数据库中的Os_51k基因芯片数据,选取种子萌发和发育过程中胚、胚乳、幼苗和叶片的基因转录表达数据,并绘制表达热图,分析水稻家族基因的组织及诱导表达谱。
1.8 水稻WOX家族基因在逆境胁迫下表达分析
1.8.1 RNA提取及反转录合成cDNA第一链具体步骤如下:运用植物总RNA快速提取试剂盒提取水稻种胚RNA,用NanoDrop分光光度计检测RNA的浓度和质量。采用ReverTra Ace Qpcr RT Master Mix with gDNA Remover试剂盒合成cDNA第一链。
1.8.2 基因表达定量分析采用qRT-PCR检测水稻种子在不同逆境胁迫下的相对表达量。qRT-PCR采用2×RealStar Green Fast Mixture(GenStar,A301-10)试剂盒。反应体系20.0μL:2×RealStar Green Fast Mixture 10.0μL,10μmol/L正、反向引物0.8μL,5 ng/μL cDNA模板2.0μL,ddHO补充至20.0μL。扩增程序:95℃,2 min;95℃,15 s;58℃,30 s;72℃,30 s,进行40个循环。每组试验设3次生物学重复,相对定量用2计算。内参基因为。试验引物序列见表1。
2 结果与分析
2.1 水稻WOX家族成员鉴定及系统进化分析结果
从PlantTFDB数据库鉴定获得13个水稻基因家族成员(~)。为了分析水稻家族基因的系统进化规律,选取基因序列信息较完整的拟南芥(16个)、玉米(20个)、番茄(10个)和胡杨(17个)的家族基因序列作为参考,构建系统发育进化树,如图1所示。5个物种76条基因可聚为分成3个类群。根据模式植物拟南芥的分类标准(王俞程等,2015),将水稻基因家族成员分为远古进化支(Ancient clade)、中间进化支(Intermediate)和现代进化支(WUS clade)。13个基因中仅有基因为远古进化支,推测该基因编码蛋白具有更为保守的结构和功能特性;中间进化支包含6个成员,分别是、、、、和基因。现代进化支也包含6个成员,分别是、、、、和基因,推测这6个基因是经漫长自然选择后演化出来的基因。
2.2 水稻WOX基因结构分析及染色体定位结果
由图2-A所示,是水稻基因家族中最长的基因,而、和为最短的基因。、、、和基因仅含有外显子区域(CDS序列),无内含子和UTR区域;、和基因具有3个被内含子分割的外显子区域,而、和基因具有较长的内含子序列。可见,水稻家族成员间基因结构存在较大差异,暗示水稻基因功能具有差异性和多样性。

表1 qRT-PCR引物序列Table 1 Primer sequence of qRT-PCR
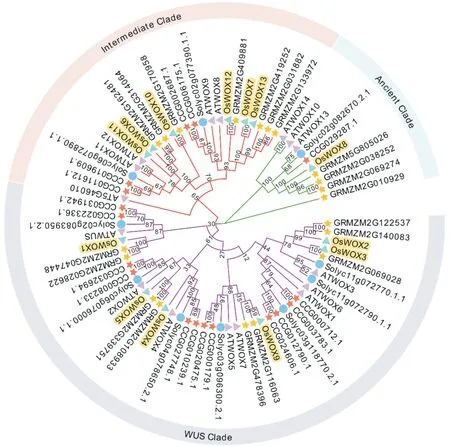
图1 基于不同物种WOX家族基因序列构建的系统发育进化树Fig.1 Phylogenetic tree based on WOX family gene sequence of different species
由图2-B可知,13个基因不均匀地分布在水稻的1、3、4、5、7、8和11号染色体上,其余5条染色体上则不含该家族基因,其中1号染色体上的基因数量最多,含有4个成员;4和5号染色体上各有2个家族成员;3、8和11号染色体上各有1个基因分布,分别为、和。值得关注的是,和基因位于染色体的末端,只有和基因定位于染色体中端区域,说明大多数水稻基因家族成员倾向于分布在染色体的末端区域。
2.3 水稻WOX家族蛋白理化性质分析结果
通过生物信息学分析发现,13个基因的编码区(CDS)长度差异较大,为603~1602 bp,平均长度为931 bp,其编码蛋白由200~533个氨基酸残基组成,平均含有312个氨基酸残基;相对分子量为22.35~54.80 kD,平均为33.24 kD;理论等电点(pI)为5.94~11.64,平均为8.16,其中远古进化支的OsWOX8蛋白pI最小(5.94),为酸性蛋白,中间进化支的OsWOX13蛋白pI最大(11.64),分为碱性蛋白;13个水稻WOX家族蛋白均位于细胞核中(表2)。
2.4 水稻WOX保守结构域与保守基序分析
由图3-A可知,水稻WOX家族蛋白共含有10个保守基序,其中OsWOX12蛋白所含的保守基序最多,共有7个保守基序,其次是OsWOX7和OsWOX10,包含6个保守基序;OsWOX8蛋白仅含有2个保守基序。一些保守基序仅存在于少数进化支中,如motif 6仅存在于现代进化支中,而Motif 3、Motif 4和Motif 7、Motif 8、Motif 9和Motif 10存在于中间进化支。值得关注的是,13个水稻WOX家族蛋白均具有Homodomain superfamily保守结构域,同时均含有Motif 1和Motif 2,而这2个保守基序正是蛋白保守功能域homeobox中的序列。由于OsWOX8蛋白的保守结构域中只含有Motif 1和Motif 2,表明这两个基序是水稻WOX家族蛋白中最保守的序列。通过进一步分析发现,Motif 1末端含有8个连续高度保守的氨基酸:天冬酰胺(N)-缬氨酸(V)-苯丙氨酸(F)-酪氨酸(Y)-色氨酸(W)-苯丙氨酸(F)-谷氨酰胺(Q)-天冬酰胺(N);motif 2的保守序列较短,前段含有2个保守氨基酸,即精氨酸(R)和色氨酸(W),中间含有一个保守的脯氨酸(P),中尾部含有一个保守连续的谷氨酸(E)-谷氨酰胺(Q)(图3-B)。

图2 水稻WOX家族基因结构(A)及染色体定位(B)结果Fig.2 Rice WOX family gene structure(A)and chromosome mapping(B)
2.5 水稻WOX家族基因启动子区域的顺式作用元件分析结果
由图4-A可知,13个基因均含有较多的光响应元件及防御和胁迫相应元件,除基因以外,其他基因均含有干旱响应元件,85.0%的基因含有脱落酸响应元件和厌氧诱导元件,76.9%基因含有茉莉酸甲酯诱导元件,其次分布比例较多的是生长素响应元件、分生组织响应元件及乙烯和赤霉素响应元件。相比之下,其余元件在水稻基因家族中分布的数量和比例较低,比如高温胁迫元件仅存在于基因启动子区域中,而低温胁迫元件只存在于基因中(图4-A)。由上述推测,水稻基因家族成员主要在光合作用、生长发育、逆境胁迫、激素信号转导等方面发挥重要调控作用。
对每个基因启动子的顺式作用元件进行深入分析,结果发现基因启动子所含的顺式作用元件最多,有37个,主要包括G-box、GATA-motif、MYB等光响应和防御胁迫响应的元件。基因启动子所含的顺式作用元件最少,共20个,除含有较多的光响应和胁迫响应元件外,也含有4个厌氧响应元件(ARE)和2个生长素响应元件(TGA-element)。此外,种子特异性反应元件(RY-element)存在于、、和基因的启动子中,推测这些基因参与水稻种子萌发的过程(图4-B)。
2.6 水稻WOX家族基因在种子萌发及逆境胁迫下的表达情况
为了研究13个基因在水稻种子萌发和逆境胁迫下的转录水平,本研究从Genevestigator数据库中获取转录表达数据,并绘制基因表达热图。经检索发现,该数据库中仅存在9个基因的转录表达数据,未检索到、、和基因的表达信息。由图5-A可知,种子在萌发过程中,随着种子吸胀时间的延长,基因在胚中的表达量呈先升高后降低的变化趋势,但在胚乳中表达量较低;和基因在吸胀4~8 h的胚中表达量较高,之后呈下降趋势,但二者在吸胀4~24 h的胚乳中表达量均较高;、和基因在吸胀4~24 h的胚和胚乳中表达量均较低。如图5-B所示,低温胁迫下,基因在2个水稻品种IR29和K354的叶片和幼苗中均有一定程度的表达;除和基因在冷胁迫8 h的叶片中表达量较高外,其他基因均呈现较低的表达量。综上所述,、和在水稻种子萌发过程的表达量较高,可能是参与萌发过程的关键基因;而基因可能在水稻冷胁迫过程中发挥重要作用。
为进一步验证探索家族基因在种子萌发、幼苗形成及逆境胁迫下的表达情况,以吸胀2 d水稻种子和5 d幼苗的水稻种子为材料,并加入逆境胁迫条件,采用qRT-PCR检测13个基因的表达水平,结果如图6所示。在CK组中,、和基因在2 d种子中的相对表达量较其在5 d幼苗中的相对表达量高,结合启动子序列分析的
结果,推测三者是调控萌发过程的关键基因;、和基因在5 d幼苗中的相对表达量高于其在2 d种子中的相对表达量;其余基因在种子和幼苗的相对表达量均处于较低的表达水平(图6-A)。和基因在干旱处理下表达上调,二者在干旱处理5 d幼苗中的相对表达量分别是CK组的15.0倍和8.0倍(图6-B和图6-C)。基因在淹水处理5 d幼苗和干旱处理2 d种子中表达下调,与CK组相比,其相对表达量分别下降了93.2%和87.2%(图6-D)。基因在高温处理下表达上调,其在5 d幼苗的相对表达量是CK组的2.7倍;基因在干旱处理2 d种子中相对表达量较CK组降低86.9%,但在干旱处理5 d幼苗中的相对表达量是CK组的3.9倍(图6-E)。基因的表达水平受干旱胁迫的影响较大,其在干旱处理2 d种子和5 d幼苗中的相对表达量分别是CK组的12.5%和3.6倍(图6-F)。、和基因在干旱处理2 d种子中的相对表达量较
CK组降低39%、97.8%和61%,但在干旱处理5 d幼苗中的相对表达量有不同程度的升高(图6-G、图6-H和图6-I)。此外,基因在高温处理2 d种子中表达下调,其相对表达量比CK组降低90.1%(图6-H)。基因在低温和干旱处理2 d种子中的相对表达量比CK组降低,但在高温处理下相对表达量升高(图6-J)。基因在高温处理2 d种子和5 d幼苗中的相对表达量是CK组的2.9倍和5.9倍,但其而在盐胁迫处理5 d幼苗中相对表达量是CK组的5.0倍(图6-K)。基因在高温处理2 d种子和5 d幼苗中的相对表达量分别是对照组的1.7倍和5.3倍(图6-L)。基因在低温和高温处理2 d种子中的相对表达量分别是CK组的5.3倍和7.7倍(图6-M)。基因在盐处理2 d种子和5 d幼苗的相对表达量是CK组的5.1倍和9.6倍(图6-N)。综上所述,13个基因在不同逆境胁迫下的转录表达特征存在明显差异,表明水稻基因家族功能具有多样性。

表2 水稻WOX家族蛋白成员信息Table 2 Information of rice WOX family protein member

图3 水稻WOX家族蛋白保守基序(A)及序列标识图(B)Fig.3 Rice WOX family protein conserved motif(A)and sequence identification diagram(B)

图4 水稻WOX家族基因启动子区域顺式作用元件分析结果Fig.4 Cis-acting element analysis of rice WOX family genes

图5 水稻在种子萌发期(A)和低温胁迫(B)下WOX家族基因的转录表达水平Fig.5 Transcriptional expression level of WOX family genes during rice seed germination(A)and cold stress(B)

图6 水稻种子逆境萌发过程中WOX家族基因的转录表达水平Fig.6 Transcriptional expression level of WOX family genes during rice seed germination under stress
3 讨论
WOX是植物特有的转录因子,在植物干细胞的动态平衡调控、植物生长发育、组织器官的发生和形成及非生物胁迫响应中具有重要调节作用(Stahl et al.,2009;Ji et al.,2010;Katsir et al.,2011)。尽管部分水稻基因家族成员的功能已有报道,但有关水稻整个WOX家族基因的生物信息学相关分析及在种子逆境萌发过程中的表达情况未见报道。本研究结构域和基序分析结果表明,水稻13个WOX蛋白均Homodomain superfamily结构,与番茄(李晓旭等,2016)、葡萄(王鹏飞等,2018)、玉米(郑玲等,2019)、猕猴桃(付春等,2021)等物种的WOX结构域类似,表明该结构域在不同物种间存在高度保守性;13个水稻WOX家族蛋白序列中均含有保守基序Motif 1和Motif 2,而这2个基序也正是保守蛋白结构域Homodomain的组成序列。与前人研究相比,水稻的保守结构域和保守基序与拟南芥和葡萄WOX家族蛋白(王鹏飞等,2018)类似,但与其他物种略有不同,如番茄(李晓旭等,2016)、苹果(王楚堃等,2019)和中华猕猴桃(付春等,2021)的WOX家族蛋白的Homeodomain结构域中均含有Motif 1;毛竹WOX家族蛋白均含有Motif 1和Motif 3,这两个保守基序共同组成Homodomain结构域(李晨曦等,2016)。参考模式植物拟南芥的分类标准(王俞程等,2015),本研究结合系统发育进化树可知,水稻基因家族成员分为远古进化支、中间进化支和现代进化支,与苹果(王楚堃等,2019)、中华猕猴桃(付春等,2020)、苦荞(侯思宇等,2021)等较多作物的家族基因系统分类结果一致,但毛竹基因家族基因系统分类结果(李晨曦等,2016)存在一定差异,即系统发育进化树中只含有现代进化支和古老进化支,缺乏中间进化支。进一步分析发现,在水稻古老进化支仅含基因,而在中间进化支和现代进化支均含有6个基因。该结果与藜麦的家族基因进化规律(即2个基因属于远古支,4个基因属于中间支和7个基因属于进化支)(朱满喜等,2020)类似。
种子萌发和幼苗建成质量在较大程度上决定着作物生育后期的生物量和产量。研究发现,水稻(Chen et al.,2020)和(Cho and Paek,2016)基因参与初生根的伸长和根系建成,和基因控制水稻侧根原基(LRP)大小(Katsir et al.,2022)。但关于水稻家族基因如何调控水稻种子萌发和幼苗生长的研究尚未见报道。本研究发现,基因在萌发种子和幼苗中的表达量均较高,、基因在萌发种子的表达量高于其在幼苗中的表达量,而、和基因在幼苗中的表达量高于种子中的表达量。结合水稻家族基因启动子顺式作用元件的分析结果,上述基因中的和基因存在种子特异性反应元件(RY-element),因此,推测这2个基因主要参与水稻种子萌发。低温胁迫下,水稻萌发种子中和基因的表达量下调,而基因表达量上调,而其他基因的表达并未受到低温胁迫的明显影响。许多植物在低温胁迫下家族基因表现相似的表达特征,如低温胁迫下黄瓜叶片中基因的表达量升高,而、和基因的表达量下降(Han et al.,2021);乌拉尔图小麦在低温胁迫下基因表达量显著增加,、和基因表达量显著降低(单强强等,2019)。但生长14 d的水稻幼苗在低温处理6 h后,、、和基因表达量达较高水平(Cheng et al.,2014),与本研究结果有所不同,表明家族基因表达具有明显的组织和时空表达特征。前人研究表明,在高温和干旱胁迫下部分基因的表达呈现相似的表达模式,如基因在高温和干旱胁迫下的表达量较高,过表达该基因可增强转基因水稻幼苗的高温和干旱抗性(Wu et al.,2009)。本研究发现,高温胁迫下、、、和基因表达量不同程度的升高,但干旱胁迫下幼苗中、、、、和基因的表达量明显升高,因此,和基因是在高温和干旱胁迫下上调表达的基因。Kawai等(2022)研究也发现,水稻幼苗根中基因的表达量随着干旱程度增加而升高。此外,本研究还发现,盐胁迫下大多数基因表达量未发生明显变化,仅5 d幼苗中、和基因的表达量有不同程度的升高,与Cheng等(2014)研究发现在高盐胁迫下和基因在生长10 d的水稻幼苗中表达量显著升高的结论相似。水淹胁迫是导致水稻生育过程中无氧呼吸的主要因素,许多应激蛋白基因在这一过程中表达(Osakabe et al.,2014)。本研究的13个基因中,仅基因的表达受到淹水胁迫抑制,基因在萌发种子中有一定程度的升高,而其他基因均未发生明显变化,表明家族基因中仅有较少基因参与水稻淹水胁迫萌发过程。
4 结论
相较于拟南芥和玉米,水稻基因家族成员在系统发育进化上较先进,仅保留一个古老分支,且其启动子区域均含有大量光响应和胁迫响应元件,推测水稻家族基因在功能上偏向于参与光合作用和逆境应答方面。基因在水稻种子萌发、幼苗及各种非生物胁迫下呈现丰富多样的表达模式,其中,和基因为调控种子萌发的关键基因。
