基于线粒体COII基因序列的长江下游翘嘴鲌群体遗传多样性分析鲌
2022-10-11张桂宁方弟安薛向平毛成诚彭云鑫
张桂宁,方弟安,2*,薛向平,毛成诚,彭云鑫
(1中国水产科学研究院淡水渔业研究中心/农业农村部淡水渔业和种质资源利用重点实验室,江苏无锡 214081;2上海海洋大学/水产科学国家级实验教学示范中心,上海 201306;3南京农业大学,南京 210095)
0 引言
【研究意义】翘嘴鲌()俗称大白鱼、翘嘴白鱼等,隶属于鲤科(Cyprinidae)鲌亚科(Cultrinae),是东亚特有鲤科鱼类中重要的一个类群(倪勇和伍汉霖,2006)。翘嘴鲌生活于水体上层,是一种广温性鱼类,其肉质鲜嫩,生长迅速,营养价值高,是目前人工养殖的重要水生经济鱼类之一(何舜平等,2004)。近年来,由于水域环境遭到破坏,加之过度捕捞,致使我国野生的翘嘴鲌资源面临巨大挑战,呈现出群体小型化和低龄化的趋势(贾永义,2019)。开展生物群体遗传多样性分析是采取有效保护措施的基础(代应贵和肖海,2011),即明确翘嘴鲌遗传多样性,不仅有利于评估其种质资源状况,还能为保护翘嘴鲌种质资源提供参考依据。【前人研究进展】线粒体DNA(mtDNA)具有结构简单、进化速率适宜及母系遗传的特点,适用于物种进化和分子多态性研究(陈四海等,2011;邹辉等,2020)。鱼类mtDNA主要包括37个编码基因(13个疏水蛋白基因、2个rRNA基因和22个tRNA编码基因)、1个负责复制和转录起始的控制区(D-loop)和1个轻链复制起始区(郭新红等,2004),其中细胞色素氧化酶(COI、COII和COIII)是由疏水蛋白基因编码。与其他线粒体蛋白编码基因相比,基因的进化速率较快(彭居俐等,2009),常被用于研究亲缘关系较近的种、种下分类单元及地理群体间的关系(王伟,2007;黄小彧,2012;杨子拓,2016)。近年来,国内外针对翘嘴鲌的研究主要集中在营养与饲料(王桂芹等,2008)、解剖学与生物学特性(Cao et al.,2011)、遗传多样性(黄小彧,2012;王丹等,2015)及人工繁殖和胚胎发育(周彦锋等,2018;贾永义,2019)等方面,而基于mtDNA分析翘嘴鲌遗传多样性的研究主要集中在基因、D-Loop控制区和基因序列。王伟等(2008)研究证实了基因序列在翘嘴鲌群体遗传学研究中的有效性,并分析黑龙江兴凯湖至江苏太湖6个水域的翘嘴鲌群体遗传多样性,认为通过基因可将我国翘嘴鲌进行区域划分,但尚不能作为群体鉴别的分子标记;黄小彧(2012)基于线粒体D-Loop控制区分析长江水系14个翘嘴鲌群体的遗传多样性,结果发现翘嘴鲌群体具有高单倍型多样性和低核苷酸多样性共存现象;王丹等(2015)利用线粒体基因初步分析鲌属鱼类的遗传多样性,结果表明鲌属鱼类具有高的遗传多样性。【本研究切入点】受环境污染、栖息地被破坏及水利修建等因素的影响,翘嘴鲌野生资源濒临枯竭,且种群小型化、低龄化现象严重,但目前针对翘嘴鲌遗传背景的系统研究较少,难以为其种质资源的保护工作提供可靠依据,尤其鲜见基于基因序列开展地理位置较近翘嘴鲌群体遗传多样性的研究报道。【拟解决的关键问题】在长江下游水域(淀山湖、高邮湖、太湖、长荡湖及长江江苏段)设点捕获收集翘嘴鲌野生样本,基于基因序列分析翘嘴鲌遗传多样性,明确其遗传多样性的丰富程度和进化历史,为翘嘴鲌育种及遗传改良打下基础。
1 材料与方法
1.1 试验材料
2019年5—9月,使用丝网分别在淀山湖(DS)、高邮湖(GY)、太湖(TH)、长荡湖(CD)和长江(CJ)江苏段设5个采样水域(图1)捕获收集翘嘴鲌样本,剪下尾鳍浸泡于95%酒精中,带回实验室备用。
1.2 形态学数据测量
使用精度为0.01 mm的游标卡尺测量所有翘嘴鲌的全长和体长,以精度为0.01 g的电子秤称量鱼体质量。当鱼体长超过500.00 mm时,则使用卷尺和台秤进行测量。
1.3 DNA提取
剪取备用鳍条组织样品(<30.0 mg)置于离心管中,采用海洋动物组织基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取DNA,以1.0%琼脂糖凝胶电泳检测DNA质量。DNA样品-20℃冰箱保存备用。
1.4 COII基因PCR扩增及测序
依据NCBI数据库中的翘嘴鲌基因序列(AY704458)设计PCR扩增引物:-3(5'-TGAT CGCTCTGCCCCCCCT-3')、-5(5'-AGGATCAG CTCGAAGTGC-3')(王伟等,2008)。PCR反应体系25.0μL:dNTP Mixture 12.0µL,上、下游引 物(5μmol/L)各0.5μL,DNA模板2.0µL,ddHO 10.0µL。扩增程序:94℃预变性5 min;94℃10 s,59℃10 s,72℃30 s,进行35个循环;72℃延伸5 min;4℃结束。2.0%琼脂糖凝胶电泳检测PCR扩增产物,将条带清晰的有效扩增产物送至亦欣生物科技(上海)有限公司进行双向测序,测序引物与扩增引物一致。
1.5 数据分析
测量所有翘嘴鲌的体长和体质量,通过SPSS 19.0进行均值比较分析。采用ClustalX 1.83(Petren and Case,1997)和Seaview(Gouy et al.,2012)进行基因核苷酸组成及序列分析;使用DNASPv5(Librado and Rozas,2009)计算群体单倍型,并进行Tajima’s D和Fu’s Fs中性检验,以推测群体是否发生群体扩张;运用Arlequin 3.5(Excoffier and Lischer,2010)进行遗传多样性分析、群体分子方差分析(Analysis of molecular variance,AMOVA)及计算遗传距离和基因流();在MEGA 6.0中以Kimura双参数法(Kimura-2-parameter)为替代模型(Tamura et al.,2013),采用邻接法(Neighbour-joining,NJ)构建翘嘴鲌群体单倍型系统发育进化树,分析各群体间的亲缘关系。
2 结果与分析
2.1 形态学数据统计分析结果
翘嘴鲌体长与体质量数据均为每个采样点的平均数值,以太湖翘嘴鲌群体最大,其次是长江群体,而后依次是高邮湖群体、长荡湖群体和淀山湖群体。共测序得到197个基因序列(表1)。

图1 翘嘴鲌采样水域分布情况Fig.1 Distribution of C.alburnus sampling waters

表1 5个翘嘴鲌野生群体的生物信息Table 1 Biological information of 5 wild C.alburnus populations

图2 部分翘嘴鲌样本的PCR扩增电泳结果Fig.2 PCR amplification electrophoresis of some C.alburnus samples
2.2 翘嘴鲌COII基因序列变异及单倍型分析结果
以提取的DNA为模板进行PCR扩增,运用2.0%琼脂糖凝胶电泳检测PCR扩增产物,部分电泳结果如图2所示。5个翘嘴鲌野生群体197个个体的基因序列长度经比对后获得的有效长度为425 bp,有31个变异位点(表2),变异率为7.29%。翘嘴鲌基因测序结果(图3)表明,其碱基含量排序为T(29.61%)>C(28.03%)>A(24.19%)>G(18.17%)。AT含量为53.8%,CG含量为46.2%。
31个变异位点在197个个体中共定义出13种单倍型(表3)。其中,9个单倍型为各群体特有的单倍型,占69.23%,即hap6和hap7为高邮湖特有,hap4为淀山湖特有,hap8和hap9为长荡湖所特有,长江群体特有4个单倍型(hap10、hap11、hap12和hap13)。此外,有4个单倍型(hap1、hap2、hap3和hap5)在翘嘴鲌群体中共享,占30.77%,有2个单倍型(hap1和hap2)在5个群体中均有分布。其中,又以hap1最常见,存在于138个个体中,是优势单倍型;其次是hap2。太湖群体与淀山湖群体共享hap3。基于Kimura-2-parameter构建的翘嘴鲌群体单倍型系统发育进化树(图4)显示,5个翘嘴鲌野生群体所特有的单倍型并未各自聚类形成独立分支,而是相互交错形成复杂的簇群,说明不同翘嘴鲌群体间的分化并不明显。

表2 翘嘴鲌COII基因的变异位点Table 2 Variation sites of mtDNA COII gene of C.alburnus

图3 部分翘嘴鲌COII基因的测序图谱Fig.3 Sequencing map of COII gene in some C.alburnus

表3 COII基因在5个翘嘴鲌野生群体中的单倍型分布情况Table 3 Haplotype distribution of the mtDNA COII gene in the 5 populations of C.alburnus
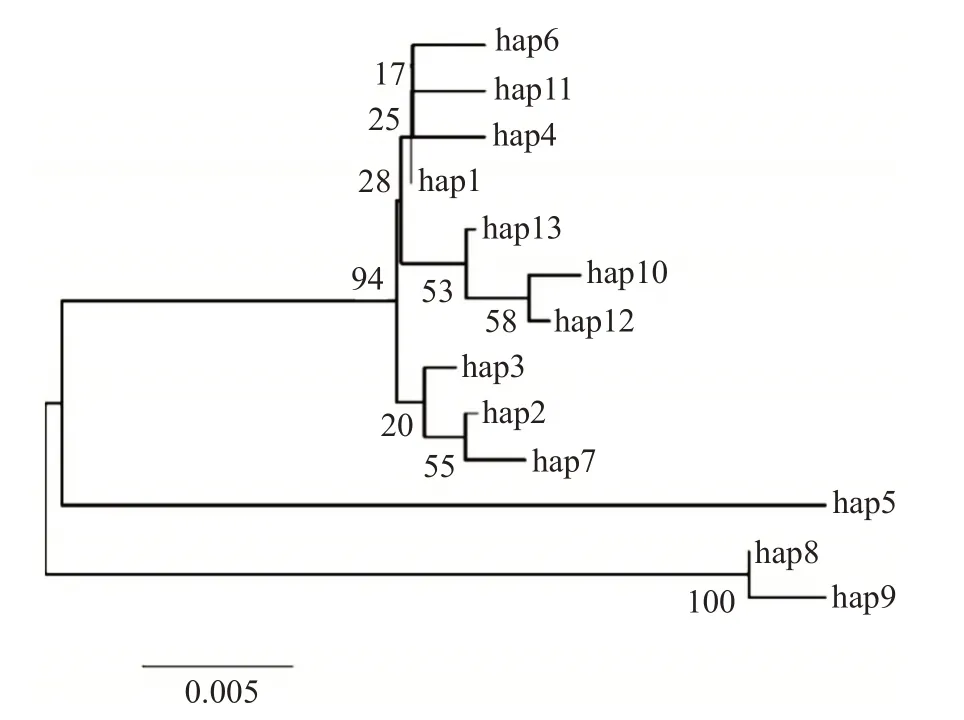
图4 基于Kimura-2-parameter构建的翘嘴鲌群体单倍型系统发育进化树Fig.4 Phylogenetic tree of haplotype of C.alburnus populations based on Kimura-2-parameter
2.3 遗传多样性分析结果
从5个翘嘴鲌野生群体197个个体中共检测出13个单倍型,单倍型多样性指数()为0.273~0.603,以长江群体和长荡湖群体的最高,太湖群体的最低;核苷酸多样性指数()为0.001~0.017,以长荡湖群体的最高,淀山湖群体的最低(表4)。5个翘嘴鲌野生群体的为0.491,为0.007,说明其遗传多样性丰富。翘嘴鲌群体内的遗传距离为0.001~0.018(表5),其中淀山湖群体内的遗传距离最小,长荡湖群体内的遗传距离最大;不同群体间遗传距离为0.002~0.015,即群体间无显著差异。5个翘嘴鲌野生群体间的为2.443~54.325(表5),以太湖群体与淀山湖群体间的最大(54.325),长荡湖群体与淀山湖群体间的最小(2.443)。分子方差分析(AMOVA)结果(表6)显示,不同群体间的遗传变异为10.47%,而群体内的遗传变异为89.53%。
2.4 群体历史动态分析结果
中性检验结果显示:除了长荡湖群体的Tajima’s D为正值外,其余群体的Tajima’s D均为负值(表4),且太湖群体表现为极显著偏离中性理论下的Wright-Fisher模型(<0.01),长江群体表现为显著偏离中性理论下的Wright-Fisher模型(<0.05)。Fu’s Fs检验结果表明,淀山湖和长江的Fu’s Fs为负值(表4),且长江群体具有统计学意义。5个翘嘴鲌野生群体的Tajima’s D和Fu’s Fs均为负值(-1.479和-0.547),但不具统计学意义。
3 讨论
遗传分化指数()是群体间遗传分化的一个重要指标,常用于衡量2个群体间的遗传分化程度:当<0.05时表示群体间几乎无遗传分化,当0.05<<0.15时表示群体间存在低度分化,当0.15<<0.25时表示群体间存在中度分化,当>0.25时表示群体间存在高度分化(黄小彧,2012)。本研究中,5个翘嘴鲌野生群体间为0.105,表明不同翘嘴鲌野生群体间存在低度分化。Hebert等(2003)对动物界11个门13320个物种的研究结果显示,种内遗传距离大多数在1%以下,很少超过2%。本研究结果表明,淀山湖、高邮湖、太湖、长荡湖和长江群体的群体内遗传距离分别为0.001、0.009、0.003、0.018和0.004,均符合Hebert等(2003)提出的观点。将5个翘嘴鲌野生群体视为一个整体进行分析发现,翘嘴鲌群体的为0.491,为0.007,表现出低和高,说明具有较丰富的遗传多样性,与黄小彧(2012)基于线粒体D-Loop控制区研究长江水系14个翘嘴鲌群体遗传多样性得出的结论(为0.866,为0.0033)相反,究其原因可能是黄小彧(2012)研究利用的D-Loop控制区标记与本研究采用的基因不同,也有可能是禁捕政策的实施促使近年来长江水域翘嘴鲌的资源量有所增加所致。颜岳辉等(2019)曾研究证实波氏吻虾虎()表现出低和高,与本研究结果相似,可能是历史群体曾发生瓶颈效应,而后伴随出现群体快速增长及积累新突变。
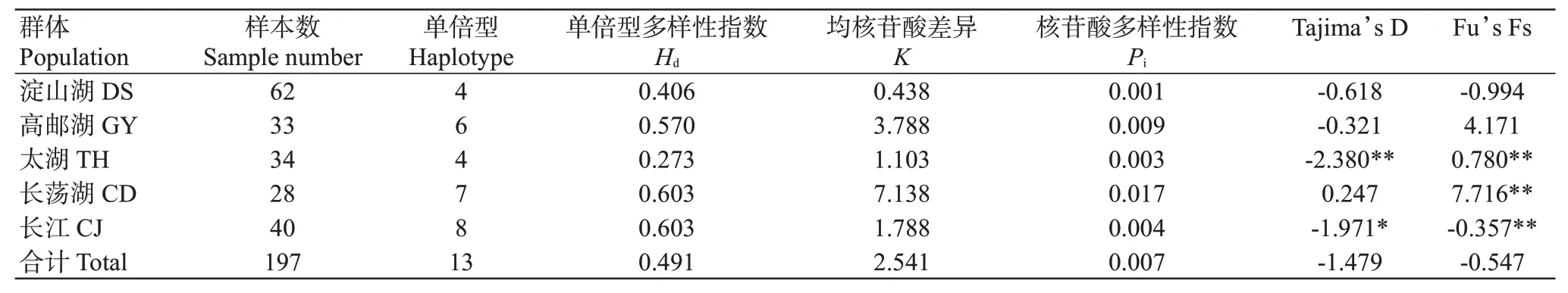
表4 5个翘嘴鲌野生群体的遗传多样性参数Table 4 Genetic diversity parameters of 5 C.alburnus populations

表5 不同翘嘴鲌群体的基因流和遗传距离Table 5 Gene flow and genetic distance of different C.alburnus populations
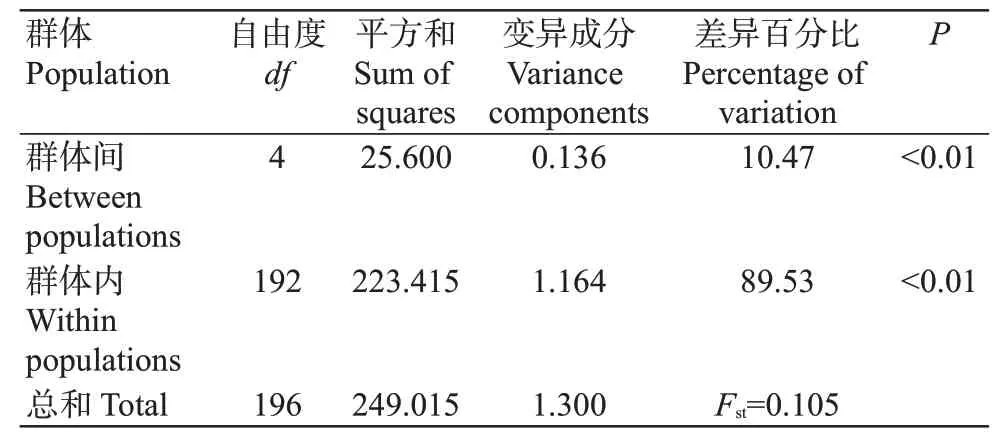
表6 不同翘嘴鲌野生群体间及群体内的分子方差分析结果Table 6 Analysis of molecular variance between and within the C.alburnus populations
人类活动在很大程度上会影响群体间的基因交流,如人工引种和增殖放流等。基因交流是指生物个体从其发生地分散出去而导致不同群体间基因杂交的过程,其基本作用是削弱生物群体间的遗传差异(Grant and Bowen,1998)。如大于1.000,表明在群体中会有较高水平的基因交流,尤其是>4.000表明群体间存在频繁的基因交流(Mcmillen-Jackson and Bert,2004)。本研究中,5个翘嘴鲌野生群体的在2.443~54.325,且长荡湖群体与其他水域群体间的均较小(2.443~6.179)。从本研究采样区域的地理位置来看,长荡湖与其他水系不通,由于地理隔离造成该水域翘嘴鲌群体与其他水域翘嘴鲌群体间存在基因交流障碍;而太湖的地理条件优越、物产丰富,先后建立了银鱼()、秀丽白虾()、翘嘴鲌和青虾()等国家级水产种质资源保护区(谷孝鸿等,2009),为不同地理群体的基因交流创造了条件。太湖渔业资源调查发现,随着人类捕捞活动的加剧及栖息环境被破坏,翘嘴鲌多样性逐渐降低,鱼种趋于小型化和单一化(贾永义,2019),也可能是其他因素导致太湖翘嘴鲌群体遗传多样性降低,具体原因有待进一步探究。翘嘴鲌性情活泼好动,在无地理隔离条件下群体间的基因交流可能是导致不同群体形态相近的主要原因之一(王伟,2007)。淀山湖群体与太湖群体间的为54.325,表明这2个水域的翘嘴鲌存在一定的基因交流,是由于淀山湖与太湖距离相对较近,且历史上有河流连通;高邮湖群体与长荡湖群体间的遗传距离最大(0.015),则因地理隔离形成了稳定的地理群体;由于地理隔离的原因,长荡湖与其他几个水域间无河流连通,因此长荡湖翘嘴鲌群体与其他湖泊的翘嘴鲌群体间几乎无基因交流。
本研究对不同翘嘴鲌野生群体及整体分别进行Tajima’s D检验和Fu’Fs检验,以推测翘嘴鲌群体是否经历过群体扩张事件。当Tajima’s D和Fu’Fs均为负值且具有显著意义时,则认为该群体曾发生过群体扩张现象(Fu,1997;刘伟等,2016)。在5个翘嘴鲌野生群体中,仅长江群体的Tajima’s D和Fu’Fs均为负值且具有显著意义,故推测该群体曾发生过群体扩张现象。
4 结论
长江下游翘嘴鲌群体表现出低单倍型多样性和高核苷酸多样性,遗传多样性较丰富,群体间存在遗传分化但分化程度差异不显著。因此,后续研究应增加野生翘嘴鲌群体的样品数量和调查水域,全面而系统地评估长江下游各水域翘嘴鲌的种质资源状况,为建立自然保护区及人工增殖放流提供科学依据。
