甘薯基腐病病原鉴定及生长特性测定
2022-10-11唐伟张成玲王芳杨冬静马居奎陈晶伟谢逸萍孙厚俊
唐伟,张成玲,王芳,杨冬静,马居奎,陈晶伟,谢逸萍,孙厚俊*
(1.江苏徐淮地区徐州农业科学研究所/农业农村部甘薯生物学与遗传育种重点实验室,江苏徐州 221131;2宁波市农业科学研究院,浙江宁波 315040)
0 引言
【研究意义】甘薯[(L.)Lam]俗称番薯、红薯、山芋等,隶属于旋花科甘薯属,因其具有高产稳产、适应性强、营养丰富的特点广泛种植于世界上100多个国家和地区(马代夫等,2021;王欣等,2021;赵凌霄等,2021),是一种重要的粮食作物,也可用作食品加工作物、保健、蔬菜和观赏作物。我国是世界上最大的甘薯种植国,据联合国粮农组织2019年统计数据,我国甘薯种植面积占世界总种植面积的30.56%,产量约为5.2×10kg,占世界总产量的一半以上(Food and Agriculture Organization,2019)。甘薯基腐病是近年来在我国东南沿海薯区新发生的一种病害,可导致甘薯茎基部变褐、发黑,地上部叶片发黄枯萎,严重时茎基部干枯,地上部逐渐枯死,致使甘薯绝产。目前甘薯基腐病在我国南方沿海薯区发生并有向内陆扩展蔓延的趋势,但田间生产上暂未发现有良好防效的药剂和抗病品种,其对我国沿海及内陆薯区甘薯生产带来巨大的威胁和隐患。因此,明确甘薯基腐病病原菌,探究病原菌生物学特性,对甘薯基腐病的综合防治具有重要的指导意义。【前人研究进展】1913年甘薯基腐病在美国弗吉尼亚州首次报道(高岩,2020),之后在东非、巴西、日本等地相继报道(Almeida et al.,2020;Fujiwara et al.,2021)。2008年我国在台湾省首次发现(黃巧雯等,2012),2014年在我国大陆发现,并开始在东南沿海广泛报道(Gai et al.,2016;余继华,2018;余继华等,2019)。不同地区甘薯基腐病病原菌有所不同,Gai等(2016)、黄立飞等(2019)通过形态学和分子生物学方法鉴定出引起浙江三门市、台州市的甘薯茎基腐烂病的病原有拟轮枝镰刀菌[(Sacc.)Nirenberg]、茄病镰刀菌[(Sacc.)Mart.]、毁坏拟茎点霉菌[(Harter)Boerema Loer.&Hamers]、甘薯间座壳菌(Harter & E.C.Field)等;Almeida等(2020)通过形态学和分子生物学方法明确了是引起巴西甘薯基腐病病原。间座壳菌属于子囊壳菌纲(Ascomycota),间座壳目(Diaporthales),间座壳科(Diaporthaceae),其无性态为拟茎点霉属()真菌。在甘薯上,甘薯间座壳菌可造成甘薯干腐病和蔓枯病(刘奕君等,2017;谢昀烨等,2021),致使薯块两端薯皮褐化皱缩,后期组织坏死,病部出现黑色瘤状突起,影响甘薯的储存和翌年薯苗繁育。目前对甘薯间座壳菌的防治措施较少,Lee等(2019)通过测定气态二氧化氯(ClO)处理后菌丝生长和接种病变直径,发现气态二氧化氯可在体内和体外抑制甘薯间座壳菌的生长;Fujiwara等(2021)开发的荧光定量检测技术能对甘薯间座壳菌和毁坏间座壳菌()实现定量检测,为甘薯基腐病快速诊断和防治策略制定提供技术支撑;近期,Yang等(2022)通过基因组测序获得甘薯间座壳菌的基因组草图,为病原菌比较基因组学研究提供了新的基因信息资源以及防治甘薯间座壳菌提供了研究基础。【本研究切入点】前期对甘薯基腐病的研究仅集中在病原物的分离鉴定及病原菌的快速检测等方面,关于甘薯基腐病病原菌生长特性的研究尚未见报道。【拟解决的关键问题】以采自浙江省宁波市宁海县甘薯基腐病病样为材料,采用组织分离法进行病原菌分离,并用离体茎秆接种法进行柯赫氏法则验证;采用形态学结合分子生物学方法对病原菌的种类进行鉴定,并通过菌丝培养法研究病原菌在不同环境下的生物学特征,为甘薯基腐病的预防和田间防治提供理论指导。
1 材料与方法
1.1 试验材料
从浙江省宁波市宁海县甘薯病田中采集具有甘薯基腐病典型症状的甘薯植株。供试甘薯品种为烟薯25。
主要仪器与试剂:显微镜(Leica DM 4000 B配Leica DFC550,Leica Microsystems,Mannheim,Germany);PCR仪(USA,Bio-Rad Laboratories);凝胶成像仪(上海天能科技有限公司)。真菌基因组DNA快速抽提试剂盒(B518229)购自生工生物工程(上海)股份有限公司;PCR mix购自北京擎科生物科技有限公司;葡萄糖等均为国产分析纯。
培养基:马铃薯葡萄糖培养基(PDA)、马铃薯蔗糖培养基(PSA)、察氏培养基(CDM)、甘薯葡萄糖培养基(SPDA)、燕麦片培养基(OMA)、胡萝卜培养基(CA)和牛肉膏蛋白胨培养基(NA)。
1.2 试验方法
1.2.1 病原菌分离采用组织分离法对具有基腐病典型特征的甘薯病样进行病原菌分离纯化(方中达,1998)。
1.2.2 病原菌致病力测定用无菌水配置孢子悬浮液,用无菌小刀在烟薯25茎部纵割约2 cm长伤口,将孢子悬浮液注入伤口中,25℃保湿培养,以接种无菌水为对照,记录发病情况。
1.2.3 病原菌形态和分子鉴定将从接种发病甘薯上分离纯化的病原菌在PDA培养基上25℃培养5 d,观察菌落特征。以水为载体,挑取菌丝,显微镜观察菌丝和孢子形态并拍照。
利用真菌基因组DNA快速抽提试剂盒提取病原菌基因组DNA。利用ITS引物(ITS1:5'-TCCGTA GGTGAACCTGCGG-3'/ITS4:5'-TCCTCCGCTTAT TGATATGC-3'),Cal引物(Cal-228F:5'-GAGTTCAA GGAGGCCTTCTCCC-3'/Cal-737R:5'-CATCTTTCT GGCCATCATGG-3')、His3引物(CYL-H3-1a:5'-AG GTCCACTGGTGGAAG-3'/CYL-H3-1b:5'-GCGGG CGAGCTGGATGTCCTT-3')进行PCR扩增,扩增产物回收后连接至pMD18-T,阳性克隆送生工生物工程(上海)股份有限公司测序。序列上传至GenBank,利用Clstualx 2.0进行多重序列比对,利用MEGA 6.06采用邻接法(Neighbor-joining,NJ)构建系统发育进化树。
1.2.4 病原菌生物学特性测定
1.2.4 .1不同培养基对病原菌菌丝生长的影响用打孔器将培养7 d的病原菌沿菌丝外周打孔,形成直径为5 mm的病原菌菌饼,将菌饼置于不同培养基中央。每处理重复3皿,培养5 d后采用十字交叉法测量菌落直径。
1.2.4 .2不同碳、氮源对病原菌菌丝生长的影响以察氏培养基为基础培养基,分别用等量的葡萄糖、木糖、麦芽糖、乳糖、半乳糖、可溶性淀粉、糊精、纤维素和甘露糖代替蔗糖,制成不同的碳源培养基;以察氏培养基为基础培养基,分别用等量的草酸铵、甘氨酸、硫酸铵、硝酸铵、氯化铵、磷酸氢二铵、亚硝酸钠和尿素代替硝酸钠,制成不同的氮源培养基。每处理重复3皿,培养7 d后采用十字交叉法测量菌落直径(下同)。
1.2.4 .3不同温度、pH对病原菌菌丝生长的影响将病原菌菌饼置于PDA培养基中央,分别置于15、20、25、30和35℃5个温度处理;利用1 mol/LHCl和1 mol/LNaOH调节PDA培养基pH,制成pH依次为4、5、6、7、8、9、10、11和12的PDA培养基,将病原菌菌饼置于培养基中央进行培养。
1.2.4 .4病原菌致死温度测定刮取在PDA培养上培养3~4 d的病原菌菌丝,用无菌水配制菌丝悬浮液;吸取在PDA培养基上培养10 d后分泌的病原菌孢子液,用无菌水稀释形成孢子悬浮液;将孢子悬浮液盛于1.5 mL离心管中置于恒温水浴锅,分别在40、45、50、55、60、65和70℃下处理5、10和15 min;将处理后的悬浮液吸取150μL涂布于PDA培养基上,25℃培养5 d,观察孢子及菌丝生长情况。根据试验结果选取菌落生长变化之间的温度,设置1℃的温差再进行试验。
1.3 统计分析
利用IBM SPSS Statistics 25对试验数据进行分析,采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 病原菌分离及致病性测定结果
从浙江宁海甘薯田间采集茎基部变黑腐烂的样品(图1-A),分离纯化获得1株菌株,标记为RFNH。将分离获得的菌株RF-NH接种到烟薯25号上,25℃保湿10 d后,接种部位四周出现黑色病斑,并逐渐扩展(图1-D);对照接种部位无黑色病斑(图1-E)。通过柯赫氏法则,从接种茎秆处重新分离获得与接种菌株形态一致的病原菌,表明接种菌为甘薯基腐病致病菌。
2.2 病原菌形态观察结果
菌落大致呈圆形但边缘不规则,在PDA培养基上菌落菌丝初期为白色,后期菌落从中心向外周颜色逐渐加重呈黄褐色(图1-F);在培养基上单生或聚生黑色珊瑚状或管状分生孢子器,分泌淡黄色或白色液体,内含大量分生孢子(图1-B、图1-C、图1-G和图1-H)。在显微镜下观察,可见梭状无色透明分生孢子,大小为3.166~4.563μm×6.954~11.327μm,大部分内含2个油球,偶见3个油球(图1-H)。与前人报道间座壳菌的形态相似(黄立飞等,2019),故从形态上初步鉴定病原菌为间座壳属真菌。
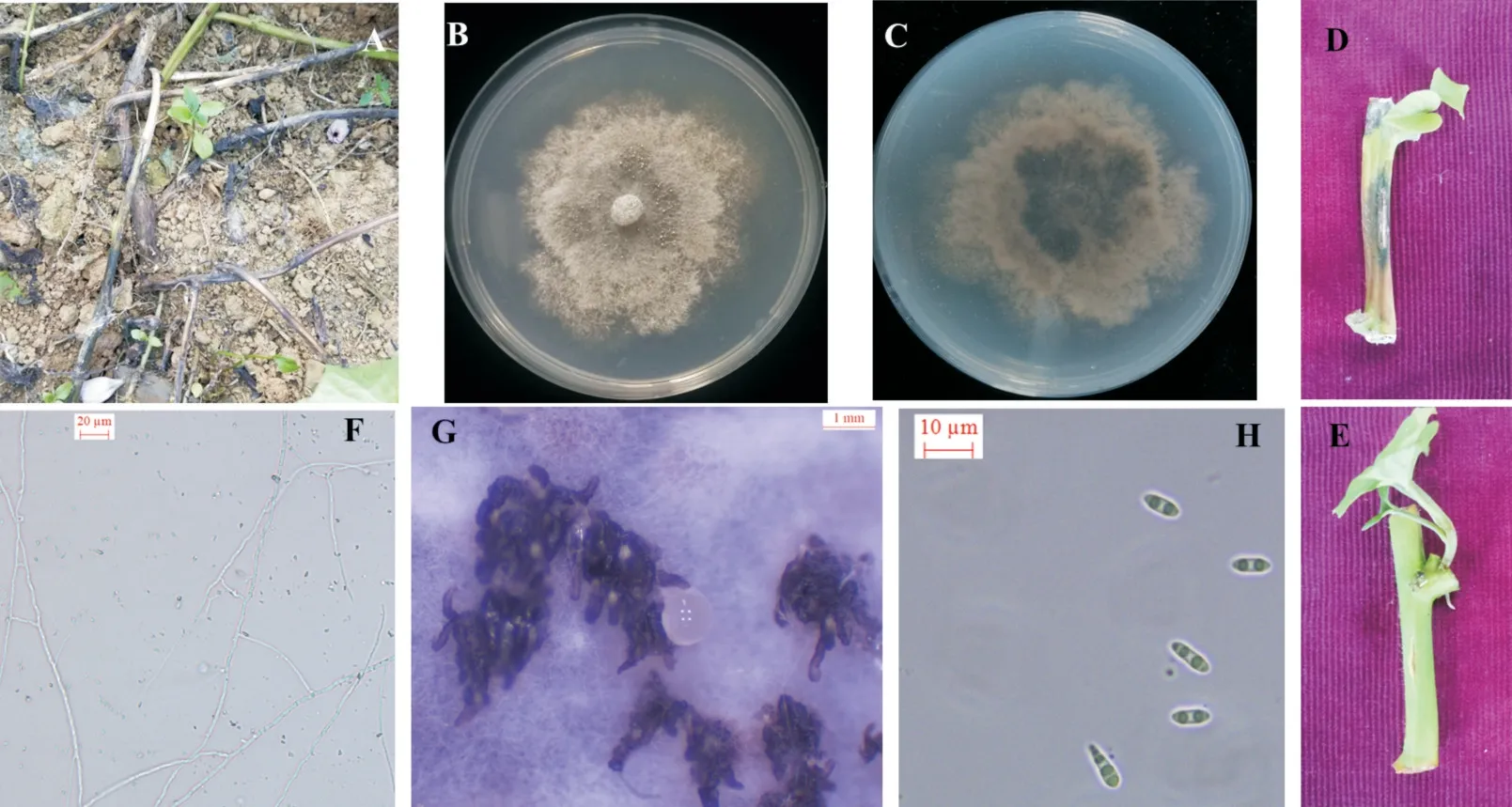
图1 甘薯基腐病症状与病原菌形态Fig.1 Symptom and pathogen morphology of sweet potato foot rot disease
2.3 病原菌分子鉴定
利用ITS、和基因的通用引物对病原菌DNA进行扩增,分别获得各基因的片段(图2),其中,ITS基因片段长579 bp,基因片段长480 bp,基因片段长537 bp,并上传至GenBank,序列登录号分别为OK432549、OK432550和OK432551。经序列比对,所得基因均与甘薯间座壳菌()的一致率为100%。从GenBank中下载间座壳属真菌相关基因,利用MEGA 6.06的NJ法以CBS 121124相关基因作为外群,构建基于ITS、和基因的系统发育进化树,结果(图3)发现菌株RF-NH序列与甘薯间座壳菌聚类在一起。综合形态学和分子生物学鉴定结果,将菌株RF-NH鉴定为甘薯间座壳菌。
2.4 病原菌生物学特性测定结果
2.4.1 培养基对病原菌菌丝生长的影响由图4可看出,不同培养基对菌株RF-NH菌丝生长有显著影响,其中菌株RF-NH在SPDA培养基上生长最快,培养5 d后菌落直径为7.48 cm,显著高于除CA培养基外的其他5种培养基(<0.05,下同);在CDM培养基上生长最慢,培养5 d后菌落直径为2.45 cm,且菌丝稀疏。培养后期,在PDA、SPDA、PSA、OMA和CA培养基中病原菌可产生分生孢子,而在CDM和NA培养基中病原菌未产生分生孢子。
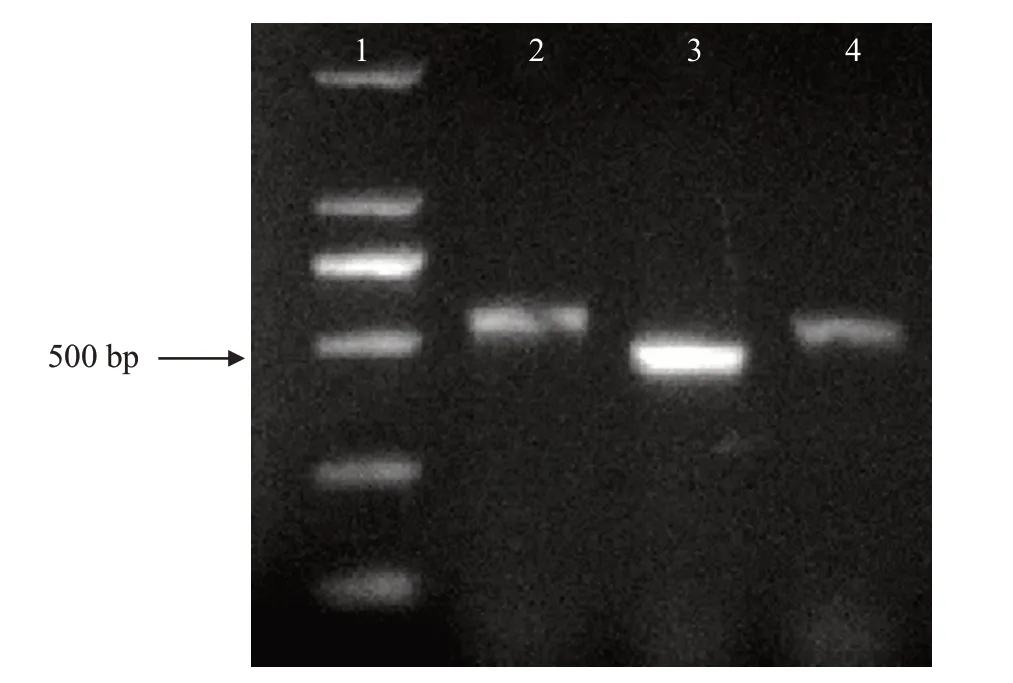
图2 甘薯间座壳菌不同基因的扩增电泳图Fig.2 Amplification electrophoretogram of different genes of D.batatas
2.4.2 碳、氮源对病原菌菌丝生长的影响由图5可知,菌株RF-NH在所测碳源和氮源下均可生长。在碳源对比中,以糊精为碳源的培养基上的菌落直径最大,为6.78 cm,其次是可溶性淀粉,为5.42 cm,两者间菌落直径差异显著,且均与其他碳源培养基上的菌落直径差异显著;以木糖为碳源的培养基上的菌落直径最小,仅为2.95 cm;尽管以纤维素为碳源的培养基上的菌落直径为4.40 cm,与常规的蔗糖处理间无显著差异(>0.05,下同),但菌丝最为稀疏。在氮源对比中,所有测试氮源培养基上的菌落直径均小于对照硝酸钠,说明培养基中所添加的甘氨酸、磷酸氢二铵和氯化铵等相对于硝酸钠不利于菌落的生长,尤其是以氯化铵和磷酸氢二铵为氮源的培养基上的菌落直径最小,分别为2.25和2.23 cm。从氮源种类上看,菌株RF-NH对硝态氮利用高于铵态氮。

图3 基于ITS、Cal和His3基因序列构建的菌株RF-NH系统发育进化树Fig.3 Phylogenetic tree of strain RF-NH based on ITS,Cal and His3 gene sequence
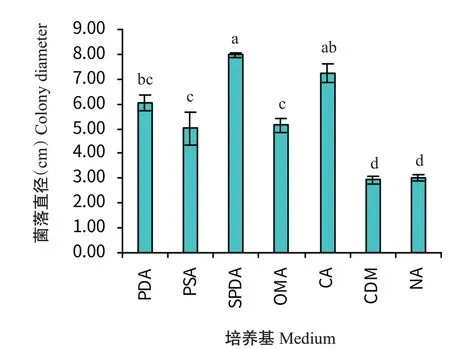
图4 不同培养基对菌株RF-NH菌落生长的影响Fig.4 Effects of different media on colony growth of strain RF-NH
2.4.3 温度和pH对病原菌菌丝生长的影响 由图6可知,菌株RF-NH的菌落直径先随温度的升高而增大,25℃时达最高值,为8.17 cm,菌落直径与其他温度处理差异显著;然后随温度的升高,菌落直径逐渐减小。由图7可知,随着pH的增加,菌株RF-NH的菌落直径逐渐减小,pH 4时菌落直径最大,为8.15 cm,pH 12时菌落直径最小,为1.98 cm,在pH 8~10时菌落直径无显著变化。
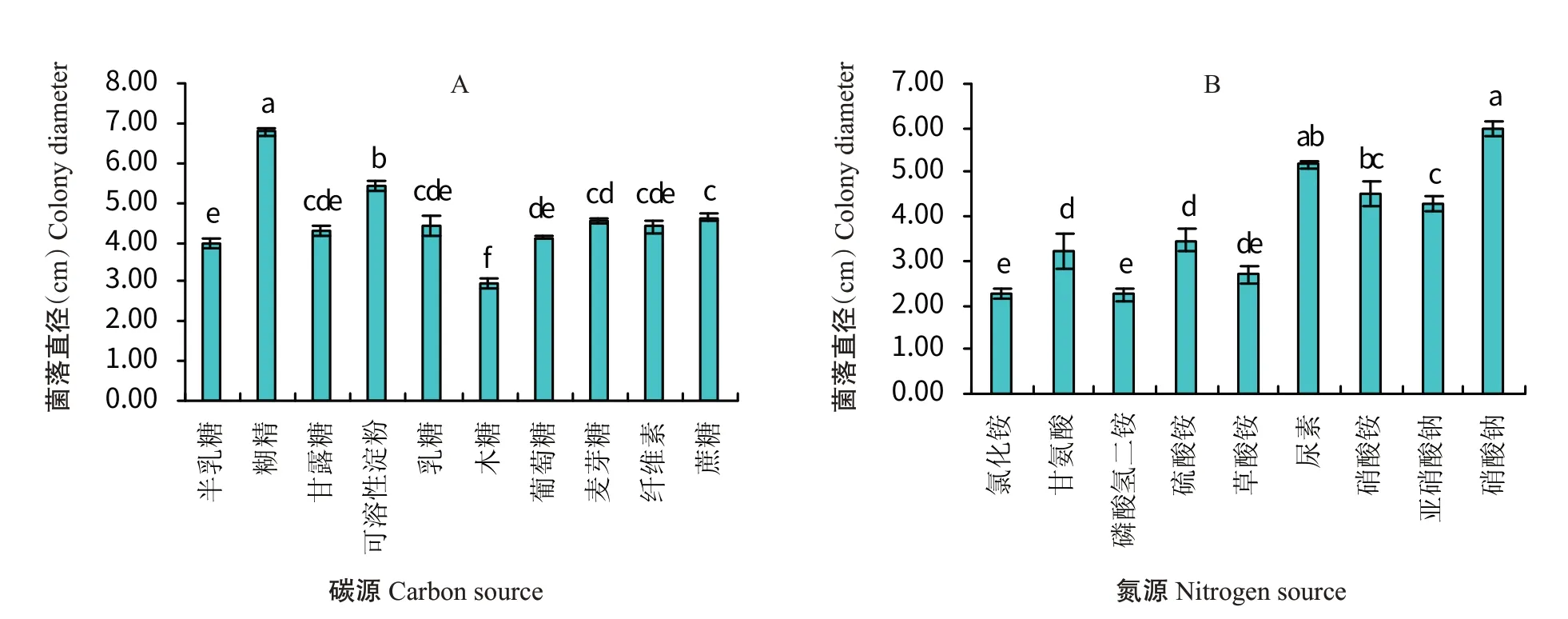
图5 不同碳源(A)和氮源(B)对菌株RF-NH菌落生长的影响Fig.5 Effects of different carbon(A)and nitrogen(B)sources on colony growth of strain RF-NH
2.4.4 病原菌致死温度测定菌株RF-NH的分生孢子和菌丝悬浮液在40、45、50、55、60、65和70℃下分别处理5、10和15 min后发现,40~45℃各时间处理的分生孢子和菌丝均能生长,55~70℃各时间处理的分生孢子和菌丝均不能生长。在50℃时处理5 min,分生孢子和菌丝均可生长,但处理10 min后分生孢子和菌丝均不能在PDA培养基上形成新的菌落。将孢子悬浮液和菌丝悬浮液在46、47、48和49℃下分别处理5、10和15 min,结果发现在46~49℃各处理中,孢子悬浮液均在PDA培养基上形成新的菌落;而菌丝于49℃处理15 min在PDA培养基上不能产生新的菌落,其余处理均能生长,说明菌株RF-NH分生孢子的致死温度为50℃10 min,菌丝致死温度为49℃15 min或50℃10 min。
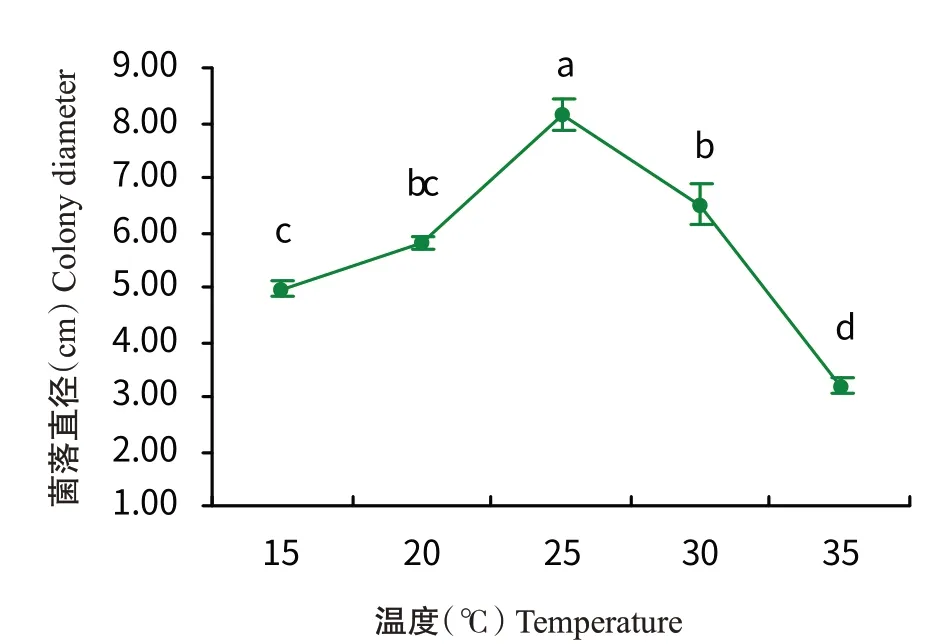
图6 不同温度对菌株RF-NH菌落生长的影响Fig.6 Effects of different temperatures on colony growth of strain RF-NH
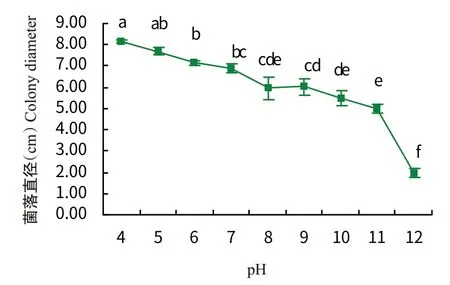
图7 不同pH对菌株RF-NH菌落生长的影响Fig.7 Effects of different pH on colony growth of strain RF-NH
3 讨论
间座壳菌无性态为拟茎点霉菌,是植物上的内生菌或致病菌,作为致病菌常导致植株枯死、根腐、溃疡等症状(苏文文等,2021)。目前,Rossman等(2015)推荐采用有性态名称,而不是无性态名称来命名这类真菌。在甘薯上,甘薯间座壳菌前期认为是甘薯储藏期病害甘薯干腐病和甘薯蔓枯病的病原(刘奕君等,2017;谢昀烨等,2021)。导致甘薯基腐病的还有镰刀菌等其他病原菌,包括毁坏拟茎点霉菌和茄病镰刀菌等(黃巧雯等,2012;黄立飞等,2019)。
在分生孢子形态上,本研究人工培养时只观察到α型分生孢子,未见β型分生孢子,与前期黃巧雯等(2012)对毁坏拟茎点霉菌研究发现β型分生孢子未在人工培养中出现,仅在发病茎秆处偶现相似。由于间座壳菌形态在种间和种内具有多边性和形态可塑性,依据形态学分类易受观察者的主观影响,因此间座壳菌形态特征不适用于间座壳菌分类全部依据(Udayanga et al.,2012;Gomes et al.,2013),而通过对真菌保守看家基因的系统发育分析结合形态学特征鉴定已应用于间座壳菌和链格孢菌等病原真菌分类。Chaisiri等(2020)通过系统发育分析明确了柑橘黑化病病原菌()的分类,而本研究通过对菌株RF-NH的ITS、和联合基因进行系统发育分析,表明所得病原菌为。
病原菌生长特性的研究对农作物病害的田间防治和农产品储存具有指导意义(杜艳丽等,2019;郭强等,2019;王秀娟等,2019)。本研究在对甘薯间座壳菌生长特性分析时发现,甘薯间座壳菌在糊精、可溶性淀粉和纤维素为碳源的培养基中生长较快,说明该病原菌能够有效利用多糖。而在氮源利用上,甘薯间座壳菌对硝酸钠等硝酸盐的利用好于氯化铵、硫酸铵等铵盐,因此在甘薯施肥时可适当施用铵盐代替硝酸盐,创造不利于病原菌生长的环境。
甘薯间座壳菌能在15~35℃和pH 4~12的环境中生长,其生长最适温度为25℃,与同属的毁坏间座壳菌的最适温度28℃相似;甘薯间座壳菌菌丝生长最适pH为4,与菌丝生长最适pH为6有所不同,说明甘薯间座壳菌的适应力较强,且与毁坏间座菌壳稍有差别(高岩,2020)。甘薯间座壳菌在供试温度培养时35℃下菌落直径最小,在供试pH培养时pH 12下菌落直径最小,说明该菌不偏好高温和碱性环境;在50℃处理10 min时分生孢子致死,较分生孢子致死温度48℃10 min稍高;在49℃处理15 min或50℃处理10 min时菌丝致死,较菌丝致死温度为49℃10 min稍长(高岩,2020)。尽管2种菌致死温度不完全一致,但差别较小,说明甘薯间座壳菌和毁坏间座壳菌对高温的耐受程度低于低温。因此,在田间防治时要及时清理病残体,避免病残体在田间越冬,提供病原菌生长的不适环境,抑制病害发生。此外,基于病菌偏好低温环境,该菌可能具有在北方等薯区侵染危害的潜在能力,因此在种源调运时要加强对病区种薯和种苗带菌情况的检验检测,防止病苗调运。因甘薯间座壳菌在察氏培养基中未能诱导出孢子,因此,下一步应筛选能诱导产孢的基础培养基,进一步探究不同环境因素对病原菌孢子的影响。
目前生产上未见对甘薯基腐病具有良好抗性的甘薯品种,该病对我国沿海地区甘薯种植具有极大威胁,因此可通过抗性鉴定,以期获得对该病具有抗性的品种,满足我国病区甘薯种植需求。今后,一方面应进一步分析该病原菌分生孢子发育特点,利用基因组学和转录组学等分析甘薯间座壳菌侵染甘薯的关键基因,以明晰该菌的侵染机制;另一方面,应进一步筛选抗性品种、防治药剂和生防菌剂,从而指导田间生产,避免该病害的进一步扩散。
4 结论
甘薯间座壳菌是导致浙江省宁波市宁海县甘薯基腐病的病原,该菌生长温度范围较窄,偏好25℃,适应的pH较宽,偏好酸性环境,最适培养基为SPDA培养基。根据甘薯间座壳菌的生长特性,在田间病害防治中可通过改变栽种环境因素,调节土壤pH,营造碱性环境,合理施肥,适当轮作,以抑制甘薯基腐病病原菌的生长,实现对甘薯基腐病的防治。
