2株广西鹅源基因XII型新城疫病毒的病原学分析
2022-10-11曾婷婷谢芝勋华俊谢丽基李孟黄娇玲张民秀张艳芳苑亚东撒薇
曾婷婷,谢芝勋*,华俊,谢丽基*,李孟,黄娇玲,张民秀,张艳芳,苑亚东,撒薇
(1广西兽医研究所/广西兽医生物技术重点实验室,广西南宁530001;2广西大学养禽与禽病学研究所,广西南宁530004)
0 引言
【研究意义】禽1型副黏病毒(1,APMV-1)又称新城疫病毒(Newcastle disease Viruses,NDV),在世界范围内能感染家禽或鸟类250多种(Amarasinghe et al.,2018),尤其是强毒株感染家禽特别是鸡和火鸡后表现为羽毛蓬松、腹泻、食欲废绝、瘫痪甚至死亡,死亡率高达100%。目前,由于NDV疫苗的推广应用,在鸡、鸭、鹅等家禽上已鲜有新城疫(Newcastle disease,ND)暴发,但鸽子ND暴发时有报道,且NDV宿主广泛、可在不同宿主间互相传播,全球范围内不断出现NDV新基因型毒株(Dimitrov et al.,2019)。因此,仍需密切监测NDV的流行分布情况,为科学防控ND疫情提供参考依据。【前人研究进展】根据基因组长度,NDV可划分为两大分支:Class I和Class II(Czeglédi et al.,2006)。其中,Class I基因组长度为15198 nt,Class II则包含2种长度,分别是15186和15192 nt。每个分支又细分为若干基因型。根据Diel等在2012年提出的分类系统中,宜利用F基因全长编码序列描绘系统发生树,至2019年NDV基因分型系统得到进一步优化。Class I NDV包含1个基因型,下分3个基因亚型:1.1.1、1.1.2和1.2;Class II NDV包含I~XXI共21个基因型(Dimitrov et al.,2019)。不同基因型NDV具有一定的地域分布特征(Dimitrov et al.,2016),我国境内的流行毒株是以感染鸡、鸭、鹅等家禽为主的基因VII型(Liu et al.,2003;Qin et al.,2008)和感染鸽子为主的基因VI型(Guo et al.,2013;Xue et al.,2017)。由于家禽生产中广泛使用疫苗,近十年来已很少出现基因VII型病例,但鸽子感染基因VI型NDV病例的报道较多(Wei et al.,2018;He et al.,2020)。class II基因XII型NDV于2004年首次在南美洲发现(Chumbe et al.,2017),随后2008年在越南被分离鉴定(Xuyen et al.,2018),2010年在我国广东和福建活禽市场监测中也分离到基因XII型NDV(刘华雷等,2017)。【本研究切入点】2018年本课题组在广西分离鉴定出2株鹅源基因XII型NDV(曾婷婷等,2020),但其生物学特性,以及与其他省份分离株的亲缘关系均有待进一步探究。【拟解决的关键问题】通过对2株分离株进行致病性试验、全基因组测序,并分析主要毒力基因的氨基酸差异位点及遗传进化关系,以期为NDV流行分布的系统监测和ND的科学防控提供参考依据。
1 材料与方法
1.1 试验材料
2018年通过SPF鸡胚从广西活禽市场销售鹅的咽/泄殖腔拭子中分离获得2株基因XII型NDV(曾婷婷等,2020),分别命名为Goose/China/GX02/2018和Goose/China/GX17/2018。SPF鸡胚购自北京梅里亚维通实验动物技术有限公司,由广西兽医生物技术重点实验室自行孵化至9~11日龄。核酸抽提试剂盒EasyPureViral DNA/RNA Kit、胶回收试剂盒EasyPureQuick Gel Extraction Kit及载体连接试剂盒pEASY-Blunt Cloning Kit购自北京全式金生物技术股份有限公司;双链cDNA合成试剂盒Prime-ScriptDouble Strand cDNA Synthesis Kit、高保真RT-PCR试剂盒PrimeScriptII High Fidelity One Step RT-PCR Kit及末端序列扩增试剂盒SMARTer RACE 5'/3'Kit购自宝日医生物技术(北京)有限公司;DMEM/F12培养基和胎牛血清购自Gibco公司。
1.2 病毒纯化
根据赵明等(2014)的方法,连续进行4个代次的病毒噬斑纯化。当DF-1细胞铺满6孔细胞板95%底部时,以PBS清洗2次。以无血清DMEM/F12培养基对原代病毒液进行10倍梯度稀释至原浓度的10倍,每个浓度分别接种至6孔细胞板中,置于37℃、5% CO培养箱孵育2 h。孵育完成后吸净病毒液并以PBS清洗2次,然后覆盖含1%胎牛血清及1%低熔点琼脂的DMEM/F12培养基(2 mL/孔)。待琼脂完全凝固,置于37℃、5% CO培养箱培养72 h,再覆盖含0.02%中性红、1%胎牛血清及1%低熔点琼脂的DMEM/F12培养基(2 mL/孔),12~24 h后观察挑斑。挑取轮廓清晰,与其他噬斑距离较远,且大小与大多数噬斑相似的噬斑2个,置于无血清DMEM/F12培养基中漩涡振荡1 min并冻融2次后作为下一代噬斑纯化的母液。连续纯化4个代次后,接种SPF鸡胚增殖病毒,收获尿囊液备用,并参照广西兽医生物技术重点实验室建立的检测方法排除其他禽副黏病毒(谢志勤等,2017)。
1.3 致病性试验
根据GB/T 16550—2008《新城疫诊断技术》的步骤进行致死鸡胚平均死亡时间(MDT)和脑内接种致病指数(ICPI)试验,测定2株分离株的致病性。
1.3.1 MDT操作步骤使用无菌生理盐水将新鲜尿囊液稀释为10~10,每个稀释度取0.1 mL,经尿囊腔途径接种5枚9日龄的SPF鸡胚,8 h后以同样的尿囊液再接种1次,所有接种鸡胚置于37℃下继续孵化培养。鸡胚连续观察7 d,每天观察2次,记录鸡胚死亡时间和死亡数量。

式中,、为或小时死亡的SPF鸡胚数(枚),、为鸡胚死亡时间(h),为SPF鸡胚死亡总数(枚)。
1.3.2 ICPI操作步骤HA≥4 log2的新鲜尿囊液以无菌生理盐水稀释10倍,出壳24~40 h的雏鸡均经脑内途径接种0.5 mL稀释后的尿囊液。接种后连续观察8 d,每天1次,并计分:正常计0分,病鸡计1分,死亡计2分(雏鸡死亡后每天仍计2分)。

式中,∑s为8 d累计发病数(羽),∑d为8 d累计死亡数(羽),为8 d累计观察雏鸡总数(羽)。
1.4 全基因组测序及分析
根据核酸抽提试剂盒说明分别抽提2株分离株的总RNA,反转录合成双链cDNA后送至泽塔生物科技(上海)有限公司进行测序。由于NDV为单股负链RNA病毒,二代测序无法直接获得病毒基因组5'端和3'端50~100 nt序列,因此分别使用5'端引物(5'-TTCTGTTTCCCTGCAAGGG-3')和3'端引物(5'-GTGCTCAACAAAAATTCTAC-3')配合末端序列扩增试剂盒提供的通用引物,以2株分离株RNA为模板进行RT-PCR扩增,扩增片段克隆后送至深圳华大基因股份有限公司测序。
1.5 主要抗原蛋白氨基酸序列比对及遗传进化分析
使用DNASTAR比对2株分离株与南美分离株(基因XIIa亚型)、越南分离株(基因XIId亚型)及我国广东分离株(基因XIIb亚型)(表1)的主要抗原蛋白(F蛋白和HN蛋白)氨基酸序列,计算F基因核苷酸序列相似性,并使用MEGA X的最大似然法(Maximum likelihood method),基于F基因核苷酸序列相似性构建系统发育进化树(Kumar et al.,2018),设1000次自展(Bootstrap)验证。同时,以MEGA X的Maximum Composite Likelihood计算各毒株间的遗传距离,并通过Gamma Distribution计算每个位点的变异率(Diel et al.,2012)。
2 结果与分析
2.1 病毒纯化及致病性
经过DF-1细胞4个代次的噬斑纯化,分别获得2株分离株(Goose/China/GX02/2018和Goose/China/GX17/2018)的纯化株。纯化株接种SPF鸡胚收获的尿囊液-30℃保存,作为后续试验的母液。致病性试验结果显示,2株分离株的MDT分别为54和48 h,ICPI分别为1.65和1.65,表明这2株NDV均为强毒株。
2.2 全基因序列测定结果及基因组基本结构
使用DNASTAR将测序获得的序列与RT-PCR扩增的5'端和3'端序列拼接成完整的NDV全基因组,然后上传至GenBank,获得序列号分别为MZ306224和MZ306223。2株分离株的基因组长度均为15192 nt,与我国广东分离的基因XII型NDV基因组结构(王静静等,2018)一致,基因组3'端引导序列为55 nt,5'端尾随序列为114 nt,NP基因-P基因、P基因-M基因、M基因-F基因、F基因-HN基因、HN基因-L基因的间隔区分别为1、1、1、31和47 nt(图1)。
2.3 F基因遗传进化分析结果
截取2株分离株的F基因全长序列,使用DNASTAR计算其核苷酸序列相似性。结果显示,2株分离株的F基因核苷酸序列相似性为99.9%,与我国广东分离株的相似性为97.9%~99.3%,与南美分离株的相似性为90.9%~92.1%,与越南分离株的相似性为91.3%~92.8%。根据MEGA X计算F基因遗传距离及构建系统发生进化树,结果显示,2株分离株与我国广东分离株处于同一分支上,遗传距离介于0.0174~0.0220;与南美分离株(XIIa亚型)的遗传距离介于0.0911~0.1150,与越南分离株(XIId亚型)的遗传距离介于0.0801~0.0834。我国分离株与南美分离株的平均遗传距离为0.0909,与越南分离株的平均遗传距离为0.0691。根据Dimitrov等(2019)更新的NDV分类标准:平均遗传距离介于0.05~0.10,划为1个基因亚型,大于0.10划为1个基因型。即2株分离株(Goose/China/GX02/2018和Goose/China/GX17/2018)均属于基因XIIb亚型,与我国广东分离株属于同一基因亚型。系统发育进化树(图2)还显示,我国2010年的分离株、2011年的分离株及2017年后的分离株分别形成3个小分支,南美分离株也具有类似情况,2004—2006年分离株、2008—2009年分离株及2011年后的分离株分别形成3个小分支,提示基因XII型NDV一直处于不断进化中。
2.4 F蛋白氨基酸序列分析结果
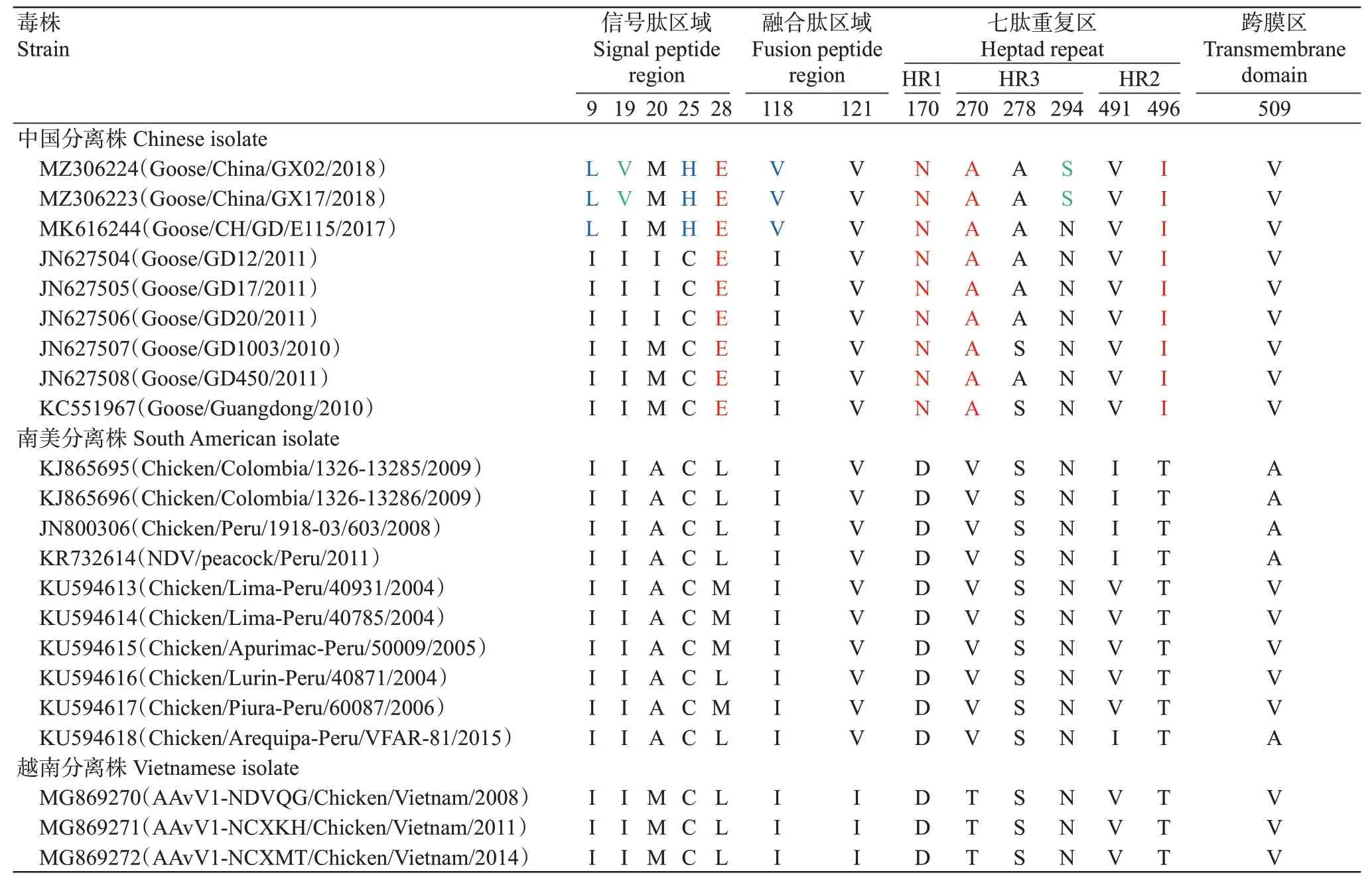
测序结果显示,2株分离株的F基因全长1662 nt,F蛋白包含553个氨基酸残基,F蛋白裂解位点均为RRQKRF。与其他基因XII型NDV相比,在F蛋白的信号肽区域、融合肽区域、七肽重复区和跨膜区共有14个氨基酸差异位点(表2)。信号肽区域有5个氨基酸差异位点,其中3个为2017年后我国分离株特有的氨基酸差异(I→L、I→V和C→H),1个是我国分离株特有的氨基酸差异(L→E);融合肽区域有2个氨基酸差异位点,其中1个是2017年后我国分离株特有的氨基酸差异(I→V);七肽重复区有6个氨基酸差异位点,其中3个是我国分离株特有的氨基酸差异(D→N、V→A和T→I),1个是2株广西分离株特有的氨基酸差异(N→S)。可见,氨基酸位点差异与时间推移有关,也提示基因XII型NDV一直处于不断进化中,与遗传进化分析结果一致。
2.5 HN蛋白氨基酸序列分析结果

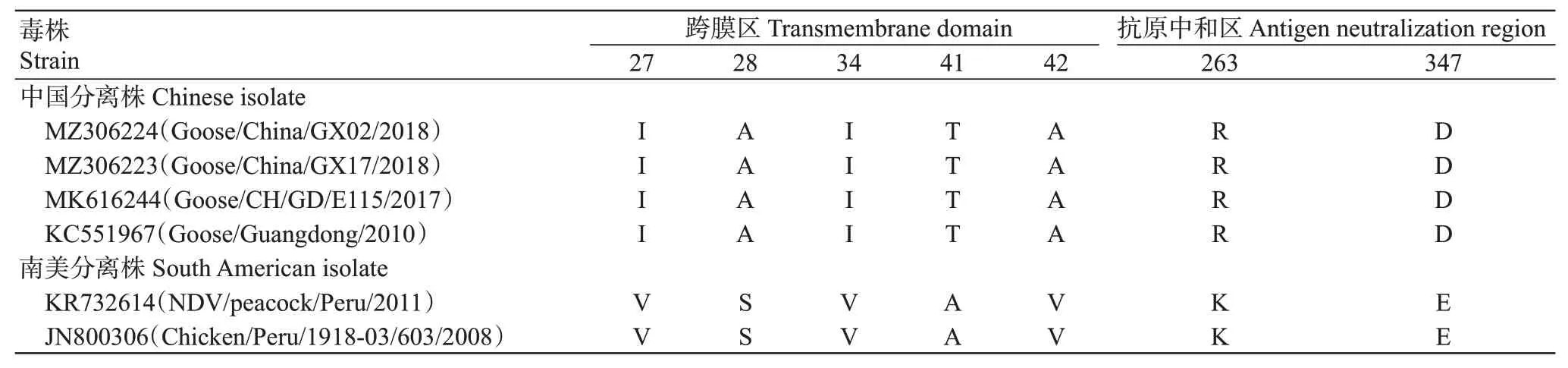
测序结果显示,2株分离株的HN基因全长1716 nt,HN蛋白包含571个氨基酸残基。由于已报道基因XII型NDV只有4株毒株(我国广东分离株2株,南美分离株2株)上传了HN基因序列,因此以这4株分离株的HN蛋白氨基酸序列为参考序列进行比对分析,结果显示,2株分离株的HN蛋白存在5个潜在N-糖基化位点(aa119、aa341、aa433、aa481和aa508),缺失aa538 N-糖基化位点,与我国广东分离株一致。10个唾液酸受体结合位点与4株参考毒株均无差异。在2株南美分离株中,分离株NDV/peacock/Peru/2011同时缺少aa508和aa538 N-糖基化位点,分离株Chicken/Peru/1918-03/603/2008缺少aa508 N-糖基化位点。2株分离株的HN蛋白跨膜区及抗原中和区氨基酸序列与我国广东分离株均一致(表3),其中蛋白跨膜区的aa27、aa28、aa34、aa41和aa42及 抗原中和区 的aa263和aa347与南美分离株存在7个氨基酸差异位点(V→I、A→S、V→I、A→T、V→A、K→R和E→D),这些氨基酸差异可能导致NDV的抗原性差异。
3 讨论
Class II基因XII型NDV于2004年首次在南美洲被分离获得(Chumbe et al.,2017),随后在越南和我国相继有报道(刘华雷等,2017;Xuyen et al.,2018)。我国分离株此前集中在广东,本研究中的2株分离株(Goose/China/GX02/2018和Goose/China/GX17/2018)是广西首次分离获得的鹅源基因XII型NDV。尽管致病性试验结果和F蛋白裂解位点氨基酸测序结果均显示这2株分离为强毒株,但其宿主鹅并未表现出任何临床症状。我国其他的基因XII型NDV分离株也均分离自肉眼观测健康的活禽,Xiang等(2020)还研究证实鹅源分离株MK616244可从鹅跨物种水平传播给鸡,人工感染非免疫鹅并未表现任何症状,感染非免疫鸡则表现出轻微精神沉郁、扭头瘫痪等神经症状,但不致死,且症状随时间推移会逐渐减轻耐过。南美分离株(XIIa亚型)和越南分离株(XIId亚型)均对鸡群表现出强毒致病性(Chumbe et al.,2017;Xuyen et al.,2018),南美分离株大部分分离自免疫后的鸡群,肉鸡感染死亡率为4.0%~12.0%,且表现出呼吸困难等临床症状,蛋鸡表现为轻微呼吸困难,产蛋量下降,感染死亡率为1.8%(Chumbe et al.,2017);越南分离株也分离自免疫后的鸡群,表现为精神沉郁、腺胃乳头出血等(Xuyen et al.,2018)。可见,在自然感染状态下我国分离株对鸡群的致病力远低于南美分离株和越南分离株。
NDV的毒力和抗原蛋白主要为F蛋白和HN蛋白。本研究通过比对分析GenBank已公布基因XII型NDV的F蛋白和HN蛋白氨基酸序列,结果在这些蛋白的主要功能域发现我国分离株相对于其他国家分离株存在一些独特的氨基酸差异:F蛋白的信号肽区域(L→E/M→E),七肽重复区的HR1(D→N),七肽重复区的HR3(V→A/T→A),七肽重复区的HR2(T→I);HN蛋白的跨膜区(V→I、S→A、V→I、A→T和V→A),抗原中和区(K→R和E→D)。前人研究结果证实,F蛋白的主要功能域与其裂解后形成的F1蛋白膜融合活性相关,信号肽区域、七肽重复区的HR1和HR2及跨膜区的氨基酸位点突变均可导致膜融合活性下降,从而降低NDV的感染力和致病力(Sergel-Germano et al.,1994;Reitter et al.,1995;McGinnes et al.,2001;Gravel et al.,2011)。因此,我国分离株(XIIb亚型)与南美分离株(XIIa亚型)、越南分离株(XIId亚型)对鸡群自然致病力的区别是否与这些位点的氨基酸差异有关,亟待应用反向遗传学进一步探究。此外,我国分离株HN蛋白aa347的改变(E→D)值得关注,该位点的氨基酸突变(E→K)已被证实会造成NDV抗原的显著差异(Hu et al.,2010),因此E→D是否导致基因XII型NDV与现有疫苗株间的抗原显著差异,以及是否会降低现有疫苗保护率将是今后的研究热点。
基于F基因核苷酸序列相似性构建的基因XII型NDV系统发育进化树可知,2株分离株(Goose/China/GX02/2018和Goose/China/GX17/2018)与我国广东分离株Goose/CH/GD/E115/2017处于同一小分支上,且这一小分支与其他小分支的遗传距离较远;F蛋白氨基酸序列比对分析结果显示,有3个氨基酸位点差异(I→L、C→H和I→V)是这3株分离株所特有,有2个氨基酸差异位点(I→V和N→S)是广西分离株所特有。说明尽管2011年后一段时间内未分离获得基因XII型NDV毒株,但该病毒并非一过性感染,而是潜伏在某些宿主身上并一直持续进化。因此,加强对不同宿主携带NDV的实时监测对分析病毒演化及防控NDV感染家禽至关重要。
4 结论
我国分离株(XIIb亚型)与南美分离株(XIIa亚型)和越南分离株(XIId亚型)在F蛋白和HN蛋白的氨基酸差异可能与其对鸡群的致病力差异有关。此外,基因XII型NDV一直处于不断进化中,而需持续监测该基因型NDV的流行分布情况。
