贝沙罗汀对氧糖剥夺/再灌注诱导HT22损伤的神经保护作用及机制研究
2022-09-27张雪林田晓翠刘海林
张雪林,王 松,田晓翠,董 志,刘海林
(1.重庆两江新区第一人民医院药剂科,重庆 401121;2.重庆医科大学药学院生物化学与分子药理学重点实验室,重庆 400016 )
脑卒中是导致人类残疾和死亡的主要原因之一,急性缺血性脑卒中(acute ischemic stroke,AIS)约占脑卒中的80%[1]。AIS是一种常见且严重的神经损伤性疾病,一旦发生缺血、缺氧可导致神经元损伤,血流再灌注后,可进一步加剧损伤,严重影响患者的生活质量及寿命[2]。尽管国内外学者们针对AIS进行了大量的基础、临床研究,但是目前仍无能够显著改善该疾病不良预后的神经保护药物。因此,寻找新的、安全有效的治疗该疾病的药物非常有必要。
细胞凋亡作为细胞程序性死亡的一种,与氧糖剥夺/再灌注(oxygen glucose deprivation/reperfusion,OGD/R)损伤密切相关。有研究表明,OGD/R后兴奋性氨基酸释放、内质网应激、炎症、钙超载等均可通过激活线粒体途径、死亡受体途径及内质网途径促进下游细胞凋亡的关键执行蛋白Caspase-3表达,进而导致神经元的凋亡[3]。C-Jun N末端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶(mitogen-activated proteinkinase,MAPK)家族中的重要成员之一,其较广泛地参与神经系统性疾病的发生、发展,在神经元的凋亡、坏死、炎症等相关信号通路中有着非常重要的作用[4]。有研究表明,在全脑缺血再灌注损伤模型中,磷酸化JNK的表达和细胞凋亡的水平明显增加,而使用JNK的特异性抑制剂能明显降低病灶部位细胞凋亡水平[5-6]。这些研究提示,JNK相关信号通路激活可能与OGD/R诱发的凋亡密切相关。被激活的JNK可磷酸化C-Jun等多种底物[7],通过调节促凋亡因子BCL及凋亡执行关键蛋白半胱氨酸蛋白酶Caspase-3的表达,最终导致神经元凋亡。
贝沙罗汀是一种被美国FDA批准用于治疗皮肤淋巴瘤的新型化学药物,具有分子量较小、脂溶性较高、易透过血脑屏障等优点。贝沙罗汀可能在中枢神经系统疾病中发挥重要作用。研究显示,贝沙罗汀有利于阿尔兹海默病模型小鼠神经功能障碍的恢复[8],可促进创伤性脑损伤模型小鼠神经功能恢复[9]。但目前关于贝沙罗汀对OGD/R体外模型神经元保护作用的研究较为缺乏。本研究使用小鼠海马神经元细胞系HT22构建OGD/R模型,观察贝沙罗汀对HT22的保护作用,同时观察贝沙罗汀对凋亡关键蛋白P-JNK、P-C-Jun、Bax、BCL-2及Cleaved-Caspase-3的影响,以探索贝沙罗汀对OGD/R损伤保护作用的新靶点、新机制,为寻找新的、安全有效的治疗AIS的药物提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
HT22由重庆医科大学药学院生物化学与分子药理学重点实验室提供。DMEM高糖培养基、DMEM无糖培养基、opti-MEM Ⅰ培养基及胰酶均购自美国Gibco公司,Triton X-100购自北京索莱宝科技有限公司,β-actin兔多克隆抗体购自武汉三鹰生物技术公司。JNK、P-JNK、P-C-Jun、Cleaved-Caspase-3兔来源单克隆抗体均购自美国CST公司,BCA蛋白定量试剂盒、JNK特异性抑制剂(SP600125)购自北京碧云天科技公司。光学显微镜购自日本Olympus公司,恒温电热水浴锅购自上海医疗器械七厂,超净工作台SW-CJ-ID型购自苏州净化公司,倒置显微镜DMI3000B型购自德国Leica公司,多功能成像系统购自法国Vilber公司。
1.2 细胞培养
将HT22培养于37 ℃、5%CO2、75%N2、含1%双抗和10%胎牛血清的培养基中。取对数生长期的HT22,使用0.25%胰酶消化,按照5×103个/孔的密度接种于96孔板,用于后续研究。
1.3 OGD/R模型的建立及分组
取对数生长期的HT22,待贴壁生长后继续培养24 h,弃原培养液,使用PBS洗涤细胞3次后更换为DMEM无糖培养基培养,将细胞置于预先设置好的厌氧培养箱中继续培养,待氧浓度降至1%开始计时,2 h后将DMEM无糖培养基更换为完全培养基,并重新置于常氧恒温培养箱中复氧再灌注24 h。将细胞随机分成对照组(Control组)、模型组(OGD/R组)、药物干预组(OGD/R+Bex组)、SP组(OGD/R+SP组)及药物干预合并SP组(OGD/R+Bex+SP组)。对照组不做任何处理,药物干预组在OGD/R前后给与9 μmol·L-1的贝沙罗汀干预,SP组在OGD/R前后给与SP600125(25 μmol·L-1)干预,药物干预合并SP组在OGD/R前后同时给与贝沙罗汀及SP600125干预。
1.4 HT22活性测定
将对数生长期的HT22以5×104个/孔的密度接种于96孔板。根据实验设计,加或不加不同浓度(0.1~81 μmol·L-1)的贝沙罗汀干预,每孔加入预先配制好的MTT(5 mg·mL-1)溶液20 μL,在正常或OGD/R环境中处理,倒掉含MTT溶液的培养基,加入100 μL DMSO溶液,水平摇床放置10 min,充分溶解已形成的结晶。用酶标仪在570 nm波长处测定吸光度值,计算细胞生存率。
1.5 流式细胞仪检测细胞凋亡水平
OGD/R后,用0.25%胰酶消化细胞,以1 000 r/min室温离心5 min,弃去上清,收集离心管底部的细胞沉淀。加入PBS,轻轻吹打使其均匀分散,以1 000 r/min室温离心5 min,重复上述步骤2次,将细胞清洗干净。弃去离心后的上清液,再次加入适量PBS吹散细胞进行重悬,转移至新的EP管送流式细胞仪中检测,定量分析细胞凋亡水平。
1.6 HT22形态学观察
取出铺于6孔板中的各组细胞,弃去培养基,PBS洗涤3次,于光学显微镜下观察各组细胞形态。
1.7 Western blot测定相关蛋白表达水平
取出铺于6孔板中的各组细胞,弃去培养基,用预冷的PBS清洗,使用含蛋白酶抑制剂的RIPA裂解缓冲液进行裂解(每孔200 μL),置于冰面20 min,小心收集于2 mL离心管中并置于冷冻离心机中,12 000 r/min 4 ℃离心15 min,将上清液小心移至新的EP管中,提取总蛋白,总蛋白浓度采用BCA法测定。每孔上样30 μg后接通电源,浓缩胶恒压90 V、30 min,分离胶恒压120 V电泳,当溴酚蓝染料接近分离胶底部时终止电泳。按照目标蛋白分子量切胶,将转膜夹黑面置平,在上面依次垫海绵垫、滤纸、胶、甲醇活化的PVDF膜、滤纸、海绵垫,夹紧后放入含有转膜液的转膜槽中,接通电源,冰浴下恒流210 mA转膜40 min,5%胎牛血清室温封闭2 h,弃去封闭液,用TBST洗涤5 min,重复3次,加入稀释好的一抗:P-JNK(1∶1 000)、P-C-Jun(1∶1 000)、BCL-2(1∶1 000)、Bax(1∶1 000)、Cleaved-Caspase-3(1∶1 000)、β-actin(1∶3 000),置于4 ℃冰箱中孵育过夜。回收一抗,TBST洗涤3次,每次5 min,加入抗兔二抗室温孵育1 h,TBST洗涤3次,每次5 min。滤纸吸去PVDF膜上的TBST,滴加适量的ECL工作液,置于Bio-Rad成像分析仪内曝光显影,用Image Lab软件分析条带灰度值。
1.8 统计学处理
2 结果
2.1 贝沙罗汀对HT22生存率的影响
在正常环境中,不同浓度(0.1~9 μmol·L-1)的贝沙罗汀对HT22的生长不会产生抑制作用;当浓度为27~81 μmol·L-1时,HT22的生存率显著降低(P<0.05)。在OGD/R环境下,HT22的生存率较正常环境低:给与不同浓度(0.1~9 μmol·L-1)的贝沙罗汀干预后,HT22的生存率呈浓度依赖性上升趋势;当贝沙罗汀浓度为27~81 μmol·L-1时,细胞生存率显著降低(P<0.05),见图1。因此,本研究选择9 μmol·L-1贝沙罗汀用于后续实验研究。
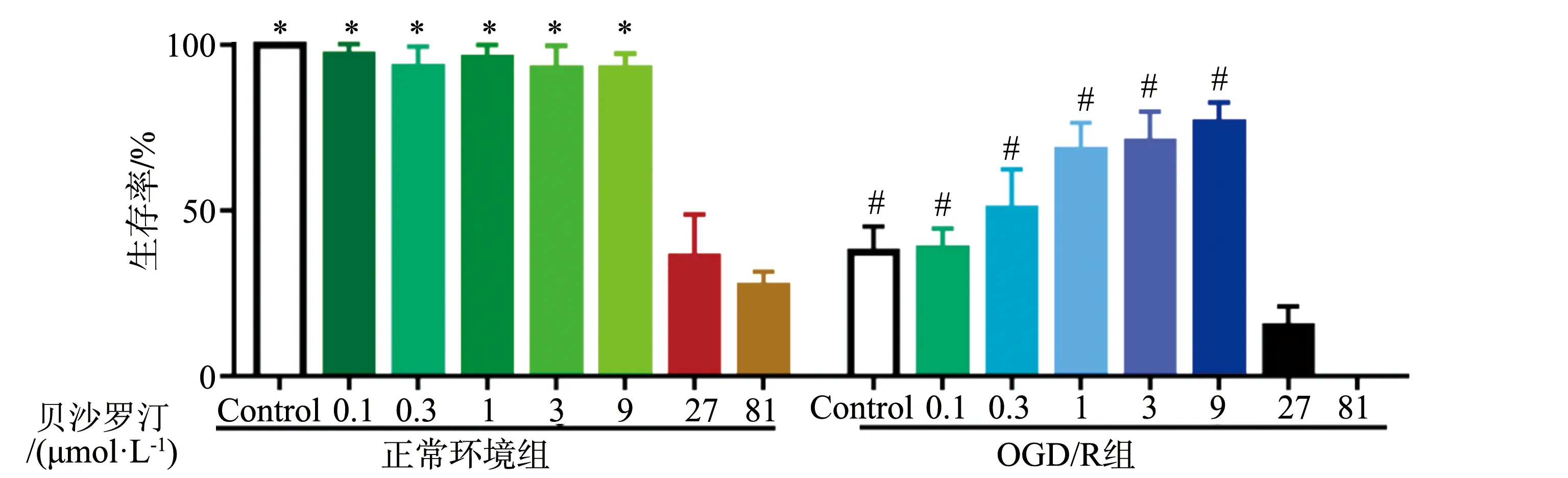
*:与正常环境组27 μmol·L-1相比,P<0.05;#:与OGD/R环境组27 μmol·L-1相比,P<0.05
2.2 OGD/R损伤促进HT22凋亡
Control组的HT22凋亡较少;与Control组相比,OGD/R组的HT22凋亡率显著升高,差异具有统计学意义(P<0.05);与OGD/R组相比,OGD/R+Bex组、OGD/R+Bex+SP组、OGD/R+SP组的细胞凋亡率降低,差异均具有统计学意义(P<0.05),见图2。

*:与Control组相比,P<0.05;#:与OGD/R组相比,P<0.05
2.3 贝沙罗汀对OGD/R后HT22形态的影响
Control组HT22贴壁牢固,胞体完整,细胞紧密连接成网络;而HT22经OGD/R处理后,可见细胞数量明显减少,胞体皱缩,细胞之间连接稀疏。贝沙罗汀干预后,OGD/R导致的HT22损伤明显改善(图3)。

图3 贝沙罗汀对OGD/R后HT22形态的影响(×200)
2.4 贝沙罗汀对OGD/R后HT22中P-JNK、P-C-Jun蛋白表达的影响
与Control组相比,OGD/R组P-JNK、P-C-Jun蛋白表达水平明显升高,差异有统计学意义(P<0.05)。与OGD/R组相比,OGD/R+Bex组、OGD/R+Bex+SP组、OGD/R+SP组P-JNK、P-C-Jun蛋白表达水平显著下降,差异均具有统计学意义(P<0.05),见图4。

*:与Control组相比,P<0.05;#:与OGD/R组相比,P<0.05
2.5 贝沙罗汀对OGD/R后HT22中Bax、BCL-2及Cleaved-Caspase-3蛋白表达的影响
与Control组相比,OGD/R组促凋亡蛋白Bax及凋亡关键执行蛋白Cleaved-Caspase-3表达水平明显升高(P<0.05),抑制凋亡蛋白BCL-2表达水平显著降低(P<0.05)。与OGD/R组相比,OGD/R+Bex组、OGD/R+Bex+SP组、OGD/R+SP组Bax及Cleaved-Caspase-3表达水平明显降低(P<0.05),BCL-2表达水平显著升高(P<0.05),见图5。
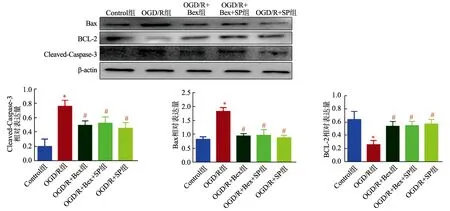
*:与Control组相比,P<0.05;#:与OGD/R组相比,P<0.05
3 讨论
AIS是一种发病率高、致残率高、病死率高、复发率高以及并发症较多的疾病,目前最有效的治疗方法是治疗窗内给予血管再通治疗[10]。但血液复流后,缺血部会发生再灌注损伤,不仅不能使组织、器官功能恢复,反而会加重组织、器官的功能障碍,该损伤涉及细胞凋亡、炎症、氧化应激等多种病理生理过程,目前临床上尚无确切的药物能有效逆转上述损伤[11-12]。
贝沙罗汀是一种新型的合成维甲酸类似物,其可以选择性地与维甲酸类X受体(RXR)亚单位(RXRa、RXRb、RXRg)结合从而发挥多种生理功能:如诱导一些恶性肿瘤细胞系的程序化死亡;抑制人鳞细胞肿瘤的异种移植等,已被美国FDA批准用于治疗皮肤T-细胞淋巴瘤。贝沙罗汀对于HT22 OGD/R损伤的保护作用的研究较少,我们前期的研究表明,贝沙罗汀对小鼠脑缺血再灌注损伤神经元具有保护作用,但缺乏体外的机制研究[13]。因此,我们建立了OGD/R模型,研究贝沙罗汀对HT22的保护作用,并探索贝沙罗汀对OGD/R损伤保护作用的新靶点、新机制,为寻找安全有效的治疗AIS的药物提供重要理论依据。
细胞凋亡时细胞变圆,与周围细胞分离,细胞质皱缩,包膜内陷使细胞分裂成凋亡小体。为了证实贝沙罗汀可有效减少或逆转AIS引起的病灶部位细胞凋亡,本研究建立了OGD/R模型,结果表明,OGD/R组的HT22生存率较正常环境组明显降低,说明氧糖剥夺2 h再灌注24 h形成的OGD/R模型是成功的;而经过贝沙罗汀治疗后,HT22的生存率均有不同程度的升高,且呈剂量依赖性趋势;在光学显微镜下可见细胞损伤程度也有所降低,表明贝沙罗汀对OGD/R引起的HT22损伤具有一定的保护作用。因此,深入探讨贝沙罗汀对神经元的损伤机制对于治疗AIS等神经系统疾病有重要意义。
JNK又被称为应激活化蛋白激酶,是MAPK信号通路的一个重要分子,在细胞周期、增殖、细胞凋亡和细胞应激等多种生理和病理过程中起重要作用[14-15]。本研究结果表明,在OGD/R模型中,使用贝沙罗汀干预可明显抑制HT22中JNK信号通路激活,减少HT22凋亡。BCL-2家族是重要的凋亡调控因子,AIS后由于缺血等刺激使Bax易位至线粒体并增强线粒体膜通透性,从而释放细胞色素C和凋亡诱导因子,引发细胞凋亡,而BCL-2则通过稳定线粒体膜电位和阻止细胞色素C释放抑制细胞凋亡。抗凋亡蛋白BCL-2和促凋亡蛋白Bax之间的平衡决定细胞的存活或死亡。本研究结果显示,OGD/R后Bax表达水平显著升高,BCL-2表达水平下降,说明OGD/R后细胞凋亡显著增加;贝沙罗汀治疗后,Bax表达水平降低,BCL-2表达水平升高,说明贝沙罗汀可通过增加BCL-2/Bax比值,减少HT22凋亡。Caspase家族对凋亡有重要的调控作用,脑出血再灌注后经线粒体通路激活Caspase-9,经死亡受体通路激活Caspase-8,Caspase-8和Caspase-9均可诱导pro-Caspase-3裂解,产生具有活性的凋亡终末剪切酶Cleaved-Caspase-3,最终导致细胞凋亡的发生。本研究结果显示,OGD/R后Cleaved-Caspase-3表达水平显著上升,而贝沙罗汀可通过降低该酶表达减少HT22凋亡。
本研究在体外观察到贝沙罗汀能显著提升OGD/R后HT22的生存率,降低HT22的凋亡水平,减轻HT22的损伤,其机制可能是通过抑制JNK/Caspase-3相关信号通路激活,发挥神经保护作用。但本研究为体外研究,具体机制有待进一步研究。
