淡紫紫孢菌微菌核发酵滤液生防活性及代谢组学分析
2022-09-16范乐乐孙漫红李世东
范乐乐,郭 妍,赵 雪,孙漫红,李世东
(中国农业科学院植物保护研究所,北京 100193)
淡紫紫孢菌Purpureocillium lilacinum(异名:淡紫拟青霉Paecilomyces lilacinus)是一种重要的生防真菌,可寄生根结线虫Meloidogynespp.、胞囊线虫Heteroderaspp.和肾状线虫Rotylenchulusspp.等多种植物线虫[1-3],同时对番茄灰霉病、辣椒炭疽病等多种植物病害具有良好的防控效果[4,5]。研究表明,淡紫紫孢菌发酵过程中可产生多种活性物质,其中几丁质酶、丝氨酸蛋白酶、丁酸和脂肪酸等对根结线虫具有强烈的抑杀作用[6-8]。Seo等[9]对淡紫紫孢菌发酵液提纯分析发现,杀线虫活性组分主要为乙酸。淡紫紫孢菌还可以产生白灰质菌素、Acremonidin E和拟青霉酰胺等具有广谱抗真菌和细菌活性的化合物,能够明显抑制立枯丝核菌Rhizoctonia solani、水稻恶苗病菌Fusarium moniliforme和辣椒疫霉病菌Phytophthora capsici等病原菌的生长及产孢[10-13]。此外,代谢物中还有一些组分能够促进植物生长,提高植株苯丙氨酸解氨酶、多酚氧化酶和过氧化物酶的活性[14,15]。
淡紫紫孢菌培养过程中产生大量的菌丝和分生孢子,而在特定条件下也可以诱导形成一种抗逆结构—微菌核(Microsclerotia,MS)[16]。微菌核由大量菌丝缠绕特化而成[17,18],可显著提高丝状真菌对高温、干旱等不良环境的耐受力[16,19],同时也可以从根本上解决生防真菌货架期短、稳定性差等问题[20,21]。目前,一些生防真菌已成功培养出微菌核,如金龟子绿僵菌Metarhizium anisopliae、球孢白僵菌Beauveria.bassiana、布氏白僵菌B. brongniartii和哈茨木霉Trichoderma harzianum[22-24],但微菌核培养过程中滤液的生防活性及其相关的活性物质尚不明确。
淡紫紫孢菌 YES-2-14是本实验室分离到的一株生防菌,对根结线虫病具有较好的防治效果[25,26]。前期研究发现,YES-2-14微菌核发酵的pH曲线显著低于分生孢子发酵液,推测在此过程中可能激活了不同的代谢途径,生成不同的代谢产物。本研究通过室内生测和温室盆栽试验,测定淡紫紫孢菌微菌核培养过程中代谢产物的生防活性,同时基于 LC-MS构建代谢组,分析代谢组分的变化,以期为揭示淡紫紫孢菌生防机制奠定基础,为微菌核制剂的研发提供理论依据。
1 材料与方法
1.1 试验材料
淡紫紫孢菌YES-2-14,分离自云南烟草根结线虫;立枯丝核菌Rhizoctonia solani和核盘菌Sclerotinia sclerotiorum,分离自黑龙江省大豆病株;大丽轮枝菌Verticillium dahlia,分离自新疆棉花黄萎病病株。以上菌株由中国农业科学院植物保护研究所土传病害生防实验室分离、鉴定和保存。
分生孢子培养基:玉米粉8 g、蔗糖20 g、酵母浸粉15 g、K2HPO4·3H2O 1 g、MgSO4·7H2O 0.5 g、NaCl 1 g、无水CaCl22 g,加蒸馏水至1 L。121 ℃灭菌25 min。
微菌核培养基:蔗糖40 g,酵母浸粉15 g,KH2PO44 g,MgSO40.6 g,CaCl20.8 g,FeSO4·7H2O 0.1 g,ZnSO4·7H2O 15 mg,MnSO415 mg,蒸馏水 1 L,调节 pH 5.5。121 ℃灭菌 25 min。
黄瓜:中农6号,购买于北京市海淀区中蔬种业公司。
1.2 淡紫紫孢菌微菌核与分生孢子发酵滤液的制备
将淡紫紫孢菌YES-2-14接种于PDA平板上培养7 d,加入10 mL 0.05%的吐温80溶液洗脱孢子,制备孢子悬浮液(浓度为3×108孢子/mL)。吸取2 mL分别接种于微菌核培养基和分生孢子培养基中,28 ℃、180 r/min振荡培养,微菌核培养120 h,分生孢子培养72 h。将发酵液5000 r/min离心15 min,上清液过0.22 μm微孔滤膜去除菌体,制备微菌核发酵滤液和分生孢子发酵滤液。
1.3 根结线虫二龄幼虫的制备
采集根结线虫病株,自来水冲洗去除土块,用解剖针挑取卵囊,放入0.5% NaClO溶液中,搅拌使线虫卵全部释放。将线虫悬液依次通过灭菌的200目和500目筛网,无菌水反复冲洗,收集500目筛网上的线虫卵,置于支起的无菌滤纸上,培养皿中加水保湿,25 ℃孵化3 d。收集二龄幼虫(J2),制备200 J2/mL悬浮液,4 ℃保存备用。
1.4 淡紫紫孢菌微菌核发酵滤液对根结线虫二龄幼虫的作用
12孔组织培养板中加入1 mL线虫幼虫悬液,然后分别加入等体积的淡紫紫孢菌微菌核和分生孢子发酵滤液及5倍稀释液,轻轻晃动混合,25 ℃培养2 d,倒置显微镜(CK2,Olympus,日本)下记录存活和死亡的线虫数量,计算校正死亡率。活跃、弯曲蠕动的幼虫为活线虫,虫体僵直且加入NaOH溶液刺激后仍然不动的为死线虫。以无菌水为对照,每个处理3个重复。
1.5 淡紫紫孢菌微菌核发酵滤液对植物病原真菌的抑制作用
将PDA培养基冷却至50 ℃,分别加入微菌核滤液和孢子滤液(4:1,v/v),充分混匀,倒板。将立枯丝核菌、核盘菌和大丽轮枝菌在PDA平板上培养7 d,用打孔器打取直径为0.5 cm的菌饼,接种于含有发酵滤液的平板中央,28 ℃培养。7 d后刮取菌丝,烘干至恒重,测量生物量。核盘菌培养15 d后,观察菌核数量的变化。以添加无菌水的培养基为对照。每个处理3个重复。
1.6 淡紫紫孢菌微菌核发酵滤液对黄瓜幼苗生长的影响
选取饱满且大小一致的黄瓜种子,1% NaClO溶液消毒3 min,自来水冲洗。在培养皿中放置直径9 cm的灭菌滤纸,分别加入4 mL稀释10倍的微菌核滤液和孢子滤液,然后均匀摆放15粒黄瓜种子,26 ℃培养,并适时补充无菌水。种子发芽后3 d测定根长、茎长和幼苗鲜重。每个处理3个重复。
1.7 淡紫紫孢菌微菌核发酵滤液防治黄瓜根结线虫病温室试验
从河北廊坊试验基地根结线虫发病严重的地块取土,充分混合均匀,密度梯度离心法测定线虫含量为56条/100 g土。将病土分装到直径为12 cm的花盆中,600 g/盆。
将黄瓜种子用1%的NaClO消毒3 min,无菌水冲洗3次,28 ℃催芽至露白,播种于病土中,每盆2株,出苗后保留1株。待长出2~3片真叶后,分别加入10 mL微菌核滤液和孢子滤液。每个处理10株苗,随机排列。温室温度控制在22 ℃~28 ℃,常规方式管理。45 d后,统计株高、茎粗、根长和病情指数,计算防效。每个处理3个重复。
采用5级分级标准,调查黄瓜根部线虫发病情况。0级:根系健康,无根结;1级:根结长度为根系总长度的1%~15%;2级:根结长度为根系总长度的16%~25%;3级:根结长度为根系总长度的26%~50%;4级:根结长度为根系总长度的51%~75%;5级:根结长度达到75%以上。
1.8 淡紫紫孢菌微菌核发酵代谢产物分析
1.8.1 微菌核发酵滤液的制备 将淡紫紫孢菌YES-2-14接种于PDA平板上培养至产孢,0.05%的吐温80洗脱孢子,制备孢子悬浮液,接种于产微菌核培养基中,28 ℃、180 r/min振荡培养。分别于0、72、120 h取样,获得微菌核发酵液。将上述发酵液4 ℃、5000 r/min离心15 min,取上清液,过0.22 μm孔径滤膜去除菌体,制备MS 0 h、MS 72 h、MS 120 h发酵滤液,每个处理4个重复。
1.8.2 样品预处理 参照Dunn等[27]方法对发酵滤液进行预处理。分别取1.5 mL MS 0 h、MS 72 h、MS 120 h发酵滤液至2 mL离心管中,真空浓缩至无液体,加入500 μL甲醇(-20 ℃)复溶,涡旋振荡1 min,4 ℃、12000 r/min离心10 min,取上清液至2 mL离心管中,真空浓缩至尽干。加入150 μL 80%甲醇配置的2-氯苯丙氨酸溶液(4 mg/L)(-20 ℃保存)复溶样品,过0.22 μm滤膜后加入到检测瓶中进行LC-MS检测。
1.8.3 LC-MS检测 参照Zelena等[28]方法,对发酵滤液进行LC-MS分析。自动进样器温度为8 ℃,柱温为40 ℃,流速为0.25 mL/min。正离子模式流动相采用0.1%甲酸乙腈和0.1%甲酸,甲酸乙腈的洗脱梯度为:0~1 min,2%;1~9 min,2%~50%;9~12 min,50%~98%;12~13.5 min,98%;13.5~14 min,98%降至2%;14~20 min,2%。负离子模式流动相为乙腈和5 mM甲酸铵溶液,乙腈的洗脱梯度程序同上述甲酸乙腈溶液。质谱检测毛细管温度325 ℃,离子扫描范围m/z 81~1000,二级分辨率为17500[29]。
1.8.4 数据处理 采用R XCMS软件包进行峰检测、峰过滤、峰对齐处理[30],采用MassBank等数据库对发酵液中检测到的物质进行鉴定[31]。采用R Ropls软件包对鉴定到的物质进行PCA、OPLS-DA分析[32]。根据统计结果计算P值和VIP值(变量投影重要度)筛选微菌核形成过程中的差异代谢物,筛选条件为P<0.05,且VIP>1。
1.9 数据统计与分析
利用IBM SPSS Statistics 23和Excel 2019对实验数据进行分析,采用单因素ANOVA检验和t检验,Duncan新复极差法比较差异显著性(P<0.05)。
2 结果与分析
2.1 淡紫紫孢菌微菌核滤液对根结线虫二龄幼虫的触杀作用
微菌核发酵滤液对根结线虫二龄幼虫具有强烈的抑杀作用(图1),稀释2倍时杀线活性为93.1%;稀释10倍后,线虫校正死亡率可达到50%以上,显著高于分生孢子滤液(P<0.05)。
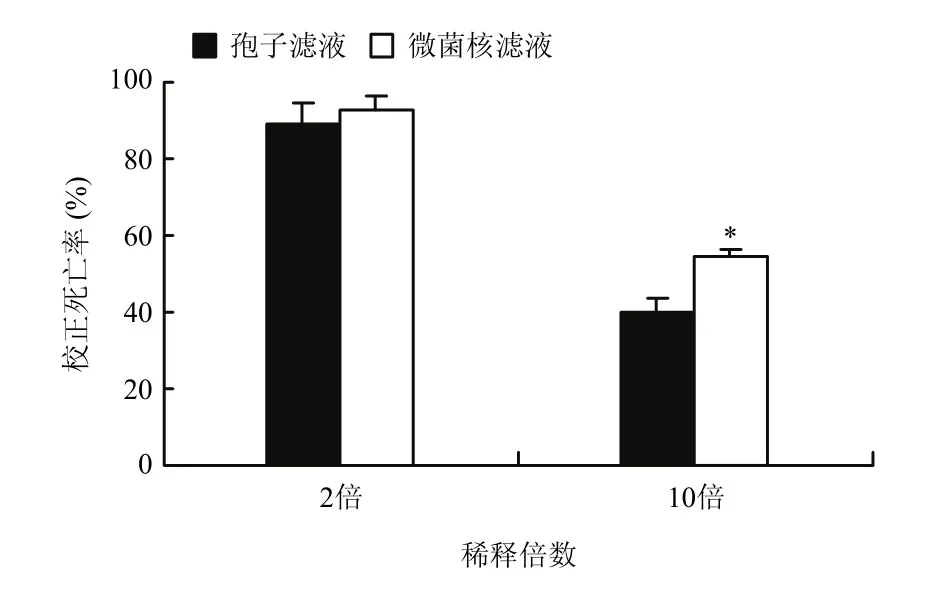
图1 淡紫紫孢菌微菌核发酵滤液对根结线虫二龄幼虫的致死作用Fig. 1 Effect of P. lilacinum MS fermentation filtrate on the second-stage juveniles of root knot nematode
2.2 淡紫紫孢菌微菌核发酵滤液的抑菌活性
淡紫紫孢菌微菌核发酵滤液对多种植物病原真菌均具有明显的抑制作用(P<0.05),处理后大丽轮枝菌菌丝稀疏,生长减慢,生物量减少62.6%。微菌核滤液对立枯丝核菌和核盘菌的抑制率分别为53.5%和70.5%,并可有效抑制菌核的形成。其抑菌活性与孢子滤液存在一定差异,对核盘菌的抑制率比孢子滤液提高1.3倍,但孢子滤液对立枯丝核菌的拮抗作用显著高于微菌核滤液(图2)。
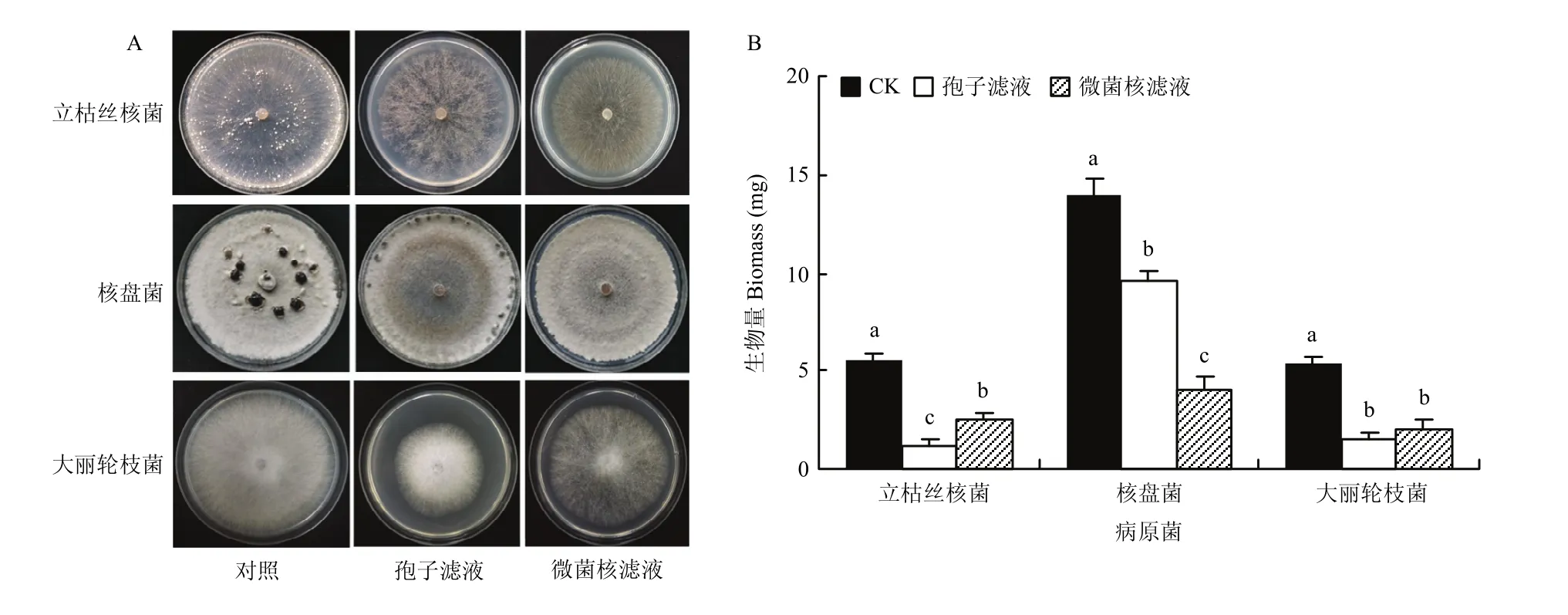
图2 淡紫紫孢菌微菌核发酵滤液对3种植物病原真菌的抑制作用Fig. 2 Inhibition of MS fermentation filtrate of P. lilacinum to three plant fungal pathogens
2.3 淡紫紫孢菌微菌核发酵滤液对黄瓜幼苗生长的影响
微菌核发酵滤液对黄瓜幼苗具有明显的促生作用(P<0.05)。采用10倍稀释液处理种子,幼苗根长和茎长分别增加了16.8%和21.3%,苗重增加13.0%,作用效果与孢子滤液一致(表1)。

表1 淡紫紫孢菌微菌核发酵滤液对黄瓜幼苗生长的影响Table 1 Effects of P. lilacinum MS fermentation filtrates on growth of cucumber seedlings
2.4 淡紫紫孢菌微菌核发酵滤液防治根结线虫病温室试验效果
微菌核发酵滤液对黄瓜根结线虫病具有较好的防治效果(图3)。当用量为10 mL/株时,防效达到44.9%,并且滤液可以明显促进黄瓜生长(P<0.05),株高和茎粗比对照分别增加了21.6%和38.4%。与分生孢子发酵滤液相比,微菌核滤液处理后黄瓜茎粗提高24.4%(表2)。

图3 淡紫紫孢菌发酵滤液对黄瓜生长及根结线虫的作用Fig. 3 Effects of P. lilacinum fermentation filtrates on plant growth and control efficacy on root-knot nematode in cucumber
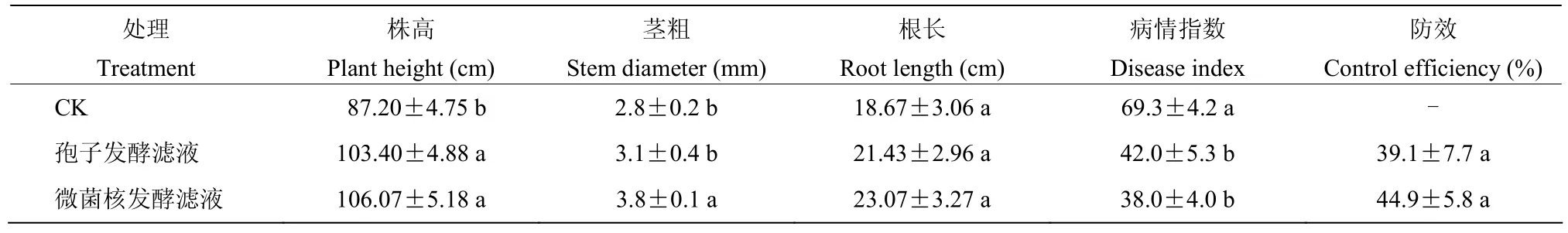
表2 淡紫紫孢菌微菌核发酵滤液对黄瓜生长的影响及对根结线虫病的防治效果Table 2 Effect of P. lilacinum MS fermentation filtrate on plant growth and its control efficacy on root-knot nematode in cucumber
2.5 淡紫紫孢菌微菌核发酵代谢产物分析
2.5.1 主成分分析(PCA) PCA得分图显示,淡紫紫孢菌微菌核发酵滤液在不同阶段(0、72、120 h)的平行样本基本聚集在一起。第一主成分PC1和第二主成分PC2累计贡献率75.1%,表明微菌核发酵过程中代谢产物具有明显差异,且所有检测分析稳定性和试验重现性良好(图4A),该模型可用于代谢物组分分析。
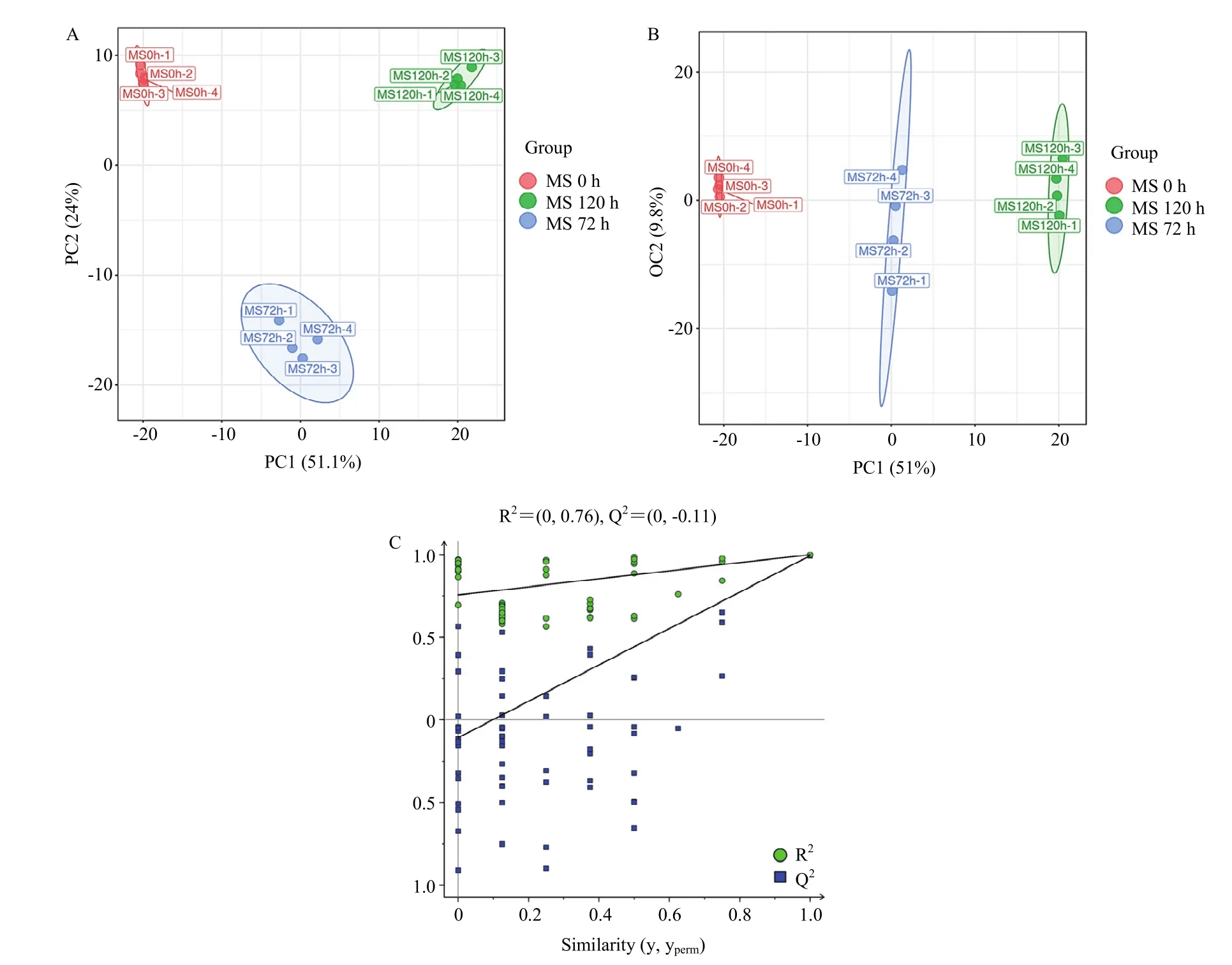
图4 淡紫紫孢菌微菌核滤液PCA和OPLS-DA得分图及OPLS-DA置换检验图Fig 4 PCA and OPLS-DA score plots and OPLS-DA permutation test chart of MS fermentation filtrate of P. lilacinum
2.5.2 正交-偏最小二乘判别分析(OPLS-DA) 将不同发酵时间滤液中的化合物进行数据处理,得到OPLS-DA得分图(图4B,C)。图中不同时间点发酵滤液中代谢产物明显分离,且全部样品组都位于置信区间内,表明各组间存在显著差异。计算得到参数 R2Y=0.999、Q2=0.992,截距 Q2回归线的截距为-0.11<0,说明模型稳定,数据可靠。
2.5.3 淡紫紫孢菌微菌核发酵代谢产物种类及含量分析 淡紫紫孢菌微菌核发酵滤液中共鉴定出588种化合物,其中氨基酸、肽和类似物(71种),醇和多元醇(50种),碳水化合物和碳水化合物结合物(39种),胺类(28种)和脂肪酸类(28种)。发酵过程中一些与生命活动密切相关的物质,如氨基酸、肽、碳水化合物、嘌呤和嘧啶等含量无明显变化。随着微菌核的大量形成(72~120 h),羰基化合物、胺类、醛类等物质含量显著下降;而一些代谢活性物质,如醇及多元醇、酚类、吡啶羧酸及其衍生物、苯甲酸及其衍生物、二羧酸及其衍生物、咪唑类含量均显著增加。此外,脂肪酸类物质在72 h时含量显著高于0和120 h,推测菌株培养后期随着培养基中蔗糖、酵母浸粉等营养物质的大量消耗,淡紫紫孢菌有可能利用前期代谢产生的脂肪酸类物质(表3)。
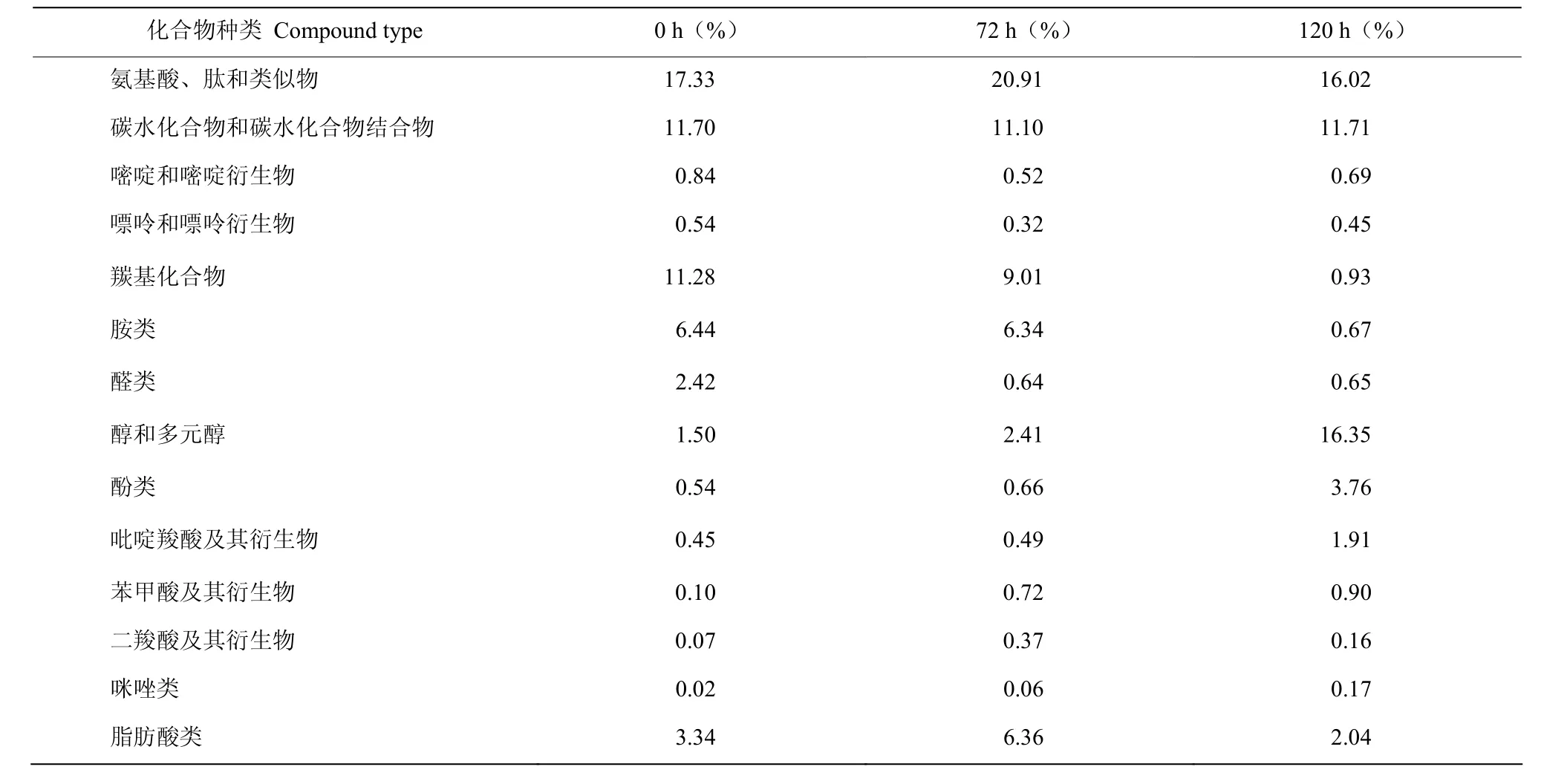
表3 淡紫紫孢菌微菌核发酵滤液中代谢产物种类及含量Table 3 Types and contents of metabolites in MS fermentation filtrate of P. lilacinum
2.5.4 淡紫紫孢菌微菌核形成过程中差异代谢物及相对含量分析 对不同取样点(0、72、120 h)代谢产物进行筛选(P<0.05,且VIP>1),共得到216种差异代谢物。其中,116种化合物在微菌核形成过程中含量显著增加,主要为醇类(16种)、碳水化合物类(9种)、脂肪酸类(8种)等;另有100种含量显著下降,以氨基酸类(14种)、嘌呤类物质(7种)、胺类物质(5种)为主;也有一些化合物前期含量明显增加,随后呈下降趋势(图5)。对其中含量增加的组分分析,得到芥酸、高香草酸、胡椒酚和泛酸等具有抑菌活性以及胍基丙酸、丁酸和咪唑乙酸等具有杀线虫活性的化合物(表4)。
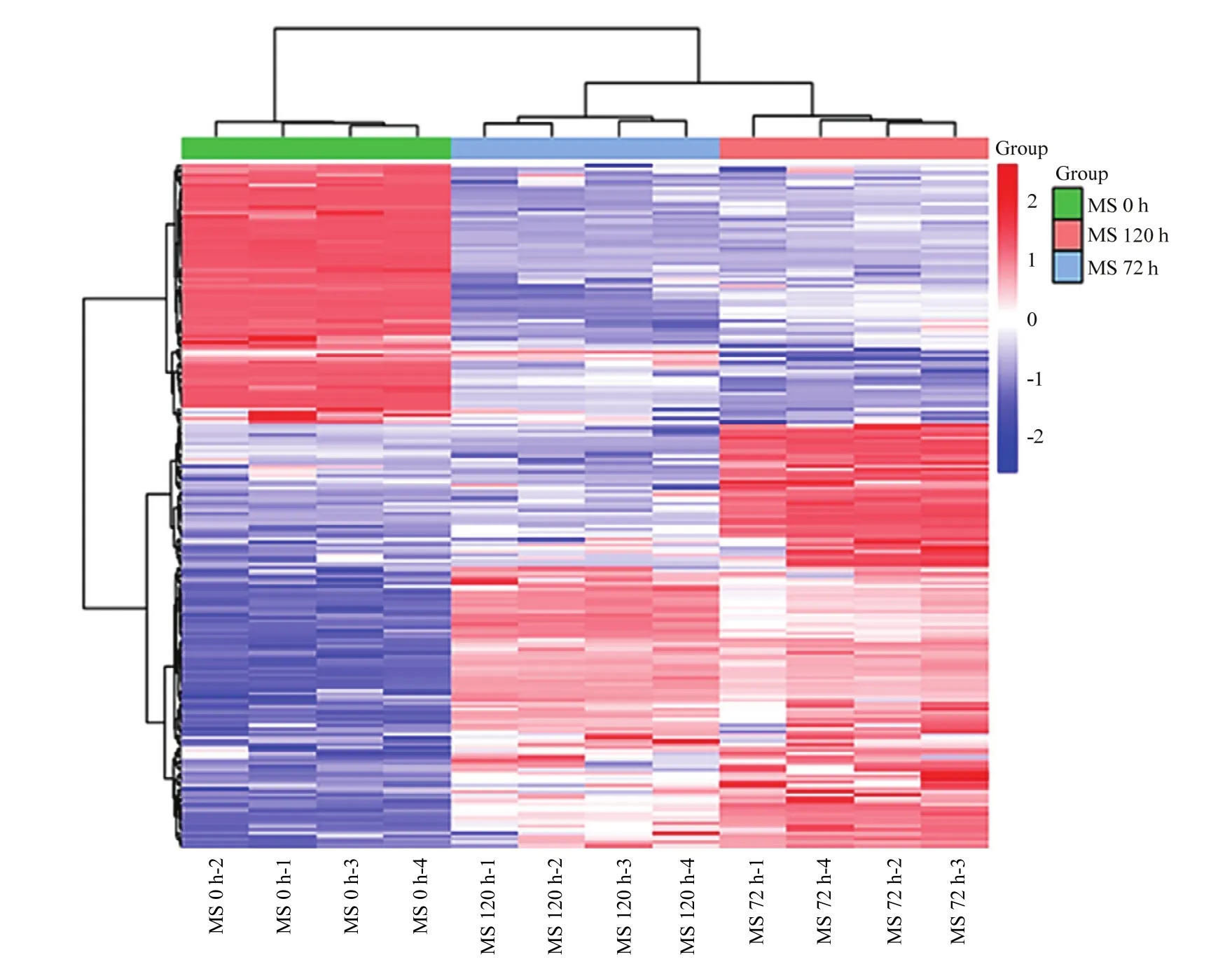
图5 淡紫紫孢菌微菌核形成过程中差异代谢物聚类热图Fig. 5 Heat diagram of differential metabolites secreted during P. lilacinum microsclerotia production
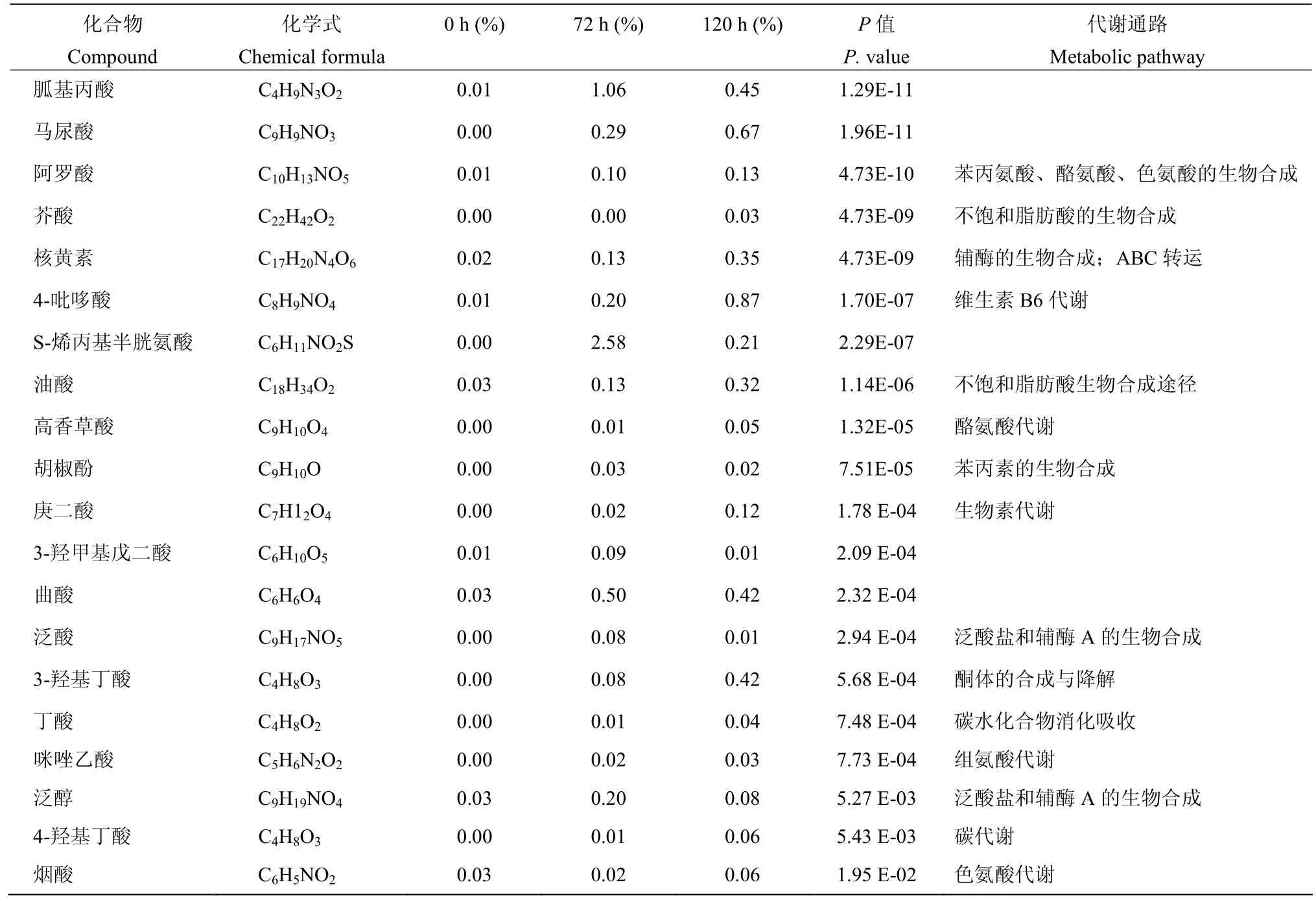
表4 淡紫紫孢菌微菌核滤液中差异代谢物质及相对含量Table 4 Relative contents of differential metabolites in conidia and MS fermentation filtrate of P. lilacinum
3 讨论
培养条件对生防真菌发酵产物的积累及其活性具有重要影响。营养和环境的改变直接影响生防微生物的生长繁殖与代谢,进而影响其生防作用[33-35]。我们发现,通过环境胁迫和营养的改变,淡紫紫孢菌从菌丝和孢子发酵转换为微菌核的大量生成,这期间发酵液pH曲线随之发生改变,推测对微菌核的诱导可能激活了不同的代谢途径,从而引起发酵和代谢产物,以及生防作用发生变化。本试验中,淡紫紫孢菌微菌核发酵滤液同孢子滤液都表现出较强的杀线虫、抑菌和促生活性,但对不同病原菌的抑制作用存在较大差异,微菌核滤液对核盘菌菌丝生长和菌核形成的抑制作用明显强于孢子滤液,但对立枯丝核菌的抑制作用则相对较差(P<0.05)。此外,稀释10倍的微菌核滤液对根结线虫二龄幼虫的致死率显著高于孢子滤液,推测淡紫紫孢菌在形成微菌核过程中,产生了更多的具有杀线虫活性的代谢物。
目前已报导的杀线虫真菌活性代谢物主要有生物碱类、萜类、醌类、大环内酯类、肽类和萘类等[36],淡紫紫孢菌发酵液中含有乙酸、脂肪酸、酚酸、倍半萜和几丁质酶等活性物质[8,37,38]。我们从淡紫紫孢菌微菌核培养代谢组中鉴定到的代谢物以羧酸、苯类和酯类化合物为主,包括氨基酸和糖类等与生长和能量代谢相关的物质,以及生物碱和脂肪酸等具有杀线抑菌作用的组分。在分生孢子形成过程中,芳香烃、酯类和杂环类物质种类和相对含量较多[39],与淡紫紫孢菌微菌核形成过程中的代谢产物存在一定差异。目前,我们仅通过 LC-MS对微菌核发酵代谢物的种类及相对含量进行分析,此外还有一些化合物,如吡啶类、唑类,相对峰面积较大,但是否具有生防作用仍然未知,接下来可以从中选取含量较高的组分进行定量分析,并检测其活性。
迄今,市场上的淡紫紫孢菌产品均为分生孢子和菌丝制剂,货架期短,受环境影响较大,严重限制了其大面积应用。微菌核制剂作为一种新型生防真菌产品,具有耐热性强、抗干燥,货架期长,作用稳定等诸多优点。虫生真菌中,白僵菌、绿僵菌微菌核制剂已成功用于寄主害虫的防治[40,41]。我们发现,较低剂量的淡紫紫孢菌微菌核对根结线虫病防效可达到50%以上(未发表),同时,微菌核发酵滤液具有良好的杀线、防病和促生效果。生产中采用硅藻土、高岭土等载体对微菌核发酵液直接进行吸附,制备微菌核粉剂或颗粒剂,同时结合其他有机添加物,既可保护微菌核,又能充分利用发酵液中的活性代谢物,提高菌剂的生防效果。通过微菌核制剂的研发可有效解决目前淡紫紫孢菌生产和应用中的问题,促进此类生防微生物的推广应用。
